例析反应热计算方法在高考中的考查
付前 董顺
(安徽省砀山中学)
《普通高中化学课程标准(2017 年版2020 年修订)》对化学反应与能量部分的要求为:认识化学能可以与热能、电能等其他形式能量之间相互转化,能量的转化遵循能量守恒定律.认识化学能与热能的相互转化,恒温恒压条件下化学反应的反应热可以用焓变表示,了解盖斯定律及其简单应用.
反应热的计算是高考的热点,几乎每套试卷都有出现,下面对反应热的计算在高考中的考查视角予以梳理,以期对大家的复习备考有些许帮助.
1 利用键能求算反应热
解题思路与方法化学反应的实质为旧化学键的断裂和新化学键的形成,旧键断裂吸收能量(ΔH为正),新键形成释放能量(ΔH为负),则ΔH=反应物的键能之和-生成物的键能之和.
例1(2021年湖南卷,节选)氨气中氢含量高,是一种优良的小分子储氢载体,且安全、易储运,可通过氨热分解法制氢气,相关化学键的键能数据如表1所示.
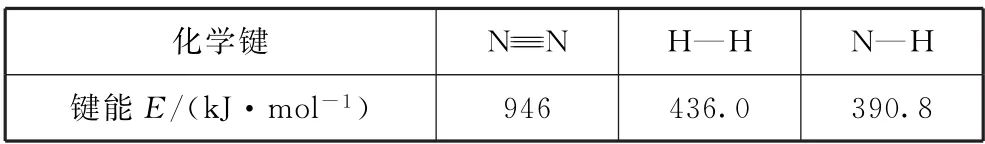
表1
在一定温度下,利用催化剂将NH3分解为N2和H2.回答下列问题:

(2)若反应自发进行,则需ΔH-TΔS<0,则
T即温度应高于(456.5-273)℃=183.5 ℃,选项C、D符合题意.
答案(1)+90.8.(2)C、D.
与往年相似高考试题的对比(2015 年全国Ⅱ卷,节选)甲醇既是重要的化工原料,又可作为燃料.利用合成气(主要成分为CO、CO2和H2)在催化剂的作用下合成甲醇,发生的主要反应如下:
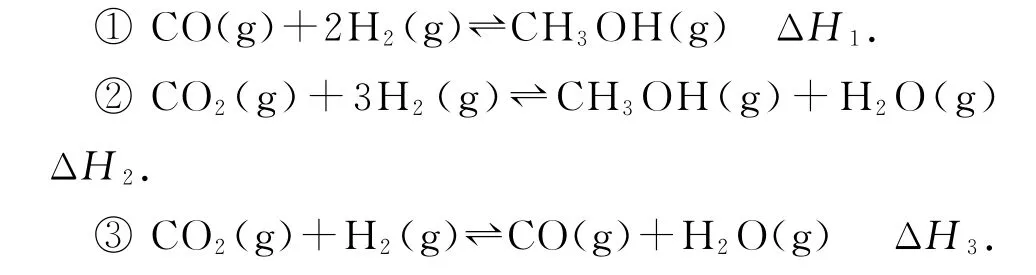
反应①中相关的化学键键能数据如表2所示.

表2

2 利用盖斯定律计算反应热
解题思路与方法利用盖斯定律求算反应热时,关键是把目标方程式用已知方程式表示出来,若方程式相加减,则焓变亦相加减;若方程式中各化学计量系数乘以某数,则焓变亦乘以某数.
例2(2021年广东卷,节选)我国力争于2030年前做到碳达峰,2060年前实现碳中和.CH4与CO2重整是CO2利用的研究热点之一.该重整反应体系主要涉及以下反应:
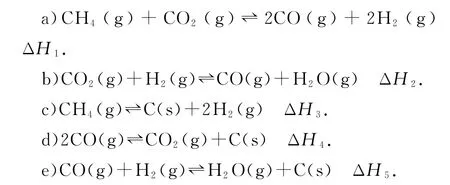
(1)根据盖斯定律,反应a的ΔH1=_________(写出一个代数式即可).
(2)上述反应体系在一定条件下建立平衡后,下列说法正确的有________.
A.增大CO2与CH4的浓度,反应a、b、c的正反应速率都增加
B.移去部分C(s),反应c、d、e 的平衡均向右移动
C.加入反应a的催化剂,可提高CH4的平衡转化率
D.降低反应温度,反应a~e的正、逆反应速率都减小
解析
(1)根据题目所给出的反应方程式关系可知,a=b+c-e=c-d,根据盖斯定律则有
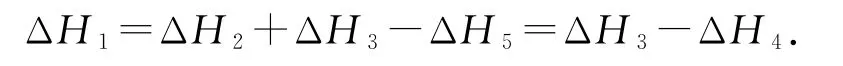
(2)增大CO2和CH4的浓度,对于反应a、b、c来说,均增大了反应物的浓度,反应的正反应速率增大,选项A 正确.移去部分C(s),没有改变反应体系中的压强,反应的正、逆反应速率均不变,平衡不移动,选项B错误.催化剂能同等程度改变正、逆反应速率,加入催化剂只能改变反应进程,不能改变反应的平衡状态,平衡转化率不变,选项C 错误.降低温度,体系的总能量降低,正、逆反应速率均减小,选项D 正确.
答案(1)ΔH2+ΔH3-ΔH5或ΔH3-ΔH4.
(2)A、D.
例3(2021年全国甲卷,节选)二氧化碳加氢制甲醇的总反应可表示为

该反应一般认为通过如下步骤来实现:
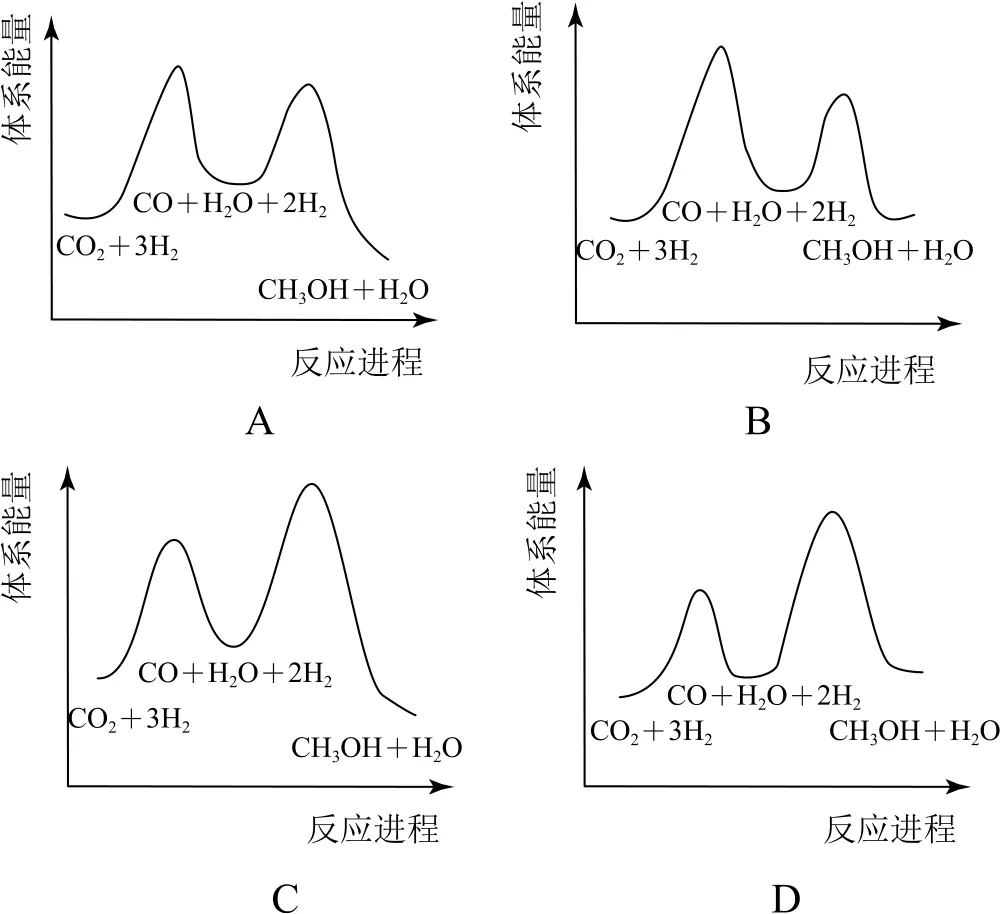
总反应的ΔH=_________kJ·mol-1;若反应①为慢反应,下列示意图中能体现上述反应能量变化的是_________(填标号),判断的理由是_________.
解析
根据盖斯定律可知,①+②可得二氧化碳加氢制甲醇的总反应方程式,即
该总反应为放热反应,因此生成物总能量低于反应物总能量,反应①为慢反应,则反应①的活化能高于反应②,同时反应①的反应物总能量低于生成物总能量,反应②的反应物总能量高于生成物总能量,示意图中能体现反应能量变化的为A 项.
答案-49;A;ΔH1为正值,ΔH2和ΔH为负值,反应①的活化能大于反应②的.
与往年相似高考试题的对比(2020年山东卷,节选)探究CH3OH 合成反应化学平衡的影响因素,有利于提高CH3OH 的产率.以CO2、H2为原料合成CH3OH 涉及的主要反应如下:
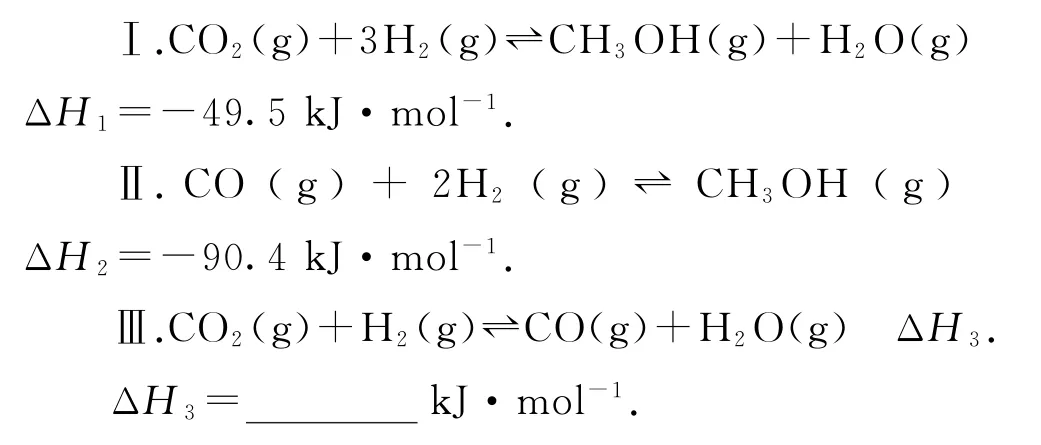

3 利用燃烧热求算反应热
解题思路与方法燃烧热(摩尔燃烧焓)是指在101kPa时,1mol纯物质完全燃烧生成指定产物(如碳元素变为CO2(g),氢元素变为H2O(l),硫元素变为SO2(g),氮元素变为N2(g)等)时所放出的热量.在利用燃烧热计算反应焓变时,可以根据燃烧热的定义先写出表示各物质燃烧热的热化学方程式,然后再根据盖斯定律求算.也可以直接用反应物的燃烧热之和减去生成物的燃烧热之和计算反应的焓变,若方程式中出现了稳定的化合物,如CO2(g)、H2O(l)等,它们的燃烧热为0,即ΔH=反应物的燃烧热之和-生成物的燃烧热之和.
例4(2021年河北卷,节选)大气中的二氧化碳主要来自煤、石油及其他含碳化合物的燃烧.已知25 ℃时,相关物质的燃烧热数据如表3所示.
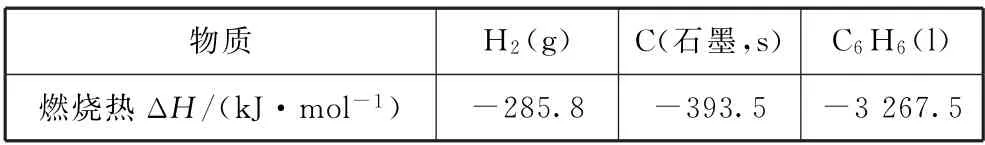
表3
则25 ℃时H2(g)和C(石墨,s)生成C6H6(l)的热化学方程式为________.
解析
方法1根据燃烧热数据,可写出以下热化学方程式:


与往年相似高考试题的对比(2020 年全国Ⅱ卷,节选)天然气的主要成分为CH4,一般还含有C2H6等烃类,是重要的燃料和化工原料.
乙烷在一定条件可发生如下反应:C2H6(g)=C2H4(g)+H2(g) ΔH,相关物质的燃烧热数据如表4所示.
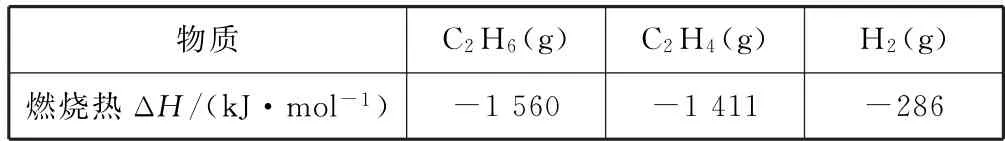
表4
4 利用相对能量大小求算反应热
解题思路与方法从宏观视角看化学反应中能量变化的实质是反应物和生成物能量的相对高低,若反应物的总能量高于生成物的总能量则反应放热;若反应物的总能量低于生成物的总能量则反应吸热.即ΔH=生成物的相对总能量-反应物的相对总能量.
例5(2020 年天津卷)理论研究表明,在101 kPa和298K 下,HCN(g)⇌HNC(g)异构化反应过程的能量变化如图1所示.下列说法错误的是().
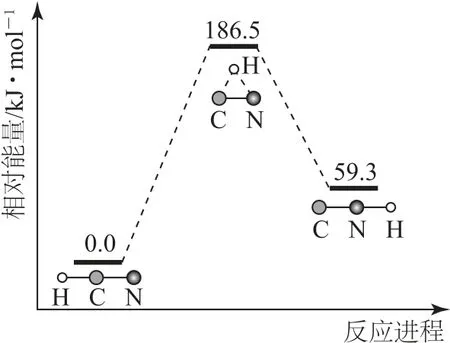
图1
A.HCN 比HNC稳定
B.该异构化反应的ΔH=+59.3kJ·mol-1
C.正反应的活化能大于逆反应的活化能
D.使用催化剂,可以改变反应的反应热
解析
根据图中信息得到HCN 能量比HNC 能量低,能量越低越稳定,故HCN 比HNC 稳定,选项A 说法正确.焓变等于生成物总能量减去反应物总能量,该异构化反应的 ΔH=59.3 kJ·mol-1-0.0=+59.3kJ·mol-1,选项B说法正确.根据图中信息知正反应的活化能(186.5kJ·mol-1)大于逆反应的活化能(127.2kJ·mol-1),选项C说法正确.使用催化剂,不能改变反应的反应热,只能改变反应路径,反应热只与反应物和生成物的总能量有关,选项D 说法错误.答案为D.
与往年相似高考试题的对比(2020 年全国Ⅰ卷,节选)钒催化剂参与反应的能量变化如图2所示,V2O5(s)与SO2(g)反应生成VOSO4(s)和V2O4(s)的热化学方程式为________.
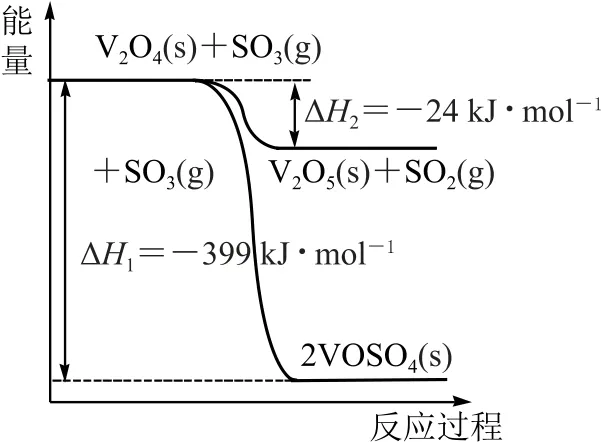
图2

5 利用实验测定数据求算反应热
解题思路与方法许多反应热可以通过量热计直接测定,反应热Q=-cm(t2-t1),式中c为反应混合物的比热容,m为反应混合物的总质量,t2为末温度,t1为初始温度.焓变,式中Δn为某反应物或产物的物质的量变化量.
例6(2020 年7 月浙江卷)100 mL 0.200 mol·L-1CuSO4溶液与1.95g锌粉在量热计中充分反应.测得反应前温度为20.1 ℃,反应后最高温度为30.1 ℃.
已知:反应前后,溶液的比热容均近似为4.18 J·g-1·℃-1、溶液的密度均近似为1.00g·cm-3,忽略溶液体积、质量变化和金属吸收的热量.请计算:
(1)反应放出的热量Q=________J.
(2)反应Zn(s)+CuSO4(aq)=ZnSO4(aq)+Cu(s)的ΔH=________kJ·mol-1(列式计算).

反应热的求算方法除上述所列类型之外还有利用物质的摩尔生成焓求算等方式,纵观近年高考试题中的反应热计算类试题,重现率较高,但对技巧的考查逐渐淡化,主要涉及基本概念、基本原理的应用,考生在解答此类试题时要对必备知识熟练掌握,另外需要不断提升计算能力.
(完)

