Temporin-PE肽对结肠癌LoVo细胞增殖、迁移及凋亡的影响
刘桃源 李昂 王顺 李淑艳 潘洪明 衣同辉





[摘要]目的在细胞水平上初步探讨Temponn-PE肽抗结肠癌作用。方法分别用50、100、150、200 μg/ml Temporin-PE肽处理的人结肠癌LoVo细胞株作为实验组,以等体积DMEM-H(无血清)处理的LoVo细胞作为对照组。通过CCK-8法和细胞克隆形成实验检测不同浓度Temporin-PE肽对LoVo细胞增殖活性的抑制作用,划痕实验检测细胞的迁移能力,DAPI染色检测LoVo细胞的凋亡形态学改变,流式细胞术检测细胞凋亡率。结果Temporin-PE肽能抑制LoVo细胞的增殖且呈剂量依赖性;划痕实验可见细胞迁移率随Temporin-PE肽浓度增高而逐渐降低;DAPI染色可见各实验组出现细胞凋亡,Temporin-PE浓度越高细胞形态变化越明显;流式细胞术检测凋亡趋势与DAPI染色一致。结论Temporin-PE肽可抑制LoVo细胞增殖与迁移、促进LoVo细胞的凋亡,呈剂量依赖性。
[关键词]Temporin-PE肽;结肠癌;增殖;凋亡
[中图分类号]R735.3+5 [文献标识码]A [文章编号]2095-0616(2022)01-0028-04
Impacts of Temporin-PE peptide on proliferation,migration and apoptosis of LoVo cells of colon cancer
LIU Taoyuan LI Ang WANG Shun LI Shuyan PAN Hongming YI Tonghui
Qiqihar Medical University,Heilongjiang,Qiqihar 161006,China
[Abstract]Objective To preliminarily investigate the anti-colon cancer effect of Temporin-PE peptide at cell level. Methods LoVo cell strain of human colon cancer treated with Temporin-PE peptide of 50,100,150 and 200 μg/ml was used as the experimental group,and LoVo cell treated with DMEM-H (serum-free)was used as the control groups. CCK-8 method and cell clone formation experiment were used to detect the inhibitory effect of different concentrations of Temporin-PE peptide on the proliferation activity of LoVo cells. Scratch test was used to detect the migration ability,DAPI staining was used to detect the morphological changes of apoptosis of LoVo cells,and flow cytometry was used to detect the apoptosis rate. Results Temporin-PE peptide can inhibit the proliferation of LoVo cells in a dose-dependent manner. Scratch test showed that the migration rate of cells gradually decreased with the increase of Temporin-PE peptide concentration. DAPI staining showed apoptosis in all the experimental groups. The higher the concentration of Temporin-PE,the more obvious the morphological changes of cells. The trend of apoptosis detected by flow cytometry was consistent with DAPI staining. Conclusion Temporin-PE peptide can inhibit the proliferation and migration of LoVo cells and promote the apoptosis of LoVo cells in a dose-dependent manner.
[Key words]Temporin-PE peptide;Colon cancer;Proliferation;Apoptosis
2020年結肠癌全球新发病例数超过190万例,位居全球恶性肿瘤发病率第3位和病死率第2位,且在东亚地区的发病率最高[1]。目前结肠癌治疗的主要手段是手术、化疗、放疗以及靶向治疗等[2- 4],但现有治疗手段也存在一定的不足,如部分抗癌药物不能精准靶向癌细胞导致患者产生不良反应。Temporin-PE 肽(F-L-P-I-V-A-K-L-L-S-G-L-L)是从Pelophylax,kl.Esculentus蛙的皮肤分泌物中分离得到的一种生物活性肽。研究发现,Temporin-PE肽对NCI-H157、U251MG、PC-3、MDA-MB-435s细胞的增殖有抑制作用,表明Temporin-PE肽具有一定的抗肿瘤活性[5]。本实验拟在体外研究Temporin- PE肽对结肠癌LoVo细胞增殖、迁移和凋亡的影响,并进一步探讨其分子机制,旨在为研发新的结肠癌治疗策略提供参考。
1 材料与方法
1.1 材料
结肠癌细胞株LoVo(中科院上海细胞库);Temporin-PE肽(安徽国平药业有限公司);DMEM-H培养基(美国Gibco公司);胎牛血清(美国Gibco公司);CCK-8试剂(北京索莱宝有限公司);吉姆萨染色液(上海碧云天生物技术有限公司);DAPI试剂(北京索莱宝有限公司);Annexin V-FITC Apoptosis Detection Kit(北京博奥森技术有限公司);FACS Calibur流式细胞仪(美国BD公司)。
1.2 方法
1.2.1 细胞培养与分组 人结肠癌LoVo细胞株用含有10%胎牛血清的DMEM-H培养基在37℃、5% CO培养箱中培养。待细胞融合度达70%~80%时,分别用50、100、150、200 μg/ml Temporin-PE处理细胞,以等体积DMEM-H(无血清)处理的细胞为对照组(每个浓度设3个复孔)。
1.2.2 CCK-8法檢测细胞增殖情况 采用CCK-8法检测Temporin-PE肽对LoVo细胞的增殖抑制作用。细胞培养与分组同1.2.1,将LoVo细胞接种于96孔板中培养过夜,实验组加入相应浓度Temporin- PE肽,对照组加入等体积DMEM-H,分别培养12、24 h,测定450 nm处OD值,计算细胞存活率。
1.2.3 细胞克隆形成实验 细胞培养与分组同1.2.1,取处于对数生长期LoVo细胞,按8×10个/孔接种于6孔板,培养24 h充分贴壁后,分别加入相应浓度Temporin-PE肽。处理24 h后弃旧培养基,用含10%胎牛血清的DMEM-H培养基继续培养1周后,PBS洗涤,吉姆萨染液染色,计算各组细胞克隆形成数。
1.2.4 划痕实验 细胞培养与分组同1.2.1,取处于对数生长期LoVo细胞,按3×10个/孔接种于12孔板,培养过夜。用200 μl枪头进行划痕,PBS洗涤2次,分别加入相应浓度Temporin-PE肽,分别于0 h和24 h拍照。
1.2.5 DAPI染色 细胞培养与分组同1.2.1,取处于对数生长期LoVo细胞,按1×10个/孔接种于96孔板,培养过夜。分别加入相应浓度Temporin-PE培养基培养24 h,4%多聚甲醛固定细胞25 min,PBS洗涤2次,加入DAPI染色液室温10 min,PBS洗涤2次,340 nm波长激发荧光,荧光镜下观察各组细胞形态。
1.2.6 流式细胞术 细胞培养与分组同1.2.1,取处于对数生长期LoVo细胞,按3×10个/孔接种于12孔板,培养过夜。分别加入相应浓度Temporin-PE 培养基培养24 h,用无EDTA胰酶消化后收集细胞,PBS洗涤2次重悬细胞,使用Annexin V-FITC Apoptosis Detection Kit试剂盒染色后冰浴放置;流式细胞仪检测各组细胞凋亡率。
1.3 统计学方法
使用Graphpad Prism 8.0软件进行统计分析,数据以
2 结果
2.1 Temporin-PE肽抑制LoVo细胞增殖
CCK-8实验结果显示,不同浓度Temporin- PE肽处理细胞12、24h后,细胞存活率均随浓度的增加而降低,见图1。表明Temporin-PE肽能抑制LoVo细胞增殖且呈剂量依赖性。
2.2 Temporin-PE肽抑制LoVo细胞克隆形成能力
克隆形成实验结果显示,与对照组比较,实验组细胞克隆形成率显著下降,差异有统计学意义(P<0.01),见图2。表明Temporin-PE肽能抑制LoVo细胞的克隆形成能力。
2.3 Temporin-PE肽抑制LoVo细胞的迁移
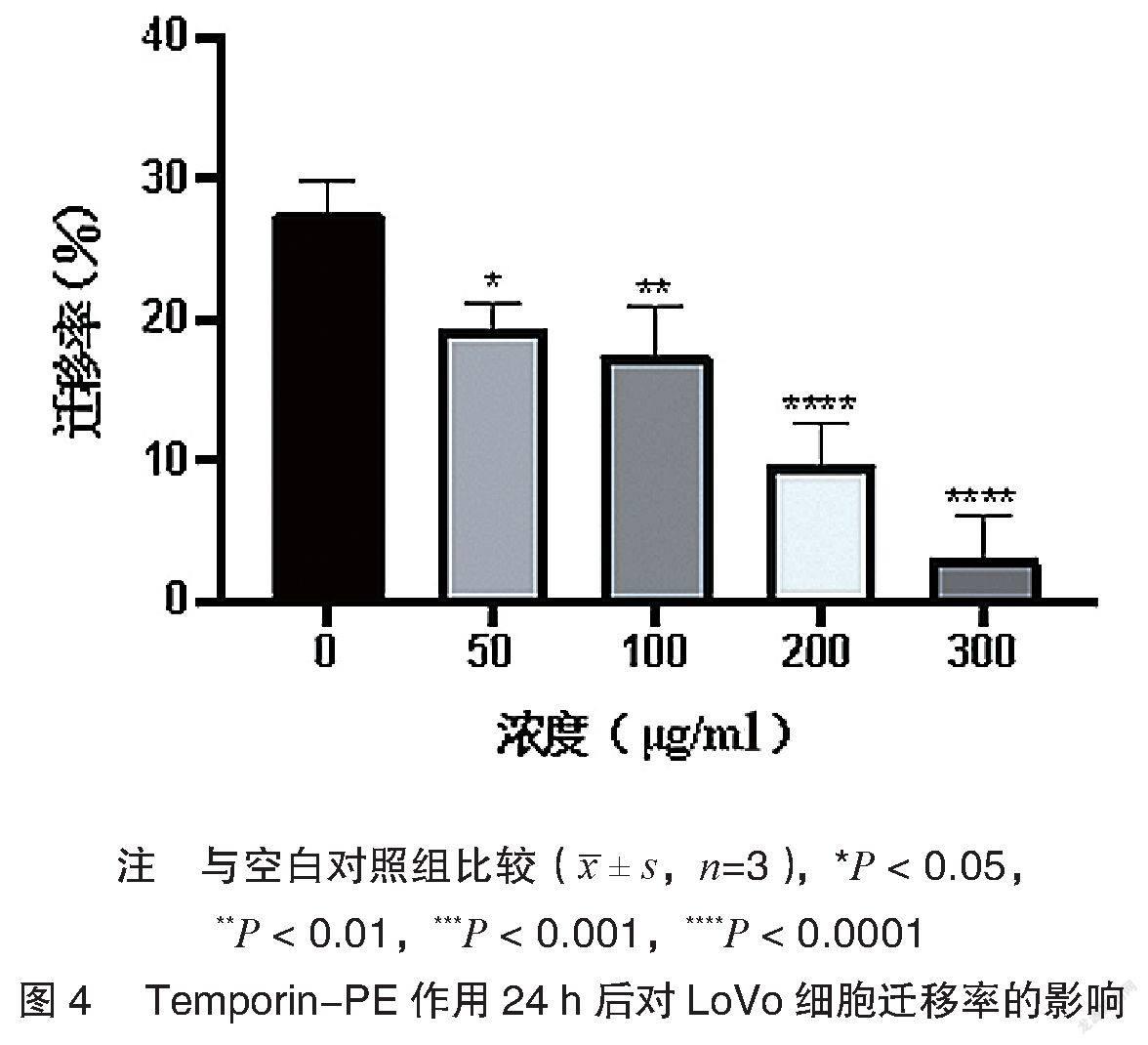
划痕实验结果显示,与对照组比较,实验组24 h细胞划痕面积随Temporin-PE肽浓度增高而增大,见图3。通过划痕面积计算各组迁移率,可见LoVo细胞迁移率随Temporin-PE肽浓度增高而降低,差异有统计学意义(P<0.05),见图4。表明Temporin- PE肽能抑制LoVo细胞的迁移能力。
2.4 Temporin-PE肽诱导结肠癌LoVo细胞凋亡
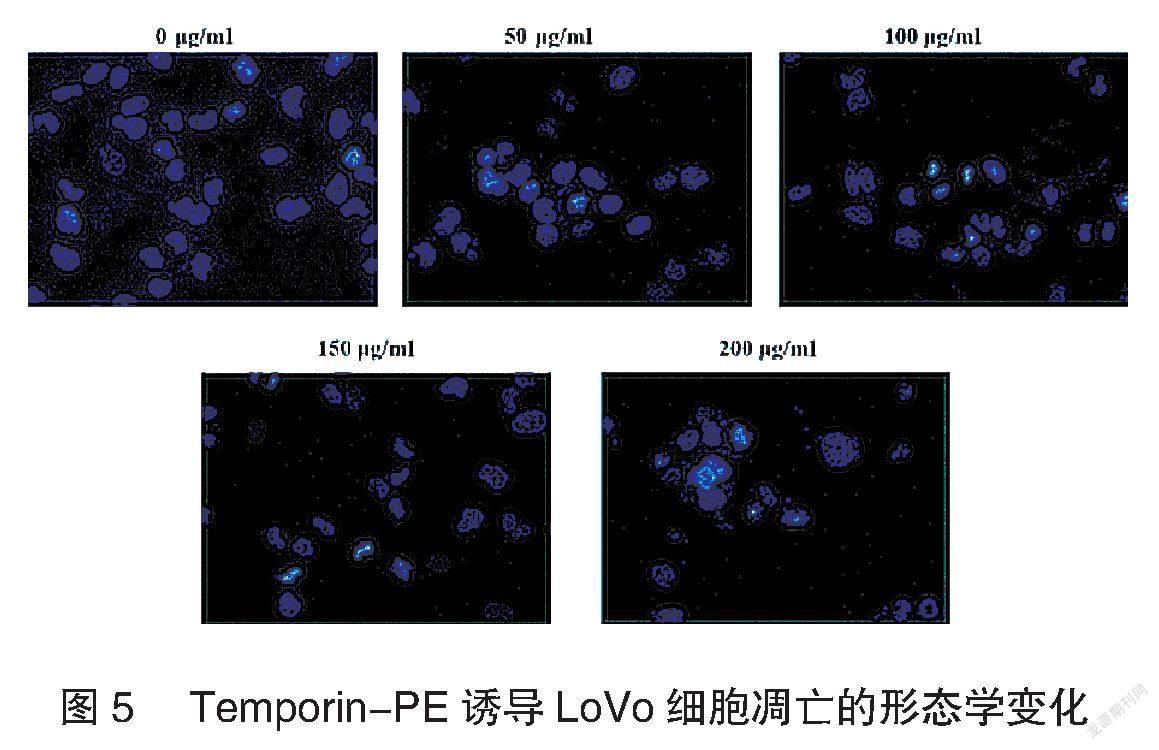
DAPI染色实验结果显示,对照组细胞核大小均一,实验组细胞核皱缩、大小不一,在200 μg/ml组出现明显凋亡小体,见图5。流式细胞术实验结果显示,与对照组比较,实验组凋亡率显著增高,且随浓度增加细胞凋亡率也显著增加,差异有统计学意义(P<0.001),见图6。表明Temporin-PE肽能诱导LoVo细胞凋亡且呈剂量依赖性。
3 讨论
近年来,结肠癌的全球发病率呈现逐年上升趋势,而且结肠癌的早期临床症状不明显,难以早期诊断早期治疗,中晚期结肠癌患者临床治疗效果差,因此寻找更有效的结肠癌治疗方法是目前的研究重点之一[6-7]。目前已有数百种生物活性肽被发现具有抗癌活性,抗癌肽因具有广谱的抗癌活性、不易产生细胞耐药、与传统抗肿瘤药物具有良好的协同效应等特点,在癌症的临床治疗中有巨大的研究应用前景[8-10]。Temporin-PE 肽是从Pelophylax,kl.Esculentus蛙的皮肤分泌物中分离得到的一种生物活性肽,已有研究表明其具有一定的抗菌及抗癌活性。
肿瘤细胞的增殖和迁移是影响患者生存率和复发率的重要因素[11-13]。本研究利用不同浓度Temporin-PE肽处理结肠癌LoVo细胞,观察其增殖、迁移和凋亡情况。CCK-8检测结果显示,在LoVo细胞培养液中分别加入不同浓度的Temporin-PE肽,培养12 h和24 h后,细胞的增殖均受到抑制,且呈剂量依赖性。克隆形成实验结果显示,Temporin-PE肽显著降低LoVo细胞的克隆形成能力。划痕实验结果显示,随着Temporin-PE肽浓度的增高,LoVo细胞的迁移能力显著降低,提示Temporin-PE肽对LoVo细胞增殖、克隆形成能力以及迁移能力均产生了明显的抑制作用。细胞凋亡是细胞增殖过程中重要的调控机制,肿瘤细胞因正常凋亡受到抑制導致细胞无限增殖[14-15]。本研究利用DAPI实验及流式细胞术检测Temporin-PE肽对LoVo细胞凋亡能力的影响。DAPI染色结果显示,Temporin-PE肽作用24 h后,可见细胞边界收缩变圆,细胞核大小不一,出现核内部分染色质断裂、皱缩现象,核碎裂细胞明显增多。流式细胞术分析可见,随着Temporin-PE肽浓度的增高,各组LoVo细胞凋亡率也呈显著增高趋势,提示Temporin-PE肽能促进LoVo细胞凋亡。
综上所述,Temporin-PE肽能抑制结肠癌LoVo细胞的增殖、克隆和迁移能力,促进细胞凋亡。其分子机制还需要进一步的研究来探讨。
[参考文献]
[1]刘宗超,李哲轩,张阳,等.2020全球癌症统计报告解读[J].肿瘤综合治疗电子杂志,2021,7(2):1-14.
[2]KARPISHEH V,NIKKHOO A,HOJJAT-FARSANGI M,et al. Prostaglandin E2 as a potent therapeutic target for treatment of colon cancer[J].Prostaglandins Other Lipid Mediat,2019,144:106338.
[3] R Gupta,Bhatt L-K,Johnston T-P,et al.Colon cancer stem cells:Potential target for the treatment of colorectal cancer[J].Cancer Biol Ther,2019,20(8):1068-1082.
[4]韦金磊,张森.结直肠癌的临床治疗进展[J].中国临床新医学,2018,11(2):202-208.
[5] SANG M,WU Q,XI X,et al.Identification and targetmodifications of temporin-PE:A novel antimicrobial peptide in the defensive skin secretions of the edible frog,Pelophylax kl.esculentus[J]. Biochem Biophys Res Commun,2018,495(4):2539-2546.
[6]徐润强,刘海盛.5-氟尿嘧啶和抗Fas单抗联合治疗结肠癌的临床治疗效果[J].中国医药科学,2021,11 (8):193-195,233.
[7] WU C.Systemic Therapy for Colon Cancer[J].Surg Oncol Clin N Am,2018,27(2):235-242.
[8] CHIANGJONG W,CHUTIPONGTANATE S,HONGENG S.Anticancer peptide:Physicochemical property,functional aspect and trend in clinical application (Review)[J].Int J Oncol,2020,57 (3 ):678-696.
[9] LISCANO Y,ONATE-GARZON J,DELGADO J P.Peptides with Dual Antimicrobial-Anticancer Activity:Strategies to Overcome Peptide Limitations and Rational Design of Anticancer Peptides[J].Molecules,2020,25(18):42-45.
[10]左琪,郭超,樊卫平,等.人非小细胞肺癌NCI-H1299细胞特异性结合肽的筛选及鉴定[J].中国肺癌杂志,2020,23(12):1023-1030.
[11]刘勇刚,黄俊勇,李曦,等.IFITM2在胃癌组织中的表达及其对胃癌细胞迁移和侵袭的影响[J].中国医药科学,2021,11(13):25-28,36.
[12] WEN J,MIN X,SHEN M,et al.ACLY facilitates colon cancer cell metastasis by CTNNB1[J].J Exp Clin Cancer Res,2019,38(1):401.
[13] DUFF D,LONG A.Roles for RACK1 in cancer cell migration and invasion[J].Cell Signal,2017,35:250-255.
[14]刘锐,丁振飞,戴策,等.MANF对A2型反应性星形胶质细胞增殖、凋亡的影响[J].安徽医科大学学报,2021(10):1511-1515.
[15]朱剑军,吴昊.结肠癌中HRH3表达对细胞增殖的影响[J].临床与实验病理学杂志,2020,36(6):652-656.

