AMD3100联合利妥昔单抗对弥漫大B细胞淋巴瘤细胞株SU-DHL-2的影响及机制研究
马志萍,曹燕珍,李新霞
(新疆医科大学1第一附属医院病理科,乌鲁木齐 830054;2附属肿瘤医院病理科,乌鲁木齐 830011)
弥漫大B 细胞淋巴瘤(Diffuse large B cell lymphoma,DLBCL)是最常见的B 细胞淋巴瘤,据我国淋巴瘤诊治协作组统计,国内 DLBCL 发病率高达40%~50%,高于国际的25%~30%[1]。不同分型的DLBCL 对治疗反应具有差异,同样使用R-CHOP (美罗华+环磷酰胺+长春新碱+阿霉素+泼尼松)治疗方案,生发中心B 细胞型淋巴瘤(GCB)具有更长的总生存期,而活化B 细胞型淋巴瘤(ABC)预后较差,其临床总有效率不到40%[2-3]。说明R-CHOP 并非是DLBCL 患者的最佳治疗方案[4-6]。因此,发现新的治疗靶标及抑制剂,并将其与R-CHOP 组合运用治疗,可能会显著地提高患者的预后。有研究显示,趋化因子受体4(CXCR4)在多种肿瘤生长、侵袭和转移中起着重要作用[7-9]。其中,基质金属蛋白酶(MMP-2、MMP-9)的分泌、激活Akt/PI3K 等信号通路促进肿瘤的发生[10]、发展[11]和转移[12-13],但在不同细胞系其调节机制有所不同。在DLBCL 活检组织及细胞系中也发现有CXCR4 蛋白和mRNA 的高表达[14]。但如何调节基质金属蛋白酶的分泌,激活Akt/PI3K信号通路促进转移,具体机制目前尚不清楚。本研究旨在探讨CXCR4抑制剂AMD3100与利妥昔单抗(Rituximab)对人DLBCL细胞株SU-DHL-2增殖、凋亡和侵袭能力的影响及可能的分子机制,为DLBCL的靶向治疗提供实验依据。
1 材料与方法
1.1 材料与试剂弥漫大B 细胞瘤细胞株SU-DHL-2(凯基生物,KG541),RPMI1640、FBS、双抗(美国,Gibco公司)、Rituximab(美仑生物,MB2749)、AMD3100(美仑生物,MB5646),CCK-8 检测试剂盒(碧云天,C0037)、凋亡试剂盒(凯基生物,KGA1026)、BCA 蛋白浓度测定试剂盒(碧云天,P0010)、GAPDH 单克隆抗体(英国,Abcam 公司,Ab8245)、AKT 多克隆抗体(美国,CST 公司,4691T)、兔抗人p-AKT(pSer473)多克隆抗体(正能生物,310021)、兔抗人MMP-9 单克隆抗体(美国,CST 公司,13667T)、兔抗人MMP-2 多克隆抗体(武汉华美,CSB-PA003258)、兔抗人CXCR4多克隆抗体(武汉华美,CSB-PA006254)。
1.2 方法
1.2.1 细胞培养及分组 弥漫大B 细胞瘤细胞株SUDHL-2,采用RPMI1640 培养基,10%胎牛血清,置于37 ℃、5% CO2,相对湿度90%的培养箱中培养,细胞悬浮生长,实验均在细胞对数生长期进行。将细胞分为对照组(未经任何处理)、AMD3100 组(加入1 μmol/L AMD3100)、Rituximab 组(加入 10 μg/mL Rituximab)、联合用药组(加入1 μmol/L AMD3100,孵育1 h 后加入10 μg/mL Rituximab)。
1.2.2 CCK-8 细胞增殖实验 将 100 μL 浓度为 1×104个/mL SU-DHL-2 单细胞悬液加入96孔板,培养24 h,用AMD3100(1 μmol/L)预处理1 h,再加入Rituximab(10 μg/L)孵育24 h,向各孔分别加入 20 μL CCK-8溶液,37 ℃孵育4 h,使用Thermo酶标仪,记录450 nm波长处各孔光密度(OD)值。酶联免疫检测仪测定各孔的光密度值,记录并取各孔均值。
1.2.3 细胞凋亡实验 将SU-DHL-2 单细胞悬液以3 × 105个/mL 密度接种至 6 孔板,每孔 1.5 mL。待处理完成,收集细胞,PBS 润洗 2 次,1 000 r/min,离心5 min;按照 Annexin V-APC Apoptosis Detection Kit 操作说明书加入500 μL Binding Buffer,重悬细胞;加入5 μL AnnexinV-APC、5 μL 7-AAD 混匀;室温避光反应5~15 min(同时设阴性对照,即正常细胞不加AnnexinV-APC 和7-AAD);流式细胞仪上机检测早、晚期细胞凋亡率。
1.2.4 细胞迁移和侵袭实验 将SU-DHL-2 单细胞悬液以3×105个/mL细胞密度,接入6孔板,每孔1.5 mL,37℃培养过夜;取200 μL 接种于Transwell 小室上室。向下室加入0.6 mL 含10%胎牛血清的RPMI1640 培养液,再向各组下室分别加入AMD3100 和Rituximab,同时在Transwell 小室上室底部中央垂直加入100 μL,最终浓度为 300 μg/mL 的基质胶(Matrigel),待成胶状后分别加入200 μL 各组细胞悬液。37 ℃、5%CO2的培养箱中培养24 h,取出Transwell 小室,接入96 孔板,200 μL/每孔,即每种处理3个复孔,加入20 μL CCK-8,37℃培养4 h。标准曲线测定:将细胞分别以 64 000、32 000、16 000、8 000、4 000、2 000、1 000、0个,每孔200 μL,接入96孔板中。
1.2.5 Western blot 实验 离心 SU-DHL-2 细胞株,加入120 μL裂解液,置于冰上裂解30 min,4℃、12 000 r/min,离心 5 min,各取 40 μg 变性蛋白质样品,采用二喹啉酰胺凝胶电泳(BCA)蛋白定量法进行十二烷基磺酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE)。转膜完成后,5%脱脂牛奶封闭2 h;所有抗体均以1∶1 000比例稀释,4℃孵育过夜;TBST洗涤5次,加入二抗,37℃孵育 2 h,PBST 洗涤 5 次;ECL 化学发光系统显色,BandScan分析灰度值。
1.3 统计学处理采用GraphPad Prism 5 软件进行统计分析,计量资料以均数±标准差()表示,组间比较采用t检验,符合正态分布的数据采用方差分析比较,以P<0.05为差异具有统计学意义。
2 结果
2.1 各组SU-DHL-2 细胞增殖作用比较CCK-8 增殖实验结果显示,AMD3100组、Rituximab组细胞平均相对存活率分别为84.910%、80.151%,均显著低于对照组,差异具有统计学意义(P<0.05)。联合用药组使用后的细胞存活率(59.431%)显著降低,差异具有统计学意义(P<0.01),见图1。
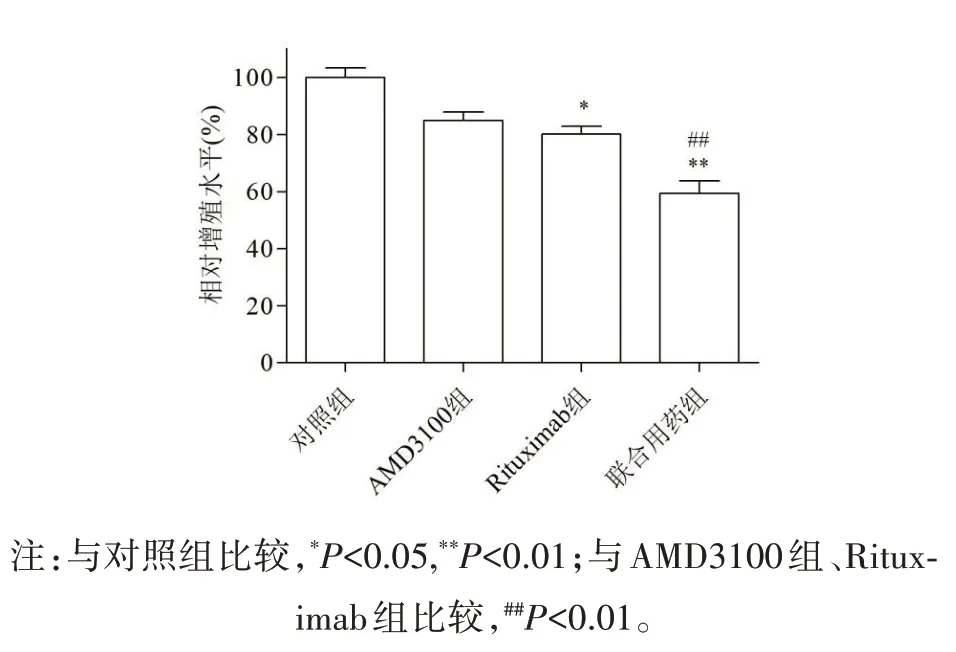
图1 各组对SU-DHL-2细胞增殖作用比较
2.2 各组SU-DHL-2 细胞凋亡结果比较流式细胞术检测结果显示,对照组、AMD3100组、Rituximab组、联合用药组早期凋亡率分别为(5.140±0.367)%、(11.830±0.238)%、(13.540±0.575)%、(17.520±0.405)%。晚期凋亡率分别为(1.687.54±0.270)%、(3.440±0.278)%、(5.333±0.646)%、(12.810±0.783)%。AMD3100 组、Rituximab 组与对照组比较,细胞凋亡率显著升高,差异具有统计学意义(P<0.01);联合用药组与AMD3100 组、Rituximab 组比较,细胞凋亡率显著升高,差异具有统计学意义(P<0.01),见图2。
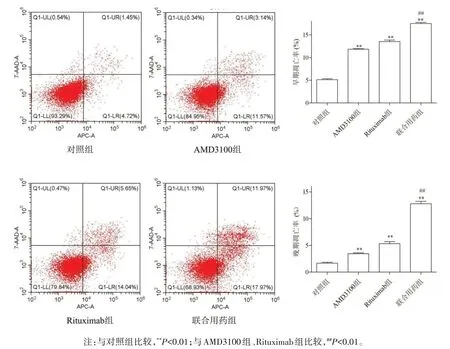
图2 各组细胞凋亡结果图
2.3 联合用药对SU-DHL-2 细胞株迁移及侵袭能力的影响Transwell 小室迁移及侵袭实验中,对照组穿膜相对细胞数(100.000±0.526;100.000±0.432)均高于AMD3100组(85.253±0.530;86.943±0.592)、Rituximab组(79.743±0.531;81.073±0.433)、联合用药组(61.860±0.526;63.477±0.592)。AMD1300 组、Rituximab 组与对照组比较,差异具有统计学意义(P均<0.01);联合用药组与AMD1300 组、Rituximab 组比较,差异具有统计学意义(P均<0.01),见图3。
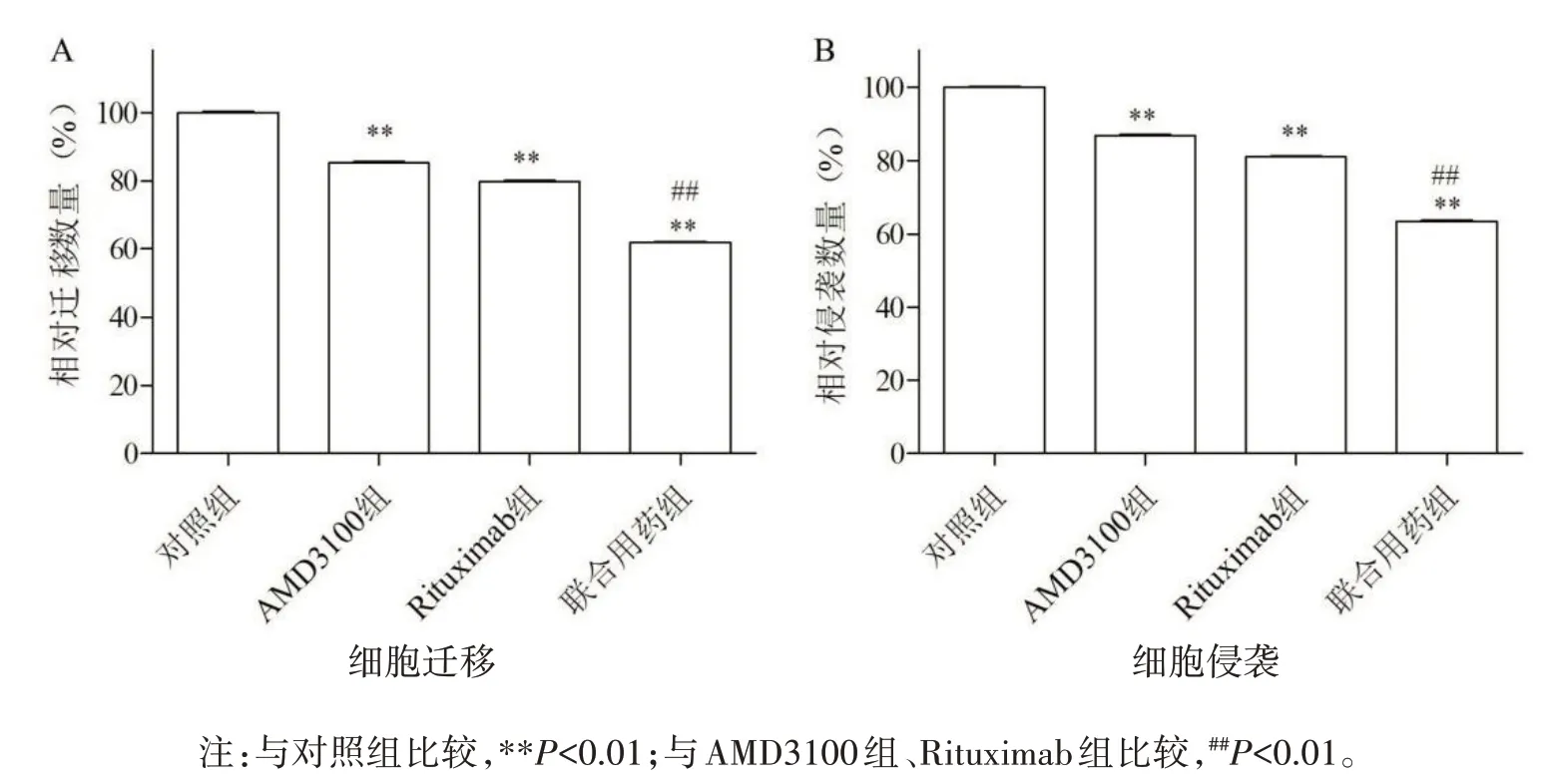
图3 各组细胞迁移侵袭结果图
2.4 各组CXCR4 、AKT、pAKT、MMP-9、MMP-2 蛋白质表达情况Western blot 检测结果显示,AMD3100 组 、Rituximab 组 CXCR4、AKT、p-AKT、MMP-9、MMP-2的表达水平降低,联合用药后作用增强,差异具有统计学意义(P<0.01),见表1、图4。
表1 各组蛋白质相对表达结果比较()
注:与对照组比较,*P<0.05,**P<0.01;与AMD3100组、Rituximab组比较,#P<0.05,##P<0.01。
蛋白质 对照组AMD3100组Rituximab组 联合用药组CXCR4 AKT P-AKT MMP2 MMP9 100.000±5.367 100.000±15.570 100.000±11.170 100.000±11.700 100.000±9.300 74.170±8.401*100.200±11.320 64.870±8.604**63.22±13.57*68.480±14.300*75.290±3.655**95.910±11.420 63.940±4.789**63.490±5.079**70.820±2.587*55.490±8.476**#100.600±17.580 37.220±6.813**##36.72±7.667**#35.910±4.584*##
3 讨论
利妥昔单抗(Rituximab)是人鼠嵌合型单克隆抗体,可特异地结合B淋巴细胞表面的CD20抗原,并引发一系列作用,导致B淋巴细胞的凋亡。临床研究发现,Rituximab 联合化疗药物可提高治疗效果,但仍有30%患者在治疗后短期内出现复发甚至在治疗过程中无法有效控制病情等情况[2-3]。临床上限制DLBCL疗效的关键因素是原发性耐药和化疗过程中产生的获得性耐药。因此,进一步探寻肿瘤发生、发展机制,寻找反映肿瘤预后的预测指标,为DLBCL 的治疗提供新的治疗靶点和思路已成为研究重点。有研究证实,转移的癌细胞在趋化因子12(CXCL12)的作用下与基质细胞结合而获得药物抵抗性,CXCR4 基因作为CXCL12 的特异性唯一受体,参与多种肿瘤的发生、发展、趋向性侵袭及转移过程中,故有效的阻断CXCR4 与CXCL12 的结合,可抑制肿瘤的生长和转移[15]。
多项研究表明,CXCR4/CXCL12 轴通过激活Akt/PI3K 等信号通路,促进伯基特淋巴瘤、慢性淋巴细胞性白血病、肺癌等细胞株的侵袭和转移[14,16-17]。说明阻断CXCR4 与CXCL12 的结合可削弱肿瘤生长和转移能力。AMD3100 作为CXCR4 抑制剂,可通过阻断CXCR4/CXCL12 轴,发挥抑制癌细胞转移的作用[18],增加其对化疗药物的敏感性。Reinholdt 等[19]研究证实,CXCR4抑制剂AMD3100联合Rituximab 在伯基特淋巴瘤中具有协同作用。本研究发现,AMD3100、Rituximab 均能抑制 SU-DHL-2 细胞株的增殖,联合用药后其对细胞增殖、凋亡、迁移和侵袭作 用 较 AMD1300、Rituximab 显 著 增 加 。 说 明AMD3100 联合 Rituximab 对 DLBCL 的 治 疗具有协同效果。本研究结果还发现,AMD3100、Rituximab 均可引 起 SU-DHL-2 细胞 株 内 CXCR4、AKT、p-AKT、MMP-9、MMP-2表达水平的下降,联合用药后此作用增强。提示AMD3100 联合Rituximab 可能通过调节基质金属蛋白酶表达、抑制Akt/PI3K 等信号通路在DLBCL治疗中发挥协同作用。
综上所述,AMD3100联合Rituximab对SH-DUL-2细胞株增殖、凋亡和侵袭具有调节作用,可产生协同效应,有望为DLBCL 靶向治疗提供实验依据。

