嵌合抗原受体修饰T细胞免疫疗法的现状、挑战及应用前景
张国林,薛满综述,景荣先,邢以文审校
1.苏州市药品检验检测研究中心,江苏 苏州 215000;2.南京中医药大学,江苏 南京 210000;3.苏州市立医院,江苏 苏州 215000
以嵌合抗原受体修饰T细胞(chimeric antigen receptor T cells,CAR-T)技术为代表的特异性过继免疫疗法是当前肿瘤治疗领域的热点,主要利用机体免疫细胞的活性特异性地杀灭含有某种抗原表型的恶性肿瘤[1-2]。CAR-T免疫疗法已成为继外科手术、放射治疗和化疗之后的最有潜力的肿瘤治疗方法,在白血病、淋巴瘤、多发性骨髓瘤中临床效果显著,且在实体肿瘤治疗方面潜力巨大[3-6]。CAR-T免疫疗法能够特异识别和杀伤表达蛋白类、糖类、脂类等特异抗原的肿瘤细胞,不受主要组织相容复合体(major histocompatibility complex,MHC)和抗原递呈细胞(antigen presenting cell,APC)的限制。CAR-T免疫疗法具有精准靶向性、活跃持久性和杀伤特异性等优点,能够通过分泌穿孔素等特定蛋白发挥作用,也可在体内持续增殖并分泌多种细胞因子发挥治疗作用。另外,CAR-T疗法也可改善肿瘤免疫微环境对免疫细胞的抑制作用,并形成记忆T细胞获得长效的抗肿瘤机制。但CAR-T免疫疗法也会产生脱靶效应和诱发诸如细胞因子风暴、神经系统毒性和基因修饰致成瘤风险等不良反应[7-8]。未来应从制定相关规范和质量标准、寻找肿瘤特异抗原设计新靶点、强化CAR-T的特异性识别能力,优化CAR-T制备工艺、筛选流程,强化质量控制及产品放行等方面,加强CAR-T疗法的研究及应用。本文就CAR-T免疫疗法的原理,在血液系统恶性肿瘤和实体肿瘤治疗中的应用及存在的挑战作一综述,为相关领域的研究和应用提供参考。
1 嵌合抗原受体(CAR)及CAR-T
1.1免疫治疗和免疫治疗细胞 免疫治疗是针对机体免疫状态亢进或低下时采用人为干预的方式抑制或增强机体免疫功能以达到治疗疾病的方法。肿瘤免疫治疗主要通过激活患者自身的免疫系统,依靠自身免疫机能杀灭肿瘤细胞[9-10]。免疫治疗的分类方法有多种,根据所用的制剂类型可分为细胞治疗、分子治疗和免疫调节治疗。免疫细胞是参与免疫应答或与免疫应答相关的细胞。发挥免疫治疗作用的细胞主要有CAR-T、树突状细胞(dendritic cell,DC)、细胞毒性T细胞(cytotoxic T cell,CTL)、自然杀伤细胞(natural killer cell,NK)、细胞因子诱导的杀伤细胞(cytokine induced killer cell,CIK)、DC刺激的CIK细胞、T细胞受体嵌合T细胞(T cell receptor chimeric T,TCR-T)等。
1.2C A R和C A R-T CAR为人工设计的全新的基因工程分子,基本结构包括胞外抗原识别结构、跨膜结构和胞内信号结构三部分。胞外抗原识别结构包括轻链和重链的单链可变区(single chain variable fragment,scFv),以非MHC限制性的方式直接识别肿瘤相关抗原(tumor-associated antigen,TAA)或肿瘤特异性抗原(tumor-specific antigen,TSA)。跨膜结构为富含脯氨酸的Ⅰ型跨膜蛋白形成的铰链结构,发挥连接胞外结构和胞内结构的作用。胞内信号结构为酪氨酸活化基序,执行共刺激和向T细胞传递活化信号的作用。根据胞内区共刺激-第二信使信号分子的构成情况,CAR的发展已经历4代。第1至第3代CAR不改变嵌合抗原受体的胞内和胞外基础结构,仅对CAR的基础部件进行替换和改进。第4代CAR是在改变基础结构的基础上构建新的结构或引入新的部件,如在原有结构的基础上增加分泌免疫因子白细胞介素-12(IL-12)等的功能,并可引入自杀基因。第1代CAR打破了MHC的限制,实现了特异性杀伤肿瘤细胞的目的,但T细胞增殖和细胞因子的释放能力不足等导致以第1代CAR为基础的CAR-T细胞的抗肿瘤效率不高。目前研究和临床上以第2和第3代CAR应用最为广泛。第1至第3代嵌合抗原受体结构的发展历程见图1。
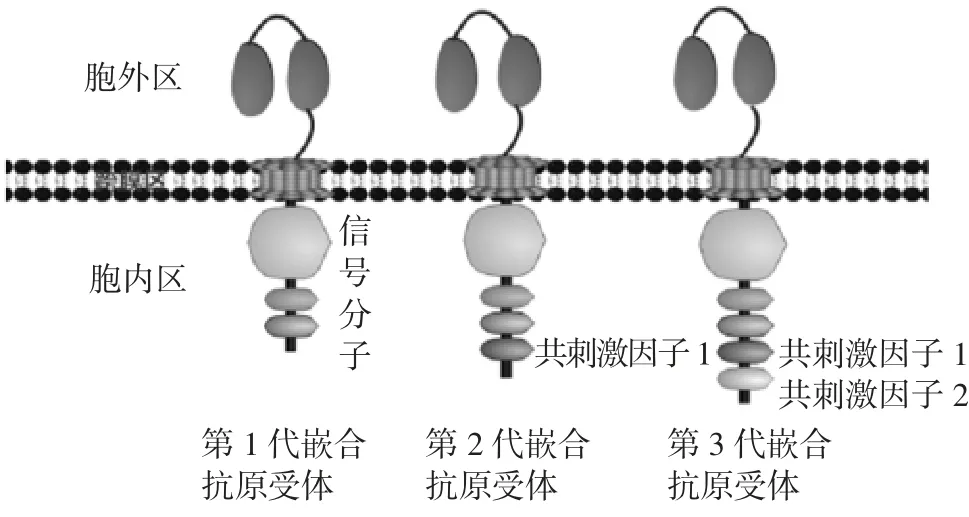
图1 CAR结构的发展历程Fig.1 Development of CAR structure
CAR-T免疫疗法属于特殊的肿瘤免疫治疗方式,是利用基因工程改进自体(最终形成自体CAR-T)或异体(最终形成异体CAR-T)的免疫细胞来清除肿瘤细胞的新型细胞疗法。基本思路是采用基因工程手段将TAA或TSA识别区基因与细胞内共刺激-第二信使信号分子基因在体外构建重组质粒(即CAR基因)后,通过特定方法转染至分离的T淋巴细胞,使T细胞表面表达肿瘤抗原受体蛋白[11-12]。上述经基因工程改造的特殊T细胞经纯化并在体外大规模扩增、筛选后制备的表达特异性嵌合抗原受体的T细胞即为CAR-T。目前体外重组子转染T细胞的方法主要有电穿孔法、逆转录病毒法和慢病毒法等,3种方法在转染效率、安全性和适用范围等方面存在一定差异性。CAR-T免疫疗法通过基因工程的方法将识别TSA或TAA的CAR基因融合并修饰T细胞,满足了特异性识别、结合、杀伤肿瘤抗原和T细胞自我更新的要求,可特异性杀灭特定肿瘤细胞[13-14]。CAR-T免疫疗法在淋巴造血系统恶性肿瘤治疗中效果显著,且在实体肿瘤的治疗中有较大潜力[15-16]。CAR-T免疫疗法治疗效果的关键在于T细胞表面表达的人工改造的嵌合抗原受体的特性。CAR-T免疫疗法的治疗流程为:收集患者血液→除去血小板和红细胞,分离T细胞→活化并进行CAR基因修饰→T细胞的体外扩增→扩增后T细胞的筛选→输回患者体内。CAR-T免疫疗法的治疗流程见图2。CAR-T疗法每一个步骤均应开展充分的工艺研究,确定最优工艺参数。若同一步骤存在两种及以上工艺,应对两种工艺均进行验证,如外周血单个核细胞(PBMC)包括分离后使用和冻存后使用两种工艺,应对两种工艺均进行验证。
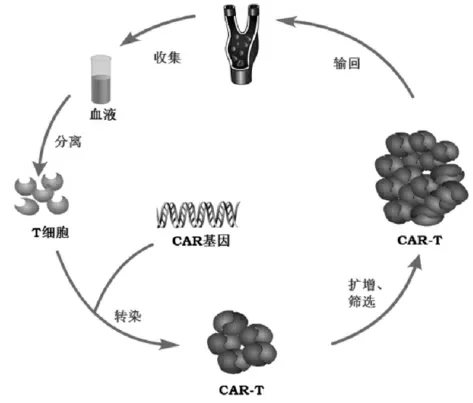
图2 CAR-T免疫疗法的治疗流程Fig.2 Treatment process of CAR-T immunotherapy
与传统的T细胞免疫治疗相比,CAR-T细胞免疫疗法具有一系列优点,如更特异性地识别肿瘤抗原靶标,无需APC参与、不受MHC限制[17-18]。CAR-T细胞免疫疗法可通过共刺激分子增强T细胞的免疫杀伤性,降低肿瘤细胞免疫逃逸的机率。
2 CAR-T免疫治疗的靶点及临床应用
2.1C A R-T免疫治疗的靶点和作用机制 目前全球针对CAR-T进行基础和临床研究的机构有数百个,国外公司以瑞士诺华公司(Novartis)、凯特制药公司(Kite Pharma)、朱诺医疗(Juno Therapeutics)等为代表,国内公司有上海恒润达生生物科技有限公司、南京传奇生物科技有限公司、复星凯特生物科技有限公司等。CAR-T免疫治疗实质上属于靶点依赖型疗法,其胞外抗原结合结构与抗原的结合特性决定了CAR-T免疫治疗的特异性、有效性和安全性[16,19]。CAR-T免疫治疗的作用靶点有两类,即TSA和TAA。已发现的TSA数量较少,除了TSA外,目前CAR-T免疫治疗多围绕肿瘤相关抗原展开。作为靶点的肿瘤抗原也在正常细胞表面表达,是造成CAR-T免疫疗法脱靶效应、神经系统毒性等副反应的重要原因。针对肿瘤免疫治疗新靶点的探索及研究从未停止。肿瘤细胞表面特异性抗原,如Cluster of Differentiation 19(CD19)、CD20、CD30、CD33等均可作为CAR-T免疫治疗各种肿瘤的潜在靶点。肿瘤相关抗原如间皮素(mesothelin,MSLN)、人类表皮生长因子受体2/3(epithelial growth factor receptor 2/3,HER2/3)、神经节苷酯2(ganglioside,GD2)、前列腺特异性膜抗原(prostate specific membrane antigen,PSMA)和癌胚抗原(carcinoembryonic antigen,CEA)等也可作为治疗的潜在靶点,但应注意脱靶效应等副反应的发生。目前已报道的部分肿瘤抗原靶点见表1。

表1 部分可作为靶点的肿瘤表面抗原Tab.1 Partial tumor surface antigens which may be used as target
2017年8月30日,美国食品药品监督管理局(FDA)批准诺华制药公司用于治疗儿童和青少年复发性/难治性急性B淋巴细胞白血病的CAR-T产品Kymriah(CTL019)上市,成为首个上市的CAR-T治疗产品。Kymriah在治疗复发性或难治性急性B淋巴细胞白血病方面效果显著[20-22]。2017年10月19日,凯特制药公司的Yescarta(KTE-C19)也被美国FDA批准用于治疗成人弥漫性大B细胞淋巴瘤[23-24]。上述两个已被批准上市的Kymriah和Yescarta均是以CD19作为靶点进行设计的。虽然目前CAR-T治疗的应用仍限制在无特效治疗手段的晚期肿瘤患者,但随着对特异性抗原靶点研究的深入和临床应用风险评估数据的积累,将有越来越多的患者适宜采用CAR-T治疗。
CAR-T免疫疗法可通过直接杀灭作用和形成长效抗肿瘤机制发挥肿瘤治疗作用。一方面,CAR-T直接与肿瘤细胞表面特异性抗原结合后,通过释放穿孔素、颗粒霉素B等直接杀伤肿瘤细胞;另一方面,CAR-T免疫疗法也可通过释放细胞因子募集人体内源性免疫细胞杀灭肿瘤细胞,还可在治疗后形成记忆T细胞获得特异性的长效抗肿瘤功能。
2.2C A R-T免疫疗法在血液系统肿瘤中的应用CAR-T免疫疗法在血液系统恶性肿瘤治疗中的安全性和有效性已得到广泛证实。FDA批准的第1个CAR-T用于治疗复发性/难治性B细胞急性淋巴细胞白血病(recurrent/refractory B-cell acute lympho-blastic leukemia,r/r-ALL)[52]。另外,CAR-T用于治疗慢性淋巴细胞白血病、肥大细胞白血病、弥漫性B细胞淋巴瘤和滤泡性淋巴瘤均已处于临床试验和实践应用阶段[53-55]。CAR-T免疫疗法治疗B细胞复发/难治性急性淋巴细胞白血病具有较高的安全性和有效性。在对1例12岁女孩患者接受氟达拉滨、丁磺胺和环磷酰胺联合CD19-CAR-T细胞作为治疗方案的研究中发现,包括CD19-CAR-T调节联合异基因造血干细胞移植治疗r/r-ALL安全有效,提示CD19-CAR-T可作为低强度毒性治疗r/r-ALL的一部分[56]。CD19-CAR-T治疗的难治性/复发性急性淋巴细胞白血病患者获得了更高的缓解率和更长的生存期,也证实了CD19-CAR-T治疗在r/r-ALL中的效果[57]。JACOBY等[58]在对21例r/r-ALL患者采用CD19-CAR-T治疗时也发现,患者的治疗缓解率达90%,但也同时伴随有较严重的不良反应,其中16例患者出现细胞因子释放综合征,11例患者出现神经毒性。虽然CD19-CAR-T治疗对复发或难治性急性淋巴细胞白血病效果显著,但严重的神经毒性副反应也应引起重视。在对53例成人复发或难治性急性淋巴细胞白血病患者的治疗中发现,神经毒性的发生可能与CD19-CAR-T细胞以外的细胞成分有关,且系统性炎症反应也与特征性神经毒性症状存在一定相关性[59]。免疫逃逸和脱靶效应等是影响CAR-T免疫疗法临床效果的重要方面。在急性髓系白血病细胞上同时定位CD123和CD33抗原可在治疗急性髓系白血病的同时消除白血病干细胞,预防由于抗原逃逸或白血病干细胞持续引起的疾病复发[60]。CAR-T免疫疗法用于血液系统肿瘤治疗的临床试验不断增多,但仍需对该技术进行进一步的优化,包括探索肿瘤表面特异性靶抗原、优化CAR的结构设计和CAR-T的制备工艺及筛选方法,在不断提高临床治疗效果的同时降低副反应或不良反应的发生率[61-62]。
2.3C A R-T免疫疗法在实体肿瘤治疗中的应用CAR-T免疫疗法在血液系统肿瘤治疗中的安全性和有效性已经得到广泛的证实,但由于实体肿瘤复杂的生物学特性和高异质性等特点,CAR-T免疫疗法在实体肿瘤治疗过程中的低浸润性、脱靶效应等是临床应用的较大挑战。同时,实体肿瘤微环境的免疫抑制作用也是影响CAR-T免疫疗法用于实体肿瘤治疗的不利因素[63-64]。
CAR-T免疫疗法特异性或相关性抗原靶点的选择是治疗实体肿瘤的首要问题。血液肿瘤细胞表面存在CD19等特异性靶点是其有效治疗血液系统恶性肿瘤的最主要原因。但实体肿瘤中特异性抗原靶点较少,相关性抗原靶点虽然在肿瘤组织中表达较高,但在正常组织中也有一定量的表达,最终会引起脱靶效应等,对其临床治疗造成障碍。虽然目前尚无CAR-T免疫疗法被批准用于实体肿瘤的治疗,但针对肿瘤表面不同抗原设计的CAR-T免疫疗法在非小细胞肺癌(non-small cell lung cancer,NSCLC)、胃癌等实体肿瘤的治疗应用中已经广泛开展[65-67]。EGFR为实体肿瘤表面的相关性抗原靶点,据此设计的EGFR-CAR-T细胞与靶细胞孵育后,细胞因子的分泌显著增加,且EGFR-CAR-T细胞对下咽癌肿瘤细胞的杀伤作用高于CAR-T对照组,证实EGFRCAR-T免疫疗法对下咽癌有显著的治疗作用[68]。NSCLC的有效治疗是肿瘤治疗领域最有挑战的课题之一。经EGFR修饰的CAR-T细胞在体外表现出时间和抗原依赖性的扩张能力和抗癌效果,在体内也显示出明显的消退肺癌转移瘤的作用,即EGFRCAR-T治疗是提高NSCLC过继免疫治疗有效性的方法[67]。EGFR-CAR-T免疫治疗有望成为NSCLC治疗的新思路。HER2蛋白在胃癌中高比例表达并影响肿瘤干细胞亚群的维持,是临床治疗HER2阳性胃癌的靶点[69-70]。以不依赖MHC的方式激活HER2-CAR-T可有效杀死HER2阳性胃癌细胞,且与未转染的T细胞相比,HER2-CAR-T细胞具有更强的肿瘤抑制能力,提示CAR-T免疫疗法在HER2阳性晚期胃癌患者中具有较好的应用前景[71]。虽然目前尚无CAR-T免疫疗法被批准用于实体肿瘤的治疗,但研究证实,HER2-CAR-T细胞可在体内外杀死葡萄膜和皮肤黑色素瘤细胞,且HER2-CAR-T也能杀死对过继性T细胞移植耐药患者的黑色素瘤细胞[72]。探索实体肿瘤特异性的表面抗原(尤其是特异性抗原)、改善肿瘤微环境对CAR-T免疫疗法的抑制作用、降低副反应或不良反应的发生率将是CAR-T免疫疗法治疗实体肿瘤的探索方向。
3 CAR-T治疗存在的问题
通过设计不同类型的CAR基因,可实现对肿瘤的个体化精准治疗。CAR-T免疫治疗在血液系统恶性肿瘤及实体肿瘤的治疗中均表现出较好的应用前景。但同时,CAR-T免疫治疗后患者会出现脱靶效应及各种副反应,如神经系毒性、细胞因子风暴、基因修饰致瘤风险等,部分严重的副反应甚至会危及患者的生命。
3.1脱靶效应 脱靶效应是CAR-T免疫治疗最主要的风险。CAR-T细胞能高效识别、亲和TAA,但当正常组织也表达与肿瘤相同的TAA抗原时,CAR-T细胞则无法区分正常细胞和肿瘤细胞,进而对正常组织和细胞也造成攻击损伤[73]。理想的目标抗原应为特异性抗原,即仅在肿瘤细胞表面表达而不在正常细胞表面表达的TSA。CAR-T免疫疗法对血液系统恶性肿瘤临床效果显著的原因之一就是其特异性表面抗原。目前作为实体肿瘤靶点的大多数肿瘤抗原通常在正常细胞中也有低水平的表达,最终会引起脱靶效应的发生。CAR-T攻击表达目标抗原的正常细胞会导致正常细胞死亡和脏器损伤,甚至会危及患者生命。识别肿瘤表面特异性抗原并建立T细胞表面表达体系对避免脱靶效应的发生意义重大。因此,寻找肿瘤表面特异抗原是CAR-T免疫技术研究和临床应用的首要任务之一。
3.2神经系统毒性 CAR-T免疫治疗会产生神经系统毒性,也称为CAR-T相关脑病综合征。神经系统毒性症状包括运动障碍、嗜睡、谵妄、语言障碍、癫痫等。CAR-T免疫治疗产生的神经系统毒性可能与细胞因子被动扩散进入脑部有关,但其确切机制尚不明确。已有的证据提示,神经系统毒性可能与细胞因子风暴同时发生,但也可能发生在细胞因子风暴消退后[74-76]。CAR-T免疫治疗的神经系统毒性按照严重程度可分为5级,轻度的神经系统毒性通常是自限性的,可自行缓解,但重度神经系统毒性可能会危及患者生命,需进行干预治疗[77-78]。
3.3细胞因子风暴 也称为细胞因子释放综合征(cytokine release syndrome,CRS),是临床应用CAR-T治疗的最常见的急性不良反应[79]。CRS通常发生于患者接受治疗后的6~20 d。CAR-T细胞单链抗体可变区与靶抗原相互接触活化后,在清除肿瘤细胞的同时胞内结构-共刺激分子双重信号刺激会引起CAR-T释放大量的肿瘤坏死因子-α(TNF-α)、干扰素γ(IFNγ)、白细胞介素和C反应蛋白等炎症因子,诱发炎性反应。产生大量的细胞因子激活机体的免疫系统进而造成机体组织和器官的损害。细胞因子风暴会诱发患者发生呼吸衰竭、发热、疲劳、低血压、心动过速以及毛细血管渗透综合征等[80]。CRS损害的严重程度与患者肿瘤负荷、靶抗原密度以及接受到的CAR-T数量有关。根据发生的严重程度CRS可分为5级,其中≥3级为严重CRS。轻度的CRS通常是自限性的,但重度CRS可能会危及患者生命,需密切关注并采取干预措施。目前认为白细胞介素家族成员(IL-6、IL-10和IL-13)、C反应蛋白、TNF-α、单核细胞趋化蛋白1(monocyte chemoattractant protein-1,MCP1)等可作为预测CRS严重程度的参考指标。
3.4基因修饰风险 CAR-T免疫疗法是基因治疗与细胞治疗相结合的产物。虽然采用慢病毒或逆转录病毒可将CAR基因整合至T细胞并实现CAR基因的稳定表达,但CAR基因整合位点的不确定性也可能导致CAR-T免疫治疗造成潜在的致瘤性风险[81-82]。因此,采用新型的转导方式以降低CAR-T的致瘤性风险也是CAR-T免疫疗法研究的方向之一。
3.5疾病复发 CAR-T免疫疗法在治疗恶性肿瘤中显示了较好的临床效果,但部分患者也存在复发的现象。白血病患者在接受CD19-CAR-T治疗后多数患者能够得到缓解,但少数患者在治疗一段时间后会出现疾病复发的情况,其主要原因可能是由于白血病肿瘤细胞的CD19抗原丢失导致CD19-CAR-T无法识别,造成抗原的逃逸引起的[83-85]。设计双特异性嵌合抗原受体基因修饰T细胞能降低因抗原逃逸而导致的白血病复发的风险。
3.6实体肿瘤微环境与免疫耐受 实体肿瘤微环境中存在大量的免疫抑制分子,与成纤维细胞、内皮细胞和细胞外基质等一起构成巨大的免疫抑制网[86]。实体肿瘤微环境免疫抑制网能过分泌大量的白细胞介素、转化生长因子等细胞因子,严重抑制CAR-T对肿瘤细胞的抑制和杀灭作用。因此,避免实体肿瘤微环境的抑制作用是CAR-T免疫疗法用于实体肿瘤必须解决的问题。将CAR基因与IL-4和IL-7等细胞因子受体结合是提高CAR-T细胞对抗肿瘤微环境免疫抑制性、发挥抗肿瘤活性的策略之一[87]。
4 展望
CAR-T免疫治疗是目前最有潜力的肿瘤治疗方法。但国内尚缺乏CAR-T细胞的制备及质量控制的统一标准及管理规范,限制了制备机构和应用机构之间的有效交流。为了更好地控制CAR-T的质量,发挥更佳的治疗效果、降低不良反应的发生,应从以下几个方面加强:①制定确保CAR-T细胞制剂安全和可追溯的质量控制体系及管理规范,确保CAR-T治疗的有效性、安全性和规范性;②寻找肿瘤细胞的特异性抗原并设计CAR-T,强化T细胞识别能力;③优化CAR-T的制备工艺及筛选流程,降低副反应和不良反应的发生。CAR-T疗法属于自体(自体CART疗法)或异体(异体CAR-T疗法)T细胞疗法,治疗过程涉及抽血、分离、激活、转染、扩增、制剂、放行、冻干、运输和给药,生产工艺复杂,条件要求高,因此,必须优化制备工艺及筛选流程、缩短生产周期、降低用药成本;④加强CAR-T细胞制剂的质量控制,完善产品放行标准。制剂的质量控制参数包括但不局限于鉴别、转染效率、效价、T细胞亚群、细胞存活率以及安全性指标(无菌检查、支原体检测、内毒素检测、致瘤细胞残留、核酸残留、残余磁珠量、培养基及添加剂残留量等)。CAR-T疗法的每个产品均为独立批次,需要完整的放行检测。由于CAR-T免疫疗法的时效性要求较高,需探索快速、高效的检测方法。据估计,CAR-T的质控成本可能远高于工艺成本;⑤肿瘤治愈或缓解患者体内残存的CAR-T的消除。在设计CAR时在原有结构的基础上一方面增加分泌免疫因子功能,一方面引入自杀基因就是一个思路;⑥探索CAR-T免疫治疗不良反应的应对措施,降低治疗过程中不良反应的损害。
CAR-T作为一个新兴的治疗领域取得了较大的进展,但也存在诸多挑战,如多种新技术进入该领域后的安全性评估,起始材料差异性大与生产工艺一致性的难调和等。目前CAR-T免疫治疗领域尚无足够的相关的风险评估数据。因此,基于CAR-T治疗个体化、产量小和批次有限等特点,需要在原材料及辅料控制、生产制备工艺、安全性评价等方面进一步突破。在以后的研究和应用中应着重解决CAR-T细胞治疗产品的安全性、有效性、质量可控性和生产工艺的一致性,在确保治疗效果和安全性的基础上不断突破使用人群的限制。

