p-BRAF在心肌缺血再灌注损伤中的作用和机制研究
王 菲,李培峰,高岩岩
(青岛大学转化医学研究院,青岛 266021)
心肌缺血再灌注(Myocardial ischemia reperfusion,MIR)可恢复心肌缺血造成的血流、供氧和营养不足,是恢复正常细胞稳态和挽救心肌的必要手段[1-2],但是缺血心肌在恢复血液再灌注后,可能进一步引起细胞死亡[3]形成不可逆的心肌损伤,即“心肌缺血再灌注损伤(Myocardial ischemia-reperfusion injury,MIRI)”[4-5]。目前原因尚不完全明了,但普遍认为线粒体作为细胞的能量代谢中心,可通过提供心脏收缩弛豫循环所需的能量以及活性氧(ROS)产生、代谢调控、钙平衡等核心功能在维持心脏稳态中发挥重要作用[6-7]。已有研究表明,线粒体Ca2+超载可致使线粒体通透性转换孔(Mitochondrial Permeability Transition Pore,mPTP)不可逆性过度开放,是导致心肌缺血再灌注损伤的关键因素之一[8]。BRAF作为 Raf 激酶家族成员,是下游丝裂原激活的蛋白激酶(MAPK)途径中最强激活剂,可影响细胞的增殖、分裂、分化等诸多过程,在控制细胞生长和调节方面发挥着重要作用[9]。大量研究表明,MAPK通路中发生的BRAF突变会使下游的细胞信号持续激活,细胞不受控制地生长和增殖,发挥致癌驱动作用[10-12]。近年来,BRAF抑制剂已作为肿瘤靶向药物得到广泛应用,但一些患者会对治疗产生获得性耐药。有研究表明,BRAF丝氨酸729磷酸化可能导致了异常剪接版本的BRAF V600E与MEK的结合力增加,在BRAF抑制剂耐药中起重要作用[13-14]。另有研究表明BRAF在心脏相关疾病中也发挥一定作用,可通过调节线粒体Ca2+参与调控病理性心肌肥大[15-17],但其在心脏中的更多功能以及p-BRAF(S729)作为其活化形式之一能否成为心肌缺血再灌注损伤等心血管疾病治疗的靶点仍有待深入研究。因此,本文基于心肌缺血再灌注的细胞与动物模型,研究MIR时p-BRAF的表达情况,以及干预p-BRAF对线粒体功能及细胞死亡的作用,为MIRI的临床研究提供新的靶点与思路。
1 材料与方法
1.1 材料
1~2日龄昆明小鼠乳鼠、C57BL/6小鼠(大任富城),DMEM/F12(SparkJade),胎牛血清(BI),胰液素、Ⅱ型胶原酶、钙离子荧光探针(Rhod-2/AM)(翊圣生物科技公司),RIPA裂解液(索莱宝),BCA蛋白浓度测定试剂盒(索莱宝),ECL超敏显影液(雅酶),线粒体通透性转换孔(MPTP)检测试剂盒(碧云天),propidium iodide(PI,US Everbright Inc,China),Cyclosporin A(MCE),Ru360(MCE),BRAF shRNA腺病毒、BRAF mOE腺病毒(汉恒生物),冰台,眼科剪,弯头镊,小烧杯,260目过滤网,生理盐水,青链霉素(美仑生物),GAPDH(CST,2118S)、p-BRAF(S729)(Abcam,ab124794)、BRAF(SANTA,sc-55522)。
1.2 实验方法
1.2.1 小鼠原代心肌细胞的分离和培养 取雌雄不分的1~2日龄昆明小鼠乳鼠放至容器中,用75%的酒精清洗乳鼠1~2次。于超净台中用眼科剪取出乳鼠心脏,置于PBS中清洗心脏3次。在冰台上剪碎心脏,加入消化液,转移到灭菌的100 mL锥形瓶中。锡纸包裹瓶口后,37℃摇动水浴5 min,将上层液体移至含有5 mL血清的离心管(50 mL)中,再次加入消化液,反复10次以上直到消化完毕。收集消化产物,1000 r/min离心5 min,弃上清,用DMEM/F12悬起沉淀,再次离心。加入10 mL的含有5%血清的DMEM/F12重悬沉淀,通过260目过滤网过滤悬液,将其收集到10 cm培养皿中。置于恒温细胞培养箱内,于37℃温度下进行细胞培养。细胞差速贴壁 1~1.5 h后,收集细胞悬液,此时没有贴壁的细胞即为小鼠原代心肌细胞。将细胞接种于适合的细胞培养皿中,即可进行后续实验。
1.2.2 MIR模型的构建 构建缺氧复氧细胞模型(H/R):按照1.2.1步骤分离小鼠原代心肌细胞,培养24 h后换液。实验分为三组,常氧(Normoxia)组使用含有5%血清的 DMEM/F12培养基于正常培养箱持续培养,缺氧(Hypoxia)组和H/R组用DMEM/F12无糖无血清培养基预处理24 h后,转移至缺氧培养箱培养6 h,H/R组缺氧6 h后更换5%血清的DMEM/F12培养基继续培养3~12 h,即可用于后续分析。
构建心肌缺血再灌注小鼠模型(I/R):将雄性C57BL/6小鼠分为三组,假手术组仅实施开胸手术;梗死组和I/R组在小鼠麻醉消毒后,连接心电图,实施气管插管,连接呼吸机,开胸结扎冠状动脉左前降支45 min,缺血45 min后,I/R组松动结扎物,再灌注复流3~6 h,再观察心电图,上抬的ST段下降50%以上或恢复到缺血前水平,表明再灌注成功。在再灌注结束时,收集组织样本用于后续分析。
1.2.3 Western blot检测MIR时的蛋白表达 RIPA裂解液(混有1×PMSF, 1×Phosphatase inhibitor cocktail)裂解组织或细胞样品,4℃离心机12 000 r/min离心15 min,收集上清。BCA法检测蛋白浓度后,在上清中加入适量4×蛋白上样缓冲液,98℃煮10 min。选择适当浓度的SDS-PAGE胶分离蛋白并转移到PVDF膜上,50 g/L的脱脂牛奶封闭非特异性结合位点1 h,膜和按比例稀释的一抗在4℃的冷室中孵育过夜。次日使用适量的TBST清洗膜10 min,重复3次,用抗鼠或抗兔二抗孵育膜1.5 h,再次使用适量的TBST清洗膜3次,即可通过化学发光仪来检测信号,以GAPDH为参照分析免疫印迹的条带强度。
1.2.4 细胞病毒感染 当细胞密度70%~80%,即可进行腺病毒感染。将细胞分为Normoxia组和H/R组,每组将干扰或过表达腺病毒及其对照以multiplicity of infection(MOI)=300的病毒量感染细胞,空白对照不做任何处理,6 h后更换培养基。细胞感染24 h后,即可按照Normoxia组和H/R组分别预处理,细胞缺氧6 h并复氧3 h后可用于后续实验。
1.2.5 细胞加药处理 将细胞分为Normoxia组和H/R组,每组又分空白对照组、CsA组和Ru360组。在细胞按照Normoxia组和H/R组分别进行预处理的最后8 h,CsA组加入CsA(5 μmol/L),作用8 h后换为加药前相对应的培养基进行常氧/缺氧。此时,Ru360组加入Ru360(10 μmol/L),作用1 h后换为相对应的培养基继续常氧/缺氧5 h。换液后复氧3 h即可用于进行后续实验。
1.2.6 心肌细胞线粒体Ca2+水平检测 将原代心肌细胞接种于含有12 mm玻片的24孔板中,按实验要求进行不同处理后,吸出培养液,HEPES(25 mmol/L)清洗细胞3遍。加入适量钙离子荧光探针(Rhod-2/AM)工作液(4 μmol/L),缓慢晃动孔板,使染料能够均匀覆盖所有细胞,37℃条件下避光孵育30 min。去除工作液后,HEPES清洗细胞3遍,37℃条件下继续避光孵育30 min。吸除HEPES,加入适量4%多聚甲醛,常温下固定15 min,HEPES清洗细胞2遍后,取出玻片,封片并固定在载玻片上,即可在激光共聚焦显微镜下观察。
1.2.7 心肌细胞mPTP检测 将原代心肌细胞接种于35 mm的玻底培养皿中,按实验要求进行不同处理后,吸出培养液,PBS清洗细胞2遍后,加入适当体积的荧光淬灭工作液:500 μL检测缓冲液+0.5 μL钙黄绿素乙酰氧基甲酯(Calcein AM)+5 μL 促溶剂+ 7 μL CoCl2,缓慢晃动培养皿,使染料能够均匀覆盖所有细胞,37℃条件下避光孵育30 min。工作液更换为新鲜的37℃预热的培养基(无血清),再次于37℃条件下避光孵育30 min。吸出培养基, PBS清洗细胞2遍,培养皿加入检测缓冲液,即可在激光共聚焦显微镜下观察。
1.2.8 PI染色检测细胞死亡 将原代心肌细胞接种于24孔板中,按实验要求进行不同处理后,吸出培养液,PBS清洗细胞2遍,加入适当体积的碘化丙啶(PI)稀释染液(1∶10 000),缓慢晃动孔板,使染料能够均匀覆盖所有细胞。冰上避光静置5 min,镜下观察出现红色即可吸出染液,PBS清洗细胞1遍。加入适量4%多聚甲醛,常温下固定15 min,PBS清洗细胞2遍后,即可在荧光显微镜下观察。
1.3 统计学方法

2 结果
2.1 MIR中线粒体Ca2+超载和mPTP开放导致心肌细胞死亡
为了验证MIRI与线粒体功能密切相关,在小鼠原代心肌细胞中通过H/R模拟MIR,观察发现H/R时心肌细胞Rhod-2荧光强度明显增加(图1(a)),Calcein荧光强度明显降低(图1(b))(P均<0.05)。分别在心肌细胞中加入线粒体钙摄取抑制剂Ru360和mPTP开放抑制剂CsA,观察H/R时心肌细胞死亡的变化。与Normoxia组相比,H/R后细胞死亡率明显增加,但在Ru360和CsA的作用下,这种细胞死亡率的增加得到明显恢复(P均<0.05)(图1(c))。

图1 MIR中线粒体Ca2+超载和mPTP开放导致心肌细胞死亡(a)Rhod-2/AM染色检测相对荧光强度;(b)CalceinAM染色检测相对荧光强度;(c)PI染色检测细胞死亡率
2.2 p-BRAF在MIR中上调并促进心肌细胞死亡
在细胞和动物水平上构建MIR模型,检测p-BRAF和BRAF的蛋白表达情况如图2(a)、(b)所示。BRAF蛋白表达量无明显变化,而p-BRAF的蛋白表达量在再灌注过程中明显升高(P<0.05)。构建BRAF shRNA/BRAF mOE腺病毒(图2(c)、(d)),发现BRAF敲低后,H/R造成的细胞死亡增加明显降低(P<0.05)(图2(e));p-BRAF过表达后,Normoxia组细胞死亡数量明显增加(P<0.05),H/R造成的细胞死亡增加无明显降低(图2(f))。

图2 p-BRAF在MIR中上调并促进心肌细胞死亡(a)Western blot检测心肌细胞H/R过程中p-BRAF和BRAF的蛋白表达;(b)Western blot检测小鼠MIR过程中p-BRAF和BRAF的蛋白表达;(c)Western blot检测BRAF shRNA腺病毒的效率(MOI=300);(d)Western blot检测BRAF mOE腺病毒的效率(MOI=300);(e)PI染色检测敲低BRAF后细胞死亡率;(f)PI染色检测过表达p-BRAF后细胞死亡率
2.3 p-BRAF导致心肌细胞线粒体Ca2+超载和mPTP开放
小鼠原代心肌细胞分别感染BRAF shRNA干扰腺病毒和BRAF mOE过表达腺病毒后,检测线粒体Ca2+和mPTP的变化,发现BRAF干扰后,Normoxia组Rhod-2荧光强度无明显变化,H/R造成的Rhod-2荧光强度增加得到明显恢复(图3(a))(P<0.05)。p-BRAF过表达后,Normoxia组Rhod-2荧光强度明显增加,Calcein荧光强度明显降低(P<0.05),而H/R造成的Rhod-2荧光强度增加,Calcein荧光强度降低在p-BRAF过表达后无明显变化(图3(b)、(c))。
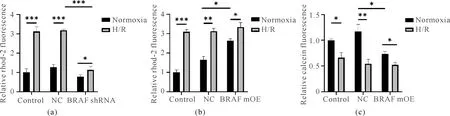
图3 p-BRAF导致心肌细胞线粒体Ca2+超载和mPTP开放(a)Rhod-2/AM染色检测BRAF干扰后相对荧光强度;(b)Rhod-2/AM染色检测p-BRAF过表达后相对荧光强度;(c)Calcein AM染色检测p-BRAF过表达后相对荧光强度
3 讨论
心肌缺血再灌注作为恢复血流的重要手段,是治疗缺血性心脏病尤其是急性心肌梗死最有效的方法。但它也是“双刃剑”,因为再灌注本身会导致MIRI即原缺血的心肌反而受到更严重的损伤。越来越多的研究证据表明,线粒体介导的细胞死亡在MIRI的发病机制中起着关键作用,并涉及到线粒体钙稳态的结构和功能mPTP开放[18-21]。
线粒体Ca2+浓度可对线粒体ATP的生成、离子通道的通透性以及钙信号转导通路的调节发挥重要作用[22-23]。有研究表明线粒体Ca2+超载可诱导线粒体内膜mPTP开放,使线粒体膜(IMM)不选择性地渗透小于1.5 kDa的分子,破坏线粒体膜电位,解偶联氧化磷酸化,导致ATP耗竭和细胞死亡[24-26]。本研究基于此,分析了H/R过程中线粒体Ca2+和mPTP水平的变化,再次证明了MIR过程中线粒体Ca2+超载和mPTP的开放。另有大量研究表明Ru360作为一种选择性的线粒体钙摄取的抑制剂,可有效抑制Ca2+吸收到线粒体中,具有一定的心脏保护作用[27-28],CsA靶向Cyp-D可抑制mPTP的开放,减轻MIRI[29]。本研究通过PI染色分析发现Ru360和CsA在H/R中可有效抑制心肌细胞死亡,提示线粒体Ca2+超载和mPTP开放造成的MIRI是通过细胞死亡实现的。因此,维持线粒体钙稳态、抑制mPTP开放对降低心肌细胞死亡率改善MIRI具有重要意义。RAF基因家族包含BRAF、ARAF和CRAF,其中BRAF自21世纪初已被确定为人类肿瘤中的一种常见突变基因[30],其S729磷酸化位点已被证实在肿瘤治疗中具有重要研究价值[31]。随着相关研究的深入和多样化,证明BRAF在心肌重塑中也发挥一定作用,为探究其在心肌重塑中可能的调控机制,本文构建了MIR细胞和小鼠模型,发现在MIR中BRAF表达水平无明显变化,而p-BRAF(S729) 明显上调,这说明在MIR过程中BRAF在S729位点发生了磷酸化,并可能通过磷酸化的形式发挥一定的作用。在干扰/过表达p-BRAF后,通过分析H/R过程中线粒体Ca2+浓度、mPTP水平和细胞死亡情况的变化,显示p-BRAF在MIR过程中能够通过介导线粒体Ca2+超载和mPTP的开放导致心肌细胞死亡。基于p-BRAF和线粒体功能的相关性分析,本文认为其调控机制可能与线粒体相关蛋白有关,可以从p-BRAF的分子层面入手展开MIRI发生机制研究,为心肌缺血再灌注损伤患者带来希望。
4 结论
本研究结果在证明MIR造成的心肌细胞死亡与线粒体Ca2+超载和mPTP开放密切相关的基础上,通过构建MIR细胞和小鼠动物模型,首次发现p-BRAF在MIR中明显上调,并在干扰/过表达p-BRAF后,证明了其能够通过介导线粒体钙超载和mPTP开放导致心肌细胞死亡造成心肌缺血再灌注损伤。p-BRAF可能作为一个新的靶点,助力于心肌缺血再灌注损伤的预防和治疗,对心脏保护由基础研究走向临床应用具有实际意义。今后工作将探究p-BRAF在MIR过程中的具体调控通路,为心血管疾病的临床预后提供新思路。

