酸橙内生菌Bacillus thuringiensisBt028产几丁质酶的发酵条件优化
徐勤茜,张泽宇,陶雪婷,赵梓伶,李子院,2,郝再彬,2,李海云,2,
(1.桂林理工大学化学与生物工程学院,广西桂林 541004;2.广西高校食品安全与检测重点实验室,广西桂林 541004)
几丁质是由N-乙酰-D-葡糖糖胺以β-1,4 糖苷键连接而成的天然多糖和可再生多聚物,广泛存在于自然界,如无脊椎动物的外骨骼、虾蟹的外壳、真菌的细胞壁、线虫卵壳等[1]。几丁质是一类重要的生物资源,但由于其结构稳定、高结晶度而难溶于水及大多数有机溶剂[2−3],其应用受到很大限制而造成巨大的资源浪费。几丁质酶是一类能特异性催化几丁质水解的酶[4−6],其水解产物如几丁质寡糖、N-乙酰氨基葡萄糖等产物[7]具有良好的溶解性、生物相容性以及多种生物活性,被广泛应用于医药工业[8−10]、食品工业[11]、农业[12−13]等领域。微生物是几丁质酶的主要来源,国内外对微生物产生的几丁质酶进行了大量研究[14−17]。尽管如此,寻找产酶性能优良的微生物菌株仍是当前研究的主要方向之一[18]。
植物内生菌是一类生活在健康植物组织内部的,不引起宿主植物出现明显病害症状的一类微生物[19]。在与宿主植物长期共存的过程中,植物内生菌被赋予多种独特的生物活性,如能够产生与宿主植物相同或相似的活性物质[20−22]、广泛参与宿主次生代谢产物的合成与转化[23−24]等。近年来,植物内生菌的产酶特性及其在生物催化与生物转化领域的应用也开始受到人们的重视[25]。例如利用内生菌产葡萄糖苷酶对虎杖苷[26−27]、人参皂苷[28]的生物转化;Harwoko 等[29]从柳叶分离出的真菌能够对植物衍生的类黄酮进行生物转化反应;陈智慧等[30]从花魔芋实生种子中筛选出一株具有良好的酶学性质的产β-甘露聚糖酶内生菌。
酸橙(Citrus aurantiumL.)又称苦橙,其浓缩果汁含有丰富的黄酮类物质,具有抗氧化、抗炎症等多种生物活性[31]。目前尚未见有酸橙内生菌的研究报道。为进一步寻找产几丁质酶性能优良、实用潜力大的微生物菌株,课题组前期对产几丁质酶的酸橙内生菌进行了分离筛选,获得一株产酶性能较好的Bacillus thuringiensisBt028 菌株。本文对该菌株产几丁质酶的发酵条件进行优化,为后期几丁质酶的分离纯化、酶学性质、实际应用等研究奠定基础。
1 材料与方法
1.1 材料与仪器
酸橙 采自桂林永福苏桥镇,新鲜酸橙果实;酸橙内生菌Bacillus thuringiensisBt028 分离自酸橙果实,保存于桂林理工大学生物工程实验室;几丁质、3,5-二硝基水杨酸、β-D-N-乙酰氨基葡萄糖 分析纯,购于上海易恩化学技术有限公司;硫酸镁、硫酸亚铁 分析纯,购于天津市大茂化学试剂厂;蛋白胨、酵母粉、琼脂磷酸氢二钠、磷酸二氢钠、氯化钠、氢氧化钠、酒石酸钾钠、苯酚、结晶亚硫酸钠、磷酸分析纯,购于西陇化工股份有限公司;Bt 平板活化培养基:蛋白胨10 g/L、酵母粉5 g/L、氯化钠5 g/L、琼脂15 g/L;几丁质酶发酵培养基:胶体几丁质10 g/L、酵母粉10 g/L、K2HPO40.7 g/L、KH2PO40.3 g/L、MgSO4·7H2O 0.5 g/L、FeSO4·7 H2O 0.01 g/L,pH 7.0。
LRH-150-Z 振荡培养箱 珠江留关市泰宏医疗器械有限公司;BX30R 立式压力蒸汽灭菌器 上海博讯实业有限公司;CJ-ISFS 医疗设备超工作台 天津市泰斯特仪器有限公司;VIS-7220N 可见分光光度计 北京瑞利分析仪器有限公司;HH-S2 型数显恒温水浴锅 金坛市医疗仪器厂;ZXRD-B5110 鼓风干燥箱 上海智城分析仪器制造有限公司。
1.2 实验方法
1.2.1 胶体几丁质的制备 将几丁质粉碎过100 目筛即得细粉几丁质,参考文献方法[32],称取25 g 细粉几丁质,加250 mL 85%磷酸,30 ℃反应1 d,然后加蒸馏水使胶体沉淀后,反复水洗直至中性。用0.02 mol/L NaH2PO4-Na2HPO4缓冲液(pH=6.0)调整终溶度至10%,4 ℃保存。
1.2.2 培养条件对Bt028 菌株产几丁质酶的影响斜面保存的Bacillus thuringiensisBt028 经平板培养活化24 h 后,挑取一环接入100 mL 几丁质酶发酵培养基中(250 mL 三角瓶),在温度为30 ℃,转速为180 r/min 的摇床上振荡培养24 h,即为种子液,此时为菌株生长时间。将种子液按照3%的接种量接入到装有100 mL pH7.0 的几丁质酶发酵培养基的250 mL 三角瓶中,在温度为30 ℃、转速为180 r/min的摇床上振荡培养48 h,此时为菌株产酶时间。发酵液在4 ℃、12000 r/min 条件下离心10 min,收集上清液即为粗酶液,4 ℃冰箱储存,用于几丁质酶酶活的测定。
1.2.2.1 单因素实验 按上述摇瓶培养方法,分别考察碳源种类(粉末几丁质、胶体几丁质、淀粉、乳糖、蔗糖、麦芽糖、葡萄糖)、碳源浓度(0.25%、0.5%、1%、1.5%、2%、2.5%)、氮源种类(酵母浸粉、蛋白胨、酵母粉、硫酸铵、氯化铵、硝酸铵、硝酸钠)、氮源浓度(0.5%、1.0%、1.5%、2%、2.5%、3%)、初始pH(5.5、6.0、6.5、7.0、7.5、8.0)、培养温度(20、25、30、35、40、45 ℃)、接种量(0.5%、1%、2%、3%、4%)、装液量(50、75、100、125、150 mL/250 mL)、摇床转速(100、120、140、160、180、200 r/min)、生长时间(12、24、36、48、60、72、84、96、108、120 h)、产酶时间(12、24、36、48、60、72、84、96 h)等因素对菌株Bt028 产几丁质酶的影响,以碳源种类为第一因素实验时,其他条件为碳源浓度1%、氮源种类蛋白胨、氮源浓度1.0%、初始pH7.0、培养温度30 ℃、接种量3%、装液量100 mL/250 mL、摇床转速180 r/min)、生长时间48 h、后续因素的实验均在前一因素实验的较优结果上进行。
1.2.2.2 响应面优化试验 根据单因素实验结果,选择3 个对酶活影响较显著的因素进行响应面设计,根据Box-Behnken 设计原理,运用Design-Expert 进行三因素三水平响应面试验设计,共计17 个实验点的响应面分析试验,实验选取的因素和水平见表1。

表1 试验因素和水平编码值Table 1 Test factors and level coding values
1.2.3 几丁质酶酶活的测定 参考戴德慧等[33]方法并加以改进,分别吸取5 mmol/Lβ-D-N-乙酰氨基葡萄糖标准液0、0.2、0.4、0.6、0.8 mL 于1、2、3、4、5 号试管中,用蒸馏水补至1 mL,再加入1 mL DNS试剂,混匀后沸水浴中煮沸5 min,冷却后用蒸馏水稀释至10 mL,以1 号试管为对照,测定540 nm 波长处吸光度,以A540为纵坐标、β-D-N-乙酰氨基葡萄糖浓度C(mmol/L)为横坐标绘制β-D-N-乙酰氨基葡萄糖标准曲线,其标准曲线方程为A540=0.0074C-0.03(R2=0.9987)。
粗酶液酶活测定[33]:取0.5 mL 粗酶液与0.5 mL含1.0%胶体几丁质的磷酸缓冲液(0.1 mol/L,pH7.0)混合,50 ℃保温20 min 后,沸水浴10 min,冷却后加入1 mL DNS 试剂,在沸水中煮沸5 min 后用蒸馏水稀释至10 mL,以粗酶液加磷酸缓冲液(0.1 mol/L,pH7.0)为对照,按上法测定β-D-N-乙酰氨基葡萄糖浓度,并计算几丁质酶酶活。
几丁质酶酶活单位定义为:在50 ℃,pH=7.0 的条件下,每分钟催化几丁质生成相当于l μmolβ-DN-乙酰氨基葡萄糖所需的酶量为一个酶活单位。
1.3 数据处理
实验中每个处理重复三次,利用Design-Expert软件设计响应面试验并进行结果分析,采用SPSS 软件分析数据的显著性,利用Origin 以及Excel 对试验数据处理分析并进行图表制作。
2 结果与分析
2.1 培养条件对Bt028 菌株产几丁质酶的影响
2.1.1 不同碳源对菌株Bt028 产几丁质酶的影响本实验研究了7 种不同碳源对菌株Bt028 几丁质酶产量的影响,由图1 可知,采用这7 种碳源发酵培养基所获得的几丁质酶酶活有着很明显的差异。其中以几丁质作为碳源时,菌株Bt028 产几丁质酶的活力远高于其他碳源;同浓度的胶体几丁质诱导菌株Bt028 产几丁质酶的性能又优于粉末几丁质,其余5 种碳源培养基所得到的发酵液酶活明显不如前者,故表明胶体几丁质是诱导Bt028 产几丁质酶的最佳碳源。

图1 碳源种类对几丁质酶合成的影响Fig.1 Effects of carbon sources on synthesis of chitinase注:不同小写字母代表差异显著(P<0.05);图2~图11 同。
2.1.2 胶体几丁质浓度对菌株Bt028 产几丁质酶的影响 以胶体几丁质为碳源,考察其浓度对菌株Bt028 产几丁质酶的影响。图2 结果显示,随着胶体几丁质浓度的增加酶活力逐渐上升,在浓度为1%时达到最高,与其他胶体几丁质浓度下几丁质酶活性存在显著性差异(P<0.05)。在此基础上增加培养基中几丁质的浓度,产酶能力反而下降。这说明Bt028不仅对碳源的种类有着专一的要求,而且对碳源的浓度也比较严格,在胶体几丁质浓度小于0.5%的条件下,产酶能力迅速降低。当胶体几丁质浓度高于1%,随着其浓度的增加,酶活不断降低。几丁质含有的大量羟基和氨基具有很强的吸附能力[34],当浓度过高时酶会被吸附在几丁质上从而降低了离心后上清液的酶活。

图2 胶体几丁质浓度对几丁质酶合成的影响Fig.2 Effect of colloidal chitin concentration on the synthesis of chitinase
2.1.3 氮源种类对菌株Bt028 产几丁质酶的影响细菌可利用的氮源可分为有机氮和无机氮。将Bt028菌种液接种于含不同氮源的产酶培养基中,测定几丁质酶活,结果如图3 所示,添加的几种有机氮源酵母浸粉、蛋白胨、酵母粉均能提高产酶能力,其中酵母粉的效果最明显,铵盐、硝酸盐等无机氮源则使产酶能力有不同程度下降,故酵母粉这种有机氮源更容易被利用,从而提高产酶能力。从酶活的大小来看,有机氮(酵母浸粉、蛋白胨、酵母粉)明显优于无机氮(硫酸铵、氯化铵、硝酸铵、硝酸钠),表明菌株Bt028 几丁质酶合成对氮源的种类具有选择性。

图3 氮源种类对几丁质酶合成的影响Fig.3 Effects of nitrogen sources on chitinase synthesis
2.1.4 酵母粉浓度对菌株Bt028 产几丁质酶的影响 以酵母粉为氮源,考察其浓度对菌株Bt028 产几丁质酶的影响,结果如图4 所示。结果表明,当酵母粉浓度为1%时,菌株Bt028 发酵液中几丁质酶酶活最高。当氮源浓度高于1%时,随着底物浓度的升高使得溶液的粘稠度增加,影响酶的作用,因此酶活迅速降低,故酵母粉浓度以1%为最佳。
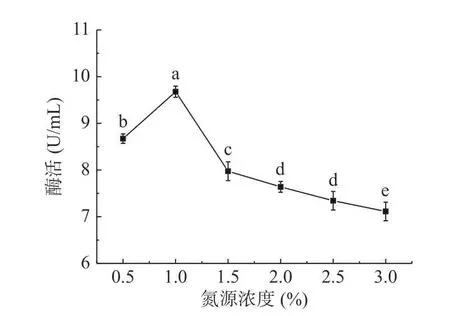
图4 酵母粉浓度对几丁质酶合成的影响Fig.4 Effect of yeast powder concentration on chitinase synthesis
2.1.5 培养基初始pH 对菌株Bt028 产几丁质酶的影响 微生物各项生命活动都与酶反应息息相关,pH直接影响各种酶活力,在最适pH 条件下,才可能发挥最佳酶活。将Bt028 菌株接种于初始pH 不同的产酶培养液中,测定酶活力,结果见图5。当培养基pH 为5.5 时,与pH7.0 时酶活相比,几丁质酶酶活显著降低(P<0.05);当pH 大于5.5 时,酶活不断提高,pH 为7.0 时,几丁质酶酶活最高,且与其他pH 下几丁质酶活存在显著性差异(P<0.05)。结果表明菌株Bt028 产酶最佳的初始pH 为7.0,该菌株适合在中性环境下生长代谢。

图5 初始pH 对几丁质酶合成的影响Fig.5 Effect of initial pH on chitinase synthesis
2.1.6 培养温度对菌株Bt028 产几丁质酶的影响发酵温度主要影响细胞产生酶的活力,温度过高或过低都会降低酶活;只有发酵温度适宜时,菌株才会最大限度利用培养基中营养物质。将Bt028 菌株接种于产酶培养基中,分别在不同温度下培养,测定酶活力。结果见图6,当培养温度为20~30 ℃时,酶活随温度的升高而增加;当温度高于30 ℃时,酶活开始急剧下降。因此,当培养温度达到30 ℃左右时,菌株生长代谢所产生的几丁质酶活性最高,且与其他几个温度下几丁质酶酶活显著性差异(P<0.05)。

图6 温度对几丁质酶合成的影响Fig.6 Effect of temperature on chitinase synthesis
2.1.7 接种量对菌株Bt028 产几丁质酶的影响 如图7 所示,当接种3%菌种液时,酶活力最高为10.11 U/mL;在接种量低于3%时,随着接种量的升高,几丁质酶活不断提升;当接种量大于3%时酶活下降,是由于接种量过大导致瓶内菌株大量繁殖,过快消耗瓶内营养物质和氧气,导致菌体停止合成分泌几丁质酶甚至死亡,使酶活降低,因此最佳接种量为3%。

图7 接种量对几丁质酶合成的影响Fig.7 Effect of inoculation amount on chitinase synthesis
2.1.8 装液量对菌株Bt028 产几丁质酶的影响 图8表明,当装液量为50~100 mL/250 mL时,菌株产几丁质酶酶活缓慢上升,到100 mL/250 mL达到最高,这是因为装液量较少,发酵液中溶氧量充足;但当装液量超过100 mL/250 mL 时,摇瓶内溶氧不足,从而使菌株代谢受到抑制,发酵液活性反而降低,由此说明最适装液量为100 mL/250 mL。

图8 装液量对几丁质酶合成的影响Fig.8 Effect of liquid loading on chitinase synthesis
2.1.9 摇床转速对菌株Bt028 产几丁质酶的影响摇床转速影响到发酵液中氧气的溶解量以及底物、产物的传质过程。如图9 所示,摇床转速在150~200 r/min 范围内,酶活力呈现先升高后减小,在转速达到180 r/min 时,测得的酶活力达到最高。当摇床转速在100~150 r/min 时,酶活力随着转速的增加不断升高,转速低导致培养液中的溶氧率太低,而高转速提供的通气量能较好地满足菌体生成的需求;当转速高于180 r/min 时,虽然培养液中的通气量得到提升,但过高的振荡速率会菌体产生影响,不利于菌体和底物的接触,影响了菌株的生长,从而使得菌株产酶能力的降低,故Bt028 的最优摇床转速为180 r/min。

图9 摇床转速对几丁质酶合成的影响Fig.9 Effect of table speed on chitinase synthesis
2.1.10 培养时间对菌株Bt028 生长和产几丁质酶的影响 图10(a)为条件优化后的菌株生长曲线,结果表明培养36 h 内菌株处于对数生长期,菌体浓度迅速提高并达到最大值;在36~72 h,由于培养基中营养物质消耗、代谢产物积累等不利因素的影响,细菌繁殖速度渐趋下降,故菌体生长曲线在36~72 h 时逐渐下降,在72 h 后趋于稳定。菌株Bt028 培养过程中酶活随时间的变化如图10(b)所示。在前36 h,Bt028 处于对数生长期,该时期主要是菌株利用营养成分进行繁殖生长,几丁质酶产量较少;在36~48 h期间,随着菌体的快速增殖以及培养基中营养成分的减少,菌株开始迅速分泌几丁质酶并在48 h 左右达到最大,之后酶活力开始下降并趋于稳定。因此菌株Bt028 产几丁质酶的培养时间确定为48 h。

图10 Bt028 生长曲线和产酶曲线Fig.10 Growth curve and enzyme production curve of Bt028注:a 为Bt028 生长曲线;b 为Bt028 产酶曲线。
2.2 菌株Bt028 产几丁质酶发酵条件的响应面优化
2.2.1 回归模型建立及方差分析 根据单因素实验中对菌株Bt028 产几丁质酶影响相对较大的3 个因素:胶体几丁质的浓度、培养温度和培养基初始pH 对产酶培养条件进行优化。以胶体几丁质浓度(A)、培养温度(B)、培养基初始pH(C)3 因素为自变量,以几丁质酶活力为响应值,设计3 因素3 水平共17 个实验点,分为12 个析因点和5 个零点。试验因素水平选取见表1,实验设计与结果如表2 所示。

表2 Box-Behnken 试验设计及结果Table 2 Design and results of Box-Behnken tests
该响应面模型的显著性检验和方差分析结果(见表3)显示,该回归模型的P值<0.01,而失拟项的P值>0.05,证明模型建立成功;从表中P值可以看出其自变量B 对响应值的影响显著(P<0.05),自变量A、C、BC、A2、B2、C2对响应值影响极显著(P<0.01),AB、AC 影响不显著(P>0.05);回归系数R2=99.65%大于90%,校正决定系数R2Adj=0.9921>0.9,表明模型相关度很好;本试验的变异系数为1.03%,说明模型拟合较好;本模型精密度为45.594>4.0,说明胶体几丁质含量、培养温度、培养基初始pH 对产几丁质酶活力影响的试验数据可靠,此模型可用来分析和预测实验结果。各因素对苏云金芽孢杆菌Bt028 产几丁质酶酶活力影响的二次回归模型编码方程为:
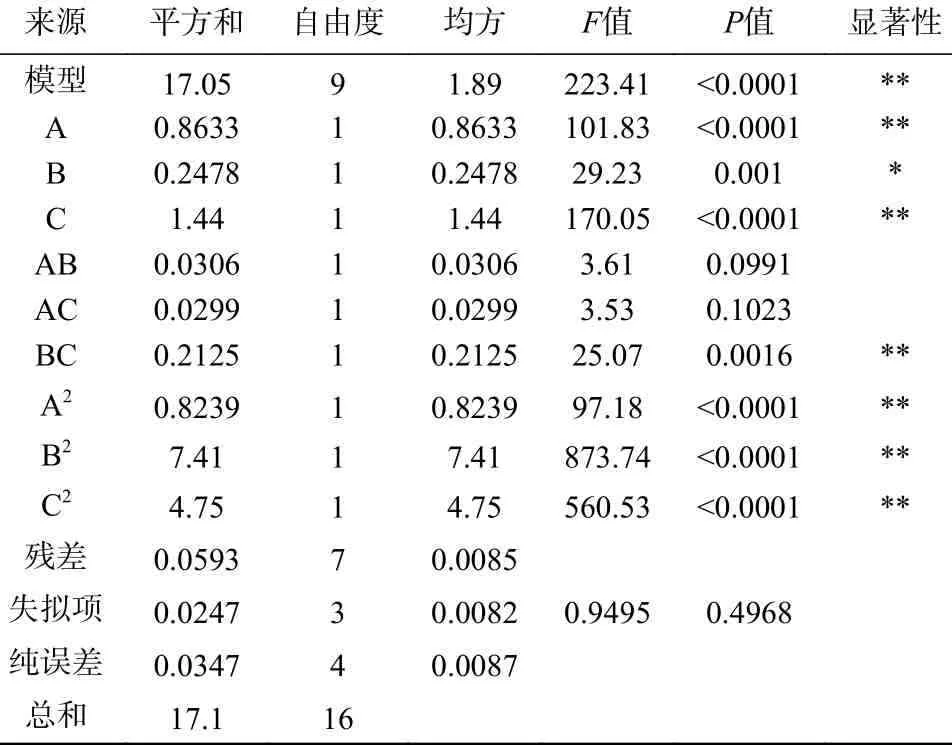
表3 回归模型方差分析Table 3 Variance analysis of regression model
酶活力(U/mL)=10.40−0.33A−0.18B+0.43C+0.09 AB+0.09AC+0.23BC−0.45A2−1.34B2−1.072C2。
2.2.2 响应曲面分析 对各因素对几丁质酶活力的交互影响进行响应面分析,结果见图11~图13。响应面图表明了实验因素对实验结果的影响,由图11~图13 可以看出,三个因素两两之间的交互作用响应面曲面均呈凸起趋势,说明存在最大响应值。运用Design-Expert12.0 软件对其结果进行分析,预测最佳发酵条件为胶体几丁质0.839%、培养温度29.615 ℃、培养基初始pH6.9155,几丁质酶活力理论值为10.50 U/mL。

图11 胶体几丁质浓度和温度交互作用对几丁质酶活影响的曲面图及等高线Fig.11 Response surface polt and contour polt showing the effects of interactions of colloidal chitin concentration and temperature on chitinase activity

图12 温度和pH 交互作用对几丁质酶活影响的曲面图及等高线Fig.12 Response surface polt and contour polt showing the effects of interactions of temperature and pH on chitinase activity

图13 胶体几丁质浓度和pH 交互作用对酶活力影响的曲面图及等高线Fig.13 Response surface polt and contour polt showing the effects of interactions of colloidal chitin concentration and pH on chitinase activity
2.2.3 验证试验 在考虑到实际实验操作的基础上,对模型的准确性进行验证,将软件分析得出的最佳发酵条件进行调整:胶体几丁质0.8%、酵母粉1%、发酵温度30 ℃、初始pH6.9、转速为180 r/min、装液量100 mL/250 mL、接种量3%、发酵时间48 h,3 次平行实验所得几丁质酶的平均酶活为10.48±0.28 U/mL,与理论值10.50 U/mL 接近,表明响应面法所得结果准确可靠。
3 结论
本实验通过单因素实验和响应面试验最终确定了Bt028 产酶的最适培养基组成为:胶体几丁质0.8%、酵母粉1%;最适产酶条件为初始pH 为6.9、接种量3%、装样量100 mL/250 mL、温度30 ℃、培养时间48 h。在此条件下,该菌株酶活最高可达到10.48 U/mL,较筛选时的3.56 U/mL 提高了1.94 倍。通过实验观察发现,本文筛选的Bt028 菌株从培养24 h 后开始大量产酶,在48 h 时达到最大值,说明该菌株有良好的产酶性能,具有较高的产酶效率,应用潜力较大,为几丁质酶的生产应用奠定了良好的基础。本文仅对该菌株的实验室摇瓶培养产酶条件进行了研究,对于该菌株产几丁质酶的工业生产工艺、酶的分离纯化、酶的催化特性及其在食品、农业等领域的应用等还有待于进一步深入研究。

