饲料中添加丁酸梭菌对卵形鲳鲹幼鱼生长性能和肠道菌群的影响
吴 杨,杨 铿,黄小林,周传朋,徐创文,黄 忠,,虞 为,,荀鹏伟,5,黄健彬,5,麦晓勇,林黑着,
1. 河北农业大学,河北 秦皇岛 066003
2. 中国水产科学研究院南海水产研究所/农业农村部南海渔业资源开发利用重点实验室/广东省渔业生态环境重点实验室,广东 广州 510300
3. 中国水产科学研究院南海水产研究所深圳试验基地,广东 深圳 518121
4. 广州市欣海利生生物科技有限公司,广东 广州 510300
5. 上海海洋大学 水产与生命学院,上海 201306
卵形鲳鲹 (Trachinotus ovatus) 属于暖水性鱼类,生活在中上水层,在我国东海、黄海以及南海海域均有分布。其具有生长速度快,体型较大,温度、盐度适应范围广[1-2]和价格适宜等特点,深受人们青睐,是我国广东、广西和海南等地区规模化养殖的重要经济鱼类之一。
肠道是动物消化吸收营养物质和抵御外来病原微生物的重要场所[3]。肠道内存在一个复杂的微生态系统,含有大量的微生物,这些微生物构成了动物的肠道菌群[4]。肠道菌群是肠道黏膜屏障的重要组成部分,对鱼类的肠道健康至关重要。鱼类肠道菌群受养殖水体环境、食物组成以及鱼体不同发育阶段和健康状况的影响,正常状态下肠道菌群保持动态平衡[5-6],肠道菌群紊乱可能会损害宿主的健康。外源益生菌的摄入能改善宿主的肠道菌群,抑制病原微生物生长,维持肠道微生物的动态平衡,改善宿主的肠道健康[7]。益生菌是一种健康、绿色、安全的微生态制剂,可以作为饲料添加剂或者直接用于养殖水体,能部分替代抗生素在水产养殖中的使用[8-9]。丁酸梭菌 (Clostridium butyricum) 是一种革兰氏阳性、严格厌氧、形成内生孢子的益生菌[10-11],可提供短链脂肪酸 (SCFA) 特别是丁酸,用于肠道上皮细胞的再生和修复,调节肠道健康微生态环境[12-13]。此外,丁酸梭菌可以耐受低pH和高温条件,对某些抗生素具有抗性[14-15]。对鮸 (Miichthys miiuy)[16]、鲤 (Cyprinus carpio)[17]、凡纳滨对虾 (Litopenaeus vannamei)[18-19]的研究表明,丁酸梭菌在促进水生动物生长、提高酶活性、调节肠道菌群和增强免疫力等方面发挥着重要作用。
本实验通过在饲料中添加丁酸梭菌菌液拌料投喂卵形鲳鲹幼鱼,研究其对卵形鲳鲹幼鱼生长性能和肠道菌群的影响,以期为丁酸梭菌在卵形鲳鲹养殖上的应用提供理论依据。
1 材料与方法
1.1 试验材料
丁酸梭菌菌液由广州欣海利生生物科技有限公司提供,丁酸梭菌菌液浓度实测值为 1×109CFU·mL−1,卵形鲳鲹幼鱼购自深圳市龙岐庄实业发展有限公司,基础饲料为广东越群海洋生物有限公司共利牌鲳鱼专用饲料。基础饲料干物质主要营养水平 (质量分数):粗蛋白≥42.0%,粗脂肪≥6.0%,粗纤维≤4.0%,粗灰分≤14.0%,赖氨酸≥2.2%,钙≥2.0%,总磷≥1.2%,水分≤10.0%。
1.2 饲养管理
池塘于试验开始前清塘冲洗,放苗前10 d使用二氧化氯 (ClO2) 消毒剂进行水体消毒,试验过程中进水经40目纱网过滤以避免自然海水中浮游动物对养殖试验造成干扰。分鱼前将卵形鲳鲹幼鱼暂养于中国水产科学研究院南海水产研究所深圳试验基地池塘网箱7 d,饥饿24 h后用丁香酚麻醉。随机挑选健康状况良好、大小规格相似的卵形鲳鲹幼鱼分布于 15 个 1 m×1 m×1.5 m (长×宽×高) 的网箱 (网目为 1 cm) 里,每个网箱 25 尾,初始体质量为 (9.5±0.3) g,随机分为5组,每组3个重复。本试验采用丁酸梭菌菌液拌料投喂卵形鲳鲹幼鱼。对照组M0投喂基础饲料,实验组 M1、M2、M3和 M4分别投喂添加 1% (1×107CFU·g−1)、2% (2×107CFU·g−1)、3% (3×107CFU·g−1) 和 4%(4×107CFU·g−1) 的丁酸梭菌菌液的饲料。添加方法为将丁酸梭菌菌液溶解于蒸馏水中,按上述比例均匀喷洒于基础饲料颗粒上,对照组喷洒等量的蒸馏水,配制的饲料于4 ℃冰箱保存。每次投喂量约为体质量的2%,剩余饲料回收干燥后重新称质量并记录,养殖试验进行20 d。
1.3 样品采集
养殖试验结束后将卵形鲳鲹幼鱼饥饿24 h,麻醉后称取各网箱全部鱼的总质量并记录用以分析生长差异,每个网箱随机取5尾鱼用于全鱼体成分分析,另外从每个网箱中随机取3尾测量体长、称体质量用于计算肥满度,解剖后取出内脏团和肝脏,分别称质量并记录用以分析脏体比和肝体比。剪取肠道后肠于5 mL离心管中,液氮浸泡后于−80 ℃保存,用于肠道菌群分析。
1.4 指标测定
增重率 (Weight gain rate, WGR, %)、特定生长率 (Specific growth rate, SGR, %·d−1)、饲料系数 (Feed coefficient,FC)、肥满度 (Condition factor, CF)、脏体比 (Viscerosomatic index, VSI, %)、肝体比 (Hepatosomatic index, HSI,%) 等指标计算公式为:

式中:Wt为末均质量 (g);W0为初均质量 (g);t为天数(d);F为摄食量 (g);Wh为肝脏质量 (g);Wv为内脏质量(g);Wb为鱼体质量 (g);L为鱼体长 (cm)。
1.5 样品测定
全鱼和肌肉粗蛋白采用凯氏定氮法测定 (FOSS 2300,Hoganas, Sweden);粗脂肪采用索氏抽提法测定 (以石油醚为抽提剂,Soxtec Avanti 2050, Foss TecatorAB, Switzerland);水分用常压干燥法测定 (烘箱,105 ℃);灰分采用550 ℃ 马弗炉灼烧法测定 (FO610C, Yamato Scientific Co.Ltd., Japan);肠道菌群结构送往广州吉瑞基因科技有限公司测定。
1.6 肠道菌群多样性测定
肠道菌群结构委托广州吉瑞基因科技有限公司测定。采用操作分类单元 (OTU)、Ace指数、Chao1指数、香浓指数 (Shannon) 和辛普森指数 (Simpson) 等参数评估肠道菌群的Alpha多样性,肠道菌群的Beta多样性利用PCA主成分分析评估,并计算各菌群在门和属水平上的相对丰度,分析肠道菌群的组成特征。
1.7 数据分析
实验数据采用Excel 2019和SPSS 23.0软件进行单因素方差分析 (One-way ANOVA),所得数据以“平均值±标准差 (SD)”表示,采用Duncan氏法进行多重比较分析,P<0.05为差异显著。如果试验组间肠道菌群多样性分析的差异显著,则进一步采用Tukey's HSD检验进行多重比较,显著水平为0.05。
2 结果
2.1 卵形鲳鲹幼鱼的生长性能和饲料利用率
随着饲料中丁酸梭菌菌液添加量的增加,卵形鲳鲹的终末质量、增重率、特定生长率表现出升高后降低的趋势(表1)。2%添加组的增重率和特定生长率显著高于4%添加组 (P<0.05),其余各组间无显著差异 (P>0.05)。2%添加组的饲料系数最低,且与对照组、4%添加组间存在显著差异 (P<0.05)。各组间肥满度、脏体比、肝体比均无显著差异 (P>0.05)。
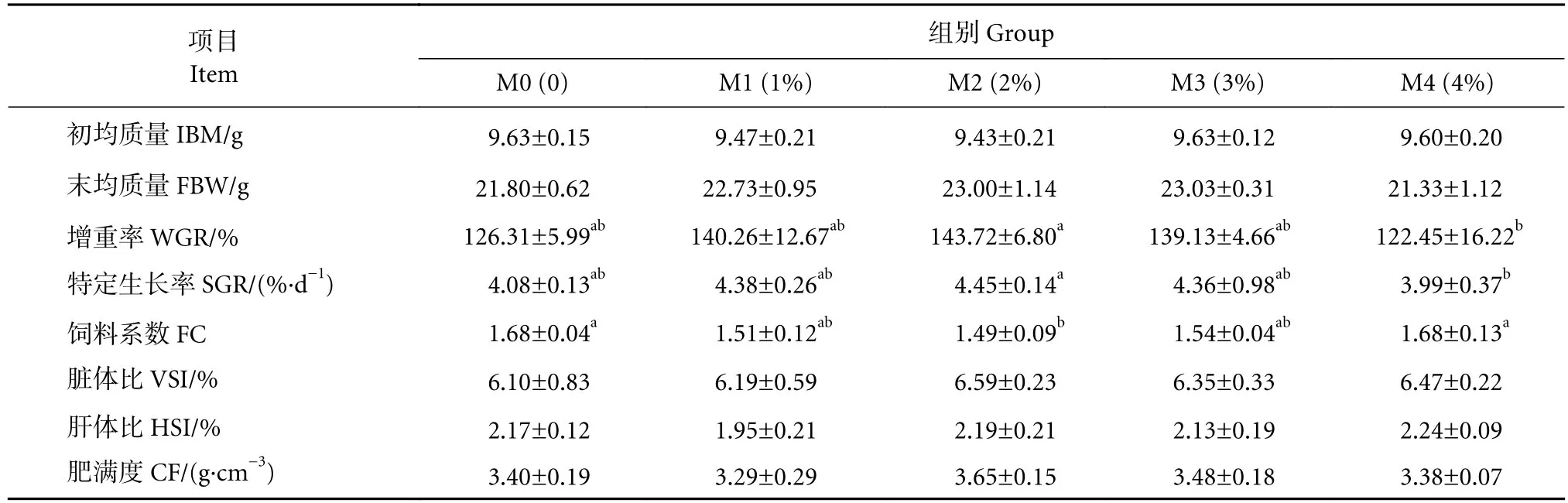
表1 饲料中添加丁酸梭菌对卵形鲳鲹幼鱼生长性能的影响Table 1 Effects of dietary supplementation of C. butyricum on growth performance of juvenile T. ovatus
通过线性回归分析,得出一元二次方程y=−5.071 4x2+19.386x+125.86,计算最高点的曲线坐标,得出当丁酸梭菌添加量为1.91%时,卵形鲳鲹的增重率最大 (图1)。
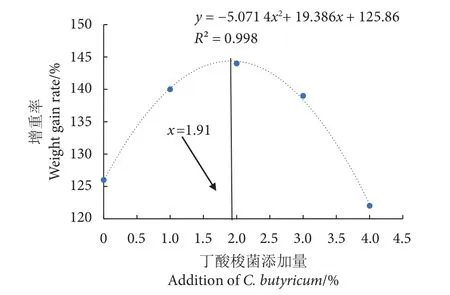
图1 卵形鲳鲹幼鱼增重率与饲料中丁酸梭菌添加量的关系Fig. 1 Relationship between weight gain rate of juvenile T. ovatus and amount of C. butyricum added in diet
2.2 卵形鲳鲹幼鱼的全鱼体成分
各组全鱼体成分见表2,各组之间的水分、粗脂肪、粗灰分、粗蛋白无显著差异 (P>0.05)。
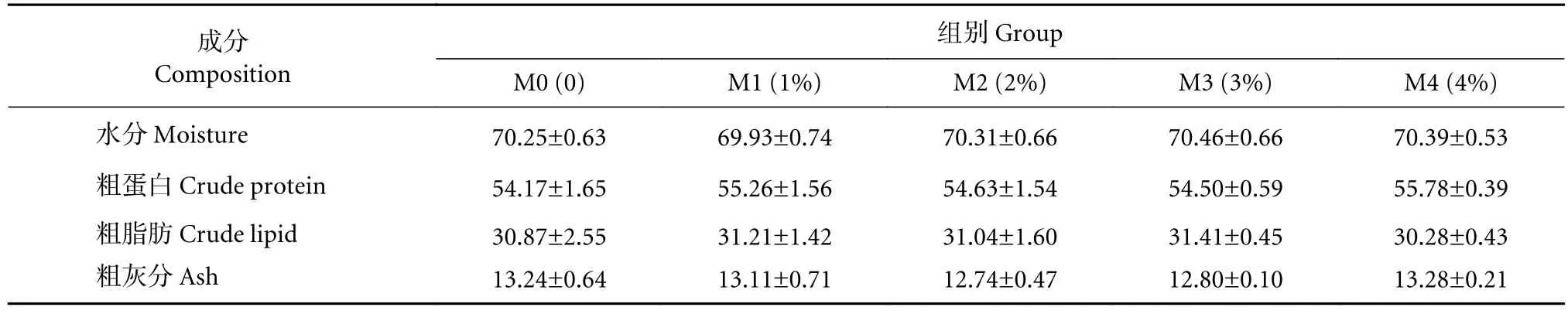
表2 饲料中添加丁酸梭菌对卵形鲳鲹幼鱼全鱼营养成分的影响 (干质量)Table 2 Effects of dietary supplementation of C. butyricum on whole fish nutrient composition of juvenile T. ovatus (dry mass) %
2.3 卵形鲳鲹幼鱼的肠道菌群
2.3.1 肠道菌群微生物 OTU 及 Alphy多样性分析
不同处理组卵形鲳鲹幼鱼肠道菌群稀释性曲线 (图2)趋于平缓,测序覆盖率≥99.85%,表明对各组的卵形鲳鲹肠道微生物菌群的测序深度合理,能覆盖样品中的绝大部分物种。通过16S rRNA高通量测序共获得135 923条序列,平均序列长度为1 490 bp。在相似水平为97%下,共获得了63个运算分类单元 (OTU)。由不同处理组卵形鲳鲹肠道菌群OTUs的venu图 (图3) 可得,各组间共有的OTU数为25个。3%添加组的Chao1和Ace指数最高,群落丰富度最大。2%添加组的Shannon指数最大,Simpson指数最小,卵形鲳鲹肠道菌群群落的多样性最大,与对照组和4%添加组有显著差异 (P<0.05);对照组和4%添加组的Shannon指数接近,差异较小,肠道菌群群落的多样性相似 (表3)。随着饲料中丁酸梭菌添加量的增加,卵形鲳鲹肠道菌群群落的多样性和丰富度表现出先升高后降低的趋势。
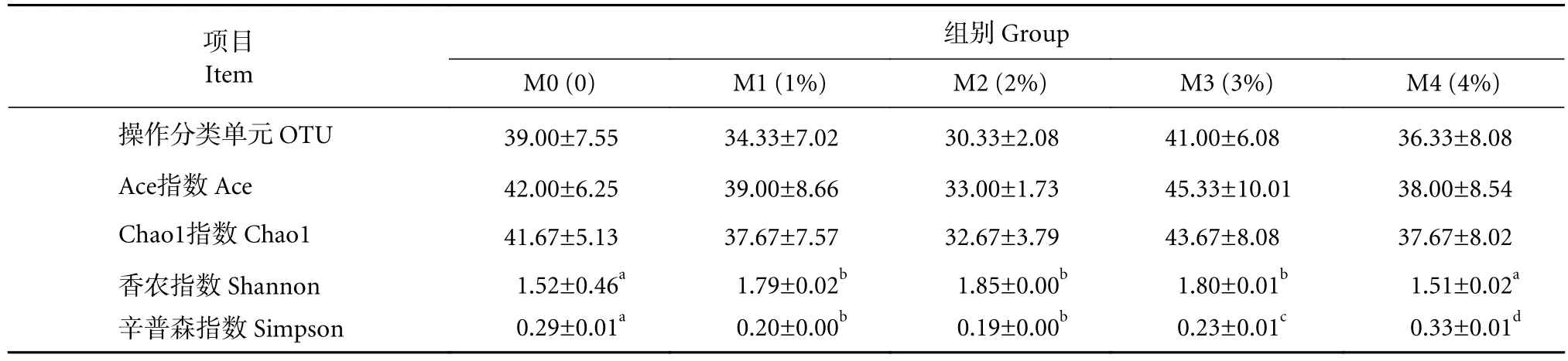
表3 不同处理组卵形鲳鲹幼鱼肠道菌群的多样性统计Table 3 Diversity statistics of intestinal samples of juvenile T. ovatus in different treatment groups

图2 不同处理组卵形鲳鲹幼鱼肠道菌群稀释性曲线Fig. 2 Dilution curve of intestinal flora of juvenile T. ovatus in different treatment groups
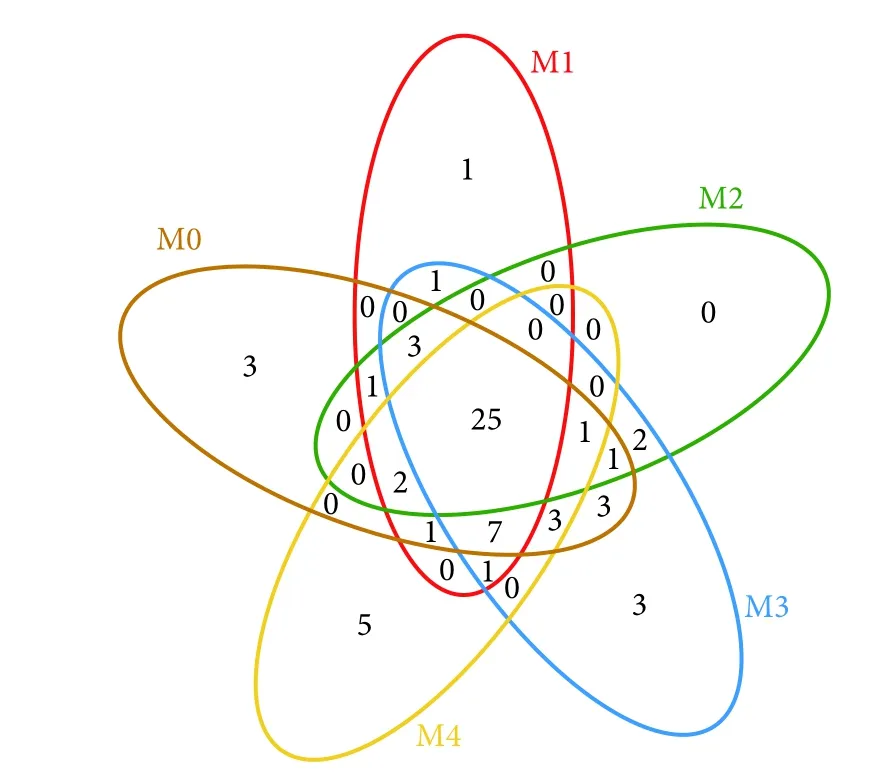
图3 不同处理组卵形鲳鲹幼鱼肠道菌群的OTUs的venus图Fig. 3 Venus map of OTUs intestinal flora of juvenile T. ovatus in different treatment groups
2.3.2 肠道菌群 Beta 多样性分析
各组的肠道菌群组内重复样品距离较近,表明各组组内的微生物组成结构相似 (图4、图5)。1%和2%添加组距离较近,且与对照组距离较远,表明1%和2%添加组的亲缘关系较近,微生物组成结构相似,与对照组亲缘关系较远。而3%添加组与对照组倾向于聚集在一起,物种组成结构相似度较高。
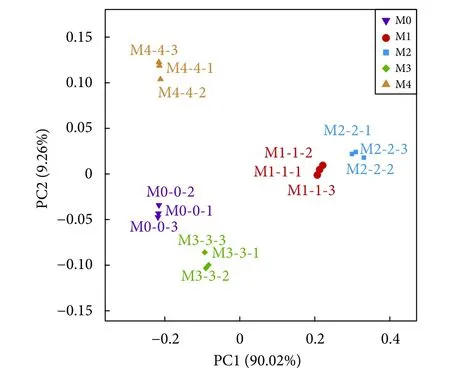
图4 不同处理组卵形鲳鲹幼鱼肠道菌群主坐标分析Fig. 4 Principal co-ordinates analysis of intestinal flora of juvenile T. ovatus in different treatment groups
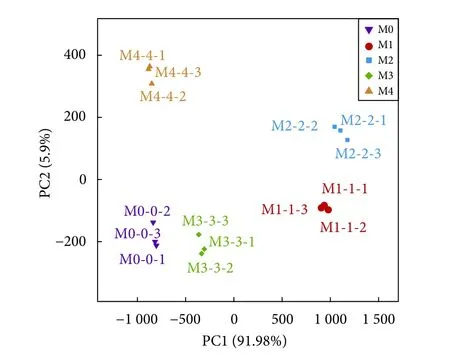
图5 不同处理组卵形鲳鲹幼鱼肠道菌群主成分分析Fig. 5 Principal component analysis of intestinal flora of juvenile T. ovatus in different treatment groups
2.3.3 肠道菌群组成及其相对丰度分析
各组的肠道菌种在门水平上的主要组成见图6,在卵形鲳鲹肠道中注释到9个门水平上的菌群,其中软壁菌门和变形菌门是所有样品中均包含的丰度最高的两个门,分别占样品所包含物种总数目的61.87%和36.65%。变形菌门是1%和2%添加组中丰度最高的门,分别占53.68%和57.16%。软壁菌门是对照组、3%和4%添加组中丰度最高的门,分别占73.72%、64.04%和85.01%。在门水平上对各组间进行差异性检验分析,发现各组之间的软壁菌门和变形菌门的丰度均有显著差异 (P<0.05)。随着饲料中丁酸梭菌添加量的增加,变形菌门的丰度先升后降,软壁菌门的丰度趋势则与之相反。
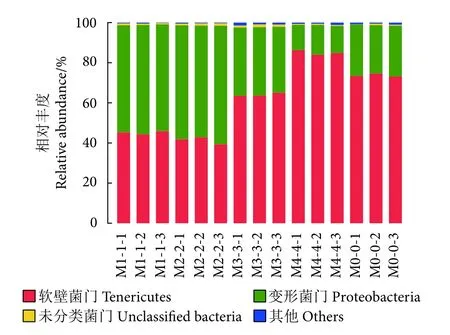
图6 不同处理组卵形鲳鲹幼鱼肠道菌群在门水平上的相对丰度聚类堆叠图Fig. 6 Cluster stack diagram of relative abundance of intestinal flora of juvenile T. ovatus in different treatment groups at phylum level
从属水平上分析各组的肠道菌群结构及分布,发现在卵形鲳鲹幼鱼肠道中注释到35个属水平上的菌群,对丰度百分比小于1%的区域进行合并 (图7)。支原体属(Mycoplasma)、发光细菌属 (Photobacterium) 和弧菌属(Vibiro) 是卵形鲳鲹肠道菌群丰度最高的菌属。2%添加组的最优势菌属是弧菌属,占该组全部属的54.75%,其余各组丰度最高的菌属均为支原体属。发光细菌属是3种优势菌属中丰度较低的菌属,占样品所包含物种总数目的12.01%。随着丁酸梭菌添加量的增加,支原体属的丰度表现出先降低后升高的趋势,弧菌属的丰度趋势与之相反。在属水平上对各组间进行差异性检验分析,发现各组之间的支原体属和发光细菌属均有显著差异 (P<0.05),对照组和4%添加组的发光细菌属占比相似,分别为2.42%和2.41%,与其他各组之间差异显著 (P<0.05)。此外,在对各组鱼体肠道菌群的测定中并未发现梭菌属的分布。
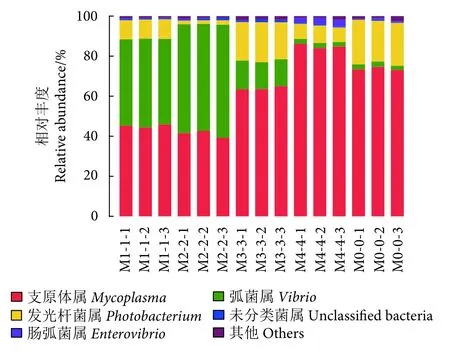
图7 不同处理组卵形鲳鲹幼鱼肠道菌群在属水平上的相对丰度聚类堆叠图Fig. 7 Cluster stack diagram of relative abundance of intestinal flora of juvenile T. ovatus in different treatment groups at genus level
3 讨论
3.1 丁酸梭菌对卵形鲳鲹生长性能和体成分的影响
饲料中添加丁酸梭菌能促进鱼类的生长,提高饲料利用率[16,20-22]。本试验中,2%添加组的增重率和特定生长率最大,且饲料系数显著低于对照组,这表明丁酸梭菌提高了卵形鲳鲹的生长性能和饲料利用率。丁酸梭菌对生长性能和饲料利用率的积极作用可能与肠道中该益生菌代谢产生的短链脂肪酸如乙酸、丙酸和丁酸有关。短链脂肪酸能为肠道细胞代谢提供能量来源,提高肠道消化酶的活性,从而促进动物对饲料中营养物质的吸收利用[7]。然而,4%添加组的特定生长率和增重率显著低于2%添加组,过量的丁酸梭菌导致卵形鲳鲹的特定生长率和饲料利用率下降,这与丁酸梭菌在奥尼罗非鱼 (Oreochromisniloticus×O. aureus)[23]、罗氏沼虾 (Macrobrachium rosenbergii)[24]中的研究类似。就生长性能而言,与2%添加组相比,4%添加组卵形鲳鲹幼鱼的生长性能显著降低,可能的原因是:1) 过量的丁酸梭菌导致了卵形鲳鲹幼鱼胃肠道菌群的不平衡[25],影响了其他有益菌的生长,造成微生物群多样性和丰富度降低;2) 过量的丁酸梭菌会大量消耗卵形鲳鲹肠道的营养物质,导致卵形鲳鲹生长性能降低。本试验中,各组之间全鱼的水分、粗脂肪、粗灰分、粗蛋白无显著差异,这与丁酸梭菌在罗非鱼[23]中的研究结果一致。
3.2 丁酸梭菌对卵形鲳鲹肠道菌群的影响
肠道微生物菌群参与机体代谢、营养吸收、生长发育和免疫等生理过程[26-27],肠道正常菌群的稳定有利于宿主的健康。本试验中,丁酸梭菌添加组的肠道菌群OTU数目与对照组无显著差异,这与对虹鳟 (Oncorhynchus mykiss)[22]的研究结果类似。在鱼类中,肠道菌群多样性与宿主的肠道健康密切相关[28]。Alpha多样性通过分析Chao1、Ace、Shannon、Simpson等指数来反映动物肠道微生物群落的丰富度和多样性。Chao1和Ace指数越大代表群落丰富度越高,Shannon数值越大,Simpson数值越小,则说明菌群群落多样性越高。1%、2%和3%添加组的Shannon指数显著高于对照组,Simpson指数显著低于对照组,表明适量的丁酸梭菌能显著提高卵形鲳鲹肠道菌群多样性,可能是因为添加丁酸梭菌改变了卵形鲳鲹幼鱼肠道优势菌群数量,使其具有潜在的有益微生物群落。Beta多样性可以反映样本间的丰度分布差异程度。主成分分析 (PCA) 能将物种进化程度方面类似的样品聚类在一起,主坐标分析(PCOA)是将物种分布程度方面类似的样品聚类在一起[29],两者都能通过观察样品间的距离来判断样品的微生物组成结构相似性。样品间的距离越近,说明样品之间的微生物组成结构相似性越高,差异性越小。1%和2%添加组的肠道微生物菌落组成结构相似,与对照组肠道微生物菌落亲缘关系较远。结果表明饲料中丁酸梭菌的添加量是改变卵形鲳鲹肠道菌群结构的主要因素,类似的结果也出现在鲤[17]的研究中。添加外源益生菌是调控鱼类肠道微生物菌群的手段之一,早期发育阶段鱼类肠道微生物菌群的组成和活性可以用添加益生菌的饲料来控制[30]。而对照组与3%添加组鱼的肠道微生物菌落组成结构相似,推测可能是3%添加量的丁酸梭菌对卵形鲳鲹幼鱼肠道的益生作用较弱,对卵形鲳鲹幼鱼肠道菌群结构的影响很小。
在卵形鲳鲹肠道中,变形菌门和软壁菌门是主要的优势菌门[31-32],这与本试验的结果一致。地理因素对鱼类肠道微生物群落的组成有重要影响,而变形菌门是中国沿海地区养殖水体的优势菌门[33-34],这可能是变形菌门是卵形鲳鲹幼鱼肠道菌群优势菌门的重要原因之一。饲料中添加益生菌能改变鱼类肠道菌群结构,调节肠道菌门丰度。如投喂添加2%多种益生菌复配的饲料能够显著影响草鱼(Ctenopharyngodon idella)[35]中变形菌门、放线菌门、蓝藻菌门、衣原体门、螺旋藻菌门的丰度。在本试验中,1%、2%和3%丁酸梭菌组肠道中的变形菌门丰度显著高于对照组,软壁菌门丰度显著低于对照组。类似地,在饲料中添加丁酸梭菌能提高罗非鱼肠道中浮霉菌门和变形菌门的丰度[24]。变形菌门能分解代谢饲料成分[36],其丰度的增加,可能有利于卵形鲳鲹吸收饲料中的营养物质。在属水平上,卵形鲳鲹幼鱼肠道的优势菌属为弧菌属、支原体属以及发光细菌属。支原体属属于软壁菌门,有研究发现支原体属细菌是致病菌[37]。在本试验中,1%、2%和3%添加组的支原体属丰度显著低于对照组,4%添加组的支原体属丰度显著高于对照组。这表明,饲料中添加适量丁酸梭菌能抑制支原体属细菌的生长,有益于卵形鲳鲹幼鱼的健康。但是添加过量的丁酸梭菌对支原体属细菌的抑制作用逐渐减弱,甚至促进支原体属细菌的生长,这可能是由于过量的丁酸梭菌导致卵形鲳鲹幼鱼肠道微生物菌群失衡,损害其肠道健康。此外,在投喂丁酸梭菌处理后饲料的各组鱼体肠道菌群中未观察到梭菌属的分布,推测丁酸梭菌尚未在卵形鲳鲹幼鱼肠道内定植或占比极低。卵形鲳鲹幼鱼肠道中梭菌属并非优势菌属[32,38],这与本实验结果类似。有学者认为,丁酸梭菌即使未在动物肠道内定植,也能发挥益生作用,如Duan等[18]推测丁酸梭菌可能不会在对虾肠道内定植,只在肠组织中产生有益的作用。死亡或灭活的益生菌也能在水产动物体内发挥益生作用[39-40],如Pan等[41]发现灭活的丁酸梭菌能增强鮸的免疫力和抗病力。本试验中未发现丁酸梭菌在卵形鲳鲹幼鱼肠道内定植,推测可能是因为养殖周期较短导致丁酸梭菌尚未定植或占比极低。
4 结论
饲料中添加1%~3%的丁酸梭菌对卵形鲳鲹幼鱼的生长性能有促进作用。根据二次回归方程分析,卵形鲳鲹饲料中丁酸梭菌菌液的适宜添加量为 1.91% (1.91×107CFU·g−1)。此外,丁酸梭菌能显著增加卵形鲳鲹的肠道菌群多样性,调节肠道优势菌门和菌属,从而促进其肠道健康。
——奇妙的蛋

