氮磷营养变化对钦州湾球形棕囊藻藻体生长的影响
莫 钰, 蓝彩碧, 许铭本, 赖俊翔, 凌慧娇
(1. 广西民族大学 海洋生物资源保护与利用重点实验室, 广西 南宁 530008; 2. 广西科学院 广西北部湾海洋研究中心 广西近海海洋环境重点实验室, 广西 南宁 530007; 3. 广西壮族自治区环境保护科学研究院,广西 南宁 530022)
球形棕囊藻(Phaeocystis globosa)隶属定鞭藻纲, 是广温广盐性的有害藻华原因种, 在碳、硫元素的生物地化循环、食物网结构及全球气候变化中有重要影响[1]。棕囊藻具有异型生活史, 兼有单细胞和囊体两种形态, 囊体是藻华发生时的优势形态[2]。从单细胞到囊体结构的转变被认为是球形棕囊藻具有优势生存策略的关键[3], 胶质囊体形态可抵御细菌或病毒的侵害, 并通过增大粒径抑制浮游动物的摄食[4-5]。中空的囊体结构使棕囊藻易漂浮于海水表层, 从而获得更多的光照进行光合作用[6]。囊体由单细胞在适宜条件下, 固着在基质表面不断分裂并产生黏液而形成[7], 囊体细胞通过二分裂增殖从而扩大囊体直径[8]。通常用囊体直径与囊体细胞数的对数回归关系反映囊体细胞的分布状况, 从而研究不同株系球形棕囊藻的囊体形态及结构, 囊体细胞的分布对囊体形态的维持有重要影响[8-9]。
囊体的形成需要额外物质和能量的投入, 较高水平的氮、磷营养是囊体的大量繁殖和棕囊藻藻华暴发的有利条件[10-11]。随着经济的发展及建设工程的实施, 陆源污染物的增加及水动力条件的改变导致近岸海域富营养化问题逐步加剧[12-13]。钦州湾作为广西北部湾海域规模最大的港湾, 富营养化问题的加重引起球形棕囊藻藻华发生次数逐步增加[13-14]。钦州湾的营养盐输入以无机氮为主,磷酸盐呈下降趋势甚至呈现低磷特征[15-16]。氮、磷营养均为我国球形棕囊藻藻株生长的主要限制因子, 不同株系对营养盐的利用特性存在差异[8,17]。钦州湾海域球形棕囊藻藻华多发生于11月至次年3月, 此时钦州湾的无机氮和无机磷浓度为一年最高时期[18], 为了研究氮、磷营养对钦州湾海域球形棕囊藻囊体生长的影响, 本研究通过改变氮、磷浓度的培养方式验证钦州湾浮游植物是否受到单一氮、磷限制或氮磷共同限制, 研究球形棕囊藻囊体对不同营养盐、氮磷比及营养盐添加方式的响应,以期了解氮、磷营养的输入对钦州湾球形棕囊藻藻华发生和持续的影响。
1 材料与方法
1.1 营养加富及添加方式试验设计
于2019年1月在钦州湾外湾观测到球形棕囊藻的海域取表层海水, 经200 μm筛绢轻柔过滤,滤除大型浮游动物干扰后, 在常温状态下, 将水样速运回实验室(运输约耗时2 h), 进行混合后分装16 L海水至PET透明塑料桶中。原始海水中无机氮、无机磷及硅酸盐的浓度分别为3.58、0.29和14.30 μmol·L–1, 氮和磷浓度处在钦州湾历史调查3月份的浓度范围, 其中无机氮浓度范围为1.8~62.3 μmol·L–1, 均值15.1 μmol·L–1, 无机磷浓度范围为0.01~2.16 μmol·L–1, 均值0.32 μmol·L–1, N/P比范围35~154[18-20]。在系统本底浓度基础上按倍数改变营养盐浓度是常见的营养添加方式, 倍数有2~100倍不等[21], 本文根据历史数据设置2~10倍左右并进行取整, 无机氮及无机磷分别设置40 μmol·L–1、0.5 μmol·L–1, 并进行一次性添加和每天添加的比较, 同时将N/P设置Redfield比值16︰1与50︰1进行比较。按表1所示加入不同浓度的KH2PO4、NaNO3设置7个实验组, 其中对照组设2个平行, 除添加氮或磷外其它按f/2培养基添加微量元素。培养光照强度设为50 μmol·(m2·s)–1, 光暗比12h︰12h, 温度设为 (20±1) , ℃ 每天上午10: 00对培养瓶进行缓慢充分摇匀, 并随机更换培养桶的位置。培养周期根据球形棕囊藻囊体的生长情况定为12 d。

表1 各处理组营养盐添加浓度设置及原始海水营养盐浓度Tab. 1 Nutrition concentration in different treatments and original seawater
1.2 样品采集与分析
每天定点(10: 00)采集水样, 取30 mL用于营养盐分析的样品经25 mm GF/F玻璃纤维膜过滤后, 加入三氯甲烷于–20℃保存, 用Skalar Sanplus营养盐自动分析仪测定营养盐浓度, 无机氮、无机磷和活性硅酸盐的检测下限分别为0.07、0.03、0.03 μmol·L–1[22]。取60 mL水样过滤至25 mm GF/F膜, 滤膜浸泡于90%丙酮中于4℃下黑暗萃取24 h, 取出离心得到上清液用紫外分光光度计(Agilent, Cary 100)分别在630、647、664及750 nm处测定吸光值[23], 进行叶绿素a含量计算。
取5 mL水样置于30孔板中在倒置显微镜(Nikon,Eclipse Ti)下观察囊体数量、囊体细胞数并测量囊体直径[24]。囊体在采样后24 h内观察完毕, 以防囊体裂解。取500 mL水样加入鲁格试剂固定后, 经自然沉降后对样品进行浓缩, 取一定量亚样品于浮游植物计数框中用显微镜(Nikon, Eclipse Ti)进行浮游植物物种鉴定与细胞计数[25], 浮游植物样品第1~6 d为每天取样, 第6~10 d为隔天取样。
1.3 数据分析
球形棕囊藻丰度以每升出现的囊体数表示, 单位为colonies·L–1; 其它浮游植物细胞密度以每升出现的细胞数表示, 单位为cells·L–1。
数据统计和检验在SPSS下进行, 采用one-way ANOVA及T检验分析不同处理组营养盐浓度、球形棕囊藻囊体丰度、叶绿素含量及浮游植物细胞密度的差异性, 显著性水平设置为P<0.05; 采用Origin绘制参数变化图。
2 结果
2.1 培养实验中营养盐浓度的变化
M1/3/6三个处理组的无机氮第1 d开始下降, 之后于1 μmol·L–1左右波动, M3组的无机氮大部分时间皆低于检测限(图1a), 该三个处理组的无机氮浓度显著低于其它处理组(P<0.01)。M2/4/5三个处理组的无机氮浓度随培养时间的下降趋势不同, M2组的下降幅度较小, M4/5组在第1~7 d的下降幅度较大。每天添加氮的M7组第1~3 d处于停滞, 第4~12 d则逐步上升。
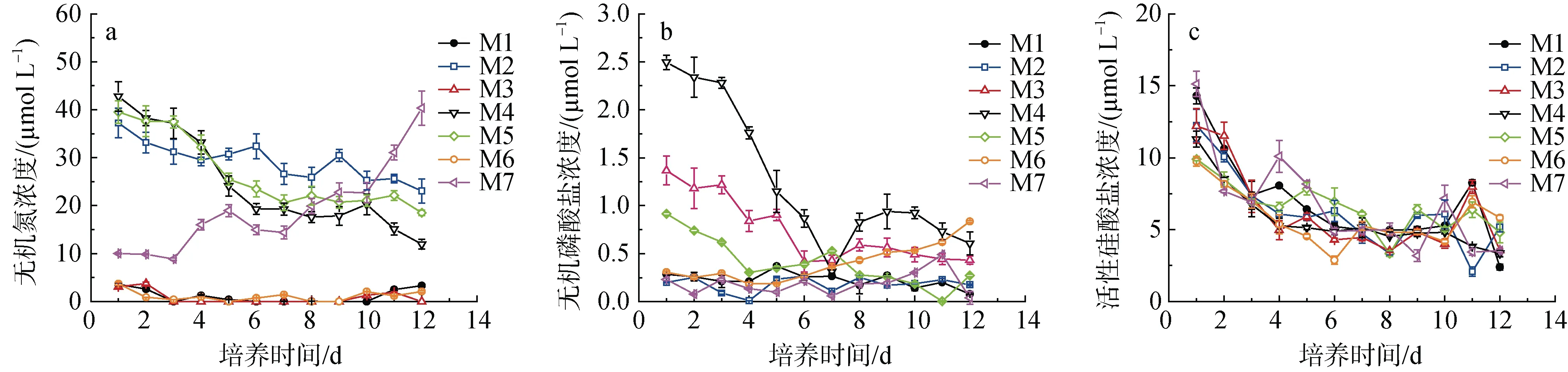
图1 氮、磷营养变化培养实验中无机氮(a)、无机磷 (b)和活性硅酸盐(c)浓度的变化Fig. 1 Variations of dissolved inorganic nitrogen (a), dissolved inorganic phosphorus (b) and reactive silicate (c) concentrations in different treatments of nutrient addition bioassay
无磷添加的M1/2/7处理组在培养期间无机磷浓度在0~0.40 μmol·L–1之间稳定波动(图1b)。存在磷添加的M3/4/5处理组的无机磷在第1~7 d呈明显下降趋势, 第8 d后无明显下降趋势。M4组的下降趋势最为显著, 从第1 d 的2.5 μmol·L–1降至第7 d的0.31 μmol·L–1。每天添加磷的M6组在第1~7 d无机磷在0.3 μmol·L–1以下波动, 此后逐步上升。
7个处理组的活性硅酸盐在第1~5 d为快速下降期(图1c), 从~15 μmol·L–1降至~5 μmol·L–1, 此后无明显下降趋势。
2.2 叶绿素a对氮磷营养盐变化的响应
叶绿素a对氮和磷的一次性添加响应存在明显差别(图2a), M2组对氮添加的响应为第2~4 d较慢增长, 第5~8 d稳定在~26 μg·L–1, 第9~12 d降至~20 μg·L–1波动。M3组对磷添加的响应表现为刺激性增长后快速下降, 第2~4 d快速增长, 第4 d上升至峰值44.5 μg·L–1后逐步下降至第9 d的10.3 μg·L–1。M3组第3~7 d的叶绿素a显著高于M1及M2组(P<0.05), M2组则是在第9~11 d显著高于M1及M3组(P<0.05)。磷的添加对前期叶绿素a的促进作用强于氮的添加, 而氮的添加则有利于后期维持叶绿素a的稳定。
同时添加氮和磷设置氮磷比为16︰1和50︰1的M4及M5组叶绿素a显著高于对照组(P<0.01),高峰期的叶绿素a含量约是其它处理组的2.5倍(图2b)。第3~6 d为叶绿素a快速增长期, M4组在第6 d达到最高值96.28 μg·L–1, M5峰值达76.58 μg·L–1。第7 d开始下降, 降至第9 d低值约30 μg·L–1后转为上升。两种氮磷比条件下, 叶绿素a的变化无显著差异(P>0.05)。
一次性添加和每天添加氮或磷的条件下叶绿素a的变化趋势大致相同(图2c, d)。两种添加方式下,M2及M7组叶绿素a的变化趋势为前期较慢增长后期平稳, 在第8~12 d显著高于对照组(P<0.05)。M3及M6组叶绿素a的变化趋势为前期快速增长后期快速下降, 含量无显著差异(P>0.05), 在第3~7 d显著高于对照组(P<0.05)。营养盐添加方式对叶绿素a含量的影响无明显差异。

图2 一次性添加氮和磷(a)、不同氮磷比(b)、一次性添加和每天添加氮(c)及一次性添加和每天添加磷(d)培养条件下叶绿素a含量的变化Fig. 2 Variations of chlorophyll a in nitrogen and phosphorus addition in once (a), different N/P ratio (b), nitrogen addition in once and daily (c) phosphorus addition in once and daily (d) of different culture conditions
2.3 浮游植物种类组成及细胞密度变化
初始海水中浮游植物主要由硅藻和甲藻组成,种类数共22种, 其中硅藻18种, 甲藻4种(见表2),优势种为针杆藻(Synedraspp.)、柔弱根管藻(Rhizosolenia delicatula)、中华根管藻(Rhizosolenia Sinensis)及条纹小环藻(Cyclotella striata)等。值得注意的是, 尽管实验开始前利用200 μm筛绢对初始海水进行预处理滤除浮游动物, 但各处理组在培养期间中仍出现浮游动物。硅藻在第1~9 d的密度占绝对优势, 第10 d甲藻的组成比例逐步增加, M4~M7四个处理组中甲藻的比例可高达40%~65%, 优势甲藻种类为微小原甲藻(Prorocentrum minimum)。

表2 原始海水浮游生物物种组成Tab. 2 Plankton species composition of original seawater

续表
培养过程中, 浮游植物的种类数表现为随着培养时间增加而降低的趋势, 各个处理组的种类数相差不大(图3a)。浮游植物细胞密度的变化与叶绿素a含量的变化相似(图3b), 第3~6 d为细胞密度高峰期,第8 d开始下降。高峰期时, 有氮或磷添加的处理组的细胞密度普遍高于对照组, 同时添加氮和磷的M4及M5组细胞密度呈持续上升, 最大密度分别为

图3 氮、磷加富及添加方式实验中浮游植物物种数(a)及细胞密度(b)的变化Fig. 3 Variations of phytoplankton species number (a) and cell density (b) in different treatments of nutrient addition bioassay
14.8×105, 15.9×105cells·L–1。
2.4 球形棕囊藻囊体生长对氮磷营养变化的响应
本研究培养期间共统计囊体476个, 同时测量直径及囊体细胞数量。囊体的生长对氮和磷的添加响应存在明显差别, 添加磷浓度为0.5 μmol·L–1时能刺激囊体快速增长, M3组第6、7 d的囊体丰度显著高于其它处理组(P<0.05)(图4a), 丰度于第7 d达峰值4.8×103colonies·L–1, 但第8 d囊体开始大量衰败, 丰度降至1.2×103colonies·L–1, 第12 d已镜检不出囊体。氮添加的M2组囊体丰度的变化与对照组相近, 于第7 d达峰值(2.3±0.2)×103colonies·L–1后, 囊体丰度在1.5×103colonies·L–1稳定波动, 培养后期囊体较少出现衰败。M2组的囊体平均直径最低为(87±57) μm, M3组的为(115±84) μm, 对照组M1则为(109±89) μm(图5),各处理组别的囊体直径无显著差异(P>0.05)。囊体直径与囊体细胞数对数值的线性回归的斜率存在差别(表3), 氮添加组M2的斜率为0.55, 低于对照组M1的1.02, 磷添加组M3的斜率则为1.17。磷的添加促进囊体丰度及囊体细胞数的增长, 但囊体持续的时间较短,氮的添加则不利于囊体直径及囊体细胞的生长。
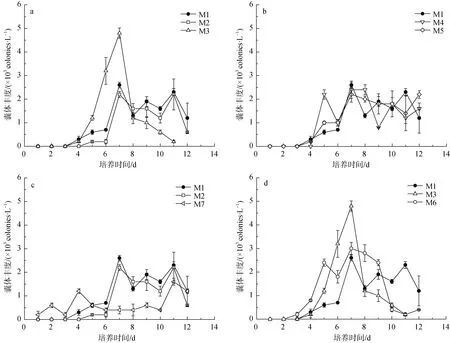
图4 一次性添加氮和磷(a)、不同氮磷比(b)、一次性添加和每天添加氮(c)及一次性添加和每天添加磷(d)培养条件下囊体丰度的变化Fig. 4 Variations of colony density in nitrogen and phosphorus addition in once (a), different N/P ratio (b), nitrogen addition in once and daily (c) phosphorus addition in once and daily (d) of different culture condition

图5 氮、磷营养变化培养实验中球形棕囊藻的囊体直径变化Fig. 5 Colony diameters of Phaeocystis globosa in different treatments of nutrient addition bioassay
同时添加氮和磷设置氮磷比为16︰1和50︰1的M4及M5组, 囊体数量无明显提高。M5组囊体丰度变化与对照组基本一致(图4b), 第4~7 d逐渐上升至峰值后稳定波动, M6组的囊体丰度则在1×103colonies·L–1~2×103colonies·L–1间来回波动。两个处理组的囊体平均直径较其它处理组高(图5), 分别为(133±74) μm和(139±96) μm, M4和M5组囊体直径与囊体细胞数的线性回归斜率分别为1.31和0.86(表3), 氮磷比升高限制囊体细胞数的增长。

表3 氮、磷加富及添加方式实验中球形棕囊藻的囊体直径与囊体细胞数量对数值线性回归斜率比较Tab. 3 Logarithm relationships between colony diameter and colonial cell number of Phaeocystis globosa in different treatments of nutrient addition bioassay
囊体丰度对一次性添加和每天添加氮的响应存在差异, 一次性添加氮的M2组囊体丰度变化与对照组相近, 于第4、5 d形成, 第7 d达到峰值后波动稳定。每天添加氮的M7组囊体于第1 d形成, 并持续至第12 d, 但丰度较低(图4c), 第7~10 d的囊体丰度显著低于其它组(P<0.05)。每天添加氮组的囊体平均直径(110±91) μm大于一次性添加氮的直径(87±57) μm (图5), 每天添加氮的M7组囊体直径与囊体细胞数的回归斜率为0.79, 高于M2组的0.55。
囊体数量对一次性添加和每天添加磷的响应皆在前期表现为刺激生长的作用(图4D), 一次性添加磷的刺激作用较强, M3组囊体丰度从第5 d的1.0×103colonies·L–1上升至第7 d的4.8×103colonies·L–1,但第8 d即回落至1.2× 103colonies·L–1。每天添加磷的M6囊体较早出现响应, 第5 d即上升至2.0×103colonies·L–1, 囊体丰度高值维持至第9 d, 第10 d回落至0.4×103colonies·L–1。两种添加方式下的囊体平均直径相近(图5), 一次性添加磷的M3组囊体直径与囊体细胞数的回归斜率为1.17, 高于M6组的0.79。
2.5 球形棕囊藻生长与环境因子的关系
将7个处理组的囊体数据与环境因子进行Spearman相关分析, 结果见表4。囊体丰度与活性硅酸盐浓度呈显著负相关(P<0.01), 囊体细胞数与无机磷浓度、叶绿素a含量及浮游植物细胞密度呈显著正相关(P<0.01,P<0.01,P<0.05)。
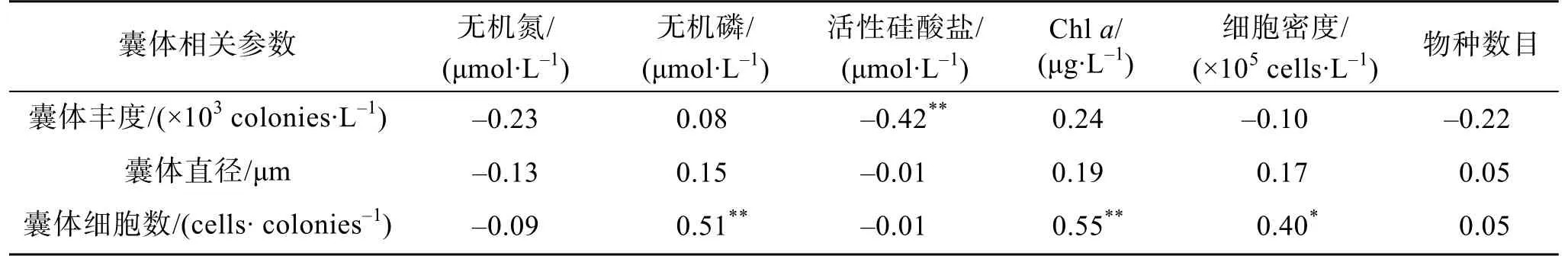
表4 氮磷营养变化下球形棕囊藻囊体参数与营养盐质量浓度、生物量及物种数的Spearman相关系数Tab. 4 Spearman correlation coefficients between colony parameters of Phaeocystis globosa and nutrient concentrations and biomass and species number in different treatments of nutrient addition bioassay
3 讨论
原始海水中N/P比为12, 接近Redfield比值,Redfield比值是反映浮游植物对氮磷营养盐需求的平均水平[26], 营养盐限制的研究结合加富实验、营养吸收动力学等可更全面分析。本研究中通过单独添加和同时添加氮、磷营养的培养实验, 表明氮和磷是浮游植物生长的共同限制因子, 其中磷是浮游植物生长的主要限制因子。
浮游植物的群落的结构受环境中营养盐变化的影响[27], 在营养充足条件下, 繁殖速率高的硅藻易成为优势类群, 当营养盐缺乏时, 具有较强营养储备能力的甲藻则成为优势类群[28]。初始海水中硅藻占绝对优势, 前期的优势种有根管藻(Rhizosoleniaspp.)、海线藻(Thalassionemaspp.)、海链藻(Thalassiosiraspp.)及条纹小环藻(Cyclotella striata)等。同时添加氮和磷的M4和M5组, 叶绿素a及细胞密度明显提高, 但球形棕囊藻囊体丰度维持在较低水平, 表明氮和磷营养充足时球形棕囊藻无法获得竞争优势。随着硅酸盐大量消耗降至较低水平时, 囊体丰度逐步上升,从而与硅酸盐浓度呈现负相关。球形棕囊藻藻华通常发生在硅藻藻华后[8], 较大型硅藻和链状硅藻是棕囊藻赤潮消长过程中常见的伴生浮游植物[29-30]。硅藻可为棕囊藻囊体提供附着基质, 使其稳定悬浮于水体中有利于囊体的进一步形成[2,31]。囊体丰度峰值出现在浮游植物细胞密度峰值之后, 各处理组中囊体大量形成的第5~7 d, 浮游植物细胞密度仍较高。随着硅酸盐的消耗, 培养后期硅藻的比重逐步下降, 甲藻的比重逐步提高。甲藻具有摄食棕囊藻的能力, 其丰度常随棕囊藻藻华暴发而提高[32], 从囊体中逃逸的单细胞可能成为甲藻的食物来源, 使得甲藻丰度提高[33]。
北部湾现场调查中球形棕囊藻囊体在水温为19~21 ℃时具有较高丰度, 囊体丰度介于103~106colonies·L–1,直径主要分布在1~5 mm[34-35]。本研究中囊体丰度不超过103colonies·L–1, 囊体直径小于1 mm, 培养时的“瓶子效应”是影响囊体丰度和直径的因素之一。本研究所用的光强与现场光强的差别亦可能是影响因素之一, 囊体在光强超过40 μmol·(m2·s)–1时形成,高光条件下囊体数量提高[36]。游离单细胞的增殖是囊体存在的基础, 而自然海区中游离单细胞常聚集在低光照区域, 藻华亦通常发生在低光照和浑浊、湍流的海域[37]。本研究仅讨论低光条件下, 球形棕囊藻囊体对氮、磷营养变化的响应。自然海区条件下, 水体的扰动及气体交换等条件有利于囊体对营养的吸收[38], 在形成藻华时囊体直径与囊体细胞的对数回归斜率可达2.44[39]。实验室培养条件下给培养基提供不同程度的扰动能显著提高囊体直径和囊体细胞数量[40]。本研究中仅每天对培养瓶进行一次摇匀, 球形棕囊藻处于静止的状态, 亦可能是影响囊体直径的因素之一。囊体粒径的不匹配是球形棕囊藻抵御浮游动物摄食的有效策略[41], 摄食压力的存在能加快囊体的形成, 促进囊体直径的增长, 且维持囊体长时间存在[42]。本研究中, 培养海水经过200 μm筛绢过滤后, 各处理组仍不同程度地出现了浮游动物,摄食压力对处理组组囊体的形成和持续产生一定的影响。
囊体由游离单细胞不断分裂并产生粘性物质而形成, 囊体细胞通过二分裂增殖, 囊体随之增大[2,7]。囊体形态的维持需要囊体细胞供给物质和能量, 额外物质和能量的投入并不会降低囊体细胞的生长速率[10], 且稀疏的囊体细胞密度会限制体积的增大[43]。实验室条件下以f/2培养基进行培养时, 囊体直径与囊体细胞数的对数线性回归斜率为1.52[24]。本研究中,各处理组的斜率皆低于1.50, 添加氮的处理组斜率皆较低, 表明氮的添加对囊体细胞的增殖无促进作用;囊体细胞数与无机磷浓度呈正相关, 表明磷的添加有利于囊体细胞的增加。磷作为生命细胞组成, 以磷脂形式在细胞的分裂增殖中起重要作用[44], 磷充足的条件下, 有利于囊体细胞的增殖, 从而扩大囊体直径。通常稀疏的囊体细胞密度会导致囊体形态不稳定且易碎[43,45], 而M2及M7组中囊体持续稳定生长至第12d, M3组具有较高的囊体密度但持续时间较短。可推测氮营养盐在囊体粘性外被形成中起重要作用,粘性多糖由囊体细胞产生, 是形成囊体外被维持囊体形态的重要物质[46]。初始海水在一次性添加磷后, 生物量的迅速增加加快了营养盐的消耗速率, 过早的营养盐耗尽会导致囊体细胞提前溢出或消散加快囊体的衰败[40], 可推测M3组快速生长的大量囊体可能因氮营养的供应不足导致囊体外被形成和维持受限, 当囊体外被薄弱时囊体形态易变形和破裂[43], 因此囊体维持时间较短。
球形棕囊藻在较低的N/P比(5.9~19.6)下具有较高的生长速率[47], 藻华发生时低N/P比水体中囊体丰度较高, 磷酸盐的限制是导致藻华消亡的主要原因[38,48]。本研究中同时添加氮和磷调节不同氮磷比条件下囊体数量无明显优势, 但最佳N/P比16︰1的M4组囊体形态更紧致, 具有较高的囊体直径及囊体细胞数, 随着氮磷比升高囊体细胞密度下降, 表明充足氮磷营养条件是囊体形态维持的物质基础,磷在囊体细胞生长过程中起重要作用。
营养盐的输入方式对浮游植物生长的影响不同,一次性大量输入的营养盐添加方式有利于具有较高营养储存能力的种类(储存策略者), 少量且频繁的脉冲式输入方式有利于具有快速生长速率的种类(生长策略者)[49]。本研究中, 每天添加的输入方式第1~3 d的细胞丰度上升速度较一次性添加的快,表明浮游植物群落以生长策略者为主。一次性添加和每天添加磷皆可刺激囊体丰度的增加, 但每天添加时囊体丰度高峰可持续更长时间, 表明球形棕囊藻偏向生长策略。生长策略者通常具有较高的Vmax,适应于以高吸收速率迅速获取外界脉冲式输入的营养[50]。游离单细胞是囊体形成的物质基础[43], 具有较高的生长速率[8], 可推测游离单细胞在脉冲式营养盐条件下的生长特性有利于囊体的形成, 从而在第5~9 d维持较高的囊体丰度, 相比一次性添加磷, 每天添加磷时球形棕囊藻囊体更有可能在群落竞争中获得优势。两种添加方式下磷添加组的囊体数量、囊体直径及囊体细胞的生长皆优于氮添加组,在N/P比持续上升的钦州湾[14-15], 一旦发生突然的磷污染, 则容易刺激球形棕囊藻囊体的快速大量形成而引发藻华。
4 结论
本研究于2019年1月采用钦州湾海域可观察到球形棕囊藻囊体的表层海水进行了营养盐加富培养实验得到的主要结果如下:
(1) 氮和磷营养是钦州湾浮游植物生长的共同限制因子, 其中磷是首要限制因子。
(2) 硅藻是培养过程中的优势类群, 球形棕囊藻囊体继浮游植物细胞密度高峰期后大量形成。
(3) 添加氮后球形棕囊藻可形成囊体, 但不利于囊体数量、囊体直径及囊体细胞数的增长;
(4) 一次性添加和每天添加磷均可刺激囊体大量形成, 并有利于囊体直径的增加, 一次性添加磷促进囊体细胞的增长但囊体衰退较快, 每天添加磷的方式则有利于囊体丰度的维持。

