高温胁迫对马铃薯幼苗活性氧代谢及生理特性的影响
杨芳 乔岩 金中辉 李丹 李茜 任艺彬






摘要:高温是限制马铃薯生长和稳产的重要环境胁迫因子,研究高温胁迫下马铃薯活性氧代谢及相关生理指标变化,对培育耐热型马铃薯品种(系)具有重要意义。以马铃薯栽培种费乌瑞它为研究对象,进行高温胁迫、正常温度恢复处理,对O· 及HO活性进行组织化学定位,检测幼苗抗氧化酶(APX、CAT、POD、SOD)活性、脯氨酸含量和可溶性蛋白含量。结果表明:高温胁迫后,马铃薯幼苗O·、HO与MDA含量明显提高,4种抗氧化酶活性均增强,可溶性蛋白含量降低,脯氨酸含量升高。解除高温胁迫24 h后,O· 及HO含量明显降低,POD活性降低,可溶性蛋白恢复正常;抗氧化酶APX、CAT和SOD的活性持续增强,脯氨酸含量保持较高水平。适度高温胁迫能提高马铃薯费乌瑞它耐热性的抗氧化机制,APX、CAT、SOD和脯氨酸可作为耐热性鉴定生理指标,并维持马铃薯对高温胁迫的“胁迫记忆”。
关键词:马铃薯;高温胁迫;活性氧;抗氧化酶系统;渗透调节物质
中图分类号:S532.01 文献标志码:A
文章编号:1002-1302(2022)11-0097-07
收稿日期:2021-11-29
基金项目:国家自然科学基金地区科学基金(编号:31960441);甘肃省自然科学基金(编号:18JR3RM236);陇东学院博士科研启动基金(编号:XYBY1706)。
作者简介:杨 芳(1982—),女,甘肃庆城人,硕士,助理研究员,主要从事马铃薯抗逆生理、遗传育种等研究。E-mail:yangfangmail@foxmail.com。
通信作者:乔 岩,博士,副教授,硕士生导师,主要从事马铃薯抗逆生理、遗传育种等研究,E-mail:yanqiao@ldxy.edu.cn;杨 芳,硕士,助理研究员,主要从事马铃薯抗逆生理、遗传育种等研究,Email:yangfangmail@foxmail.com。
马铃薯(Solanum tuberosum L.)是全世界种植面积和总产量仅次于禾本科作物的第四大粮食作物,为我国粮食安全和脱贫攻坚作出了重大贡献。马铃薯是粮菜两用型作物,具备产量高、广适性强、营养均衡和加工特性优异等特点,马铃薯在解决粮食短缺和营养健康方面发挥了巨大作用,随着马铃薯主粮化发展战略的实施,其播种面积和总产量逐年增长。随着全球气候继续变暖,直接影响农业生产,對粮食安全带来严重挑战,马铃薯适应性广、抗旱、抗寒、耐瘠薄,但不耐高温。20世纪90年代以来,我国马铃薯主产区西北地区气温上升速度加快,平均每10年增0.6℃。马铃薯是喜凉作物,气温增高致使我国北方马铃薯营养生长期缩短,生殖生长期延后;夏季气温升高致使马铃薯茎节间伸长,叶片变小,影响其光合作用,造成块茎退化、畸形,生长停滞,这对马铃薯的生产安全和产量持续增长极为不利。在高温胁迫下,植物会发生氧化损伤,进而产生多种活性氧分子(reactiveOxygen species,ROS),而ROS修复机制失活会造成核酸、蛋白质等生物大分子的直接损伤,进而导致亚细胞结构受损。高温胁迫下ROS分子会诱导植物细胞发生程序化死亡,然而植物进化出特殊机制以消除ROS毒性,招募超氧化物歧化酶(superoxide dismutase,SOD)、过氧化物酶(peroxidase,POD)、过氧化氢酶(catalase,CAT)及抗坏血酸过氧化物酶(ascorbic acid peroxidase,APX),降低膜脂过氧化水平,保护细胞膜结构稳定性,维持ROS自由基稳态,增强农作物耐热性。
植物抗氧化系统能降解细胞内活性氧与膜脂过氧化产生的冗余物质,在增加植物耐热性等方面发挥重要作用。SOD、POD、CAT与APX等抗氧化酶在高温胁迫植物细胞中发挥着重要功能。SOD能催化O· 发生歧化反应生成HO和O,防止其对细胞内膜系统和亚细胞器的损害,其活性高低能有效反映植物应对高温、干旱和盐胁迫的能力。POD 和 CAT 能降解植物细胞内光呼吸途径产生的冗余过氧化氢,进而保护生物膜系统。APX是抗坏血酸-谷胱甘肽途径清除叶绿体多余HO 和O· 的核心酶,APX 蛋白定位于植物细胞质体,其抗逆性作用弱于SOD、POD和CAT等抗氧化酶。研究表明,适度高温胁迫能显著提高作物的耐热性,增强作物耐热性的光合和抗氧化机制,相关抗氧化酶及基因表达会明显增强,进而启动当代胁迫记忆效应,以增强植物耐逆性。作物光合作用途径与其高温耐受性密切相关,高温能加剧光系统Ⅱ(PSⅡ) 损伤速率,在线粒体和叶绿体等细胞器中积累更多ROS,使膜脂质发生过氧化并损伤DNA,抗氧化系统能增加植物的热适应性。植物对高温胁迫抗性与ROS稳态调控机制高度相关,在细胞水平上,高温能损坏生物膜系统的结构,造成叶绿体、线粒体、高尔基体与内质网等生物膜系统损伤,进而增加细胞膜透性、减少胞内电解质并改变细胞膜热稳定性。高温胁迫会改变植物可溶性蛋白浓度,提高可溶性蛋白合成产率,进而有效保护植物免受逆境伤害;但胁迫加剧会减少可溶性蛋白质在细胞内的积累。
高温胁迫下,植物在生化、细胞、分子及表观修饰层面上响应逆境胁迫,建立非生物胁迫生理响应机制。目前,前人研究了部分马铃薯种质资源在高温胁迫下生理特性的变化,尚未见马铃薯生产主栽品种费乌瑞它(favorite)的耐热性研究。本研究选择产量高、品质优良的菜用型马铃薯品种费乌瑞它幼苗为研究对象,对其进行高温胁迫处理,测定其活性氧代谢水平、抗氧化酶活性及渗透调节物质的表达水平,分析其在高温胁迫及解除胁迫恢复后生理指标的变化,研究该品种耐热性及热适应性机理,以期为马铃薯的耐热性评价及培育耐高温的马铃薯新品种(系)提供参考。
1 材料与方法
1.1 试验材料
马铃薯栽培种费乌瑞它(favorite)由陇东学院农林科技学院提供。
1.2 试验方法
试验于2021年3月在甘肃省庆阳市陇东学院进行,试管苗的扩繁采用单茎节扦插法,培养基为 MS 培养基,光照度约4 000 lx,光—暗周期为16 h—8 h,温度(25±2)℃进行培养。设2个处理(高温胁迫处理、正常温度恢复处理),3次重复,对照(CK)为常温下普通 MS 培养基生长的组培苗。高温胁迫处理(HT4):将25℃生长的试管苗置入 40℃ 处理4 h。正常温度恢复处理(RNT24):将 40℃ 生长的试管苗置入25℃恢复24 h。取出不同处理的幼苗,放入液氮中速冻后-70℃冰箱保存。
1.3 相关生理指标的测定
1.3.1 生长指标的检测 测定试管苗根长、根鲜质量、茎鲜质量、株高、叶片长度,将根与茎叶从根基部剪开,测量最大根长和株高,测定4株试管苗的根长、株高、叶片长度、根鲜质量和茎鲜质量,取平均值。
1.3.2 HO2和O· 的检测 HO和O· 的組织化学定位参考Kumar等的方法,对马铃薯组培苗整株O· 和HO进行NBT和DAB染色。HO含量使用过氧化氢试剂盒(苏州科铭生物技术有限公司,HO-1-Y)进行测定,415 nm处测定吸光度。超氧阴离子含量与产生速率使用超氧阴离子测试盒(苏州科铭生物技术有限公司,SA-1-G)进行测定,530 nm处测定吸光度。
1.3.3 生理指标测定与数据分析 取植物样品约0.1 g,用2 mL pH 值7.8的 PBS冰浴研磨成匀浆,2 mL PBS清洗研钵转移至预冷离心管,4℃静置 5 min,4℃、8 000 r/min 离心15 min,上清液即为粗酶液,用于后续生理指标的测定。MDA含量测定参照硫代巴比妥酸法(TBA);APX活性测定参考 Nakano等的方法,290 nm处测定;CAT含量测定参考Durner等的方法;POD含量测定参考刘齐元等的方法;SOD 含量测定参考Dhindsa等的方法;可溶性蛋白含量的测量采用BCA法;脯氨酸含量的测定采用陈巧巧的方法。
1.4 数据分析
所有数据均为3次以上重复的平均值,使用Excel 2019进行数据分析和绘图,使用Duncan's法对数据进行差异显著性分析。
2 结果与分析
2.1 马铃薯试管苗生长指标变化的分析
由图1可知,对照中马铃薯幼苗叶片生长正常,茎秆坚挺,根系具有韧性,不容易断;当马铃薯幼苗经过40℃的高温处理,叶片有明显的卷曲,茎秆有点萎蔫,根容易发生断裂;经过40℃高温处理的马铃薯幼苗再经过25℃的正常温度恢复处理,叶片卷曲皱缩减轻,茎秆萎蔫有所恢复(图1)。经过高温胁迫和正常温度恢复后马铃薯幼苗株高、根长、叶片长度和根鲜质量、茎鲜质量差异不显著,变化不大(表1)。
2.2 马铃薯试管苗O·及HO的组织化学定位
由图2可知,高温胁迫前,费乌瑞它茎和叶片只有少量蓝色斑点;高温胁迫后,费乌瑞它茎和叶片的蓝色斑点大量增加,表明产生了大量的O· ;正常温度恢复24 h后,费乌瑞它幼苗叶片和茎部位蓝色斑点明显减少,表明O· 明显减少。高温胁迫前,费乌瑞它茎和叶片只有较少的红褐色斑点;高温胁迫后,费乌瑞它茎和叶片开始产生大量颜色较深的褐色斑点,表明生成大量的HO;正常温度恢复 24 h 后,费乌瑞它茎和叶片红褐色斑点明显减少,HO明显减少。
2.3 马铃薯幼苗氧化应激相关指标变化分析
由图3可知,费乌瑞它幼苗对照HO含量为2.43 μmol/g,经高温胁迫后,其HO含量增加到3.01 μmol/g,与对照相比差异达显著水平(P<0.05);正常温度恢复24 h后,其HO含量降低到2.35 μmol/g,与对照差异不显著,解除高温后HO含量恢复到正常水平。费乌瑞它幼苗对照MDA含量为1.88 nmol/g,经高温胁迫4 h后MDA含量达到15.03 nmol/g,与对照相比差异极显著(P<0.01);正常温度恢复24 h后,其MDA含量降低到4.75 nmol/g。这表明高温胁迫使细胞膜产生大量MDA,而解除胁迫后幼苗MDA含量会明显下降。由图4可知,费乌瑞它幼苗对照O· 含量为 147.68 nmol/g,经高温胁迫4 h后O· 含量达到最高值,为207.28 nmol/g,与对照相比提高了40.36%,差异极显著(P<0.01);与对照相比,高温胁迫后O· 产生速率差异极显著(P<0.01),这表明高温胁迫后马铃薯迅速产生大量的O·。
2.4 抗坏血酸过氧化物酶活性变化分析
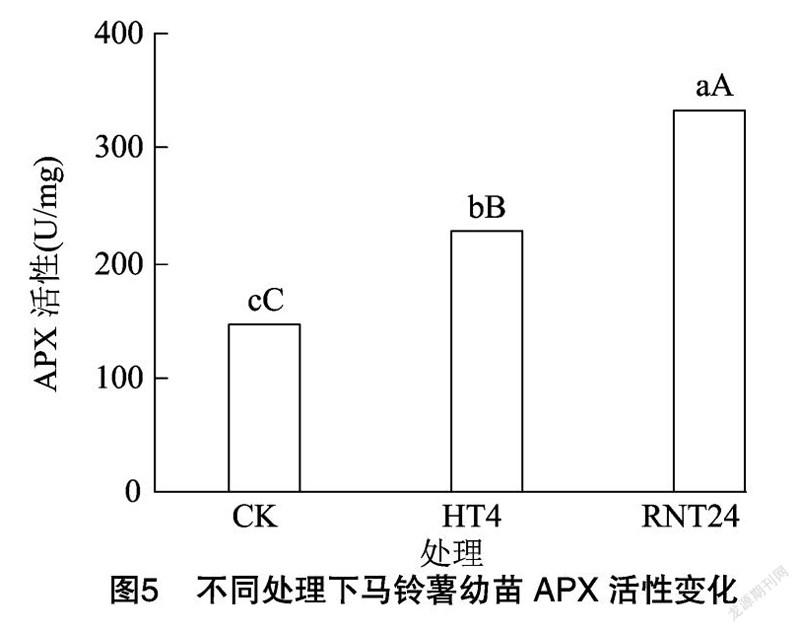
由图5可知,费乌瑞它幼苗对照APX活性为146.61 U/mg,经高温胁迫处理4 h后,其幼苗APX活性增加到227.87 U/mg,比对照提高了55.43%,与对照相比差异极显著(P<0.01);高温胁迫后的幼苗经24 h的正常温度恢复后,APX活性明显升高,升高到334.25 U/mg,比对照提高了127.99%,比高温胁迫处理提高了46.68%,差异均达到极显著水平(P<0.01),这表明胁迫解除后费乌瑞它幼苗APX活性保持较高表达水平。
2.5 抗氧化酶 SOD、CAT、POD活性变化分析
由图6可知,费乌瑞它幼苗对照的SOD活性为50.57 U/mg,经高温胁迫处理4 h后,其活性提高到95.27 U/mg,比对照提高了88.39%,差异极显著(P<0.01);经过正常温度恢复24 h后,其酶活性持续升高到100.71 U/mg,比对照提高了99.15%,差异极显著(P<0.01);这表明胁迫解除后费乌瑞它幼苗的SOD活性也能持续增长。
由图6可知,与对照相比,高温胁迫处理4 h后费乌瑞它幼苗POD活性升高,为85.34 U/mg,与对照相比提高了139.72%,差异极显著(P<0.01);经正常温度恢复处理24 h后,POD活性降低到 33.23 U/mg,均低于对照与高温胁迫处理。
由图6可知,经高温胁迫处理4 h后,CAT活性升高到6.04 U/mg,与对照相比差异极显著(P<0.01),提高了233.52%。后经解除高温胁迫24 h后,CAT活性持续提高,为6.81 U/mg,比对照提高了275.74%,差异极显著(P<0.01);比高温胁迫处理提高了12.66%,差异显著(P<0.05),这表明胁迫解除后费乌瑞它幼苗CAT活性也保持较高表达水平。
2.6 滲透调节类物质可溶性蛋白、脯氨酸含量变化分析
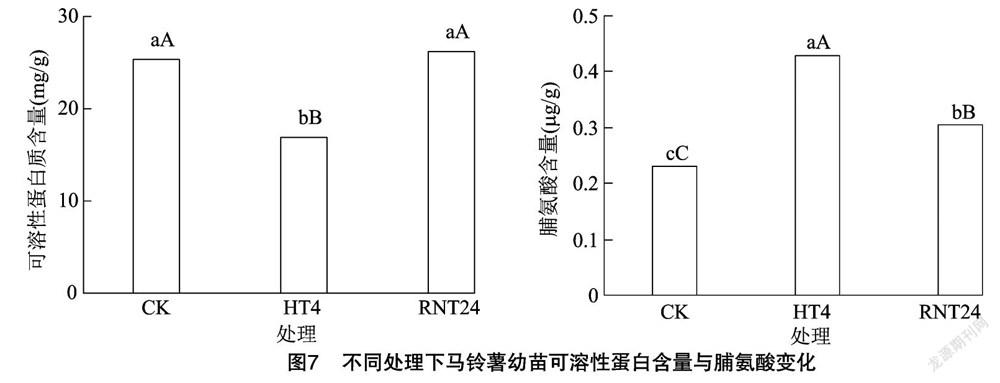
由图7可知,经过高温胁迫处理4 h后,费乌瑞它幼苗可溶性蛋白含量从25.39 mg/g降低到 16.83 mg/g,与对照相比差异极显著(P<0.01),降低了33.71%;经过正常温度恢复处理24 h后,其含量增加到26.22 mg/g,与对照基本相同,比高温胁迫处理提高了55.79%,差异极显著(P<0.01)。经高温胁迫处理4 h后,费乌瑞它幼苗产生0.428 μg/g脯氨酸,与对照相比差异极显著(P<0.01),提高了84.51%;经过正常温度恢复处理24 h后,其含量降低到0.304 μg/g,但仍高于对照,达到差异极显著水平(P<0.01),表明脯氨酸可能参与高温“胁迫记忆”过程。
3 讨论与结论
在高温、干旱等环境胁迫下,植物细胞能合成冗余活性氧,通过多重机制清除有害ROS分子;此外可溶性蛋白和脯氨酸积累是逆境胁迫下的一种重要代谢适应机制,与作物耐热性强弱相关。本研究主要探讨了马铃薯栽培种费乌瑞它在高温胁迫及胁迫后正常条件恢复后的活性氧代谢水平、抗氧化酶活力及渗透调节物质含量的变化与差异。
马铃薯生长过程中,高温气候会阻碍其形态建成,极端条件下致使马铃薯整株死亡。本研究中将马铃薯置于高温胁迫一段时间后,植株叶片会明显卷曲,茎秆萎蔫,根容易发生断裂;经过40℃高温处理的马铃薯幼苗再经过25℃的正常温度恢复处理后,叶片卷曲恢复,茎秆萎蔫减轻,这与陈巧巧等的研究结果一致,高温胁迫下会导致马铃薯幼苗表型变化,延缓植株生长,但如果高温胁迫时间较短,马铃薯幼苗能够重新恢复其正常表型。
正常环境下植物能维持细胞内活性氧的稳态,但高温胁迫会打破细胞稳态,产生过量活性氧分子,植物细胞内积累O·、·OH、HO、MDA,从而造成质膜过氧化。植物主要依赖于抗氧化酶系统维持细胞内的活性氧动态平衡。本研究发现,在高温胁迫初期,O· 和HO的含量明显增多,但高温胁迫恢复后,O· 和HO的含量则又降低。经高温胁迫正常温度恢复24 h后APX、CAT、SOD活性明显增加,POD活性下降;短期高温胁迫4 h后,费乌瑞它植株中抗氧化酶SOD、POD、CAT、APX活性显著增高,这与任彩虹等的研究结果类似。推测在高温胁迫下,费乌瑞它幼苗通过基因调控网络产生过量超氧自由基,从而引发相关抗氧化酶的大量合成,以清除细胞内HO、O· 等活性氧分子,消除亚细胞区室的活性氧伤害,维持细胞稳态,激发其保护性应激反应机制。此外,本研究发现POD活性在解除胁迫正常温度恢复后反而降低,这与李英丽等的研究结果一致,热激初期O· 迅速产生,使POD活性增高,随后下降;这可能是费乌瑞它幼苗对高温胁迫比较敏感,高温胁迫强度过高,从而导致蛋白质合成受阻,酶失活加剧。
高温环境会影响脯氨酸和可溶性蛋白在植物亚细胞中的代谢和分布。本研究发现,高温胁迫后费乌瑞它植株可溶性蛋白含量明显降低,脯氨酸含量明显增高;这与前人研究结果一致,高温胁迫后可溶性蛋白含量明显下降,C植物核酮糖二磷酸羧化酶(RuBisCo)占植物可溶性蛋白质的60%以上,在植物衰老进程中RuBisCo含量可达可溶性蛋白质总量的90%。马铃薯属于C植物,高温胁迫导致费乌瑞它RuBisCo蛋白大量降解,从而导致高温胁迫初期可溶性蛋白含量降低。高温胁迫后,马铃薯脯氨酸含量明显升高,胁迫解除后,脯氨酸含量仍保持较高水平,表明脯氨酸积累与热应激记忆相关;Feng等发现,脯氨酸合成代谢基因P5CS1(1-吡咯啉-5-羧酸合成酶基因,1-pyrroline-5-carboxylate synthetase)“转录记忆”导致胁迫标记物脯氨酸积累,使拟南芥产生盐胁迫记忆;干旱等非生物胁迫能诱导小麦、水稻中脯氨酸合成基因P5CS与-OAT(鸟氨酸——氨基转移酶基因,ornithine δ-aminotransferase)等基因的启动子去甲基化,进而积累脯氨酸,通过记忆效应增加作物耐逆性。
综上所述,马铃薯栽培种费乌瑞它对高温胁迫具有适度耐受性,其APX、SOD、CAT和脯氨酸与耐热性相关性较好,可作为该品种耐热性鉴定的生理指标。而短期高温处理可诱导马铃薯发生胁迫反应,高温解除后,APX、SOD与CAT活性保持增长,脯氨酸积累保持较高水平,进而维持马铃薯对高温胁迫的记忆,而这些物质参与“胁迫记忆”的分子调控机制仍需进行深入研究。
参考文献:
[1]李文娟,秦军红,谷建苗,等. 从世界马铃薯产业发展谈中国马铃薯的主粮化[J]. 中国食物与营养,2015,21(7):5-9.
[2]岳晓甜. 马铃薯主粮化视角下农户种植意愿影响因素实证研究[D]. 北京:中国农业科学院,2018:11-13.
[3]刘维成,张 强,傅 朝. 近55年来中国西北地区降水变化特征及影响因素分析[J]. 高原气象,2017,36(6):1533-1545.
[4]姚玉璧,杨金虎,肖国举,等. 气候变暖对马铃薯生长发育及产量影响研究进展与展望[J]. 生态环境学报,2017,26(3):538-546.
[5]Fahad S,Bajwa A A,Nazir U,et al. Crop production under drought and heat stress:plant responses and managementOptions[J]. Frontiers in Plant Science,2017,8:1147.
[6]Zhao J G,Lu Z G,Wang L,et al. Plant responses to heat stress:physiology,transcription,noncoding RNAs,and epigenetics[J]. International JournalOf Molecular Sciences,2021,22(1):117.
[7]Arnao M B,Hernández-Ruiz J.Melatonin:a new plant hormone and/or a plant master regulator?[J]. Trends in Plant Science,2019,24(1):38-48.
[8]任彩虹,张丽萍,闫桂琴,等. 高温胁迫对马铃薯幼苗抗氧化酶系统和叶绿素含量的影响[J]. 科技情报开发与经济,2007,17(14):181-183.
[9]吴 昊,李燕敏,谢传晓. 作物耐热生理基础与基因发掘研究进展[J]. 作物杂志,2018(5):1-9.
[10]王 笑,蔡 剑,周 琴,等. 非生物逆境锻炼提高作物耐逆性的生理机制研究进展[J]. 中国农业科学,2021,54(11):2287-2301.
[11]戴鸣凯,张志忠,刘 爽,等. 高温胁迫对马铃薯幼苗生长和部分生理指标的影响 [J]. 农学学报,2018,8(9):9-14.
[12]刘长远,李光达,万丽嫱,等. 高温胁迫对不同熟期马铃薯品种幼苗部分生理指标的影响[J]. 云南农业大学学报(自然科学),2020,35(4):596-600.
[13]Sattar A,Sher A,Ijaz M,et al. Terminal drought and heat stress alter physiological and biochemical attributes in flag leafOf bread wheat[J]. PLoSOne,2020,15(5):e0232974.
[14]張景云,赵晓东,万新建,等. 小白菜耐热性鉴定及其耐热性分析[J]. 核农学报,2014,28(1):146-153.
[15]Kumar D,Yusuf M A,Singh P,et al. Histochemical detectionOf superoxide and HO accumulation in Brassica juncea seedlings[J]. Bio-protocol,2014,4(8):e1108.
[16]Nakano Y,Asada K. Hydrogen peroxide is scavenged by ascorbate-specific peroxidase in spinach chloroplasts[J]. Plant and Cell Physiology,1981,22(5):867-880.
[17]Durner J,Klessig D F. Salicylic acid is a modulatorOf tobacco and mammalian catalases[J]. JournalOf Biological Chemistry,1996,271(45):28492-28501.
[18]刘齐元,程元强,朱肖文,等. 雄性不育烟草花蕾中SOD、POD和CAT活性研究[J]. 中国烟草学报,2011,17(5):34-39.
[19]Dhindsa R S,Plumb-Dhindsa P,Thorpe T A.Leaf senescence:correlated with increased levelsOf membrane permeability and lipid peroxidation,and decreased levelsOf superoxide dismutase and catalase[J]. JournalOf Experimental Botany,1981,32(1):93-101.
[20]He F L. BCA(bicinchoninic acid) protein assay[J]. Bio-protocol,2011,1(5):e44.
[21]陳巧巧. 外源蔗糖对马铃薯高温与低温胁迫耐受性的影响[D]. 兰州:兰州理工大学,2017:1-16.
[22]张宗申,利容千,王建波. 外源Ca预处理对高温胁迫下辣椒叶片细胞膜透性和GSH、AsA含量及Ca分布的影响[J]. 植物生态学报,2001,25(2):230-234,262.
[23]王 涛,黄语燕,陈永快,等. 高温胁迫下外源壳聚糖对黄瓜幼苗生长的影响[J]. 江苏农业科学,2019,47(23):142-146.
[24]李英丽,果秀敏,张建光,等. 高温胁迫对苹果果皮组织抗氧化特性的影响[J]. 河北农业大学学报,2005,28(1):18-20.
[25]Hussain H A,Men S N,Hussain S,et al. Interactive effectsOf drought and heat stressesOn morpho-physiological attributes,yield,nutrient uptake andOxidative status in maize hybrids[J]. Scientific Reports,2019,9(1):3890.
[26]Ergo V V,Lascano R,Vega C R C,et al. Heat and water stressed field-grown soybean:a multivariate studyOn the relationship between physiological-biochemical traits and yield[J]. Environmental and Experimental Botany,2018,148:1-11.
[27]Friedrich J W,Huffaker R C.Photosynthesis,leaf resistances,and ribulose-1,5-bisphosphate carboxylase degradation in senescing barley leaves[J]. Plant Physiology,1980,65(6):1103-1107.
[28]Feng X J,Li J R,Qi S L,et al. Light affects salt stress-induced transcriptional memoryOf P5CS1 in Arabidopsis[J]. ProceedingsOf the National AcademyOf SciencesOf the United StatesOf America,2016,113(51):E8335-E8343.

