吴茱萸碱对酒精性胃溃疡大鼠胃黏膜上皮细胞的保护作用
李有连, 张秉丽, 霍成英, 朱海宏
(1.青海仁济医院消化内科,青海省西宁市 810021;2.青海省人民医院消化内科,青海省西宁市810000)
胃溃疡发病原因多样,包括幽门螺杆菌感染、不良饮食习惯、药物、精神和遗传因素等[1-2]。酒精的不适当使用和摄入会引起全身多器官损伤,其中,酒精对胃肠道的影响是最为直接和严重的,作为一种胃黏膜攻击因子,大量高浓度乙醇可直接损伤胃黏膜组织,刺激胃肠道蠕动,引起水肿、出血和炎症等损伤[3-4]。吴茱萸碱(evodiamine,EVO)提取自芸香科植物吴茱萸、石虎、疏毛吴茱萸的果实,具有抗肿瘤、镇痛、抗炎、抗阿尔茨海默症、治疗内分泌系统疾病的作用[5-7]。研究表明,吴茱萸碱对胃炎、胃溃疡等胃肠道疾病具有抑制作用,但其作用机制尚不清晰[8]。本研究通过建立酒精性大鼠胃溃疡模型探讨EVO对酒精性胃溃疡的预防作用,探讨其作用机制。
1 材料和方法
1.1 实验动物
SPF级SD大鼠60只,6周龄,体质量180~220 g,雌雄各半,购自北京维通利华实验动物技术有限公司[SCXK(京)2016-0011],饲养条件:室温为(22±2) ℃,湿度为(50±10)%,保持屋内12 h光照和12 h无光照的光暗周期,摄食饮水不限。
1.2 材料与试剂
EVO(纯度>98%,上海一基实业有限公司,批号:518-17-2);奥美拉唑(重庆涪陵制药,20160511);无水乙醇(天津富宇精细化工有限公司);HE染色试剂盒、中性树胶、TUNEL细胞凋亡检测试剂盒(北京索莱宝科技有限公司);实验所需检测氧化应激及炎性因子试剂盒(武汉Elabscience生物科技有限公司);蛋白定量试剂盒(博士德生物);酪氨酸蛋白激酶2(Janus activating kinase 2,JAK2)、磷酸化的JAK2(phospho-JAK2,p-JAK2)、信号转导子与转录激活因子3(signal transducer and activator of transcription 3,STAT3)、磷酸化STAT3(phospho-STAT3,p-STAT3)、B淋巴细胞瘤-2基因(B-cell lymphoma-2,Bcl-2)、Bcl-2关联X蛋白(BCL2-associated X protein,Bax)兔单抗、羊抗兔二抗(美国CST公司)。
1.3 分组、造模与给药
将60只大鼠随机分为对照组、模型组、奥美拉唑组、EVO高剂量组、EVO低剂量组和酪氨酸蛋白激酶2特异性抑制剂(the specific inhibitor of tyrosine protein kinase 2,AG490)组,每组10只。除对照组和模型组每天使用等量生理盐水灌胃给药之外,奥美拉唑组(5 mg/kg)、EVO高剂量组(40 mg/kg)、EVO低剂量组(20 mg/kg)大鼠均采用灌胃给药的方式进行预处理,每天1次,连续7天,AG490组大鼠腹腔注射5 mg/kg AG490,每2天一次,持续7天。末次给药前1天禁食,末次给药后2 h,除对照组外,其他各组大鼠均灌胃5 mL/kg无水乙醇建立酒精性胃溃疡模型[9],1 h后处死大鼠取材,进行后续实验。
1.4 计算大鼠胃溃疡面积及胃溃疡抑制率
造模后1 h,处死大鼠,剖开腹腔,分离胃组织,沿着胃大弯剪开后用生理盐水清洗至无内容物和血丝,置于冰盒上展平,测量胃溃疡病灶的长径和短径,计算各个大鼠的溃疡面积,然后计算药物对胃溃疡的抑制率。溃疡抑制率(%)=[(模型组溃疡面积-给药组溃疡面积)/模型组溃疡面积]×100%。
1.5 HE染色观察胃黏膜组织病理变化
收集胃黏膜组织溃疡部分,取其中一部分修剪成适宜大小和形状,浸泡在4%多聚甲醛中室温固定2天;剩余部分组织清洗干净后直接放置在EP管中,冻存于-80 ℃。胃组织固定后用蒸馏水清洗,使用梯度乙醇对组织进行脱水处理,然后放入二甲苯溶液中适当透明,放入不同熔点的石蜡中制成组织蜡块,在切片机上制成厚度为4 μm的切片,固定在防脱载玻片上,烤片、脱蜡,梯度乙醇复水,行HE染色,封片后放在倒置显微镜下拍照并观察胃黏膜病理变化。
1.6 TUNEL法观察胃黏膜上皮细胞凋亡
切片制备方法同1.5。切片标本常规脱蜡、复水,严格按照TUNEL染色试剂盒说明书的步骤对各组大鼠的病理标本进行染色,常规脱水、透明后用中性树胶封片,显微镜高倍镜下观察,每组随机取4个视野拍照,计数胃黏膜上皮细胞区域凋亡细胞数量取平均值。
1.7 血清TNF-α、IL-6、IL-10水平及胃黏膜组织SOD活力、MDA含量检测
取腹主动脉血于EP管中后放置于4 ℃冰箱中,2 h后取出,以3 000 r/min的转速离心(半径为12.5 cm),10 min后用移液器小心吸取析出的上层血清,分装后保存在-20 ℃冰箱。取血完毕后剥取大鼠胃黏膜组织溃疡部分,剪碎、匀浆,以10 000 r/min的转速离心,离心半径同上,10 min后用移液器小心吸取上层清液,分装和保存环境同血清环境。根据试剂盒说明书的要求,绘制标准曲线,计算各组大鼠血清中肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)、白细胞介素-6(interleukin-6,IL-6)、白细胞介素-10(interleukin-6,IL-10)的含量及胃黏膜中超氧化物歧化酶(superoxide dismutase,SOD)活力、丙二醛(malondialdehyde,MDA)含量。
1.8 Western blotting法检测
剥取大鼠胃黏膜组织溃疡部分,剪碎后放入研磨器,在冰上研磨匀浆,加入裂解液提取各组胃黏膜组织总蛋白,BCA蛋白定量试剂盒测定胃黏膜组织蛋白的水平,在各组蛋白中加入上样缓冲液混合均匀,于沸水中煮沸变性,然后进行SDS-PAGE电泳,每个样品上样20 μg,将分离的目的蛋白转至PVDF膜上,转膜结束后将所有膜放入5%脱脂奶粉中,恒温摇床孵育2 h,TBST缓冲液清洗后将膜放入1∶1 000的一抗中,4 ℃孵育12 h,用TBST缓冲液清洗好后加入1∶2 000的二抗中,37 ℃恒温摇床孵育2 h,TBST缓冲液清洗3次,PVDF膜后于避光处均匀滴加ECL曝光试剂,置于凝胶成像仪中观察并拍照记录,使用Image J对结果进行量化分析。
1.9 统计学方法

2 结 果
2.1 各组大鼠胃溃疡面积及抑制率比较
奥美拉唑组、EVO高、低剂量组和AG490组溃疡面积均小于模型组(均P<0.05)。与奥美拉唑组比较,EVO低剂量组溃疡面积增加,溃疡抑制率降低(P<0.05)。与EVO高剂量组比较,EVO低剂量组溃疡面积增加,溃疡抑制率降低(P<0.05)。与EVO低剂量组比较,AG490组溃疡面积减少,溃疡抑制率升高(P<0.05;表1)。

表1 各组大鼠胃溃疡面积及抑制率比较
2.2 各组大鼠胃黏膜组织病理学变化
HE染色显示,对照组大鼠胃黏膜组织细胞排列整齐、有序,无炎性细胞浸润,而模型组大鼠胃黏膜组织可见明显的损伤,黏膜细胞坏死、炎性细胞增加。与模型组比较,EVO高、低剂量组和AG490组溃疡损伤和炎性细胞浸润程度均减轻(图1)。
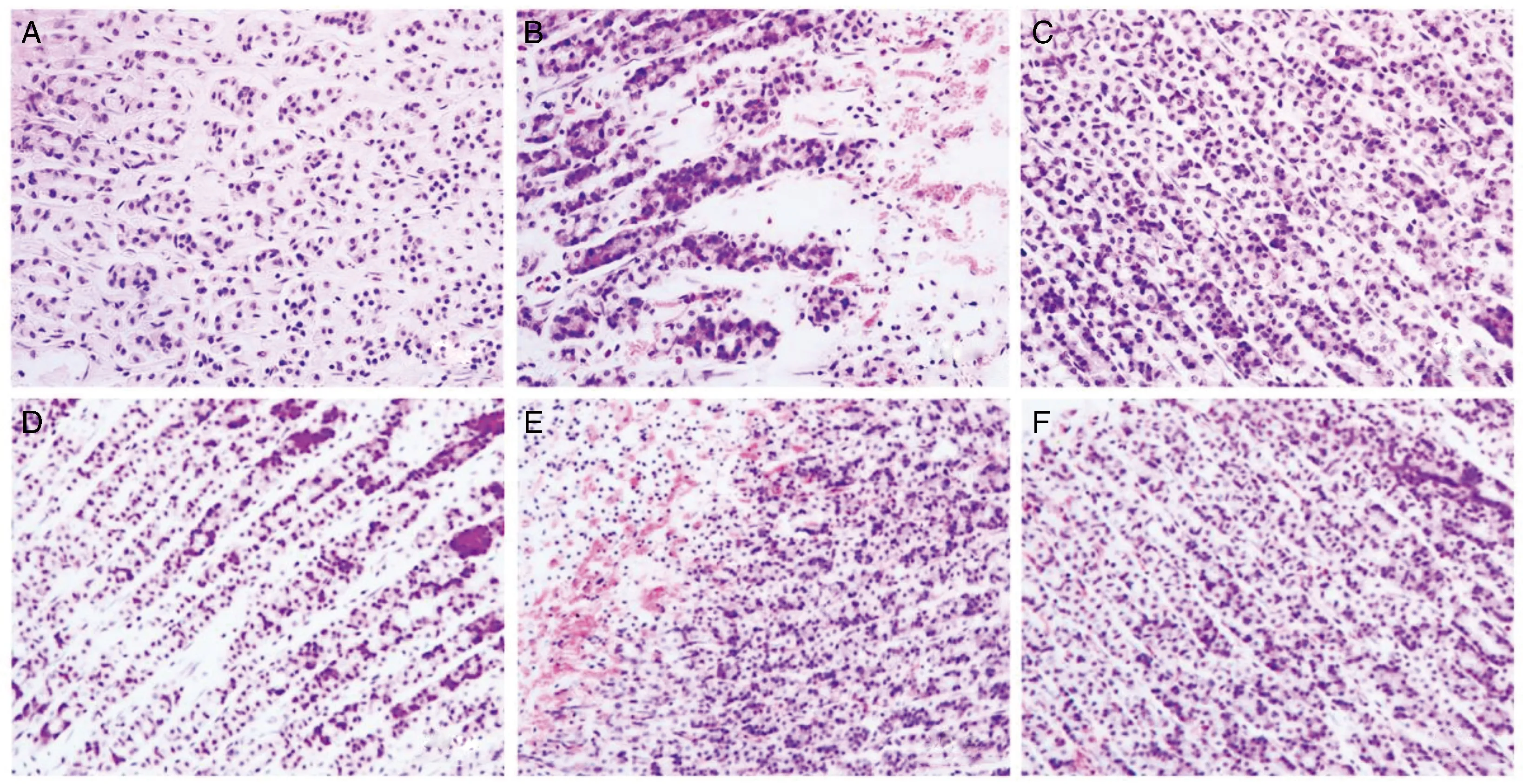
图1 各组大鼠胃黏膜组织病理学变化(HE,200×)
2.3 各组大鼠胃黏膜上皮细胞凋亡情况
与对照组比较,其余各组凋亡细胞数量均增加(P<0.05)。与模型组比较,除对照组外其他各组凋亡细胞数量均降低(P<0.05)。EVO低剂量组凋亡细胞数量高于奥美拉唑组和EVO高剂量组(P<0.05)。AG490组凋亡细胞数量低于奥美拉唑组、EVO高剂量组和EVO低剂量组(均P<0.05;图2)。

图2 各组大鼠胃黏膜上皮细胞凋亡情况比较(TUNEL,400×)
2.4 各组大鼠TNF-α、IL-6、IL-10水平及胃黏膜组织SOD活力、MDA含量的比较
与对照组比较,其余各组大鼠的胃黏膜组织IL-10含量和SOD活力降低,TNF-α、IL-6及MDA的含量增加(P<0.05)。奥美拉唑组、EVO高、低剂量组和AG490组胃黏膜组织IL-10含量和SOD活力高于模型组,TNF-α、IL-6及MDA的含量低于模型组(P<0.05)。EVO低剂量组IL-10含量和SOD活力低于奥美拉唑组、EVO高剂量组及AG490组,TNF-α、IL-6、MDA含量高于奥美拉唑组、EVO高剂量组及AG490组(均P<0.05;表2)。
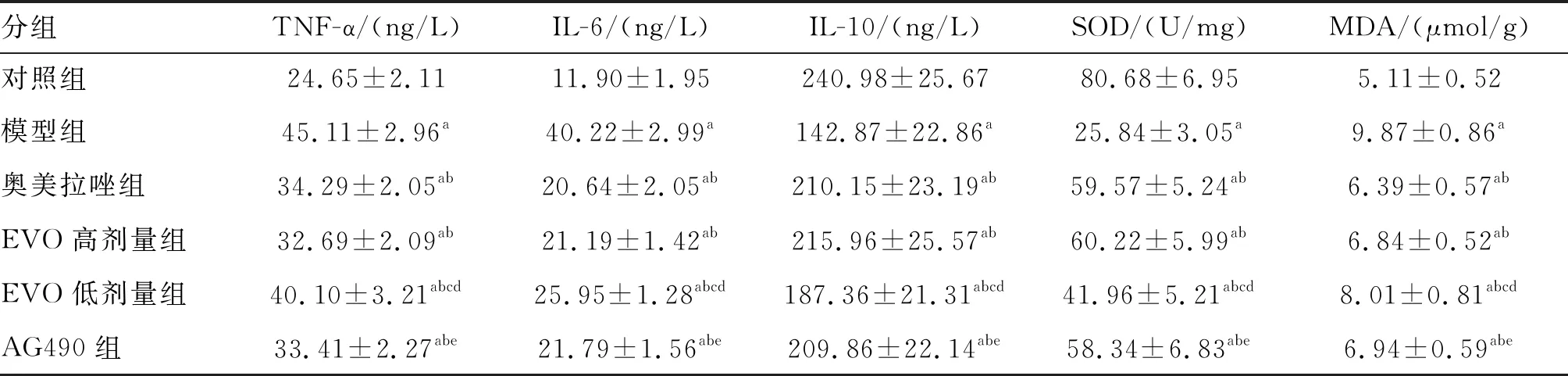
表2 各组大鼠TNF-α、IL-6、IL-10水平及胃黏膜组织SOD活力、MDA含量的比较
2.5 各组大鼠胃黏膜组织Bcl-2、Bax表达的比较
与对照组比较,其他各组Bcl-2表达降低,Bax表达增加(P<0.05)。与模型组比较,奥美拉唑组、EVO高、低剂量组和AG490组Bcl-2表达增加,Bax表达减少(P<0.05)。EVO低剂量组Bcl-2表达低于奥美拉唑组、EVO高剂量组及AG490组,Bax表达高于奥美拉唑组、EVO高剂量组及AG490组(P<0.05;图3)。

图3 Western blotting法检测胃黏膜组织Bcl-2、Bax表达
2.6 各组大鼠胃黏膜组织JAK2、p-JAK2、STAT3及p-STAT3蛋白表达的比较
与对照组比较,其他各组JAK2和STAT3磷酸化水平均增加(P<0.05)。与模型组比较,奥美拉唑组、EVO高剂量组和AG490组JAK2和STAT3磷酸化水平均降低(P<0.05)。EVO低剂量组JAK2和STAT3磷酸化水平高于奥美拉唑组、EVO高剂量组和AG490组(P<0.05;图4)。

图4 Western blotting法检测胃黏膜组织JAK2、STAT3磷酸化水平
3 讨 论
胃溃疡是一种发病率高、病因复杂的异质性疾病,常见的临床治疗药物包括抗菌药物、抗酸药、质子泵抑制剂和H2受体阻断剂等,但均存在副作用较多、易复发、疗程长等缺点,因此,从传统中药天然活性成分中寻找安全有效的抗胃溃疡药物具有重要的研究意义[10]。EVO源自中药吴茱萸、石虎及疏毛吴茱萸的成熟果实,是一种具有多种药理学作用的生物碱[11]。研究表明,吴茱萸及含吴茱萸的中药方剂对胃炎、胃溃疡等疾病具有良好的治疗作用,其活性成分EVO对胃肠道疾病亦有一定程度的保护作用,但其具体作用机制仍需进一步研究并加以阐明[12-13]。
本研究通过药物预处理后灌胃5 mL/kg无水乙醇建立大鼠酒精性胃溃疡模型,结果显示奥美拉唑组、EVO高、低剂量组和AG490组均出现不同程度的胃溃疡,病理切片显示各组大鼠均出现胃黏膜细胞坏死、炎性细胞浸润等现象,但奥美拉唑组、EVO高剂量组和低剂量组均对酒精性胃溃疡具有抑制作用,能够缩小胃溃疡面积,减轻胃黏膜损伤和炎症浸润,EVO高剂量的作用优于低剂量。研究表明,炎症和氧化应激反应是胃溃疡发生的重要过程,溃疡患者往往出现血清炎性细胞因子紊乱,TNF-α、IL-6含量异常增加而IL-10含量降低,TNF-α和IL-6是机体重要的炎性因子,与细胞凋亡和分化、免疫调节相关,而IL-10可通过降低TNF-α等炎性因子的表达而产生抗炎作用[14-15]。SOD作为机体的重要抗氧化酶可反映机体清除自由基的能力;MDA则与胃溃疡时机体受损程度相关,是氧自由基损伤胃黏膜后产生的脂质过氧化物[16]。在本研究中,酒精性胃溃疡大鼠血清炎性因子水平TNF-α、IL-6增加,IL-10减少,胃黏膜组织SOD活力降低,MDA含量增加,而预先使用EVO处理可减轻胃溃疡大鼠炎症反应和氧化应激损伤。EVO可减少胃黏膜上皮细胞凋亡数量,显著降低胃黏膜组织Bax表达,增加Bcl-2的表达,且高剂量EVO的上述作用优于低剂量EVO,表明一定剂量EVO具有抗炎、抗氧化应激和抗凋亡作用。
JAK/STAT信号通路是一种高度保守的信号转导途径,在机体的免疫调节和炎症过程中具有重要作用[17]。JAK2是一种非跨膜型酪氨酸激酶,当受到多种细胞因子刺激后可与细胞受体结合,使JAK2磷酸化,进而诱导下游的STAT3磷酸化,并参与细胞的多种生物学过程[18]。AG490是JAK2/STAT3信号通路特异性抑制剂,在本研究中,酒精性胃溃疡大鼠JAK2和STAT3磷酸化水平增加,大鼠预先使用AG490进行预处理后,胃溃疡面积、胃黏膜损伤和炎症浸润得到明显改善,炎症反应和氧化应激损伤减轻,JAK2和STAT3磷酸化水平降低,提示酒精诱导的大鼠胃溃疡可能与JAK2/STAT3信号通路活化有关。同时,高剂量和低剂量EVO均可降低JAK2和STAT3的磷酸化水平,EVO高剂量组的作用优于EVO低剂量组,提示EVO可能通过抑制JAK2/STAT3信号通路磷酸化产生对酒精性胃溃疡的抑制作用。
综上所述,EVO可能通过阻断JAK2/STAT3信号通路抑制酒精性胃溃疡的形成,抑制炎症反应、氧化应激和细胞凋亡,减轻组织损伤,为EVO的临床应用提供理论依据。

