放疗后使用贝伐珠单抗致气管纵隔瘘1例并文献复习
杜中英 柳芳 崔慧娟
关键词贝伐珠单抗;放疗;气管纵隔瘘;呼吸道瘘;临床药师
贝伐珠单抗(bevacizumab,Bev)是全球首个上市的血管内皮生长因子(vascular endothelial growth factor,VEGF)靶向药,可通过阻止VEGF与其受体结合来抑制内皮细胞的增殖及新生血管的生成,进而发挥抗肿瘤作用;此外,该药还可促进化疗药物从血液系统进入到肿瘤组织,提高化疗药物在肿瘤组织中的浓度,增强其抗肿瘤效果[1-2]。Bev 被广泛用于非小细胞肺癌、结直肠癌、子宫内膜癌、乳腺癌、卵巢癌等多种肿瘤的临床治疗[3]。由于VEGF在正常血管生成过程中也具有重要的调控作用[4],故在应用Bev 抑制VEGF 时会引发一些不良反应,如高血压、出血、伤口愈合障碍、血栓、胃肠道穿孔、动脉血栓栓塞等。目前,临床已对这些常见的不良反应有了较为充分的认识,但对Bev 带来的一些罕见且危及生命的毒副作用仍了解有限,如充血性心力衰竭、可逆性后部白质脑病综合征、呼吸道瘘等[5-6]。其中,呼吸道瘘以气管纵隔瘘更为罕见,现仅见美国学者Thawani等[7]和Castro-Varela等[8]各报道过1例,但两例患者均未接受放疗。本文报道了临床药师参与的1 例放疗后使用Bev致气管纵隔瘘患者的治疗过程,并通过检索相关文献来总结分析该药致相关呼吸道瘘的形成特点,探讨本例气管纵隔瘘的形成原因,以期为肿瘤患者安全使用Bev提供参考。
1 治疗过程
患者为女性,年龄为63 岁,身高为158 cm,体质量为59 kg,临床诊断为气管腺样囊性癌cT4NxM1c ⅣB期。患者于2017 年初出现不明原因喘息、咳嗽;于2017年4 月行正电子发射断层成像-计算机断层扫描术(positronemission tomography-computed tomography,PET-CT)示气管分叉上方气管壁软组织密度影伴葡萄糖代谢增高,考虑恶性;于同年5 月10 日行气管肿瘤切除、气管重建术,术后病理回报“腺样囊性癌,侵犯支气管壁”,另送淋巴结检查未见转移。
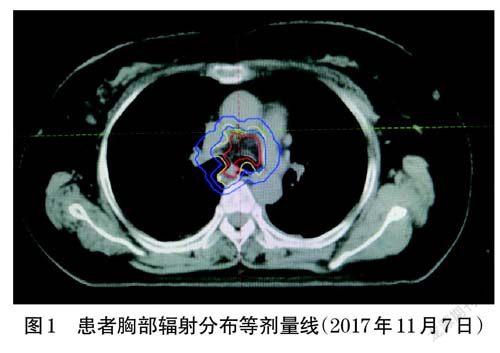
2017 年10 月20 日,患者行胸部计算机断层扫描术(computed tomography,CT)示气管下段管壁不规则增厚,气管壁结节增大,提示疾病进展(progressive disease,PD),遂行胸部放疗(64 Gy×32 次),胸部辐射分布等剂量线见图1。
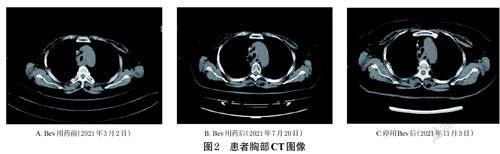
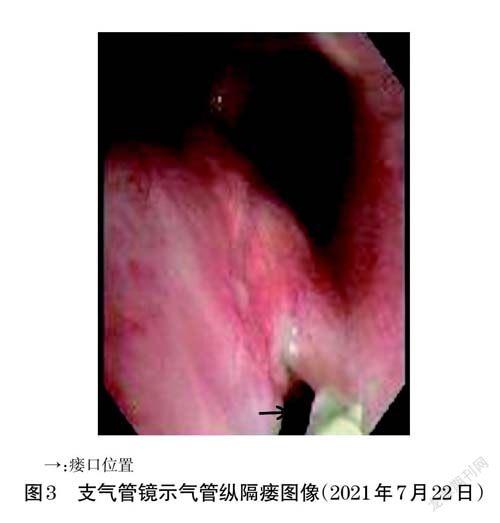
2020 年10 月19 日,患者门诊复查胸部CT示双肺多发大小不等结节,较前增多、增大,考虑转移瘤;左侧第3~4 肋骨骨桥局部软组织密度影,较前新发,左侧胸膜增厚。同年12 月24 日,行CT引导下左侧第3 前肋肿物穿刺,病理回报“腺样囊性癌,考虑转移”。2021 年1 月12 日、2 月8 日分别行一线PC 方案化疗(注射用培美曲塞二钠800 mg,d1+注射用卡铂450 mg,d2,静脉滴注,21d 为1 个周期),治疗结束后评价疗效为PD。2021 年3 月4 日、26 日分别行二线TP方案化疗[注射用紫杉醇(白蛋白结合型)200 mg,d1,8+顺铂注射液40 mg,d1~3,静脉滴注,21 d 为1 个周期],治疗结束后评价疗效为疾病稳定(stable disease,SD)。2021 年4 月15 日、5 月10 日分别行第3、4 周期TP方案化疗,但患者在第4 周期出现严重的恶心、呕吐,下周期遂将顺铂改为奈达铂,治疗结束后评价疗效为PD。考虑患者PD,故后续治疗加入Bev。2021 年6 月7 日、28 日行第5、6 周期TP+Bev 方案化疗[注射用紫杉醇(白蛋白结合型)200 mg,d1,8+注射用奈达铂120 mg,d2+Bev 注射液300 mg,d1,静脉滴注,21 d为1 个周期]。2021 年7 月20 日为行下周期化疗收治入院,入院后患者诉咳嗽、咳痰加重,行胸部CT 检查,与2021 年3 月2 日胸部CT(图2A)对比,疑似存在气管纵隔瘘(图2B)。2021年7月22日,患者于局麻下行支气管镜检查,气管纵隔瘘诊断明确(图3)。临床药师参考相关文献[7-8],结合瘘口形成位置并考虑其与Bev 使用时间的关联性,初步认为可能为Bev 相关气管纵隔瘘,与医师沟通后,建议患者植入气管支架。但患者及家属表示因个人原因放弃支架植入。后续治疗中,临床药师建议停用Bev,继续行TP方案化疗[注射用紫杉醇(白蛋白结合型)200 mg,d1,8+注射用奈達铂120 mg,d2,静脉滴注,21d 为1 个周期]。3 个月后,胸部CT示气管纵隔瘘有所改善(图2C)。
2 患者气管纵隔瘘发生原因分析
气管纵隔瘘是一种罕见病,发病率为0.005%,但病死率较高[9-10]。致病因素中,小部分为发育畸形[11-12],大部分为气管或纵隔淋巴瘤[13-14]、放疗或激光治疗[15-16]、化疗[17-19]、Bev 相关治疗[7-8]、外科手术[20-23]等获得性因素。此外,肿瘤位置是评价肿瘤性瘘形成的重要因素。研究指出,由肿瘤生长侵袭或相关治疗引起肿瘤组织消解所致的瘘口大多发生在肿瘤及其相邻器官间[13-19]。本例患者出现气管纵隔瘘位置与肿瘤生长位置不相符,故临床药师推测气管纵隔瘘应该不是由肿瘤生长侵袭或者肿瘤组织经治疗后消解所致。本例患者使用2 个周期Bev 后出现气管纵隔瘘,提示可能与Bev 的使用存在时间相关性,并且停用Bev 后气管纵隔瘘有所改善,与已有案例报道一致[7-8]。临床药师结合国家不良反应监测中心不良反应关联性评价方法,推测本例患者气管纵隔瘘很可能是由Bev引起的。但上述文献报道的2 例患者均未接受过放疗[7-8],而本例患者瘘口形成位置在放疗辐射区域内,考虑到放疗也是导致气管纵隔瘘形成的高危因素[16],故推测本例患者气管纵隔瘘的形成可能与放疗也有一定的关联。相关学者认为,放疗后Bev 相关气管食管瘘的发生机制可能与放疗和Bev 联合治疗使新生血管受损、伤口愈合受阻有关[24-27]。
3 文献复习
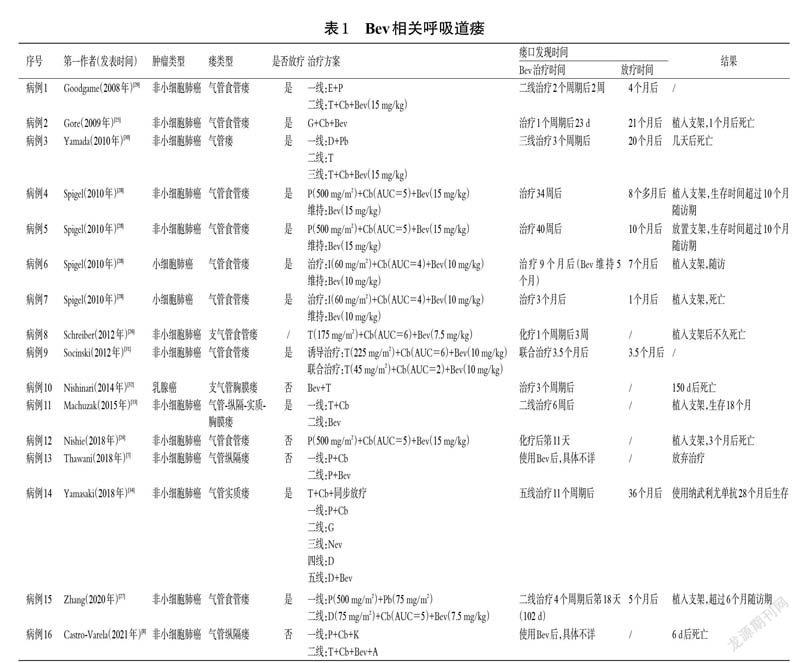
临床药师以“贝伐珠单抗”“瘘”为中文检索词,以“bevacizumab”“fistula”为英文检索词,检索PubMed、Elsevier Science Direct、Springer Link、Wiley OnlineLibrary、中国知网、万方数据等数据库中发表于2021 年9 月前的且题目、标题或关键词包含上述检索词的所有文献,排除不符合呼吸道瘘的案例报道,阅读全文,筛选出Bev相关呼吸道瘘病例,共计16例[7-8,24-34],详见表1。
从表1 可以看出,16 例与Bev 相关的呼吸道瘘患者中,包含气管食管瘘9 例、气管纵隔瘘2 例、气管-纵隔-实质-胸膜瘘1 例、气管瘘1 例、支气管食管瘘1 例、气管实质瘘1 例、支气管胸膜瘘1 例,其中气管食管瘘报道相对较多,可能与Bev 易引起食管炎、食管狭窄、食管糜烂等相关[18,28]。从呼吸道瘘形成时间来看,上述病例都发生在使用Bev 治疗后,但时间长短不一,最短的发生在化疗后第11 天[24],最长的发生在化疗后40 周[28]。Bev 的剂量包括7.5 mg/kg(2 例)、10 mg/kg(3 例)、15 mg/kg(5例)等,以高剂量(15 mg/kg)居多,提示高剂量Bev 可能会增加患者呼吸道瘘的发生风险,但该结论尚需更多大样本的相关研究予以确认。
Nishie 等[24]研究表明,放疗是形成Bev 相关呼吸道瘘的重要因素之一。由表1 也可以看出,有10 例患者进行了放疗,但纳入患者中,呼吸道瘘发生与放疗之间的时间差异较大,最长的发生在放疗后36 个月[34],最短的发生在放疗后1 个月[28]。本例患者在放疗后45 个月、使用Bev 2 个周期后出现气管纵隔瘘,与Bev 的使用存在时间关联性,并且病变位于放射野中,与文献报道的Bev相关呼吸道瘘相符[28],结合放疗是增加瘘形成关键因素之一[35],因此可以推测,气管纵隔瘘是Bev罕见且严重的不良反应,放疗可能是增加瘘形成的因素之一。故临床药师建议该例患者停用Bev 并植入支架,但患者因个人原因放弃支架植入。
由表1 可见,16 例患者中,有5 例患者(病例4~7、11)在只用Bev 单药维持或二线治疗的情况下发生了呼吸道瘘,进一步证实Bev 在呼吸道瘘形成过程中的“关键”作用。另11 例患者采用了Bev 联用化疗药物的方案,这与文献报道的Bev 临床应用主要指导策略(联合化疗药物)相符[36]。但是这11 例患者呼吸道瘘的形成是否和化疗药物与Bev 的相互作用有关尚未见相关研究。临床药师回顾分析了本例患者呼吸道瘘形成时的治疗方案:首先,从代谢途径分析,化疗药物(白蛋白结合型紫杉醇+奈达铂)与Bev 的药动学过程无相互影响——Bev 通过新生儿Fc 受体(neonatal Fc receptor,FcRn)介导途径代谢,不通过肾脏和肝脏代谢[37];白蛋白结合型紫杉醇经细胞色素P450(cytochrome P450,CYP)亚型CYP2C8、CYP3A4 代谢,经尿液和粪便排出[38-40];奈达铂则主要经肾脏代谢。其次,从呼吸道瘘形成原因分析,文献报道的可引发呼吸道瘘的化疗药物主要有白蛋白结合型紫杉醇+卡铂[41-44]、吉西他滨+卡铂[45]、环磷酰胺+阿霉素[18]、5-氟尿嘧啶+卡铂[46]、伊利替康+卡铂[47]、多西他赛+顺铂[48],其原因可能为化疗药物可通过消解肿瘤组织而引起相邻器官之间形成瘘道,瘘口形成位置通常与肿瘤生长位置相符,且这种情况在食管癌、肺鳞癌患者中较多见[35],而Bev 更多的是引起食管炎、食管狭窄、食管糜烂等,最终导致呼吸道瘘。本例患者气管纵隔瘘形成位置与肿瘤位置不符,推测应该不是化疗药物消解肿瘤组织所引起的,加之其形成时间与Bev 的使用时间存在关联性,停用Bev 后气管纵隔瘘有所改善,进一步证实本例患者的气管纵隔瘘是由Bev导致。
肿瘤治疗过程中出现呼吸道瘘是一种严重并发症,患者常发生严重刺激性咳嗽、吞咽呛咳,可伴有较严重的肺部感染,預后较差,在未接受适当治疗的情况下,其诊断后的中位生存期仅为1~6 周[49]。一项针对264 例出现呼吸道瘘的肿瘤患者的研究表明,经诊断并给予适当治疗后,患者的中位生存期只有2.8 个月[35]。目前,临床对该类患者的治疗尚无成熟标准方案,保守治疗[7]、手术[15]、支架植入术[27]、自体脂肪源性干细胞技术[15]、氩等离子电凝技术[16]等方法均有报道,但接受上述干预的患者的生存期也很少能超过1 年。
临床药师对表1 中16 例患者的诊治及预后进行分析,结果显示,9 例患者接受支架治疗,支架植入后生存期长短不等,最长的为18 个月(病例11)[33],最短的为1个月(病例2)[25],推测可能与患者肿瘤进展及瘘口严重程度有关;1 例接受纳武利尤单抗治疗的患者(病例14)生存期超过28 个月[34];未行治疗的3 例患者生存期均较短(病例3、10、16)[8,30,32]。行支架植入术的患者占比相对较高(56.3%),这与文献报道支架植入是相关指南推荐的肿瘤呼吸道瘘治疗方法相符[50]。与手术相比,身体虚弱的肿瘤患者对支架植入的耐受度相对较高,而目前新兴技术(如自体脂肪源性干细胞技术[15]、氩等离子电凝技术[16])还在探索中,应用有限。病例14 提示,免疫检查点抑制剂可能是呼吸道瘘的治疗方法之一,但个案报道的说服力有限,有待进一步研究。本例患者由于个人原因未行支架植入术,但在随访中发现,停用Bev 3 个月后,其气管纵隔瘘有所改善,提示临床在发现瘘口后可及时停用Bev。
4 结语
本例患者的发病和治疗过程提示,在放疗基础上使用Bev 可能是发生气管纵隔瘘的原因,与文献报道相符[27-30,33]。其机制可能与Bev 可抑制新生血管形成、影响伤口愈合有关[27]。这提示对于接受过放疗的患者,在使用Bev 时,临床药师要加强用药监护和用药教育,使患者充分了解相关知识,并建议在出现咳嗽、咳痰、发热等症状时及时就医;临床药师除关注Bev 所致常见不良反应(如高血压、出血、伤口愈合障碍、血栓、胃肠道穿孔、动脉血栓栓塞等)外,还应重视一些罕见但可危及生命的不良反应(如呼吸道瘘等),以保证患者用药安全。但呼吸道瘘的形成与Bev 的给药剂量及给药时间的关系、与放疗时间的关系、与其他药物的相互作用等问题都还需要进一步研究分析。

