PEI改性的硅化磁性纳米吸附剂去除废水中Cu2+性能研究
杨佳佳,王介楷,王凯,张直峰
(山西师范大学 生命科学学院,山西 太原 030031)
高效去除铜离子是含铜废水末端处置的基本环节。近年来,离子交换[1]、化学沉淀[2]、膜处理[3]、吸附法[4]等技术均用于含铜废水的处理,其中,吸附法因处理成本低而被普遍采用[5]。然而,常规吸附剂多存在吸附容量小、回收再利用困难等不足。目前,以纳米Fe3O4为基底的吸附剂因可通过外加磁场快速回收而备受青睐[6]。
本研究基于聚乙烯亚胺(PEI)分子中胺基可有效螯合Cu2+的机理[7-8],通过对纳米Fe3O4硅烷化包覆,并通过丙烯酸甲酯将PEI交联于硅烷化Fe3O4表面,制备了一种复合磁性纳米吸附剂(图1),以期为含铜废水中Cu2+高效去除提供一种新的吸附材料。
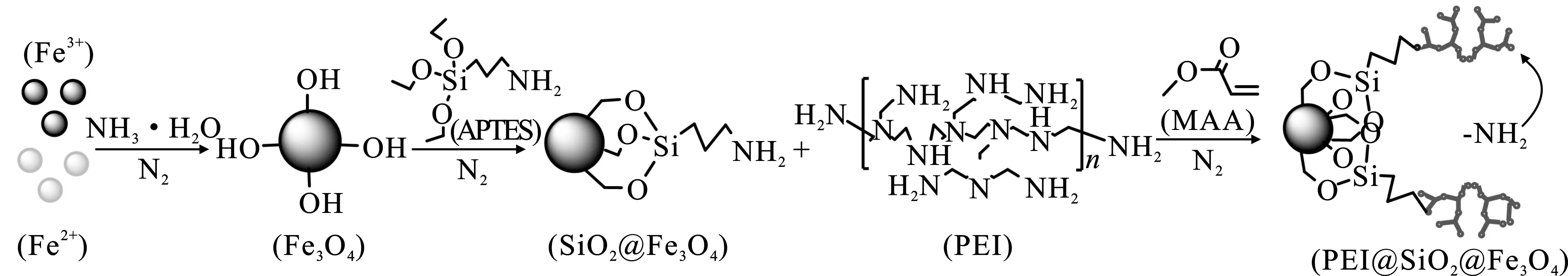
图1 PEI@SiO2@Fe3O4制备路线Fig.1 Preparation process of PEI@SiO2@Fe3O4
1 实验部分
1.1 材料与仪器
聚乙烯亚胺(PEI,分子量1 000)、硫酸亚铁、硫酸铜、三氯化铁、(3-氨基丙基)三乙氧基硅烷(APTES)、丙烯酸甲酯(MA)、二乙基二硫代甲酸钠均为分析纯。
TecnaiG2F20S-TWIN场发射透射电镜;VSM-Versalab振动样品磁强计;Varian 660傅里叶红外分光光度计;UV-759紫外可见光分光光度计。
1.2 PEI修饰的复合磁性纳米吸附剂的制备
磁性纳米Fe3O4采用共沉淀法制备[9];PEI修饰的硅烷化Fe3O4参照文献报道的原理制备[10]。首先将2.0 g Fe3O4超声分散在200 mL无水乙醇中,搅拌30 min后,边搅拌边滴加10 mL APTES于反应溶液中,60 ℃反应7 h,所得产物用乙醇反复清洗并真空干燥,得到预制备的硅烷化Fe3O4纳米颗粒(SiO2@Fe3O4)。将2.0 g SiO2@Fe3O4超声分散在50 mL乙醇中,并加入20 mL MA与0.6 g PEI,反应7 h后,将所得产物用乙醇洗5次,50 ℃真空干燥后备用。
1.3 吸附条件优化
于100 mL离心管中分别加入不同初始浓度的Cu2+溶液50 mL(pH=6.0),并加入50 mg PEI@SiO2@Fe3O4,在室温下振荡(转速140 r/min)反应20 min后,用磁铁将PEI@SiO2@Fe3O4分离,通过二乙基二硫代甲酸钠分光光度法(GB-7474—87)测定溶液中Cu2+浓度,采用公式(1)计算PEI@SiO2@Fe3O4对Cu2+的吸附量(Q,mg/g):
(1)
式中C0、Ce——吸附前后溶液中Cu2+浓度,mg/L;
V——溶液体积,L;
M——PEI@SiO2@Fe3O4的质量,g。
在考察Cu2+初始浓度对PEI@SiO2@Fe3O4吸附Cu2+影响的基础上,按照上述实验程序进一步考察溶液pH值、吸附时间、温度对PEI@SiO2@Fe3O4吸附Cu2+的影响,所有实验均重复3次。
1.4 吸附模型分析
1.4.1 吸附动力学模型 在50 mL初始浓度为 40 mg/L 及80 mg/L Cu2+溶液(pH=6.0,0.1 mol/L HCl调节)加入50 mg PEI@SiO2@Fe3O4,室温下吸附反应40 min后分别采用准一级动力学模型方程(式2)和准二级动力学模型方程(式3)对实验数据进行拟合分析[11],其中:
准一级动力学模型方程:
ln(Qe-Qt)=lnQe-K1t
(2)
式中Qt、Qe——吸附t时间时及达到吸附平衡时Cu2+的吸附量,mg/g;
K1——准一级动力学速率常数,min-1。
通过ln(Qe-Qt)对吸附时间(t)作图从斜率和截距得到K1和Qe值。
准二级动力学模型方程:
(3)
式中 K2——准二级动力学速率常数,g/(mg·min)。
通过t/Qt对吸附时间(t)作图从斜率和截距得到速率常数(K2)和Qe。
1.4.2 吸附等温线模型 将50 mg PEI@SiO2@Fe3O4加入到50 mL 10~120 mg/L梯度浓度的Cu2+溶液(pH=6.0)中,于25 ℃振荡吸附反应 20 min 后,采用Langmuir模型方程(式4)及Freundlich模型方程(式5)对实验数据进行拟合分析[11-12]。
(4)
lnQe=lnKF-bFlnCe
(5)
式中Ce——吸附平衡时Cu2+的浓度,mg/L;
Qe——吸附平衡时的Cu2+吸附量,mg/g;
KL——Langmuir模型吸附常数,L/mg;
Qmax——最大吸附容量,mg/g;
KF和bF——Freundlich模型吸附平衡常数。
1.5 再生性能分析
选择0.05 mol/L的Na2EDTA溶液(pH=4.5,稀硝酸调节)为解析剂[13],并以pH=4.5的酸性水溶液作为对比,将50 mg吸附有Cu2+的PEI@SiO2@Fe3O4(Cu2+计算吸附量为65.17 mg/g)分别置于10 mL Na2EDTA溶液及pH=4.5的酸性水溶液中,充分振荡40 min后,分离PEI@SiO2@Fe3O4,测定溶液中Cu2+浓度,计算解析率;PEI@SiO2@Fe3O4经蒸馏水清洗后,再连续进行3次的吸附-解析实验,考察吸附剂的重复利用性能。
1.6 应用性能分析
参照我国《铜、镍、钴工业污染物排放标准(征求意见稿)》,配制Cu2+浓度为10倍于排放标准限值的模拟废水(Cu2+10 mg/L,Zn2+40 mg/L,Ni+10 mg/L,Cd2+1 mg/L pH=6.0),于500 mL模拟废水中加入100 mg PEI@SiO2@Fe3O4,搅拌反应 30 min 后测定模拟废水中Cu2+浓度,同时以 10 mg/L Cu2+溶液为对比,并依据式(6)计算Cu2+的去除效率(R,%)
(6)
式中C0、Ce——吸附前后模拟废水中Cu2+浓度,mg/L。
2 结果与讨论
2.1 PEI@SiO2@Fe3O4表征结果
通过TEM对PEI@SiO2@Fe3O4形貌分析显示(图2A):单纯的Fe3O4呈球形分布(图2A镶嵌图),经修饰后PEI@SiO2@Fe3O4仍呈近球形分布,但粒径增加,粒径介于10~40 nm之间;红外光谱分析显示(图2B):在588 cm-1处PEI@SiO2@Fe3O4有一个明显的特征吸收峰,对应于Fe3O4的Fe—O的伸缩振动;相比于Fe3O4,经修饰后,2 908 cm-1归属于 —Si—O键伸缩振动,1 630 cm-1及1 541 cm-1处特征峰归属于 —CO—NH— 键及 —NH2的伸缩振动[14],说明SiO2及PEI成功交联于Fe3O4表面。由图2C可知,PEI@SiO2@Fe3O4饱和磁强度约为 33.71 emu/g,满足磁分离的要求。

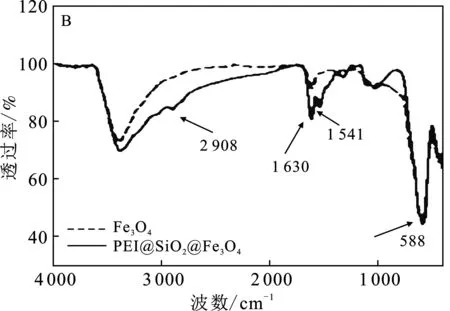

图2 PEI@SiO2@Fe3O4结构表征Fig.2 Structural characterization of PEI@SiO2@Fe3O4 A.PEI@SiO2@Fe3O4TEM形貌,镶嵌图为Fe3O4 TEM形貌;B.PEI@SiO2@Fe3O4红外光谱图;C.PEI@SiO2@Fe3O4磁滞回线
2.2 最佳吸附条件
2.2.1 Cu2+初始浓度 通过考察Cu2+初始浓度对PEI@SiO2@Fe3O4吸附Cu2+效果的影响显示(图3A),随着Cu2+浓度的增加,PEI@SiO2@Fe3O4对Cu2+的吸附量逐渐增加,当Cu2+浓度>80 mg/L时,PEI@SiO2@Fe3O4对Cu2+的吸附量不再明显变化,归因于随着Cu2+浓度增加,PEI@SiO2@Fe3O4表面的吸附位点逐渐被Cu2+所占据,吸附趋于饱和。因此,选择80 mg/L 的Cu2+溶液进行后续实验。
2.2.2 pH值 由图3B可知,随着溶液pH增加,PEI@SiO2@Fe3O4对Cu2+的吸附量随之增加。说明在酸性条件下不利于PEI@SiO2@Fe3O4对Cu2+的吸附。在低pH值条件下,PEI分子中的胺基(—NH2)会通过质子化形成 —NH3+[9],对Cu2+产生静电排斥作用,阻碍了其分子中胺基与Cu2+的络合;此外,溶液中大量的H+会与Cu2+竞争结合PEI@SiO2@Fe3O4表面吸附位点,使吸附容量减少[15]。尽管溶液pH值>7.0时,吸附量会继续增加,但考虑到部分Cu2+在碱性条件会形成Cu(OH)2而使溶液中Cu2+剩余浓度降低[16],为考察PEI@SiO2@Fe3O4对Cu2+真实吸附容量,吸附过程在pH=6.0的条件下更为适宜。
2.2.3 吸附时间 由图3C可知,随着吸附时间的增加,PEI@SiO2@Fe3O4对Cu2+的吸附量随之增加,20 min后吸附量不再明显变化,一方面可能与吸附剂表面吸附活性位点有关,另一方面随着溶液中Cu2+浓度的降低,浓度梯度差推动力越来越小,Cu2+在PEI@SiO2@Fe3O4内部扩散的阻力逐渐增加,吸附过程趋于平衡[17]。因此,在20 min内PEI@SiO2@Fe3O4对Cu2+吸附即可达到吸附平衡。
2.2.4 吸附温度 通过考察温度对PEI@SiO2@Fe3O4吸附Cu2+影响显示(图3D),随温度升高,PEI@SiO2@Fe3O4吸附Cu2+的吸附量呈现出一定的下降趋势,说明该吸附过程是一个自发的过程,在室温下更有利于吸附反应的进行。
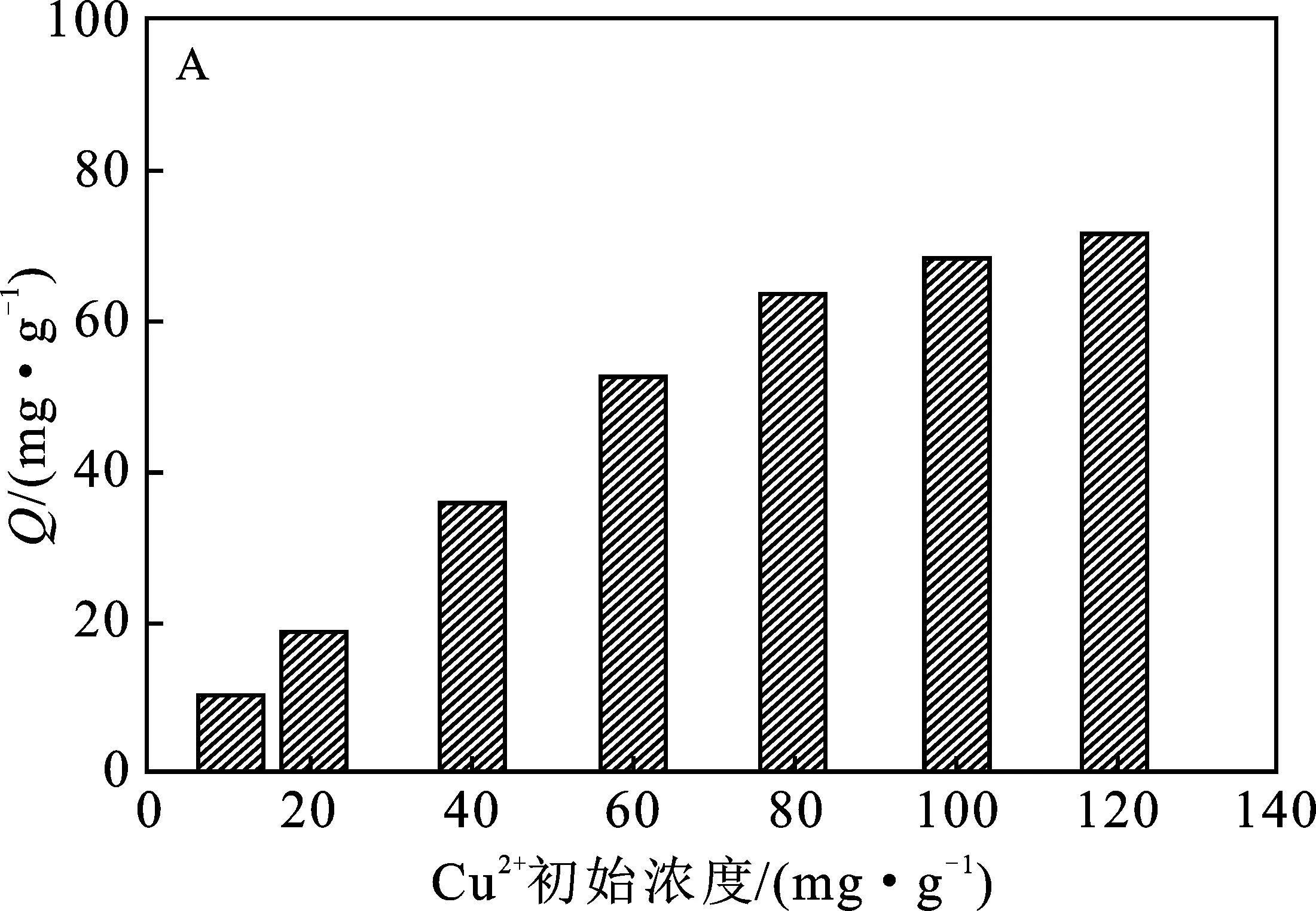
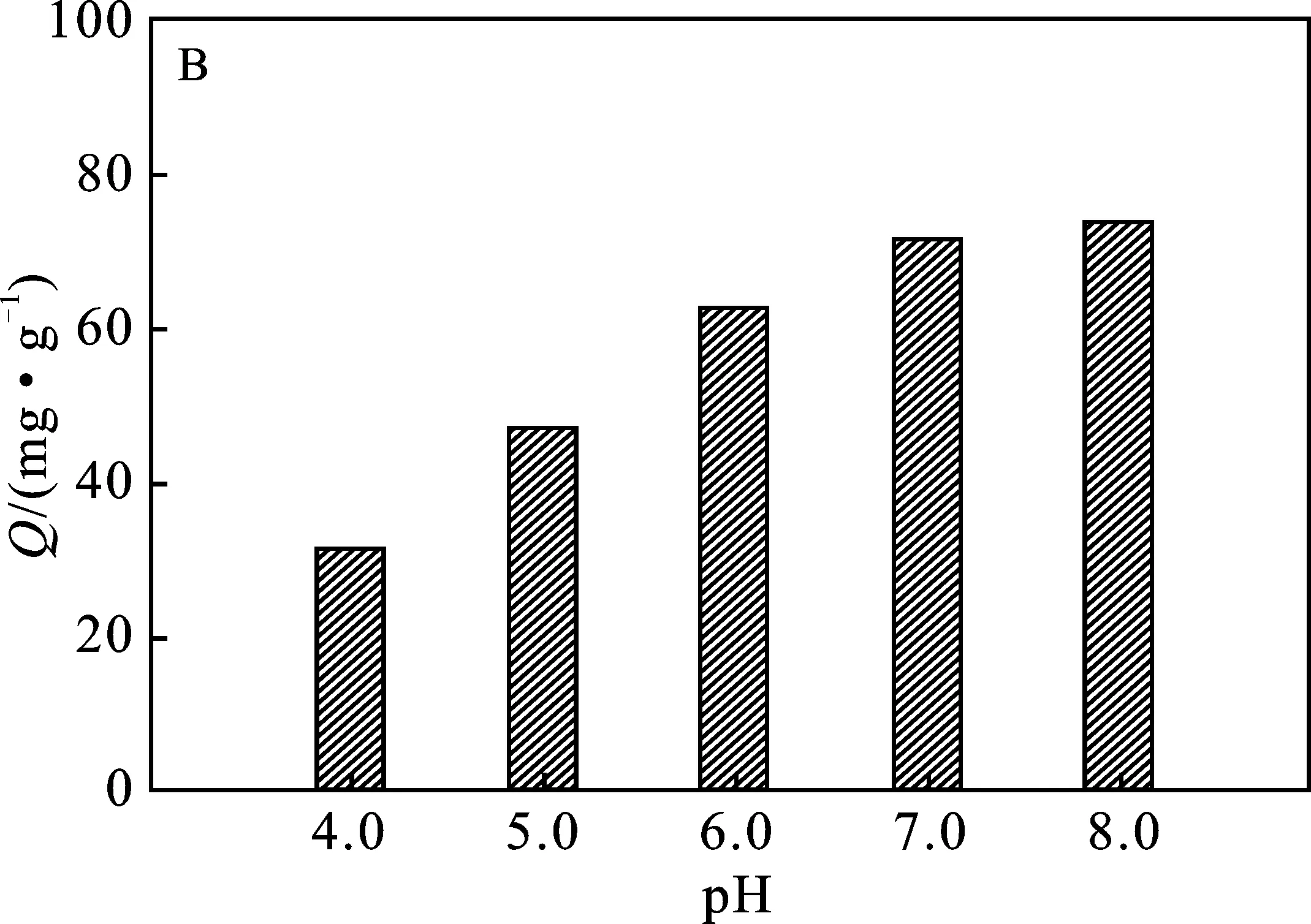
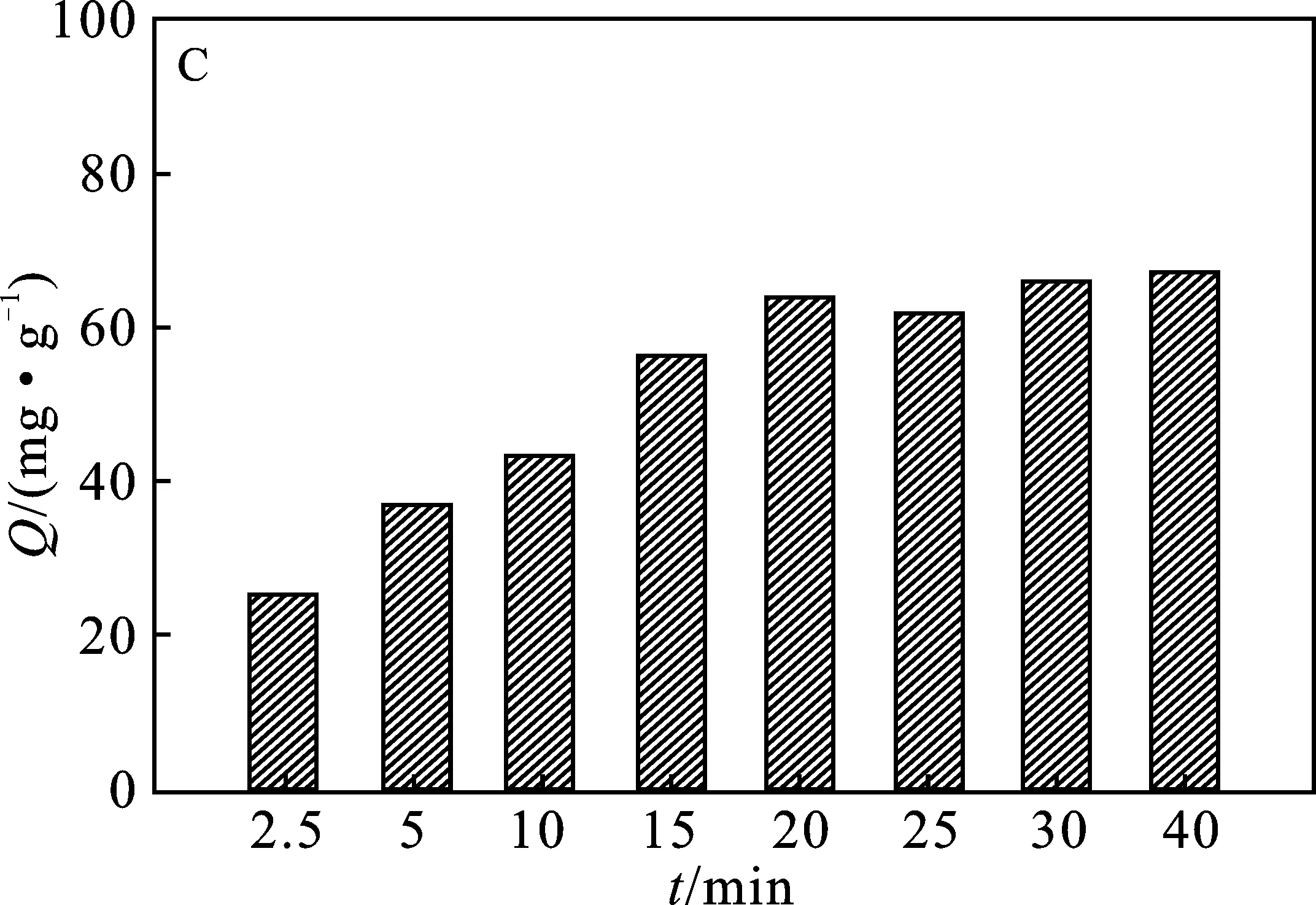
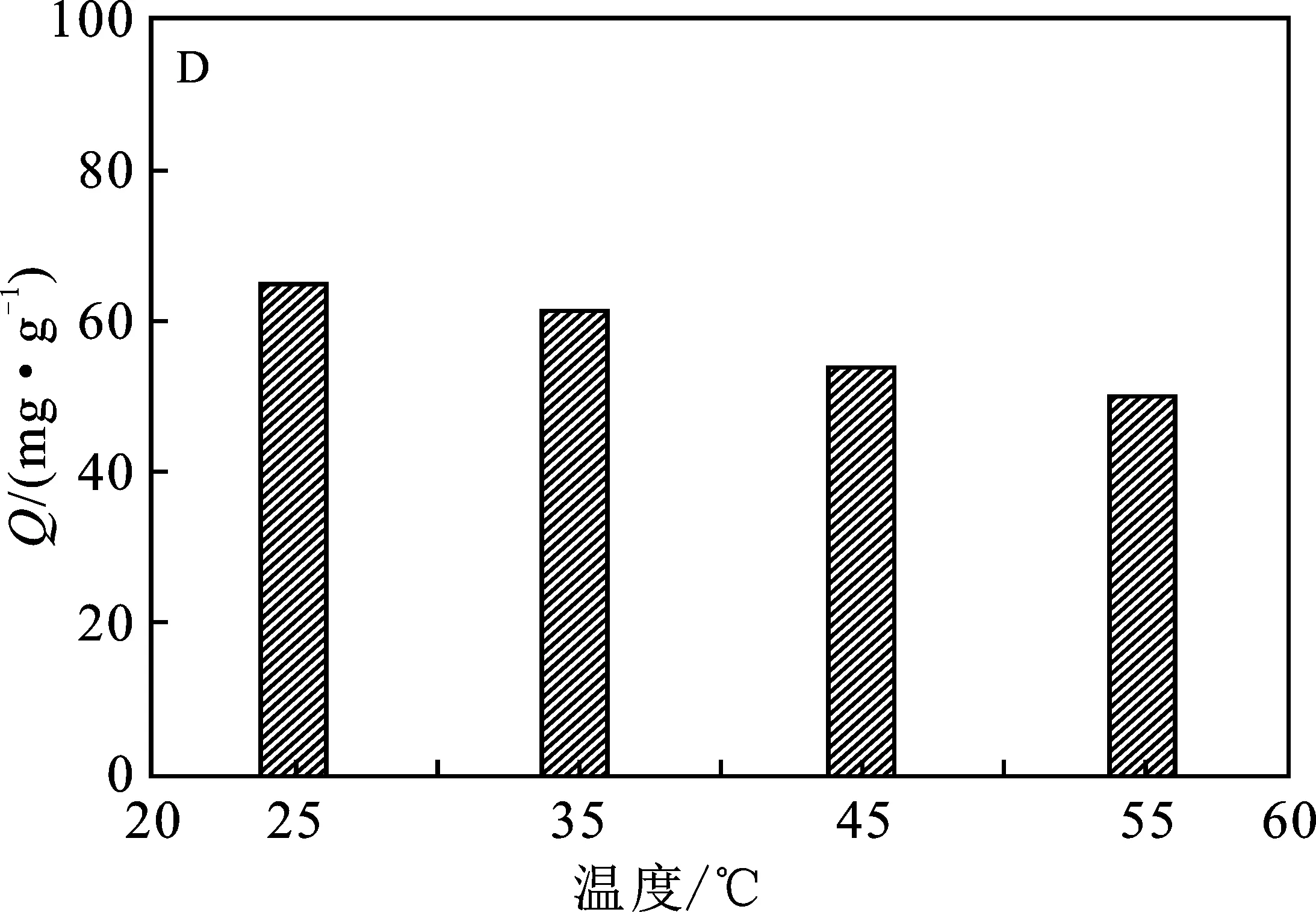
图3 Cu2+初始浓度(A)、溶液pH值(B)、吸附时间(C) 和温度(D)对PEI@SiO2@Fe3O4吸附Cu2+的影响Fig.3 The effects of initial Cu2+ concentration(A),pH value (B),time (C) and temperature (D) on the adsorption of Cu2+ by PEI@SiO2@Fe3O4
2.3 吸附模型
2.3.1 吸附动力学模型 采用准一级吸附动力学和准二级吸附动力学模型对实验数据进行拟合(图4A),所获得的参数分析见表1。
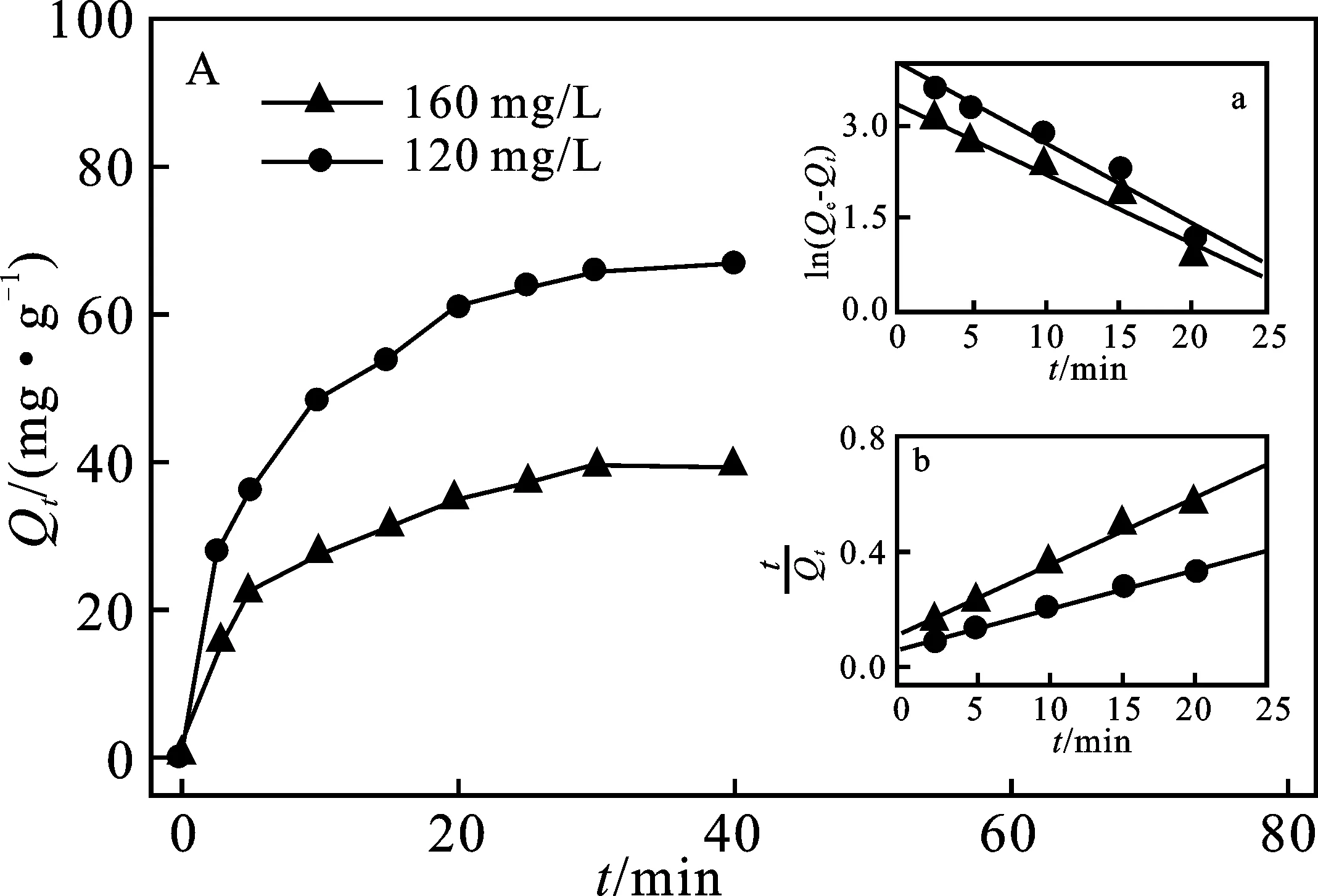

图4 PEI@SiO2@Fe3O4吸附Cu2+ 动力学(A)和等温模型(B)曲线Fig.4 The adsorption kinetics (A) and the adsorption isotherm model of Cu2+ onto PEI@SiO2@Fe3O4 order kinetics model plots(B) A镶嵌图:a.准一级动力学模型;b.准二级动力学模型 B镶嵌图:a.Langmuir模型方程拟合曲线;b.Freundlich模型方程拟合曲线
由表1可知,准二级动力学模型相关系数(R2)明显高于准一级动力学模型,且计算的平衡吸附量(Qcal)与实验实际值Qe更为接近,说明PEI@SiO2@Fe3O4吸附Cu2+更符合准二级动力学模型,PEI@SiO2@Fe3O4对Cu2+的吸附以化学吸附为主[18],同时反映了在初始吸附阶段Cu2+可快速与PEI分子中胺基与酰胺基团螯合而吸附于PEI@SiO2@Fe3O4表面。
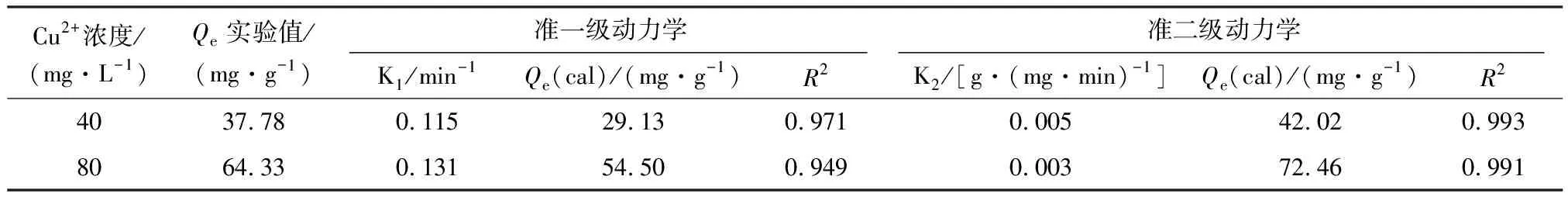
表1 PEI@SiO2@Fe3O4吸附Cu2+的准一级和准二级动力学方程拟合参数Table 1 Kinetic parameters of pseudo-first-order and pseudo-second-order kinetic models for adsorption of Cu2+ by PEI@SiO2@Fe3O4
2.3.2 吸附等温模型 通过PEI@SiO2@Fe3O4对不同浓度的Cu2+进行吸附,吸附量与溶液中剩余Cu2+浓度关系见图4B;采用Langmuir及Freundlich等温线模型方程对吸附数据进行拟合所得图形见 图4B 镶嵌图,相关参数见表2。由图4B及表2可知,与Freundlich等温线模型相比,Langmuir模型方程相关系数更高,因此PEI@SiO2@Fe3O4对Cu2+的吸附遵循Langmuir等温吸附模型。以上结果说明PEI@SiO2@Fe3O4对Cu2+吸附为表面单层吸附,且KL介于0~1之间,吸附过程非常容易进行[18]。基于Langmuir等温方程计算,PEI@SiO2@Fe3O4对Cu2+最大吸附容量为71.94 mg/g。

表2 PEI@SiO2@Fe3O4吸附Cu2+等温吸附模型参数Table 2 The parameters of the adsorption model for the adsorption Cu2+ by PEI@SiO2@Fe3O4
与目前报道的PEI修饰的麦秸 (48.6 mg/g)[4]、PEI修饰的纤维素纳米纤维(52.3 mg/g)[19]、玉米穗状氧化锌(16.1 mg/g)[20]等吸附剂相比,PEI@SiO2@Fe3O4对Cu2+具有较高的吸附容量。尽管PEI@SiO2@Fe3O4对Cu2+吸附容量低于蛭石基纳米水合氧化锆(96.23 mg/g)[21],木质素/壳聚糖复合物(283 mg/g)[22]等吸附剂,但PEI@SiO2@Fe3O4可通过外加磁场从净化废水中快速回收并能再次循环利用。
2.4 解析及重复利用
采用0.05 mol/L Na2EDTA溶液对吸附有Cu2+的PEI@SiO2@Fe3O4进行再生性能分析,得到解析效率为84.47%,而采用pH=4.5的酸性溶液解析效率仅为63.82%,说明0.05 mol/L Na2EDTA溶液可有效用于PEI@SiO2@Fe3O4的再生。经过4次吸附-解析附循环后(图5),PEI@SiO2@Fe3O4对Cu2+的吸附量从65.17 mg/g下降到24.54 mg/g,主要由于多次循环会造成部分吸附剂损失,此外部分未被解析的Cu2+还会占据PEI@SiO2@Fe3O4表面的吸附位点。但由图5可知,3次循环吸附后,PEI@SiO2@Fe3O4对Cu2+的吸附容量仍保持在初始吸附容量的58.98%,说明PEI@SiO2@Fe3O4至少可重复利用3次。

图5 吸附-解析次数对PEI@SiO2@Fe3O4 吸附 Cu2+的影响Fig.5 Effect of adsorption-desorption cycles on adsorption of Cu2+ by PEI@SiO2@Fe3O4
2.5 应用性能分析
通过分析模拟废水表明,PEI@SiO2@Fe3O4对模拟废水中Cu2+的去除效率为76.53%,Cu2+剩余浓度2.347 mg/L。与单纯的Cu2+溶液中去除效率(92.61%)相比,去除效率下降了16.08%,可能由于其它金属离子产生一定的竞争吸附。通过进一步优化PEI@SiO2@Fe3O4用量显示,随PEI@SiO2@Fe3O4用量增加模拟废水中Cu2+去除效率逐渐增加,当PEI@SiO2@Fe3O4用量为280 mg/L时,模拟废水中Cu2+浓度到达排放限值以下,表明PEI@SiO2@Fe3O4具有较好的实际应用性能,但在实际废水处理中,还有待依据废水中Cu2+浓度对PEI@SiO2@Fe3O4用量进一步优化。

图6 PEI@SiO2@Fe3O4用量对模拟废水中Cu2+去除率 及剩余Cu2+浓度(镶嵌图)的影响Fig.6 Effect of PEI@SiO2@Fe3O4 dosage on removal rate and Cu2+ concentration(insert) of Cu2+ in simulated wastewater
3 结论
(1)以分子结构中富含胺基的PEI为表面修饰剂制备了一种磁性纳米吸附剂(PEI@SiO2@Fe3O4),所制备的吸附剂在室温、pH=6.0、吸附 20 min 的条件下可实现Cu2+的有效吸附,对Cu2+的最大吸附量为71.94 mg/g;吸附过程符合准二级动力模型及Langmuir等温吸附模型。
(2)PEI@SiO2@Fe3O4可通过Na2EDTA溶液再生且至少可重复利用3次,通过对模拟含铜废水中Cu2+的吸附去除证实PEI@SiO2@Fe3O4可作为一种新的磁性吸附剂用于工业废水、选矿尾水中Cu2+的净化处置。

