我国隐孢子虫病流行现状与防控进展
王旭,沈玉娟,曹建平
中国疾病预防控制中心寄生虫病预防控制所(国家热带病研究中心),国家卫生健康委员会寄生虫病原与媒介生物学重点实验室,世界卫生组织热带病合作中心,国家级热带病国际联合研究中心,上海 200025
隐孢子虫病(cryptosporidiosis)是由隐孢子虫属(Cryptosporidium spp.)原生生物感染引起的人畜共患寄生虫病。隐孢子虫卵囊进入宿主体内后,通常寄生于人或动物的消化道上皮细胞,可引起腹痛和腹泻等症状,被认为是导致全球腹泻最重要的六种病原体之一[1-3],本文简要介绍了国内外隐孢子虫及隐孢子虫病的发现和研究历程,重点就我国隐孢子虫病的流行现状及防控进展进行综述,以期为今后的隐孢子虫病防控提供参考和依据。
1 隐孢子虫及隐孢子虫病简述
1907 年,Tyzzer 首先在实验小鼠体内发现了隐孢子虫[4],在此后近70年时间里,全球先后报道了关于蛇、家禽、犬、猫、牛、羊等动物体内的隐孢子虫感染现象;1976年Nime等[5]报道了第一例由隐孢子虫感染导致的人类自限性肠炎。随后,在欧洲和北美由隐孢子虫导致的疫情逐渐增多。1993年春,美国密尔沃基暴发了由隐孢子虫卵囊导致的急性腹泻疫情,约有403 000 人因水源污染被感染[6]。Graun等[7]回顾了北美和英国的35起水传播疾病的流行病学特征和病因,提出了预防水传播疾病暴发的建议,自此水质标准的制定和对腹泻患者开展隐孢子虫检测开始备受关注。1999年,英国政府率先出台了相关法规,对出水厂中隐孢子虫卵囊作出了少于1 个/10 L 的要求,旨在降低地下水来源的公共供水受到隐孢子虫污染的风险,并启动了一系列国家级的采样和分析计划[8]。到2003 年,已报告的325 起与水有关的寄生虫病暴发事件中,隐孢子虫相关的报道为165 起,占比50.77%,可见隐孢子虫对公共卫生安全造成的影响巨大[9]。由于儿童肠道发育不成熟并且缺乏黏膜免疫,大多数隐孢子虫病病例为5 岁以下的儿童[10]。隐孢子虫病可导致婴幼儿营养不良和发育迟缓,能够反复感染并引发严重疾病,甚至导致死亡。对于免疫功能正常的个体,这种感染被认为是自限性的,但如果感染者免疫系统功能降低(如AIDS 患者),这种感染则可能是致命的[11]。隐孢子虫病的临床问题促使世界卫生组织(WHO)于2004 年将该病纳入被忽视疾病倡议[12],并被WHO列为六大腹泻病之一[13]。
现有的调查结果显示,隐孢子虫病呈现世界性流行和分布,全球已有90多个国家和地区报道过隐孢子虫感染病例[14]。而根据全球疾病负担(global burden of disease,GBD)研究报道,隐孢子虫感染是导致5 岁以下儿童腹泻致死的3 个最常见病因之一,2015年造成约6.04万儿童死亡[15];2016年,在隐孢子虫感染相关的5.72万死亡病例中,约有4.83万人是5 岁以下儿童[16]。因此,隐孢子虫病越来越被认为是免疫功能低下人群慢性腹泻的主要原因,也是儿童营养不良和过早死亡的重要原因[3]。迄今已有40 多个虫种(基因型)和120 多个基因亚型被发现,其中19 个虫种和4 种基因型可感染人体,而且这一数据随着研究的深入尚在持续增加中[13],给隐孢子虫的诊断不断带来新的挑战。在防控方面,目前依然缺乏标准化的预防方案以及大规模的有效治疗措施[3],美国食品药品监督管理局批准的唯一药物是硝唑尼特(nitazoxanide),但这种药物的使用范围和具体效果仍然非常有限,而在这一领域内的疫苗研发需要继续付出更多的努力[17-18]。
2 我国人群隐孢子虫的感染情况
2.1 隐孢子虫感染的地区分布 我国学者围绕隐孢子虫感染情况开展了大量的调查研究,调查对象涉及成人、儿童、腹泻患者、HIV/AIDS患者、基础疾病患者、吸毒人群、学生等,检测方法涉及病原学、免疫学和分子生物学等。1987年,韩范等[19]首次报道了我国(江苏)的隐孢子虫病例,随后在安徽、重庆、台湾、福建等地也陆续报道了相关的感染病例[20-23]。至20 世纪末,我国已在包括上述地区的23个省份发现了人体隐孢子虫感染。截至2021年,据不完全统计,我国至少有29个省份有人体感染隐孢子虫的报道,涉及地级市(州、旗)107 个,累计报告各类感染人群4 975人。报告数较多的地区主要集中在上海、江苏、安徽、江西、湖北和湖南等长江中下游省份,以及黄河下游的山东省,这些省份累计报告隐孢子虫感染者3 196 例,占全国的64.24%。此外,浙江、福建和广东等东南沿海省份以及云南省的感染者和流行地市也相对较多。见表1。
2.2 普通人群隐孢子虫的感染情况 截至目前,我国只有部分地区开展过较大规模的人群隐孢子虫感染调查。陈有贵等[24]曾于1989—1990 年对江苏省城乡7 个居民点开展了隐孢子虫感染调查,结果显示普通人群隐孢子虫的平均感染率为1.66%(97/6 221),其中15 岁及以下青少年儿童感染率为1.75%(89/5 089),16 岁及以上人群感染率为0.71%(8/1 132);城市人群感染率为1.08%(8/742),农村地区为1.62%(89/5 479)。2001年Wang等[25]对安徽省11个地市的微小隐孢子虫感染调查显示,普通人群总体感染率为1.23%(63/5 107),其中幼儿园儿童感染率3.15%(28/889),小学生感染率为0.82%(9/1 098),中学生为0.82%(9/1 092),大学生为0.83%(8/969),其他成年人群为0.85%(9/1 059),幼儿园儿童感染率高于其他人群。2014—2015 年王庆权[26]对安徽省东、西、南、北4 个县的抽样调查结果显示,人群隐孢子虫感染率为1.39%(22/1 586),10岁以下和50 岁以上人群感染率相对较高。朱名胜等[27]对湖北省十堰市城乡5个调查点开展的调查显示,人群隐孢子虫感染率为4.67%(119/2 549),其中市区人群和村镇人群感染率分别为0.41%(2/483)和5.66%(117/2 066),差异具有统计学意义(χ2=22.792,P<0.01)。1990—1991年卢良安等[28]在湖南省郴州、衡阳、株洲等地开展的整群抽样调查显示,人群隐孢子虫感染率为1.85%(69/3 739)。20世纪90年代,宫玉香等[29]对山东省青岛地区开展的居民感染调查显示,普通人群的隐孢子虫感染率为1.87%(26/1 388)。1997年,戎聚全等[30]对贵州黔南地区开展的人群隐孢子虫感染调查结果显示,居民隐孢子虫感染率为2.11%(41/1 946),其中6 岁以下学龄前儿童感染率较高,为5.97%(19/318)。1991年,在云南省玉溪市人群隐孢子虫感染情况的调查中,1.35%(33/2 450)的人群粪样中检出隐孢子虫卵囊[31]。根据上述调查,我国普通人群隐孢子虫感染率约为1.3%~4.7%,低于全球总体水平[32],农村地区居民普遍高于城市居民,青少年儿童的感染率普遍高于成人,老年人群的感染率也相对较高。
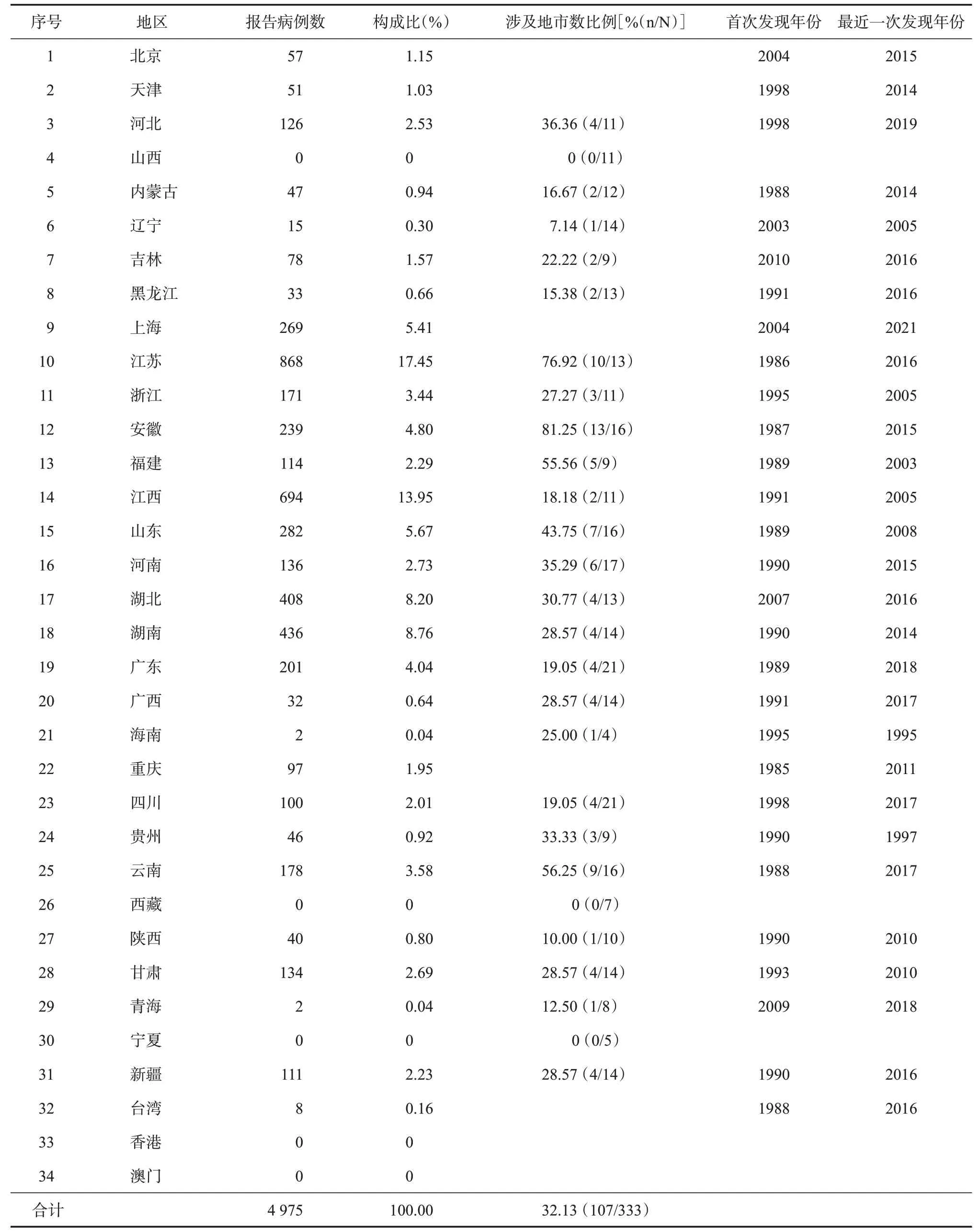
表1 我国人群隐孢子虫感染地区分布情况[20-113]
2.3 腹泻患者隐孢子虫检出情况 通过对我国有关腹泻人群隐孢子虫感染的调查报道进行汇总,据不完全统计(表2),截至2021年底,在42 807名因腹泻就诊的患者中,1 100 人被检出隐孢子虫;其中的
19 349名腹泻儿童,有499人感染隐孢子虫。因流行区域的不同,腹泻患者的隐孢子虫检出率为0.10%~16.52%,一些调查中,浙江、福建、云南和新疆等地的腹泻患者隐孢子虫检出率可高达10%。
2.4 HIV/AIDS 患者隐孢子虫感染情况 隐孢子虫是机会性致病寄生虫,对免疫功能低下的人群威胁较大[90]。2005年、2009—2011年和2012—2015年在北京开展的3 项AIDS 患者的隐孢子虫感染调查中,分别有23.33%(7/30)、5.97%(4/67)和8.80%(11/125)的患者因隐孢子虫感染而腹泻[91-93]。吉林省吉林市和黑龙江省齐齐哈尔市的HIV 感染者中分别有14.28%(13/91)和15.52%(9/58)的患者感染隐孢子虫[94-95]。安徽省阜阳市和宣城市的调查显示,分别有8.28%(21/302)和9.36%(32/342)的HIV/AIDS患者检出隐孢子虫感染[96-97]。河南省驻马店市、湖南省衡阳市、广东省广州市、四川省雅安市和新疆维吾尔自治区乌鲁木齐市、吐鲁番市的HIV/AIDS患者隐孢子虫检出率分别为16.11%(24/149)、13.16%(20/152)、17.33%(78/450)、16.64%(13/79)、10.81%(4/37)和21.57%(14/65)[98-102]。此外,广东省深圳市,广西壮族自治区桂林市、河池市,云南省昆明市以及台湾省的HIV/AIDS患者隐孢子虫检出率相对较低,分别为2.68%(3/112)、3.92%(2/51)、2.33%(6/258)、4.65%(4/86)和1.20%(4/332)[103-106]。钱方兴等[107]对照研究显示,AIDS 腹泻患者的隐孢子虫检出率(16.27%,7/43)明显高于非AIDS腹泻患者(5.33%,12/225)。综上所述,我国HIV/AIDS 腹泻患者的隐孢子虫检出率较高,不同地区的检出率为1.20%~21.57%,高于普通腹泻患者,因此,HIV/AIDS 患者主动进行隐孢子虫检测并积极配合治疗非常重要。
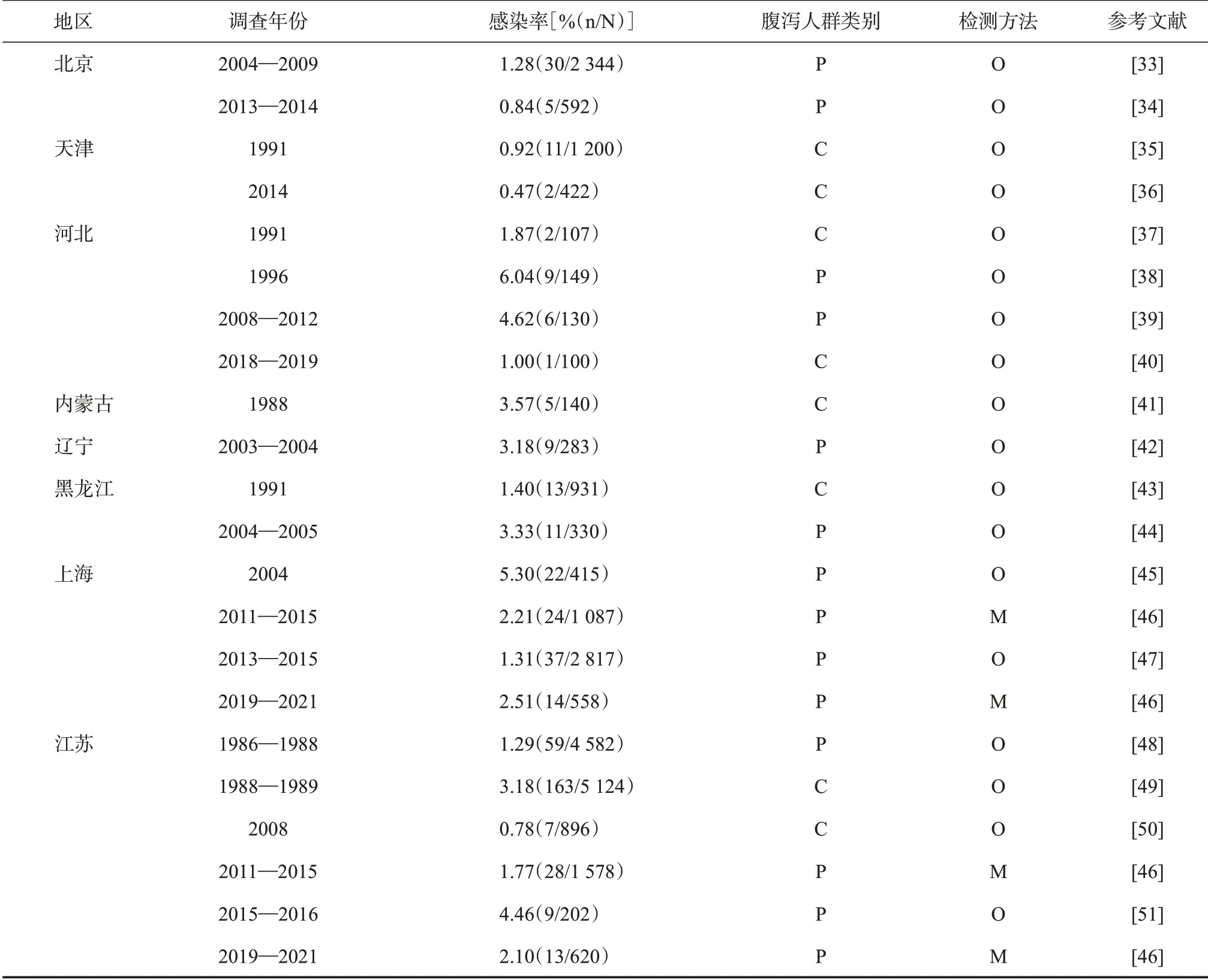
表2 我国各地腹泻人群隐孢子虫感染情况调查
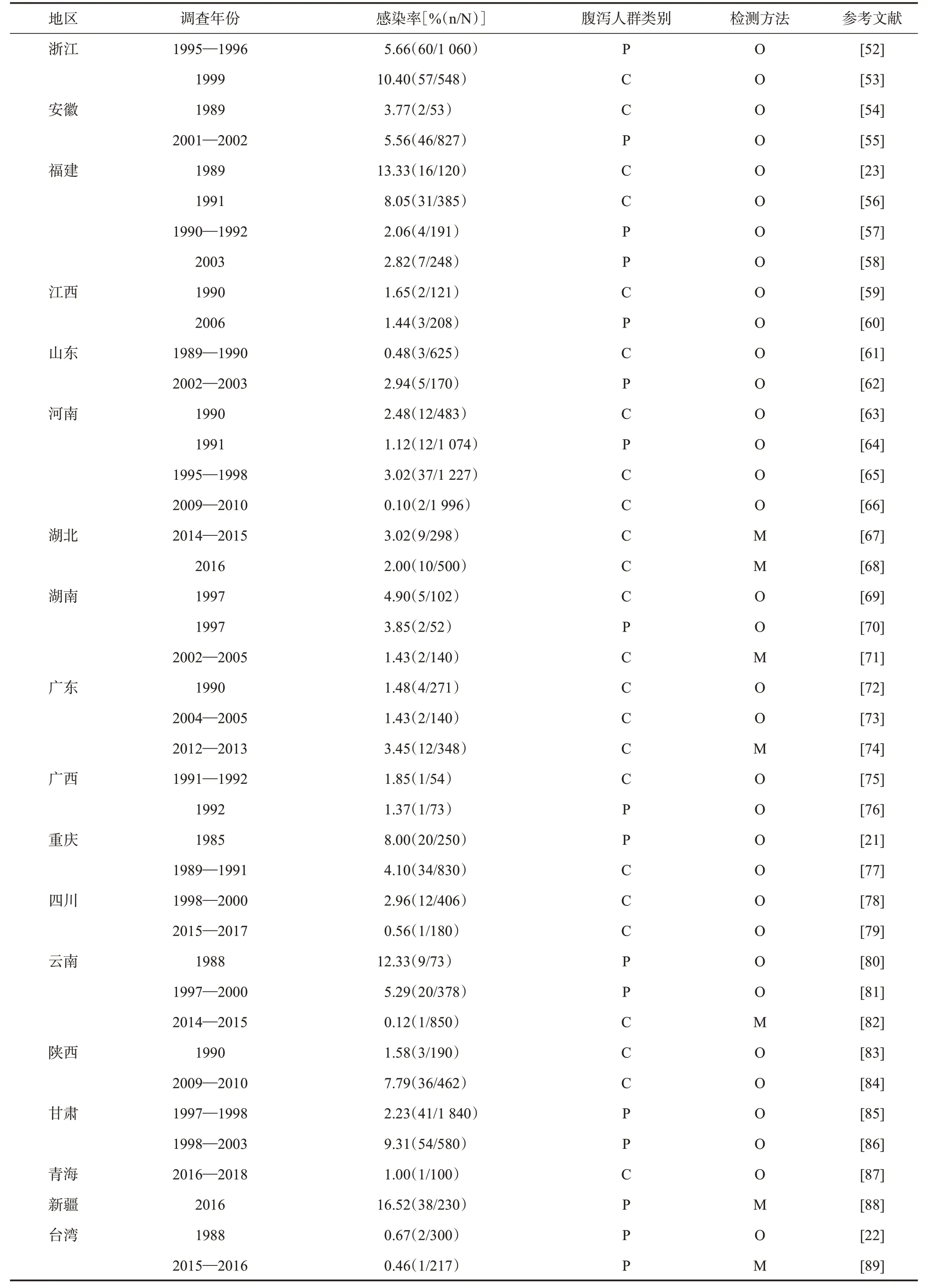
(续表)
2.5 恶性肿瘤患者隐孢子虫感染情况 恶性肿瘤患者在化疗和放疗过程中,可能出现机体免疫力下降,为隐孢子虫的感染提供了机会[108],同时,也有回顾性研究认为隐孢子虫的感染会增加消化道癌症发生的可能,应当引起进一步的关注[109]。目前我国针对恶性肿瘤患者的隐孢子虫感染调查较少。辛玲等[110]对108 名恶性肿瘤患者的粪样进行检查,发现隐孢子虫感染率高达66.67%(72/108)。其中,消化道恶性肿瘤患者的隐孢子虫检出率为77.14%(27/35),明显高于呼吸系统和消化系统的肿瘤患者;不同治疗组中,接受化疗的患者隐孢子虫感染率(80.00%,24/30)明显高于其他治疗组。朱敬等[111]对217 名恶性肿瘤患者的调查中发现,隐孢子虫感染率为48.85%(106/217),与前一项研究相似,消化系统肿瘤患者隐孢子虫感染率最高,为60.78%(62/102);接受放疗和化疗联合治疗的患者感染率为69.86%(51/73),明显高于其他治疗组。上述研究表明,我国的恶性肿瘤患者隐孢子虫感染率处于高位,且明显高于HIV/AIDS患者,提示在恶性肿瘤患者的临床治疗中,应当密切关注机会性肠道原虫的感染,并给予及时的治疗。
2.6 吸毒人群隐孢子虫感染情况 长期吸毒可能导致免疫功能下降,因此吸毒人群也是隐孢子虫感染的重点人群之一[112]。李岩等[42]调查了辽宁省沈阳市人体隐孢子虫感染情况,发现吸毒人群的隐孢子虫感染率(8.57%,6/70)高于普通腹泻患者(3.18%,9/283),差异有统计学意义(χ2=4.01,P<0.05)。黄民主等[112]在湖南省的调查中发现,静脉注射吸毒人员的隐孢子虫感染率高达19.05%(172/903)。申丽洁等[113]在云南省的调查中发现,静脉注射吸毒人群的隐孢子虫感染率达16.80%(84/500),同时发现随着吸毒时间的增加,隐孢子虫感染率也增高,吸毒10年以上者感染率高达22.53%(20/85)。综上,吸毒人群的隐孢子虫感染率高于普通腹泻人群,应当加强对相关人员的检测。
2.7 其他人群的感染情况 急性白血病、干扰素-γ受体缺陷病、器官移植和其他血液相关疾病等也可导致免疫功能严重受损,这类人群也是隐孢子虫的易感人群,但目前我国针对这些人群隐孢子虫感染的调查研究还相对较少。李发武等[73]在广东的调查显示,慢性乙型肝炎患者的隐孢子虫感染率为5.80%(16/276),显著高于普通腹泻患者(1.43%,2/140)和正常人群(0.71%,1/140),提示临床上应对相关患者进行隐孢子虫检查和辅助治疗。Yu 等[71]研究发现慢性乙型肝炎相关的急性肝衰竭患者中,隐孢子虫感染率为5.96%(13/218),明显高于慢性乙型肝炎患者(0.82%,1/122),认为隐孢子虫感染可能是慢性乙型肝炎相关急性肝衰竭患者腹泻的主要原因。综上,提示在临床治疗中,有必要对可能存在免疫功能受损的患者开展隐孢子虫检测。
2.8 我国人群隐孢子虫的分子流行病学 隐孢子虫的分子流行病学数据表明,隐孢子虫对于人类的感染存在物种(基因型)间的差异。自2011 年基因分型和分型工具被用于人类隐孢子虫的鉴定以来[114],我国已报道9种人源性隐孢子虫,包括人隐孢子虫(C.hominis)、微小隐孢子虫(C.parvum)、安氏隐孢子虫(C. andersoni)、火鸡隐孢子虫(C.meleagridis)、猫隐孢子虫(C. felis)、犬隐孢子虫(C. canis)、鼠隐孢子虫(C.suis)、旅行者隐孢子虫(C.viatorum)和潜隐孢子虫(C.occultus)[14,115]。其中,人隐孢子虫和微小隐孢子虫是主要的致病虫种[115]。Xu等[115]报道我国人隐孢子虫主要分布在东部地区,而微小隐孢子虫则主要分布在中南部地区。在基因亚型的研究方面,基于gp60 基因位点的遗传分析,我国先后报道了5 个人隐孢子虫基因亚型家族,包括Ⅰa(ⅠaA14R4、ⅠaA9R3 和ⅠaA18R4)、Ⅰb(ⅠbA16G2、ⅠbA19G2、ⅠbA20G2 和ⅠbA22G2)、Ⅰd(ⅠdA14、ⅠdA19 和ⅠdA21)、Ⅰe(ⅠeA12G3T3 和ⅠeA13G3T3)、Ⅰg(ⅠgA14),以及2 个微小隐孢子虫基因亚型家族(Ⅱa和Ⅱd)。其中一些基因亚型,如ⅠbA16G2、ⅠbA19G2 和ⅠbA20G2,目前仅在我国有相关报道。而其他亚型,如ⅠbA9G3在世界范围内广泛分布,ⅠbA9G2则主要报道于部分发展中国家[14]。
3 我国隐孢子虫的感染风险
隐孢子虫分布广泛,种类繁多,能够适应多种自然环境和动物宿主,传播模式高度复杂,防控难度极大[90]。根据现有研究结果,目前我国人群隐孢子虫感染的主要风险因素包括:不安全水源和食物、接触感染的动物(尤其是家养动物)和季节性的隐孢子虫流行等[14,28,46]。
3.1 水源和食物的隐孢子虫污染情况 隐孢子虫卵囊可污染饮用水、娱乐用水、农业用水,从而导致感染的扩散和传播,因此,水体中隐孢子虫卵囊的检测已成为众多国家和地区的水质标准评估的内容之一[116]。Hofstra 等[117]开发的隐孢子虫地表水排放模型指出,全球每年约向地表水排放3×1017个卵囊,其中我国是排放量最大的国家之一。Cao 等[116]开展的居民饮用水风险评估调查发现,我国江苏省常州市金坛区、湖北省鄂州市、广西壮族自治区宾阳县的隐孢子虫年感染概率分别为6.27 × 10-4~2.05 × 10-3、6.27 × 10-4~1.10 × 10-2和3.79 × 10-4~1.25×10-3,感染风险均超过了美国国家环境保护局(U.S. Environmental Protection Agency, USEPA)提出的1×10-4的阈值;这3个研究区域内,饮用水和娱乐用水造成的隐孢子虫疾病负担为0~1.01×10-5每人每年伤残调整寿命年(disability-adjusted life years per person per year,DALYs pppy),超过了WHO 提出的水传播疾病负担耐受阈值(1×10-6DALYs pppy)。Xiao 等[118]基于我国33 个主要城市66个自来水厂的调查研究显示,水厂源水中隐孢子虫浓度为0~6 个卵囊/10 L,平均值为0.7 个卵囊/10 L,引起的全人群腹泻发病率估算值为0.149%(95%CI:0.001%~0.606%),常规处理后的饮用水中隐孢子虫导致的疾病负担估计为8.31×10-6DALYs pppy。Han等[119]研究显示,隐孢子虫在长江中下游地区和西北地区自来水厂中的分布相对较高。而Xiao 等[120]在浙江省河网水系源水的调查中发现,水体样本隐孢子虫检出率高达78.72%(37/47),平均污染浓度为0.51 个卵囊/L。An 等[121]研究表明,浙江省常规处理后人群饮用水的隐孢子虫病疾病负担为6.51×10-5DALYs pppy。此外,夏云婷等[122]在内蒙古自治区牧区开展的儿童隐孢子虫调查显示,有喝生水习惯的儿童隐孢子虫感染风险是不喝生水儿童的2.231 倍(95% CI:1.011~4.921),表明饮水安全对人群隐孢子虫病的防控具有重要意义,而进一步改善供水系统的病原体管理可以有效降低人类感染隐孢子虫的风险。
另一方面,隐孢子虫也被认为是最重要的食源性寄生虫之一,患者因为摄入被污染的食物而感染[123]。近年来,隐孢子虫病暴发与消费者饮食习惯偏向于新鲜农产品的转变有关,未经过高温消毒处理的新鲜农产品极有可能成为传播隐孢子虫的载体[124]。全球已有多个国家在果蔬等食物中检测到隐孢子虫,总体检出率为6.04%(375/6 210),对公共健康构成了巨大威胁[125]。在河南省开展的一项关于隐孢子虫污染情况的调查中,香菜、芹菜和西瓜等日常食用的蔬菜和水果中检出了微孢子虫、环孢子虫和隐孢子虫,提示当地可能存在食源性原虫感染的风险[126]。此外,在青海省西宁市的一项调查中,玉米、白菜和生菜等样本的隐孢子虫检出率为2.49%(16/642),90%以上的蔬菜来自其他省份,表明运输可能导致隐孢子虫的传播和扩散[127]。因此,需加强对食物的感染性原虫的监测。
3.2 家养动物的隐孢子虫感染情况 隐孢子虫宿主广泛,包括哺乳动物、爬行动物、鸟类、两栖动物和鱼类等在内的260多种动物都可以成为隐孢子虫的潜在宿主,不同种的隐孢子虫能够在其适宜宿主体内引起不同程度的胃肠道疾病[128]。全球最常见的3 种可寄生于人体的隐孢子虫是微小隐孢子虫、人隐孢子虫和火鸡隐孢子虫,其中微小隐孢子虫和人隐孢子虫导致的相关病例占90%以上[129]。研究显示,隐孢子虫正在适应和进化以感染更多不同的宿主,隐孢子虫病已成为主要的人畜共患病之一[130]。Vermeulen等[131]利用模型GloWPa-Crypto L1计算了全球牲畜的隐孢子虫排放负荷,显示每年约有3.2×1023个卵囊从牲畜粪便中排出,其中贡献率最高的是牛,其次是鸡和猪,所造成的环境污染对全球公共卫生造成巨大压力。Wang等[132]回顾性研究显示,牛是隐孢子虫感染最常见的哺乳动物,断奶前的犊牛被认为是隐孢子虫最重要的宿主,在我国24个省份的相关报道中,估算牛隐孢子虫的总体感染率为14.50%(5 265/36 316),腹泻犊牛的隐孢子虫感染率可高达45.78%(141/308),感染率随着动物年龄的增加而下降;内蒙古、青海、山东、湖南和台湾等省份感染率较高;感染虫种包括安氏隐孢子虫、微小隐孢子虫、瑞氏隐孢子虫(C.ryanae)和牛隐孢子虫(C. bovis)等[133]。资料显示,目前我国有16个省份报道过鸡的隐孢子虫感染情况,感染率较高的是河南、山东和浙江等省份[134];而对广东、河南、浙江和湖北等省份家鸡的分子流行病学调查发现,家鸡隐孢子虫感染率分别为13.19%(132/1 001)、10.57%(163/1 542)、9.87%(38/385)和2.43%(5/206);感染虫种(基因型)包括火鸡隐孢子虫、贝氏隐孢子虫(C. baileyi)和禽基因型Ⅱ(avian genotype Ⅱ)等[135-138]。在针对猪的研究中,目前我国有20 个省份报道了猪的隐孢子虫感染现象[134]。根据Wang 等[139]统计,我国猪的隐孢子虫总体感染率为12.2%,并推算全国有4 151 万~6 933 万头猪感染隐孢子虫,其中华北地区感染率相对较高,断奶仔猪的感染率最高,粗放型养殖模式下猪的感染率也明显高于集约型模式;鼠隐孢子虫是猪感染率最高的虫种和基因型。除此之外,犬、猫等家养宠物的隐孢子虫感染情况也被认为是人类感染隐孢子虫的危险因素。一些研究表明,患者的腹泻症状可能和宠物店、收容所等地猫、犬隐孢子虫感染有关,常见的共感染隐孢子虫包括犬隐孢子虫、猫隐孢子虫和微小隐孢子虫,然而由于缺乏系统性的研究,犬、猫等宠物在人类隐孢子虫病流行病学中的作用尚不清楚[140]。此外,随着畜牧业和养殖业的发展,我国人畜共患隐孢子虫病的流行态势可能会逐步加剧,有必要采取合理的公共卫生和生物安全措施来控制其进一步传播[141]。
3.3 隐孢子虫传播的季节性波动 近年来,关于我国隐孢子虫感染季节性变化特征的流行病学研究逐渐增多。根据Liu 等[14]回顾性分析,隐孢子虫的人群感染高峰大多出现在夏季或秋季,但是相关研究结果并不统一,尚缺乏足够的流行病学证据来评估我国整体的隐孢子虫季节性传播规律。这种气候变化引起的波动可能和隐孢子虫的生物适应性相关,温度、湿度和降水量对于卵囊的活性、存活时间和传播动力有着复杂的影响。在潮湿的热带气候中,降水是隐孢子虫病季节性流行的重要驱动因素;而在温带气候中,隐孢子虫病的发病率则可随气温升高而升高[142]。此外,这种季节性波动还可能与不同虫种的生物特异性、保虫宿主的生物节律性、宿主动物的多样性等密切相关。例如,炎热季节水体中的卵囊浓度较高,而人群的频繁活动则加剧了卵囊的释放和扩散,导致当季的隐孢子虫感染风险明显高于其他季节[143];牛微小隐孢子虫感染高峰在夏季,而牛隐孢子虫则在秋季和冬季占主导地位[144];猪的隐孢子虫感染率在春、夏、秋、冬4个季节分别为6.7%、7.2%、9.1%和8.9%,秋冬季感染率相对较高[139];鸡的隐孢子虫感染表现为春季感染率最高(15.6%),夏季(10.1%)和秋季(5.2%)明显下降,而冬季则最低(2.0%)[138]。隐孢子虫的环境适应性、保虫宿主的感染差异和气候变化等相关的传播因素交互影响,导致人群感染出现不一致的季节性波动,甚至同一地区在不同年份的调查中也能产生有差别的结果。此外,苍蝇等昆虫也被证实是人畜共患隐孢子虫病流行的重要媒介,在病原体机械传播中的作用越来越受到关注[145]。总体而言,我国幅员辽阔,地理景观和气候类型复杂多样,兼之生物多样性高,各地风俗习惯多种多样,导致我国的隐孢子虫季节性传播规律不能一概而论,仍需开展更多的探索和研究工作。
4 我国人隐孢子虫病的防控进展
4.1 隐孢子虫病的诊断和治疗 为有效诊断隐孢子虫病,减少误诊和漏诊,2016 年原国家卫生和计划生育委员会发布了《隐孢子虫病的诊断》(WS/T 487—2016),对隐孢子虫病的实验室检测和临床诊断进行了详细的描述[146],该标准适用于全国各级医疗机构和疾病预防控制机构,使我国的隐孢子虫病检测和诊断更加规范,为建设隐孢子虫的病原监测网络奠定了基础。由于大多数免疫系统功能正常的感染者无需任何治疗即可自行恢复,因此针对发热、呕吐、恶心、胃痉挛和脱水等临床症状,可以通过如补充液体电解质、使用止吐药或镇痛药等进行支持治疗。尽管如此,在某些情况下依然需要进行抗虫治疗。目前,硝唑尼特是治疗隐孢子虫感染最有效的药物,也是唯一被美国食品药品监督管理局批准用于治疗人隐孢子虫病的药物。然而,由于该药物的使用范围和具体效果仍非常有限,因此,现阶段在隐孢子虫病的治疗方面仍缺乏可推广的特效药物[90]。
4.2 我国隐孢子虫病的防控和挑战 截至目前,已知的水源性病原微生物超过1 000种,包括病毒、细菌、真菌和原生动物等,可引起人或动物消化和呼吸等系统疾病。2006 年,我国发布了《生活饮用水卫生标准》(GB 5749—2006),其中微生物指标增加了隐孢子虫和贾第鞭毛虫,这对于我国的人群隐孢子虫病防控起到了积极作用[147]。根据Han 等[119]研究显示,我国主要城市的水处理厂中隐孢子虫和贾第鞭毛虫的去除率估算为2.03 lg。然而,由于水体原虫检测成本较高,耗时耗量,富集难度大,无法确定卵囊的活性和感染性等,使得饮用水隐孢子虫监测系统的建立较为困难[148];同时隐孢子虫传播途径多样,卵囊对氯及其他常用饮用水消毒剂具有较强的抵抗力,导致常规水处理方法对于隐孢子虫卵囊的杀灭和去除具有一定局限性;而出于对隐孢子虫耐药性以及消毒剂潜在危害的考虑和担忧,消毒剂的使用范围也受到限制,这些问题导致我国饮用水仍然面临着较高的隐孢子虫污染风险[149]。目前,我国隐孢子虫病防控面临的挑战主要有:①缺乏隐孢子虫病的常规监测系统,无法获得主动监测数据,难以深入了解我国隐孢子虫病的流行态势和规律;②我国水系网络复杂,养殖业总量大,但鉴于监测能力有限,隐孢子虫病暴发的潜在风险较大;③隐孢子虫呈全球性分布,随着全球贸易的加速和快递、运输业的发展,旅行者腹泻和病原输入的风险增加;④我国幅员辽阔,景观气候、生物群落、人文习俗等因素多样,影响隐孢子虫流行和传播的因素复杂,防控难度大;⑤专业技术人员匮乏,隐孢子虫诊断鉴别技术储备不足等。这些现实问题增加了我国隐孢子虫病的防控和应急处置的难度[150]。
4.3 隐孢子虫病的防控对策
4.3.1 建立和完善监测网络 根据“One Health”理念,建立一套覆盖“人群-动物-环境”的实时监测网络,对于易感人群以及高风险区域内的家畜、家禽、饮用水、果蔬食品等进行隐孢子虫动态监测,掌握其流行情况和传播风险,加强多部门合作,加强国内外信息交流与共享,共同推动传染病防控与高质量发展相结合[13]。
4.3.2 落实和优化防控举措 隐孢子虫的传染源是感染人群和保虫宿主,主要通过粪-口途径接触传播,一些昆虫媒介(如蟑螂和苍蝇等)因携带卵囊污染食物和水体也可传播。易感人群主要有儿童、老年人、免疫系统功能受损人群、吸毒人群、涉水作业人群等。因此,在防控措施中,有腹泻症状的患者应尽量避免在公共游泳池或公共水域中游泳,以防止传染给他人,相关区域的涉水人员应该认识到潜在的感染风险。通过限制农场或畜群中动物密度,将幼畜或感染风险高的宿主与成年动物分开,减少隐孢子虫在动物群体中的传播。另外,加强生活用水、农业用水以及污水中隐孢子虫的去除或杀灭,降低人和动物感染的概率[90]。
4.3.3 加强新技术、新产品研发 基于监测网络的基线数据,构建隐孢子虫病预测预警模型,建立风险评估体系和方案,增强疾病的智能化和精准化防控能力,提升公共卫生应急处置能力[150]。此外,积极开发卵囊高效富集技术,并利用高通量测序技术,降低隐孢子虫检测的成本和难度,提升检测灵敏度,尽快应用于隐孢子虫污染的现场检测,提升监测预警水平。着力开发针对隐孢子虫的特效药物和辅助治疗药物,提高对隐孢子虫病患者的救治水平。优化水体隐孢子虫检测方法,开发新型检测技术,降低水源监测的成本,提升检测效率[151]。水体中隐孢子虫的净化处理可联合使用多种方法,例如氯、二氧化氯、臭氧等化学消毒剂和紫外线、超声等物理灭活方法的协同作用,达到更高的隐孢子虫去除效率[152]。
4.3.4 积极开展健康教育 由于隐孢子虫的卵囊壁对温度较为敏感,经过64.2 ℃以上处理2 min,或者72.4 ℃以上处理1 min 即可灭活,避免饮用生水可以有效地减少感染隐孢子虫的风险[153]。因此,对隐孢子虫感染重点地区的居民进行隐孢子虫健康教育,提升个人防护意识,促使人群养成良好的卫生习惯,降低接触污染水体和物品的概率,减少生活和生产中病原体的随意排放,是预防隐孢子虫感染的最佳策略。
5 展 望
目前,隐孢子虫检测或隐孢子虫病诊断的目标人群多为出现相关临床症状的患者,如到医疗机构就诊的腹泻患者,仅有少数研究针对全人群。未来需要对临床患者、普通人群、风险人群、动物和环境样本(水源)进行全面动态的公共卫生监测,从而更好地评估隐孢子虫病的暴发风险和公共卫生安全隐患。大多数免疫功能正常的隐孢子虫感染者表现为无症状或轻度腹泻,但免疫功能低下人群如HIV/AIDS 患者和恶性肿瘤患者等,会出现明显的临床症状,因此要重视对该类人群隐孢子虫病的监测,并及时给予相应的治疗。对于隐孢子虫病的防控,阻断传播的最佳策略是保持良好的个人卫生习惯,同时减少、控制或消除其他动物的致病风险因素。随着“One Health”理念在我国的逐步推广,应探索建立覆盖“寄生虫-人类-保虫宿主-环境”的全方位、立体化的防控模式,逐步建立完善监测体系,通过跨部门合作,提升防控水平。同时,应积极开展跨学科合作,在药物、疫苗、检测技术研发等方面加大科学研究力度,全力推进我国隐孢子虫病的预防控制工作。

