高CO2浓度下西花蓟马和花蓟马对虫螨腈和唑虫酰胺的响应比较
樊宗芳, 陈亚平, 樊 锐, 和淑琪, 桂富荣
(云南农业大学植物保护学院, 云南省生物资源保护与利用国家重点实验室, 昆明 650201)
全球气候变化是当今人类所面临最迫切的环境问题之一,而大气中二氧化碳(CO2)浓度的不断升高是引起全球气候变化的一个主要原因(陈瑜和马春森, 2010)。当前大气CO2浓度已从工业革命前的280 μL/L上升至415 μL/L(https:∥www.esrl.noaa.gov/gmd/ccgg/trends/global.html),预计到21世纪末大气中CO2浓度将达到800 μL/L(IPCC, 2014)。西花蓟马Frankliniellaoccidentalis是入侵我国并造成严重危害的害虫(Reitzetal., 2020),在多个国家的许多作物上造成危害(Reitzetal., 2011)。花蓟马Frankliniellaintona为西花蓟马的本地近缘种,同为杂食性昆虫,主要危害棉花、水稻和蔬菜等,在田间常与西花蓟马混合发生,是云南省的主要蓟马种类(蒋兴川等, 2013; Limetal., 2013)。至今大多数国家对蓟马的防治仍然以化学防治为主,但是大量不合理地使用杀虫剂加速了其抗药性发展,目前已对大部分杀虫剂(有机磷、氨基甲酸酯、拟除虫菊酯类杀虫剂和多杀菌素等)产生了不同程度的抗性(Moudenetal., 2017)。据报道,新型取代芳基吡咯类杀虫剂虫螨腈和新型吡唑杂环类杀虫剂唑虫酰胺对蓟马有较好的防治效果(Misra and Sahu, 2018; Gaoetal., 2020)。研究高CO2浓度下杀虫剂对西花蓟马和花蓟马保护酶[超氧化物歧化酶(superoxide dismutase, SOD)、过氧化物酶(peroxidase, POD)和过氧化氢酶(catalase, CAT)]、解毒酶[羧酸酯酶(carboxylesterase, CarE)、谷胱甘肽S-转移酶(glutathioneS-transferase, GST)和细胞色素P450 (cytochrome P450 enzyme system, CYP450)]和乙酰胆碱酯酶(acetylcholine esterase, AChE)活性的影响,从生化水平阐明将来大气CO2浓度不断升高的环境条件下,虫螨腈和唑虫酰胺对两种蓟马的毒理作用,可为生产上合理使用杀虫剂提供理论依据,并对进一步研究蓟马对虫螨腈和唑虫酰胺的抗性管理具有一定的指导意义,以便及时做出害虫管理策略的调整,对维护西南生态安全提供保障。
昆虫对周围环境的变化极其敏感,外界环境变化时,昆虫体内酶系会被各种外源或内源化合物诱导,使昆虫迅速找到最适的生存对策(刘建业等, 2017)。SOD, POD和CAT是昆虫体内主要的保护酶,主要参与广泛的应激反应(Felton and Summers, 1995; Yang and Lee, 2015)。CarE, GST和AChE是昆虫体内的主要解毒代谢酶,大量文献表明,昆虫体内解毒酶解毒能力增强是其对杀虫剂产生代谢抗性的主要原因之一(陈澄宇等, 2016)。研究发现高CO2浓度显著升高了西花蓟马和黄胸蓟马Thripshawaiiensis成虫体内的CarE, AChE和GST活性,同时,高CO2有利于西花蓟马种群发展,而不利于黄胸蓟马种群发展(Caoetal., 2021)。据Bezemer等(1998)和Osbrink等(1987)报道,高CO2浓度分别增加了桃蚜Myzuspersicae的种群数量以及粉纹夜蛾Trichoplusiani对植物的消耗量。此外,高CO2浓度增强了烟粉虱Bemisiatabaci体内POD和GST活性,但降低了SOD和CAT活性(李宁等, 2016)。二斑叶螨Tetranychusurticae虫螨腈抗性品种(抗性倍数为154倍)体内单加氧酶(monooxygenase, MO)和酯酶(esterase, EST)活性增强(Leeuwenetal., 2005)。家蝇Muscadomestica经虫螨腈汏选10代后,其体内MO活性增强(Silivanovaetal., 2020)。张文成等(2009)报道虫螨腈亚致死剂量处理甜菜夜蛾Spodopteraexigua4龄幼虫48 h后,其体内仅CYP450活性显著升高,其他酶(SOD, POD, CAT, CarE和GST)活性均没有显著变化。唑虫酰胺亚致死浓度对小菜蛾Plutellaxylostella体内的EST, GST和MFO均有明显的抑制作用(陈洁琼等, 2014)。据Wimer(2013)报道,经唑虫酰胺处理后的马铃薯甲虫Leptinotarsadecemlineata体内GST活性显著增强。
目前关于虫螨腈和唑虫酰胺对昆虫的亚致死效应研究主要集中在正常大气CO2浓度下鳞翅目昆虫上,很少涉及高CO2浓度下对缨翅目昆虫的研究,尤其是对入侵物种和本地物种的亚致死效应的差异比较。本研究通过比较高CO2条件下用LC25浓度虫螨腈和唑虫酰胺处理入侵种西花蓟马和本地近缘种花蓟马成虫后,其体内保护酶、解毒酶以及乙酰胆碱酯酶活性的变化差异,以期预测未来大气CO2浓度不断升高的环境下,西花蓟马和花蓟马对虫螨腈和唑虫酰胺的代谢抗性发展,并为进一步研究两个物种的抗药性管理奠定基础。
1 材料与方法
1.1 人工气候箱设置
人工气候箱(上海三腾仪器 LTC-1000)温度为25℃±1℃,相对湿度为 65%±5%,光周期为 16L∶8D。实验设置两个CO2浓度:400 μL/L(正常CO2浓度,接近于当前大气CO2浓度)和800 μL/L(高CO2浓度,预计21世纪末大气中CO2浓度)。人工气候箱24 h通气,每30 min自动记录并调整CO2浓度值。
1.2 供试植株及虫源
供试四季豆Phaseolusvulgaris品种为绿洲,在云南农业大学温室进行种植(25°80′N, 102°45′E),期间每2天浇一次水,采摘成熟的四季豆荚,清洗后用于蓟马种群的饲养。实验期间不施用任何化肥及农药。
西花蓟马和花蓟马种群均采自云南省昆明市呈贡区斗南花卉苗圃培育基地(24°54′N, 102°46′E),在室内进行种类鉴定后,分别用四季豆荚饲养于上述不同CO2浓度的人工气候箱内,试验用虫在室内继代饲养30代以上,期间未接触任何杀虫剂。
1.3 供试试剂
虫螨腈(98%)和唑虫酰胺(96%)分别购于山东潍坊双星农药有限公司和青岛海利尔药业有限公司。保护酶活性测定试剂盒购于南京建成生物工程公司,CYP450 ELISA检测试剂盒购于上海优选生物科技有限公司,其余均为国产分析纯。
1.4 杀虫剂母液配制
准确称取5 mg虫螨腈和3.3333 g唑虫酰胺原药,分别加入1 mL的丙酮和15 mL N,N-二甲基甲酰胺(DMF)完全溶解后,作为母液备用。
1.5 杀虫剂对西花蓟马和花蓟马的生物活性测定
用0.1% 吐温-80将母液稀释成5个浓度梯度。虫螨腈: 0.175, 0.35, 0.7, 0.14和2.8 mg/L(西花蓟马, 400和 800 μL/L);0.2, 0.4, 0.6, 0.8和1.0 mg/L(花蓟马, 400 和800 μL/L);唑虫酰胺:100, 200, 400, 800和1 600 mg/L(西花蓟马, 400 μL/L);200, 400, 800, 1600和3 200 mg/L(西花蓟马, 800 μL/L);200, 400, 600, 800和1 000 mg/L(花蓟马, 400 μL/L);100, 200, 300, 400和500 mg/L(花蓟马, 800 μL/L)。采用浸渍法对西花蓟马和花蓟马种群进行毒力测定,每个浓度设置3个重复,以0.1%吐温-80为对照。将培养皿(d=60 mm)和豆荚(长约50 mm)分别在药液中浸泡2 h和15 s,取出后自然晾干;每个皿中放入一根豆荚(皿和豆荚浓度对应),并接入50头羽化后2 d的蓟马成虫,用带孔保鲜膜封口后放入上述条件的人工培养箱中饲养,48 h后观察并记录蓟马存活情况(用毛笔轻触虫体无反应则视为死亡),计算西花蓟马和花蓟马的LC25和LC50值。以上处理均在两个CO2浓度(400和800 μL/L)下进行。
1.6 蓟马成虫酶液的提取
为了统一处理蓟马的杀虫剂浓度,选取两个CO2浓度下杀虫剂对西花蓟马和花蓟马的亚致死浓度(LC25)中间值。用LC25浓度的杀虫剂处理两个CO2浓度下羽化2 d的蓟马成虫48 h后,挑取存活的蓟马,每20头装入一个2 mL离心管中(Biosharp, Beijing Labgic Technology Co., Ltd.),以0.1% 吐温-80为对照,每个处理3个重复,液氮处理后于-80℃保存待用。
酶液制备参照刘建业等(2014)和Cao等(2021)的方法。取20头待测蓟马,加入1 800 μL生理盐水(0.4%),将其在冰浴中匀浆(Tissuelyser-48, 上海净信科技), 4℃ 2 500 r/min 离心10 min后取上清作为保护酶[超氧化物歧化酶(SOD)、过氧化物酶(POD)和过氧化氢酶(CAT)]待测酶液。取20头待测蓟马,加入1 200 μL磷酸缓冲液(PBS, 0.1 mol/L, pH 7.6),将其在冰浴上匀浆, 4℃ 10 000 r/min离心15 min后取上清作为羧酸酯酶(CarE)、谷光甘肽S-转移酸(GST)和乙酰胆碱酯酶(AChE)待测酶液。取20头待测蓟马,加入1 200 μL 0.86%生理盐水,将其在冰浴上匀浆,3 000 r/min 离心10 min后取上清作为细胞色素P450(CYP450)待测酶液。
1.7 蓟马成虫体内酶活性的测定
参考Bradford(1976)方法测定蛋白质浓度,先用牛血清白蛋白作蛋白标准曲线。将200 μL待测酶溶液与2.0 mL 0.01%考马斯亮蓝G-250染色液(Solarbio, 北京)震荡混匀,静置10 min后,用紫外-可见分光光度计(UV-1 800, MAPADA, 上海)在波长595 nm处测其OD值。
保护酶和CYP450活性分别严格按照试剂盒说明书以及ELISA检测试剂盒说明书进行测定并计算。CarE活性测定参照张凯伦等(2020)方法,并做适当改良。在10 mL PBS(0.2 mol/L, pH 6.0)中加入20 mg固蓝RR盐和0.2 mL α-乙酸萘酯(100 mmol/L),震荡混匀,过滤得到底物和显色剂混合液。在酶标板中加入20 μL酶溶液和200 μL底物和显色剂混合液,用酶标仪在波长450 nm下记录吸光度值,每30 s记录一次,连续监测5 min。GST活性测定参照Cao等(2021)方法,在酶标板中加入20 μL酶液,100 μL 1-氯-2,4-二硝基苯(CDNB, 2 mmol/L)和100 μL还原型谷胱甘肽(GSH, 12.5 mmol/L),用酶标仪在波长340 nm下记录吸光度值,每30 s记录一次,连续监测5 min。AChE活性测定参照高希武(1987)方法,将100 μL碘化乙酰硫代胆碱(5×10-4mol/L), 0.9 mL PBS(0.1 mol/L, pH 7.5)和10 μL酶液加入离心管中摇匀,37℃水浴20 min后,加入1 mL 5,5′-二硫代双(2-硝基苯甲酸)(DTNB)-磷酸乙醇显色剂[2.4 mg DTNB中加入120 mL乙醇(96%)和80 mL蒸馏水,用0.1 mol pH 7.6 的PBS定容至250 mL],静置10 min,用分光光度计在波长412 nm处测定吸光度值。CarE, GST以及AChE活性均按产物生成量计算。
1.8 数据分析
采用SPSS 20.0软件计算杀虫剂对蓟马的亚致死浓度(LC25)和致死中浓度(LC50)以及毒力回归方程;使用独立样本T检验(independent-samplesT-test)比较两个物种之间和两个CO2浓度之间的差异显著性(P<0.05);单因素方差分析(one-way ANOVA, LSD)比较3个不同处理之间的差异显著性(P<0.05);采用三因素方差分析(three-way ANOVA)对CO2浓度、蓟马种类以及杀虫剂处理3个主效因子及其交互作用对保护酶、解毒酶和乙酰胆碱酯酶活性的影响进行分析。
2 结果
2.1 不同CO2浓度下虫螨腈和唑虫酰胺对西花蓟马和花蓟马成虫的毒力
800 μL/L CO2下虫螨腈和唑虫酰胺处理48 h对西花蓟马和花蓟马成虫的毒力较400 μL/L CO2下增强(表1)。800 μL/L CO2下,虫螨腈对西花蓟马和花蓟马成虫的致死中浓度(LC50)分别为1.33和0.37 mg/L,分别是400 μL/L CO2下的0.68和0.66倍;亚致死浓度(LC25)分别为0.60和0.24 mg/L,分别是400 μL/L CO2下的 0.61和0.83倍。唑虫酰胺对西花蓟马和花蓟马成虫的LC50值分别为1 002.64和247.66 mg/L,分别是400 μL/L CO2下的0.98和0.78倍;LC25值分别为368.77和146.10 mg/L,分别是400 μL/L CO2下的2.44和1.21倍。
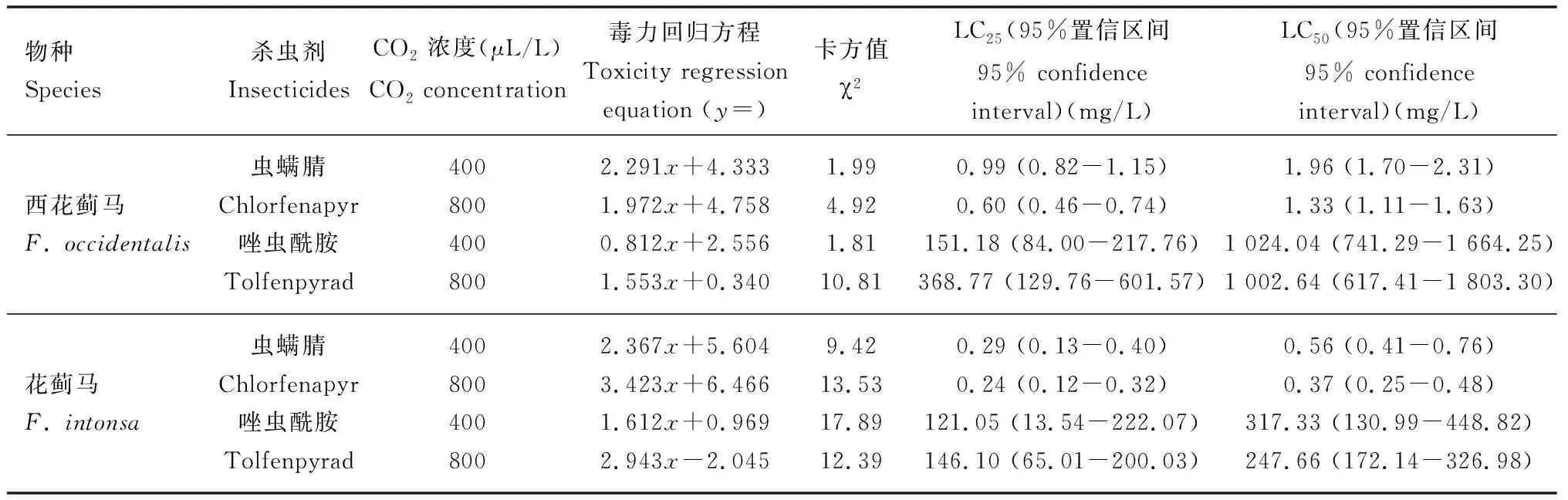
表1 不同CO2浓度下虫螨腈和唑虫酰胺处理48 h对西花蓟马和花蓟马成虫的毒力Table 1 Toxicities of chlorfenapyr and tolfenpyrad to Frankliniella occidentalis and F. intonsa adultsunder different CO2 concentrations at 48 h after treatment
2.2 高CO2浓度下虫螨腈和唑虫酰胺对西花蓟马和花蓟马成虫体内保护酶活性的影响
800 μL/L CO2下,虫螨腈和唑虫酰胺均增强了两种蓟马成虫体内的保护酶活性(表2)。CO2浓度、蓟马种类以及杀虫剂处理3个主效因子对保护酶活性均有极显著影响(SOD:FCO2浓度=35.036,F蓟马种类=336.910,F杀虫剂处理=315.808,P<0.001; POD:FCO2浓度=109.780,F蓟马种类=138.828,F杀虫剂处理=64.374,P<0.001; CAT:FCO2浓度=50.238,F蓟马种类=4 356.153,F杀虫剂处理=289.781,P<0.001);3个主效因子之间两两交互作用对SOD和POD活性有显著影响(P<0.05)(表2)。

表2 不同浓度CO2下LC25浓度虫螨腈和唑虫酰胺对西花蓟马和花蓟马成虫保护酶活性影响的三因素方差分析Table 2 Three-way analyses of variance for the effects of LC25 of chlorfenapyr and tolfenpyrad on protectiveenzyme activities in adults of Frankliniella occidentalis and F. intonsa under different CO2 concentrations
800 μL/L CO2下,经LC25浓度虫螨腈和唑虫酰胺处理48 h后西花蓟马和花蓟马成虫体内SOD活性较对照均升高(表3),且西花蓟马SOD活性显著高于花蓟马SOD活性(虫螨腈:t=-11.161,P<0.05; 唑虫酰胺:t=-13.257,P<0.05),与400 μL/L CO2下经LC25浓度的这两种杀虫剂处理后的西花蓟马和花蓟马体内SOD活性变化一致。其中,800 μL/L CO2下,经LC25浓度唑虫酰胺处理48 h后西花蓟马和花蓟马成虫体内SOD活性均达最高,分别为39.74±1.59和14.19±1.09 U/mg pro,显著高于虫螨腈处理组和对照(P<0.05)。800 μL/L CO2下西花蓟马成虫经LC25浓度的这两种杀虫剂处理48 h后,其体内SOD活性均显著高于400 μL/L CO2下LC25浓度的这两种杀虫剂处理48 h后其体内的SOD活性(唑虫酰胺:t=-5.260,P<0.05; 虫螨腈:t=-4.353,P<0.05),而花蓟马成虫经LC25浓度虫螨腈处理48 h后,其体内SOD活性略低于400 μL/L CO2下LC25浓度虫螨腈处理48 h后的SOD活性(t=1.550,P>0.05)。

表3 不同 CO2浓度下LC25浓度虫螨腈和唑虫酰胺处理48 h时西花蓟马和花蓟马成虫体内的SOD活性(U/mg pro)Table 3 SOD activities (U/mg pro) in adults of Frankliniella occidentalis and F. intonsa exposed to LC25of chlorfenapyr and tolfenpyrad for 48 h under different CO2 concentrations
800 μL/L CO2下,经LC25浓度虫螨腈和唑虫酰胺处理48 h后西花蓟马和花蓟马成虫体内POD活性均显著升高(P<0.05, 表4),且西花蓟马POD活性均显著高于花蓟马POD活性(虫螨腈:t=-3.503,P<0.05; 唑虫酰胺:t=-3.650,P<0.05)。其中,800 μL/L CO2下,花蓟马成虫经LC25浓度的这两种杀虫剂处理48 h后,其体内POD活性均显著高于400 μL/L CO2下LC25浓度的这两种杀虫剂处理48 h后的POD活性(唑虫酰胺:t=-3.258,P<0.05; 虫螨腈:t=-14.276,P<0.05);而西花蓟马成虫经LC25浓度唑虫酰胺处理48 h后,其体内POD活性与400 μL/L CO2下LC25浓度唑虫酰胺处理48 h后的POD活性之间未出现著差异(t=-1.385,P>0.05)。

表4 不同CO2浓度下LC25浓度虫螨腈和唑虫酰胺处理48 h时西花蓟马和花蓟马成虫体内的POD活性(U/mg pro)Table 4 POD activities (U/mg pro) in adults of Frankliniella occidentalis and F. intonsa exposed to LC25of chlorfenapyr and tolfenpyrad for 48 h under different CO2 concentrations
800 μL/L CO2下,经LC25浓度虫螨腈和唑虫酰胺处理48 h后的西花蓟马和花蓟马成虫体内CAT活性均显著升高(P<0.05)(表5),且西花蓟马CAT活性始终显著高于花蓟马CAT活性(虫螨腈:t=-31.737,P<0.05; 唑虫酰胺:t=-24.620,P<0.05),其中,西花蓟马经唑虫酰胺处理后其体内CAT活性达最高(37.93±1.31 U/mg pro),且显著高于虫螨腈处理组(P<0.05),是虫螨腈处理组的1.59倍,而花蓟马体内CAT活性在两种杀虫剂处理之间未出现显著差异(P>0.05),与400 μL/L CO2下经LC25浓度的这两种杀虫剂处理后西花蓟马和花蓟马成虫体内CAT活性变化一致。800 μL/L CO2下,西花蓟马成虫经LC25浓度的这两种杀虫剂处理48 h后,其体内CAT活性显著高于400 μL/L CO2下LC25浓度的这两种杀虫剂处理后的CAT活性(虫螨腈:t=-4.494,P<0.05; 唑虫酰胺:t=-2.993,P<0.05),而花蓟马成虫经LC25浓度虫螨腈处理后,其体内CAT活性与400 μL/L CO2下LC25浓度虫螨腈处理后的CAT活性之间未出现显著差异(t=-2.495,P>0.05)。

表5 不同 CO2浓度下LC25浓度虫螨腈和唑虫酰胺处理48 h时西花蓟马和花蓟马成虫体内的CAT活性(U/mg pro)Table 5 CAT activities (U/mg pro) in adults of Frankliniella occidentalis and F. intonsa exposed to LC25 of chlorfenapyrand tolfenpyrad for 48 h under different CO2 concentrations
2.3 CO2浓度下虫螨腈和唑虫酰胺对西花蓟马和花蓟马成虫体内解毒酶和乙酰胆碱酯酶活性的影响
800 μL/L CO2下,LC25浓度虫螨腈和唑虫酰胺对两种蓟马成虫体内的解毒酶和乙酰胆碱酯酶活性的影响存在一定差异。CO2浓度、蓟马种类以及杀虫剂处理3个主效因子对CarE, GST以及AChE活性均有显著影响(CarE:FCO2浓度=36.037,F蓟马种类=21.758,F杀虫剂处理=5.855,P<0.01; GST:FCO2浓度=30.433,F蓟马种类=20.573,F杀虫剂处理=25.270,P<0.001; AChE:FCO2浓度=92.906,F蓟马种类=380.417,F杀虫剂处理=103.553,P<0.001),而对于CYP450而言,仅杀虫剂处理对其活性有显著影响(F杀虫剂处理=5.483,P<0.05);3个主效因子之间的交互作用(两两相交和三因素相交)对AChE活性有显著影响(P<0.05)(表6)。

表6 不同 CO2浓度下LC25浓度虫螨腈和唑虫酰胺对西花蓟马和花蓟马成虫体内解毒酶和乙酰胆碱酯酶活性影响的三因素方差分析Table 6 Three-way analyses of variance for the effects of LC25 of chlorfenapyr and tolfenpyradon the activities of detoxifying enzymes and AChE in adults of Frankliniella occidentalisand F. intonsa under different CO2 concentrations
800 μL/L CO2下LC25浓度虫螨腈和唑虫酰胺对西花蓟马和花蓟马成虫体内CarE活性影响存在一定差异(图1)。其中,经虫螨腈和唑虫酰胺处理后,西花蓟马体内CarE活性均显著降低(P<0.05),而花蓟马体内CarE活性升高,与400 μL/L CO2下经LC25浓度的这两种杀虫剂处理48 h后西花蓟马和花蓟马成虫体内CarE活性变化趋势一致。800 μL/L CO2下,花蓟马成虫经LC25浓度唑虫酰胺处理48 h后,其体内CarE活性达最高(35.36±0.55 μmol/min·mg pro),显著高于虫螨腈处理组和对照(P<0.05),分别是其的1.25和1.29倍,而虫螨腈处理组和对照之间没有显著性差异(P>0.05)。
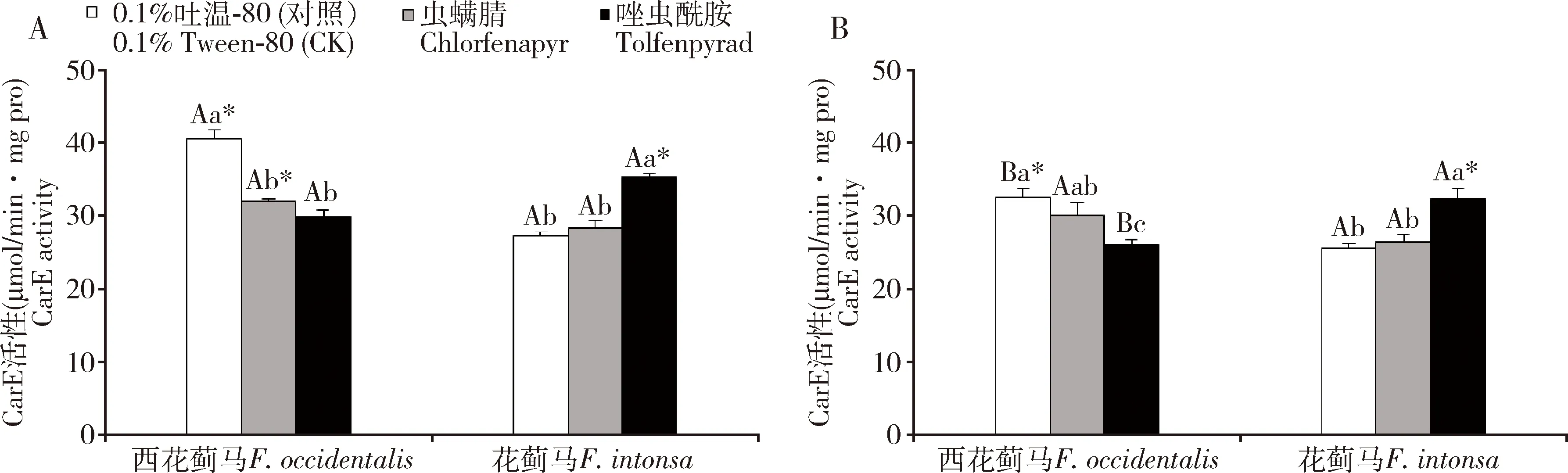
图1 不同CO2浓度下LC25浓度虫螨腈和唑虫酰胺处理48 h时西花蓟马和花蓟马成虫体内的CarE活性Fig. 1 CarE activities in adults of Frankliniella occidentalis and F. intonsa exposed to LC25 of chlorfenapyrand tolfenpyrad for 48 h under different CO2 concentrationsA: 800 μL/L CO2; B: 400 μL/L CO2. 表中数据为平均值±标准误;柱上不同小写字母表示同一CO2浓度同一物种不同处理之间差异显著(P<0.05, LSD);不同大写字母表示同一物种同一处理不同CO2浓度之间差异显著(P<0.05, 独立样本T检验);星号表示同一CO2浓度同一处理两物种之间差异显著(P<0.05, 独立样本T检验)。Data in the table are means±SE. Different lowercase letters above bars represent significant difference among treatments of the same species under the same CO2 concentration (P<0.05, LSD). Different uppercase letters represent significant differences between different CO2 concentrations within the same treatment of the same species (P<0.05, independent samples T-test). Asterisks represent significant differences between the two species in the same treatment under the same CO2 concentration (P<0.05, independent samples T-test). 下图同。The same for the following figures.
400和800 μL/L CO2下,经LC25浓度虫螨腈和唑虫酰胺处理48 h后,西花蓟马和花蓟马成虫体内GST活性较对照均升高(图2: A, B)。其中,800 μL/L CO2下虫螨腈处理48 h后西花蓟马和花蓟马成虫体内的GST活性均达最高,分别为3.36±0.12和2.57±0.08 μmol/min·mg pro,显著高于对照和唑虫酰胺处理组(P<0.05)(图2: A)。800 μL/L CO2下经LC25浓度虫螨腈和唑虫酰胺处理48 h后,西花蓟马成虫体内GST活性显著高于花蓟马GST活性 (虫螨腈:t=5.368,P<0.05; 唑虫酰胺:t=7.723,P<0.05)和400 μL/L CO2下LC25浓度的这两种杀虫剂处理48 h后西花蓟马成虫体内GST活性(虫螨腈:t=6.306,P<0.05; 唑虫酰胺:t=4.092,P<0.05);而400 μL/L CO2下,经LC25浓度虫螨腈和唑虫酰胺处理48 h后,西花蓟马和花蓟马成虫体内的GST活性无显著差异(P>0.05)。

图2 不同CO2浓度下LC25浓度虫螨腈和唑虫酰胺处理48 h时西花蓟马和花蓟马成虫体内的GST活性Fig. 2 GST activities in adults of Frankliniella occidentalis and F. intonsa exposed to LC25 of chlorfenapyrand tolfenpyrad for 48 h under different CO2 concentrationsA: 800 μL/L CO2; B: 400 μL/L CO2.
800 μL/L CO2下,LC25浓度虫螨腈和唑虫酰胺处理48 h对西花蓟马和花蓟马成虫体内CYP450活性没有显著影响(P>0.05)(图3: A);400 μL/L CO2下,LC25浓度虫螨腈和唑虫酰胺处理48 h对西花蓟马成虫体内CYP450活性也没有显著影响(P>0.05),但LC25浓度虫螨腈处理48 h后,花蓟马成虫体内CYP450活性较对照显著升高(P<0.05)(图3: B)。同时,800 μL/L CO2下,LC25浓度虫螨腈和唑虫酰胺处理48 h后这两种蓟马CYP450活性之间也无显著差异(P>0.05),这与400 μL/L CO2下两种蓟马之间CYP450活性差异一致。
800 μL/L CO2下,LC25浓度虫螨腈和唑虫酰胺处理48 h后,西花蓟马和花蓟马成虫体内AChE活性均显著升高(P<0.05)(图4),且西花蓟马成虫体内的AChE活性显著高于花蓟马成虫的(虫螨腈:t=2.922,P<0.05; 唑虫酰胺:t=2.835,P<0.05),与400 μL/L CO2下经LC25浓度的这两种杀虫剂处理后西花蓟马和花蓟马成虫体内AChE活性变化一致。其中,800 μL/L CO2下,西花蓟马和花蓟马成虫经LC25浓度唑虫酰胺处理48 h后,其体内AChE活性最高,分别为45.19±0.53和41.16±1.32 μmol/min·mg pro,显著高于虫螨腈处理组和400 μL/L CO2下LC25浓度唑虫酰胺处理48 h后两种蓟马成虫体内的AChE活性(P<0.05)。

图3 不同CO2浓度下LC25浓度虫螨腈和唑虫酰胺处理48 h时西花蓟马和花蓟马成虫体内CYP450活性Fig. 3 CYP450 activities in adults of Frankliniella occidentalis and F. intonsa exposed to LC25 of chlorfenapyrand tolfenpyrad for 48 h under different CO2 concentrationsA: 800 μL/L CO2; B: 400 μL/L CO2.
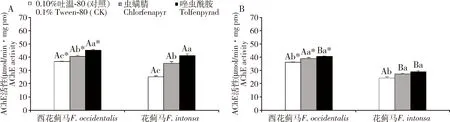
图4 不同CO2浓度下LC25浓度虫螨腈和唑虫酰胺处理48 h时西花蓟马和花蓟马成虫体内的AChE活性Fig. 4 AChE activities in adults of Frankliniella occidentalis and F. intonsa exposed to LC25 of chlorfenapyrand tolfenpyrad for 48 h under different CO2 concentrationsA: 800 μL/L CO2; B: 400 μL/L CO2.
3 讨论
目前全球气候变化已成为国内外最受关注的环境问题之一。以大气CO2浓度升高为特征的气候变化可对植食性昆虫产生直接或间接影响(Heetal., 2017; Qianetal., 2018, 2021; Caoetal., 2021)。本试验主要研究了大气CO2浓度升高对西花蓟马和花蓟马的直接影响,结果表明高CO2浓度可增强杀虫剂的杀虫活性。先前研究表明在CO2气调中加入适当的化学药剂可以加速虫体的死亡(吴仕源等, 1997),与本研究结果相似。原因可能是高CO2浓度通过呼吸作用直接影响昆虫的生理生化代谢过程(Colinet and Renault, 2012)。虫螨腈和唑虫酰胺对本地种花蓟马的毒力大于对入侵种西花蓟马的毒力。张晓明等(2018)研究表明,6种常用杀虫剂对花蓟马2龄若虫和成虫(雌、雄)的毒力均大于对西花蓟马各虫态的毒力,与本研究结果相似。该结果符合入侵物种与本地物种相互竞争时的内在优势假说(万方浩, 2011)。
昆虫在逆境胁迫时,体内活性氧增加,对许多生物功能分子有破坏作用,因此昆虫体内普遍存在着一个清除自由基的保护体系,如SOD, POD和CAT等保护酶系统;已有研究表明昆虫体内保护酶活性水平与抗药性有一定相关性(李周直等, 1994)。本研究中仅800 μL/L CO2处理西花蓟马和花蓟马时,两种蓟马体内SOD活性略降低, POD和CAT活性均升高(表3-5),与刘建业等(2014)研究结果类似。其中西花蓟马体内CAT活性显著增强,而花蓟马体内则是POD活性显著升高,说明西花蓟马主要通过升高体内CAT活性来清除体内H2O2,以应对高CO2浓度胁迫,而花蓟马主要通过升高体内POD活性来清除体内H2O2,表明不同物种在响应高CO2浓度胁迫时其生理响应机理不同。仅杀虫剂处理两种蓟马时,其体内保护酶活性均升高,这与Zhou等(2019)研究白背飞虱Sogatellafurcifera经杀虫剂处理后其体内保护酶活性变化结果一致,该结果进一步证明了保护酶活性与虫体的抗药性有关。其中虫螨腈处理后,两种蓟马体内仅CAT活性显著升高,而经唑虫酰胺处理后两种蓟马体内3种保护酶活性均显著升高,进一步解释了唑虫酰胺对两种蓟马的毒力小于对虫螨腈的毒力,这与毒力测定结果一致。高CO2浓度和杀虫剂对西花蓟马和花蓟马双重胁迫时,两种蓟马体内保护酶活性均高于仅用杀虫剂处理后两种蓟马体内的保护酶活性(表3-5)。说明高CO2浓度对杀虫剂胁迫下的两种蓟马体内保护酶活性有加性效应。西花蓟马体内保护酶活性始终显著高于花蓟马体内保护酶活性,说明在逆境胁迫下,西花蓟马应激反应及适应性均强于本地种花蓟马。
昆虫CarE, GST, CYP450和AChE对维持昆虫体内正常的生理生化代谢具有重要意义(孟琳钦等, 2019),主要参与杀虫剂的代谢抗性。本研究中仅800 μL/L CO2处理西花蓟马和花蓟马时,两种蓟马体内CarE, GST和AChE活性均升高(图1, 2和4),该结果与Cao等(2021)研究西花蓟马和黄胸蓟马在高CO2浓度下其体内解毒酶活性变化一致;经高CO2浓度或杀虫剂单一因素处理或两者交互作用均对蓟马体内CYP450活性没有显著影响(表6; 图3),我们推测CYP450可能没有参与西花蓟马和花蓟马对高CO2浓度和杀虫剂(虫螨腈、唑虫酰胺)胁迫的响应。仅用杀虫剂处理蓟马时,两种蓟马体内GST和AChE活性均升高(图2和4),Nazar等(2020)用虫螨腈汏选扶桑绵粉蚧Phenacoccussolenopsis抗性品系时,随着处理代数的增加其体内GST和AChE活性逐步升高,该现象与本研究结果类似。而经两种杀虫剂处理后,西花蓟马体内CarE活性表现为抑制,而花蓟马体内CarE活性则增强(图1),表明西花蓟马对虫螨腈和唑虫酰胺产生抗药性可能与CarE活性被抑制有关,其具体机制有待下一步研究。西花蓟马和花蓟马在高CO2浓度和杀虫剂双重胁迫时,两种蓟马体内解毒酶活性均高于仅用杀虫剂处理后两种蓟马体内的解毒酶活性(图1-4),但是毒力测定结果表明高CO2浓度下,两种蓟马对杀虫剂更敏感,原因可能是蓟马在受到双重胁迫时,需要更多的解毒酶去代谢大量毒素,而解毒酶的合成需要消耗能量(Riveroetal., 2011),根据能量权衡假说,减少了其他生物功能(如生长发育等)可用能量,或通过更多的取食来补充能量,从而摄入更多的杀虫剂,加速蓟马的死亡。西花蓟马体内解毒酶活性普遍高于花蓟马体内解毒酶活性,说明在应对不良环境时,西花蓟马对外源或内源毒素的代谢能力强于本地种花蓟马。本研究仅测定了CO2浓度倍增条件下西花蓟马和花蓟马对两种杀虫剂的直接生理响应,但其具体分子机制有待进一步研究。

