高效产壳聚糖酶海洋菌株Mitsuaria sp.SH-50 的筛选、鉴定及产酶条件优化
卢波斯,崔丹丹,李志明,袁丽君,沈宏
(华南农业大学 资源环境学院,广州 510642)
壳聚糖由D-氨基葡萄糖通过β-1,4-糖苷键连接而成,是自然界中唯一存在的碱性多糖,其独特的结构特征使其具有特殊的生理功能[1]。低聚壳聚糖则是由壳聚糖分解成聚合度在2~20之间的低聚产品[2]。目前,工业化制备低聚壳聚糖的工艺主要分为化学法、物理法和生物酶解法。化学法一般采用酸解法或氧化降解法,但酸解过程需要在高温高压的环境中进行,且会排放大量酸性环境污染物[3],易造成环境污染;氧化法降解时容易引起低聚壳聚糖色泽的改变,增加产品提纯难度。朱新锋等[4]通过撞击流技术制备低聚壳聚糖,使得反应物黏度下降率达到67.6%,但通过物理技术制备的低聚糖聚合度往往较难控制,且成本相对较高。相比于其他技术,生物酶解法是指利用专一性或非专一性的酶蛋白对壳聚糖进行水解[5],具有非常好的应用前景。研究表明,利用壳聚糖酶制备的低聚壳聚糖不仅保留了壳聚糖的生理活性,而且具有更好的水溶性及良好的生物相容性,已经被广泛地应用于提高饮品澄清度[6]、改善肠道pH、食品保鲜、生产调味品、天然防腐剂[7]、抗氧化[8]、降甘油三酯、抗炎[9]、稳定动脉粥样硬化[10]、抵御癌症[11]等食品及医疗领域[12]。
壳聚糖酶(EC3.2.1.132)可以高效地水解壳聚糖[13],其主要来源于真菌和细菌,也有少部分存在于植物和病毒中[14]。细菌类以芽孢杆菌属研究最为深入,真菌类主要有曲霉菌、链霉菌、淡紫拟青霉、木霉菌属等,但海洋来源的菌株相对较少。酶法制备低聚壳聚糖具有反应效率高、产品纯度高、后续分离纯化简单、环境友好等优势[15]。但目前利用生物酶解法制备低聚壳聚糖同样也面临着高效产壳聚糖酶原始菌株较少、壳聚糖酶普遍活力低下、菌株产酶周期长以及纯酶价格昂贵的问题。因此,筛选出高效产壳聚糖酶的原始菌株对未来大规模生产制备食品级低聚壳聚糖至关重要。
1 材料与方法
1.1 材料与试剂
滨海土壤样品:海南三亚虾蟹养殖区;粉末壳聚糖(脱乙酰度≥95%):西安百川生物科技有限公司;胶体壳聚糖(脱乙酰度≥85%):青岛博智汇力生物科技有限公司;酵母粉、蛋白胨、琼脂粉:赛默飞世尔科技公司;氨基葡萄糖盐酸盐(分析纯):阿拉丁公司;革兰氏染色试剂盒:广东环凯生物科技有限公司;Green Taq Mix:诺唯赞生物科技股份有限公司;其余试剂均为国产分析纯。
培养基:富集培养基(g/L):胶体壳聚糖10.0,硫酸镁0.5,磷酸氢二钾0.5,磷酸二氢钾0.5,蛋白胨3.0,酵母粉0.5,氯化钠5.0,pH 7.0;初筛培养基(g/L):胶体壳聚糖10.0,硫酸镁1.0,磷酸氢二钾1.0,磷酸二氢钾1.0,硫酸铵2.0,氯化钠5.0,琼脂15.0,pH 7.0;复筛培养基(g/L):粉末壳聚糖10.0,硫酸镁1.0,磷酸氢二钾2.0,磷酸二氢钾1.0,硫酸铵4.0,氯化钠5.0,pH 6.5;种子培养基(g/L):酵母粉5.0,蛋白胨10.0,氯化钠10.0,pH 7.0。
1.2 主要仪器与设备
UV-2450分光光度计 日本Shimadzu公司;PCR仪 日本Takara公司;WIX-EP600凝胶电泳仪 韦克斯科技(北京)有限公司;BSD-YX(F)3200恒温摇床、BPX-82电热恒温培养箱、BJ-1CD超净工作台 上海博迅实业有限公司;HC-3618R台式高速离心机 中科中佳科学仪器有限公司;HWS-5A恒温水浴锅 上海百典仪器设备有限公司。
1.3 菌株筛选
1.3.1 富集
将采自海南三亚虾蟹养殖区的10 g土壤样品与90 mL灭菌水混合后置于三角瓶中,180 r/min振荡1 h,静置后取1 mL上清液接种于100 mL/250 mL含富集培养基的三角瓶中,在28 ℃、180 r/min条件下摇瓶培养3 d。
1.3.2 初筛
取富集后的菌液按梯度法稀释101~107倍,吸取稀释102~107倍后的溶液100 μL均匀涂布在含初筛固体培养基的培养皿上,在28 ℃条件下恒温培养3 d,观察培养皿上菌落生长状况,挑取生长良好、不分泌黏液且具有透明圈的单菌落,在初筛培养基上划线纯化2~3次。
1.3.3 复筛
挑选透明圈直径/菌落直径(D/d)最大的单菌落进行复筛,用接菌环轻蘸菌苔后接种于100 mL/250 mL含复筛培养基的三角瓶中,在28 ℃、200 r/min条件下摇瓶培养30 h。
1.3.4 保存
取复筛培养基中菌液1 mL接种于100 mL/250 mL含种子培养基的三角瓶中,培养6 h后保存于-80 ℃冰箱中。
1.4 菌株鉴定
1.4.1 菌株形态学特征鉴定
取保存菌株在初筛培养基上划线,30 ℃恒温培养20 h后用接菌环挑起少量菌苔于载玻片上,用无菌水稀释一定倍数,明火干燥成膜后依照革兰氏染色试剂盒说明书步骤进行染色,使用光学显微镜观察菌株形态。
1.4.2 菌株分子生物学鉴定
取保存菌株在初筛培养基上划线,30 ℃恒温培养30 h后用接菌环刮取微量菌苔加入到150 μL无菌水中煮沸10 min,12000 r/min条件下离心10 min,取上清液进行PCR扩增。采用细菌16S rDNA 通用引物(正向引物 5′-AGAGTTTGATCCTGGCTCAG-3′,反向引物5′-GGTTACCTTGTTACGACTT-3′)进行 PCR 扩增,扩增程序为:94 ℃ 5 min;98 ℃ 10 s,55 ℃ 30 s,72 ℃ 1 kb/1 min,35个循环;72 ℃ 10 min;4 ℃保存。获得的PCR产物利用1%的琼脂糖凝胶电泳验证后,交由广州天一辉远基因科技有限公司进行测序。将测序结果提交到NCBI 数据库,利用BLAST程序搜索同源序列,选出同源性高的菌株的16S rDNA序列为参比对象,通过MEGA 7.0 软件的Neighbor-Joining 法构建系统发育树[16]。
1.5 粗酶液制备
发酵液在12000 r/min、4 ℃条件下离心10 min。上清液即为粗酶液[17]。
1.6 酶活测定
采用3,5-二硝基水杨酸(DNS)法测定粗酶液的酶活[18]。取100 μL酶液和900 μL 1%壳聚糖溶液加入至25 mL比色管中,75 ℃下恒温反应10 min后迅速加入1.5 mL DNS溶液,冷却至室温后沸水浴5 min显色,加蒸馏水定容至25 mL;在9000 r/min、4 ℃条件下离心10 min,取上清液在540 nm处进行比色,测定酶活。
1.7 产酶条件优化
1.7.1 单因素试验设计
在复筛培养基的基础上分析单一组分变化对SH-50菌株产酶活性的影响,影响因素主要包括:碳源的种类及浓度、氮源的种类及浓度、无机盐的种类及浓度、初始发酵pH、发酵温度、发酵时间。
1.7.2 Plackett-Burman(PB)试验设计
在获得单因素试验结果的基础上设计PB试验,设计影响SH-50菌株产酶活性的7个因素,每个因素分为高水平(1)和低水平(-1),挑选置信度≥95%且影响最大的3个因素进行爬坡试验,找到菌株产酶活性的拐点。PB试验设计见表1。

表1 PB试验不同因素及水平设计Table 1 Design of different factors and levels of PB test
1.7.3 Box-Behnken Design(BBD)试验设计
设计BBD试验(见表2),并将结果输入Design Expert V8.0.6软件构建回归模型,对数据进行方差及可信度分析,根据所得最优产酶活性的编码水平进行重复试验,验证回归模型与实际产酶活性之间的相关性。

表2 BBD试验不同因素及水平设计Table 2 Design of different factors and levels of BBD test
2 结果和分析
2.1 菌株形态学鉴定

图1 SH-50菌株的形态学鉴定Fig.1 Morphological identification of SH-50 strain
土壤样品在28 ℃条件下摇瓶富集3 d后,经筛选得到一株产壳聚糖酶菌株,由图1中a可知,菌落呈乳白色,能够降解壳聚糖,将其标记为SH-50。挑取图1中a的SH-50单菌落在唯一碳源为壳聚糖的培养基上继续培养生长2 d,由图1中b可知,菌落为边缘规则的圆形,菌苔呈乳白色,微隆起,表面光滑,易挑起,有明显的壳聚糖水解圈。刮取微量图1中b的菌苔进行革兰氏染色,在显微镜下观察,结果见图1中c,细菌呈短棒状,革兰氏染色结果为阴性。
2.2 菌株的生理生化特征
将SH-50菌株与模式菌株M.chitosanitabida3001的生理生化特性进行比较,结果见表3。
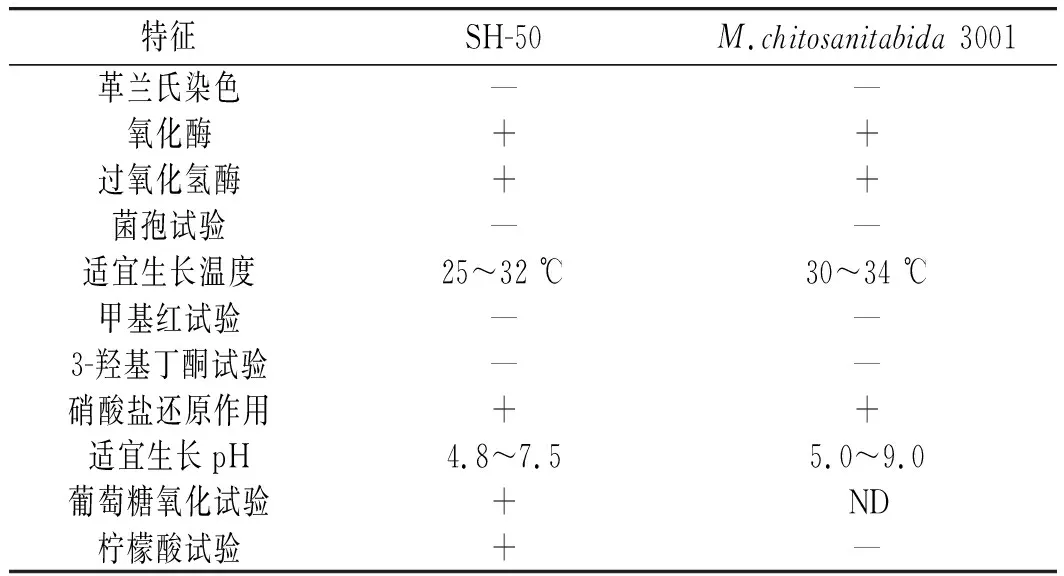
表3 SH-50菌株的生理生化性质Table 3 Physiological and biochemical properties of SH-50 strain
由表3可知,SH-50菌株的生理生化特征与模式菌株基本相同,但适宜生长温度、pH及柠檬酸试验存在一定差异,可能是因为生长环境不同,菌株生理生化性质有所改变,同时也表明SH-50菌株可能是松江菌属潜在的新种。
2.3 分子生物学鉴定
利用16S rDNA通用引物对SH-50菌株进行PCR扩增后,对6个重复样进行琼脂糖凝胶电泳试验,产物长度约为1500 bp,结果见图2。
将PCR产物送至广州天一辉远基因科技有限公司进行测序,将得到的序列在NCBI(https://www.ncbi.nlm.nih.gov)上进行BLAST比对后发现SH-50与Mitsuariasp.菌株同源性最高。其系统进化树见图3,根据16S rDNA序列,可以将Mitsuariasp.分为4簇,其中SH-50与Mitsuariastrain II3亲缘关系最近,位于同一簇的不同分支,因此将其命名为Mitsuariasp. SH-50,菌株16S rDNA上传至GenBank,编号为MW911724。
2.4 菌株生长及产酶曲线的测定
取保存的SH-50菌株接入种子培养基中培养至对数生长期,按1%的接种量转接至100 mL/250 mL含复筛培养基的三角瓶中,在28 ℃、180 r/min条件下培养,每隔3 h取样测定菌液OD600、菌液酶活,结果见图4。
由图4可知,SH-50菌株在生长6 h左右时逐渐从对数生长期进入稳定期,继续生长至12~24 h时,OD600继续增加,此时菌体分泌大量代谢产物,在24~30 h时OD600开始下降,表明培养基营养供应不足,菌体密度下降。SH-50菌株的产酶曲线与生长曲线呈一定程度上的正相关,从OD540对应的产酶曲线可以看出,产酶活性在12 h时达到最高值,但随着时间增加,酶液活性逐渐开始下降。因此,选取12 h作为该菌株最佳的发酵产酶时间。
2.5 培养基单因素变化对SH-50菌株产酶的影响
2.5.1 碳源对SH-50菌株产酶活性的影响
碳源主要在微生物生长代谢时为其提供细胞碳架,提供微生物生命活动所需的能量,同时为合成产物提供碳架,是细胞正常生长以及分裂的物质基础。该研究分别以壳聚糖、蔗糖、葡萄糖、淀粉、纤维素作为SH-50菌株的唯一碳源,探究不同碳源对该菌株产壳聚糖酶活性的影响,结果见图5。
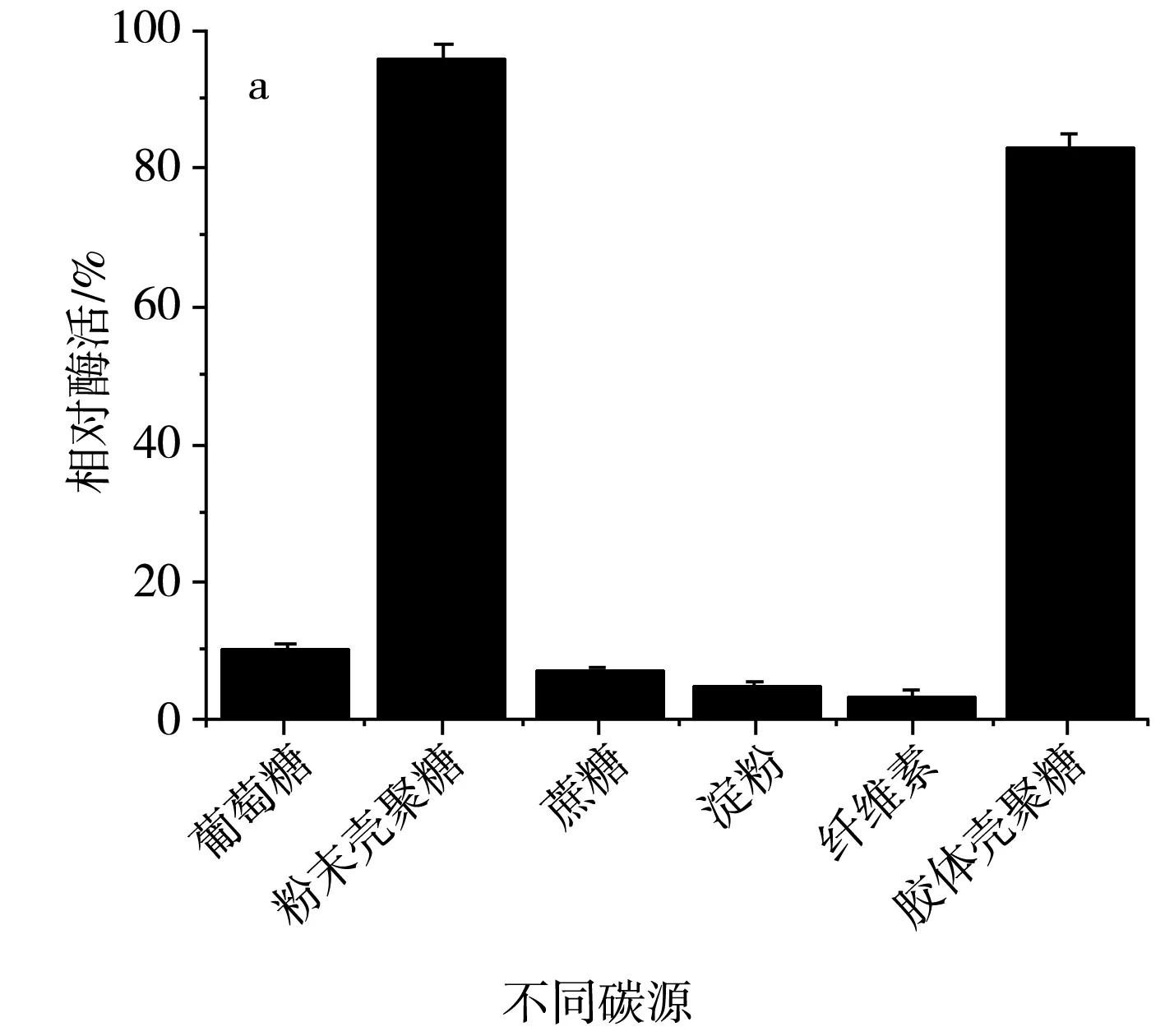
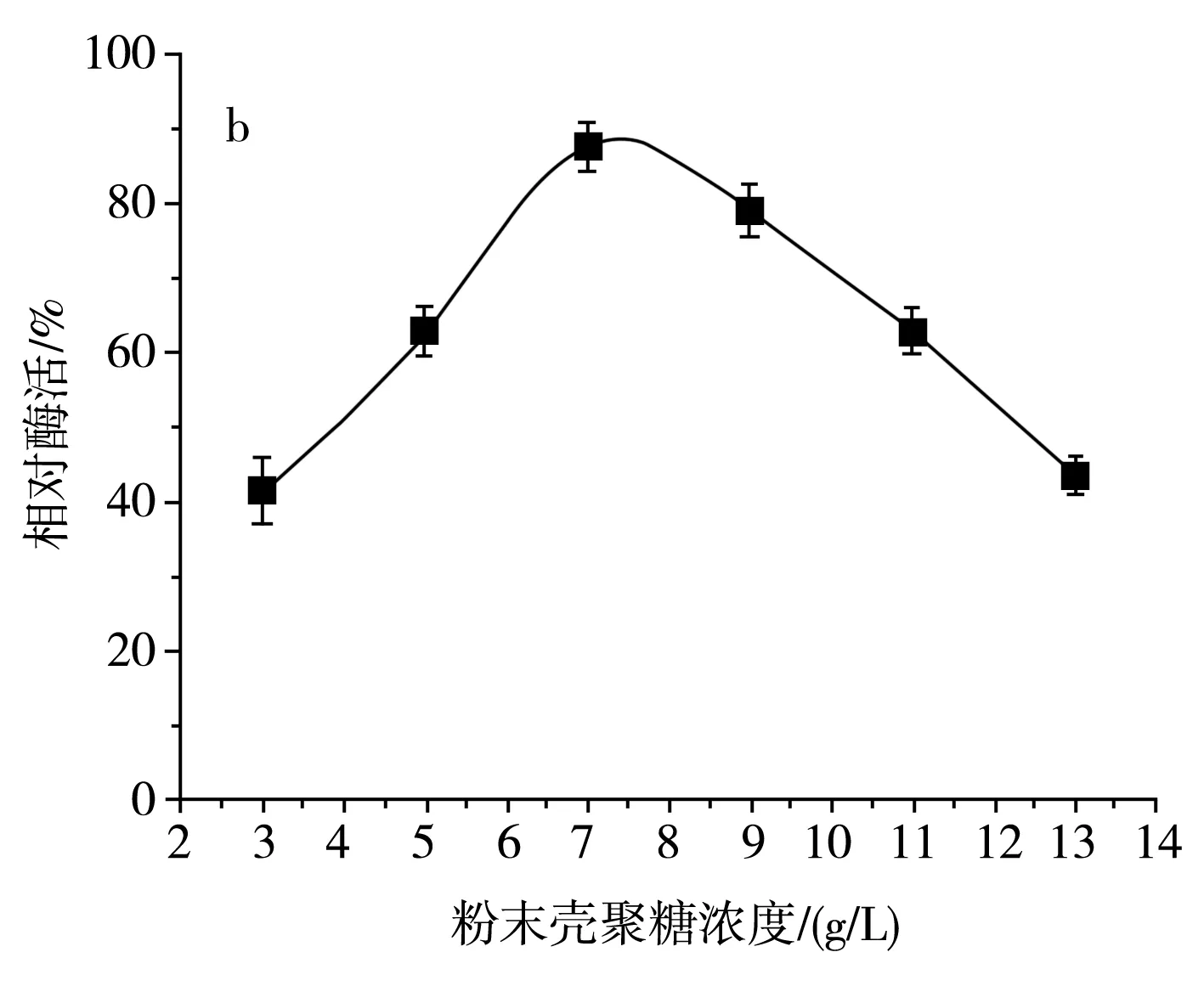
图5 不同碳源及壳聚糖浓度对SH-50菌株产酶活性的影响Fig.5 Effects of different carbon sources and chitosanase concentrations on enzyme production activity of SH-50 strain
由图5中a可知,SH-50菌株在碳源为壳聚糖时产酶活性较高,碳源为其他糖类时该菌株几乎不产壳聚糖酶。为明确壳聚糖浓度对SH-50菌株产酶活性的影响,分别设置粉末壳聚糖浓度为3,5,7,9,11,13 g/L,由图5中b可知,随着壳聚糖浓度的增加,SH-50菌株产壳聚糖酶活性呈先上升后下降的趋势,在壳聚糖浓度较低时,酶活性上升趋势明显,当壳聚糖浓度达到9 g/L时,酶活性明显下降。最适的壳聚糖浓度应在7~8 g/L,因此,选取中间值7.5 g/L作为SH-50菌株发酵的壳聚糖浓度。
2.5.2 氮源对SH-50菌株产酶活性的影响
氮源主要用于菌体细胞物质(氨基酸、蛋白质、核酸等)和含氮代谢物的合成,同样也是微生物生长不可或缺的物质,许多功能微生物也常常被用于水体氮污染的净化。在设置等量氮的前提下,该研究分别选用蛋白胨、酵母粉、硫酸铵、尿素、硝酸钾、牛肉浸膏作为SH-50菌株的唯一氮源,然后进一步确定最佳氮源的添加浓度,结果见图6。
由图6中a可知,在不同氮源培养条件下,SH-50菌株的唯一氮源为硫酸铵和酵母粉时菌株产酶活性较高,然而硫酸铵在培养基中易造成粉末壳聚糖析出,因此选用酵母粉作为SH-50菌株的最适氮源。由图6中b可知,不同浓度的酵母粉对SH-50菌株所产壳聚糖酶的酶活性具有一定影响,酵母粉浓度小于1 g/L时,菌株产酶活性随浓度增加而增加,酵母粉浓度在1~2 g/L时菌株产酶活性变化不大,综合经济因素,选取1 g/L作为SH-50菌株发酵的酵母粉浓度。
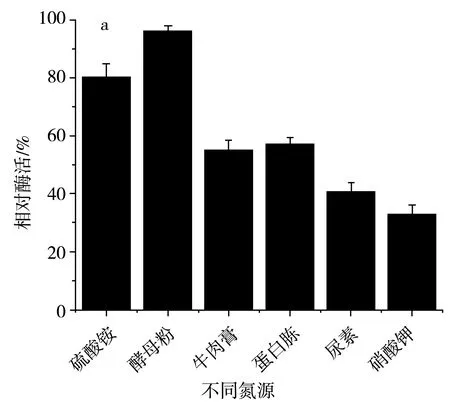
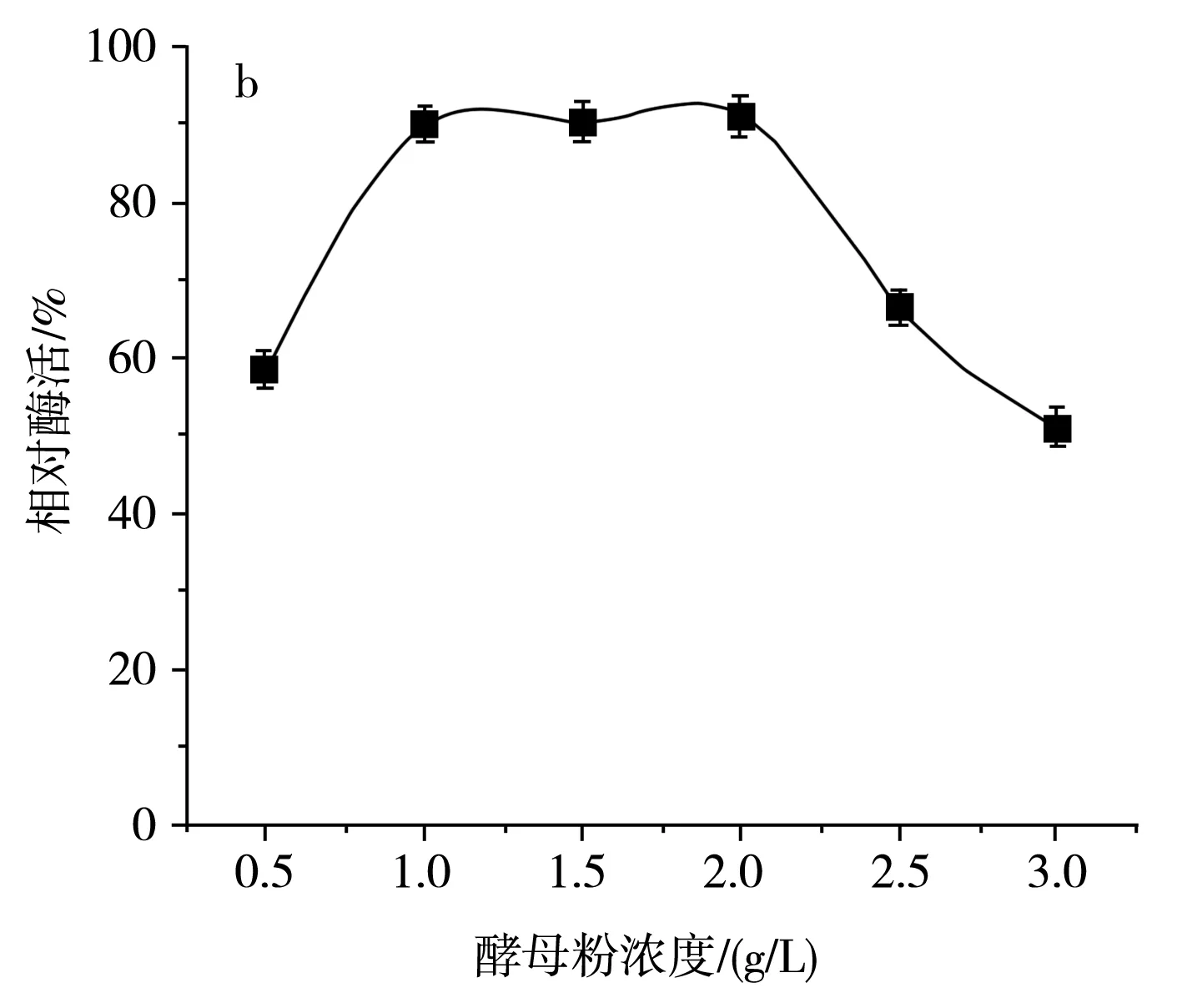
图6 不同氮源及酵母粉浓度对SH-50菌株产酶活性的影响Fig.6 Effects of different nitrogen sources and yeast powder concentrations on enzyme production activity of SH-50 strain
2.5.3 无机盐对SH-50菌株产酶活性的影响
无机盐中的各类离子同样是菌体细胞的组成成分之一,同时也可以作为酶的组成部分、酶的激活剂或抑制剂[19],具有调节细胞的渗透压、pH、氧化还原电位等功能。该研究主要分析常规无机盐氯化钠及磷酸氢二钾的浓度对SH-50菌株产酶活性的影响,结果见图7。


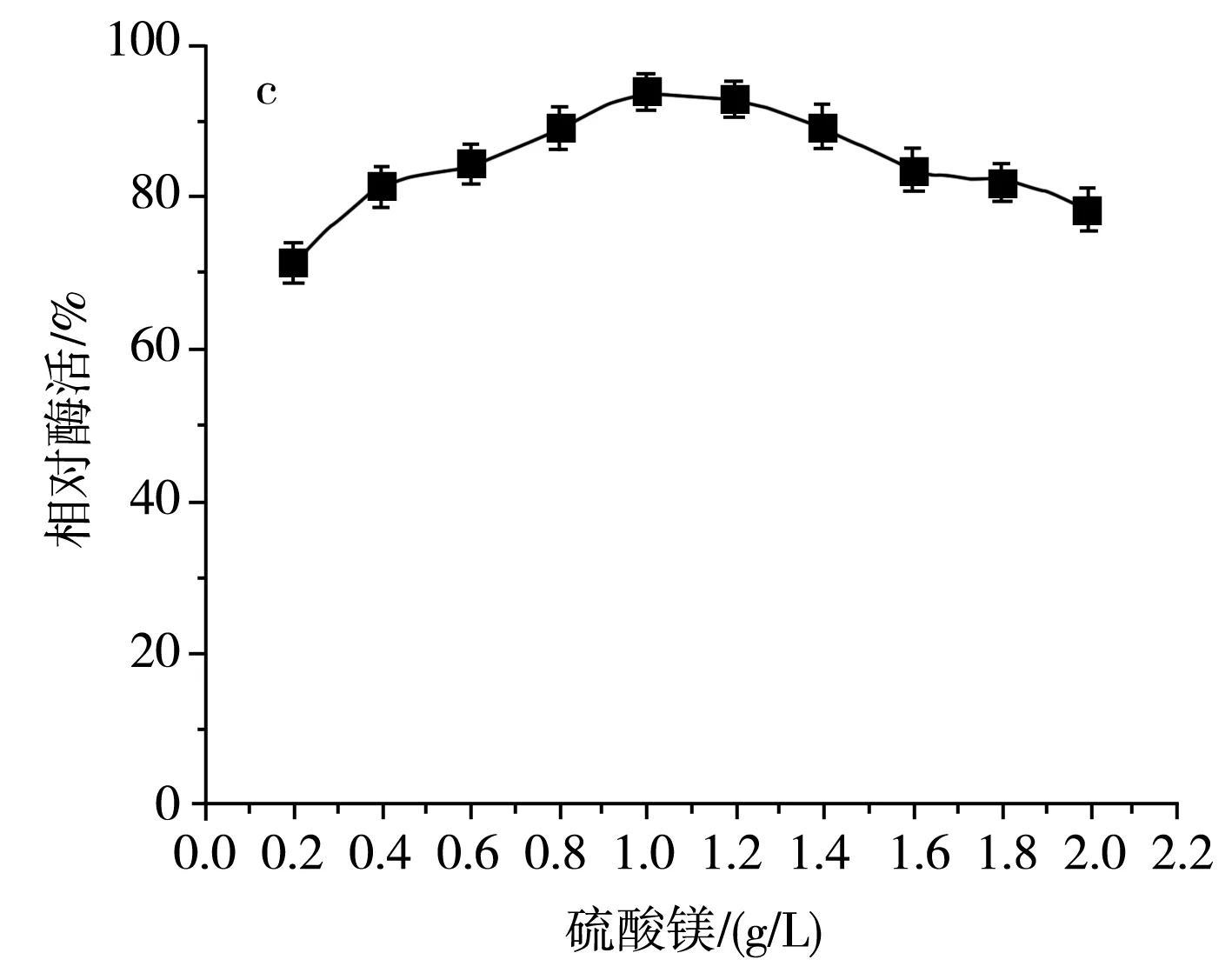
图7 不同无机盐及其浓度对SH-50菌株产酶活性的影响Fig.7 Effects of different inorganic salts and their concentrations on enzyme production activity of SH-50 strain
由图7中a可知,随着氯化钠浓度的增加,SH-50菌株产壳聚糖酶活性呈先上升后下降的趋势,这表明在一定浓度范围内,氯化钠的浓度对菌株产酶具有一定激活效应。由图7中b可知,随着磷酸氢二钾浓度的增加,SH-50菌株所产壳聚糖酶的酶活性呈先上升后平稳的趋势,表明磷酸根离子和钾离子在一定浓度范围内可以促进SH-50菌株产酶,但随着离子浓度的增加,酶活性无明显变化。由图7中c可知,硫酸镁浓度低于1 g/L时对菌株产酶具有一定正激活效应,但随着浓度的继续增加,菌株产酶活性逐渐降低。
2.5.4 初始pH及发酵温度对SH-50菌株产酶活性的影响
该研究分析了发酵液初始pH和温度对SH-50菌株产酶活性的影响,结果见图8。
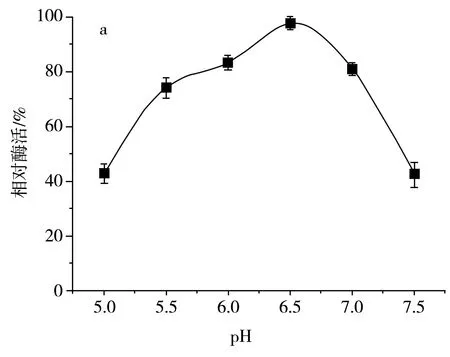

图8 不同初始pH和温度对SH-50菌株产酶活性的影响Fig.8 Effects of different initial pH values and temperatures on enzyme production activity of SH-50 strain
由图8中a可知,初始pH在5.0~6.5范围内时,SH-50菌株产壳聚糖酶活性随pH的增大而增大,pH在6.5以上时,SH-50菌株产酶活性逐渐开始降低,故选取pH为6.5作为该菌株初始发酵pH。由图8中b可知,发酵温度在25~30 ℃范围内时,SH-50菌株产壳聚糖酶活性随温度升高而增加,在30 ℃以上时,SH-50菌株产酶活性开始显著下降,故选取30 ℃作为该菌株的发酵温度。
2.6 响应面优化产酶试验
2.6.1 PB试验结果及方差分析
PB试验结果见表4,试验回归及方差分析见表5。
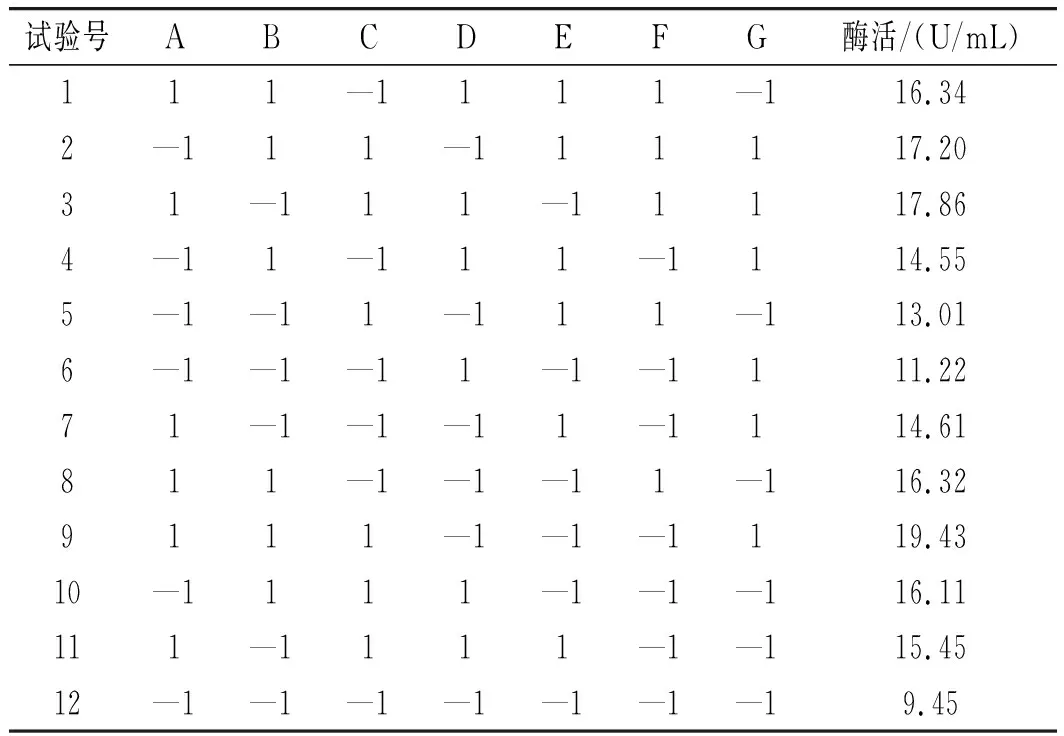
表4 Plackett-Burman试验设计及结果Table 4 Plackett-Burman experiment design and results

表5 Plackett-Burman试验回归及方差分析Table 5 Plackett-Burman test regression and variance analysis
由表5可知,(A)初始pH、(B)发酵温度、(C)壳聚糖浓度、(G)发酵时间4个因素的P<0.05,表明这4个因素对SH-50菌株产酶活性具有显著的影响,效应大小依次为A>B>C>G,因此选取A(初始pH)、B(发酵温度)、C(壳聚糖浓度)3个因素做最陡爬坡试验。
2.6.2 最陡爬坡试验
根据3个因素的效应值合理设计原点及步长,结果见表6。

表6 最陡爬坡试验设计及结果Table 6 Design and results of steepest climbing test

续 表
由表6可知,随着壳聚糖浓度的增加、初始pH的增加、温度的降低,SH-50菌株所产酶活性先升高后降低,其中项目4达到最高值,为爬坡试验的拐点,因此将试验项目4作为BBD试验的中心值,进行下一步试验。
2.6.3 响应面结果及方差分析
在最陡爬坡试验的基础上,以(A)初始pH、(B)发酵温度、(C)壳聚糖浓度作为3个因素,壳聚糖酶活作为响应值设计响应面分析,利用Design Expert V8.0.6软件对结果进行分析,试验结果见表7,构建的响应面回归模型为:Y=24.08+0.36A+2.41B+0.25C-0.67AC-0.88BC-10.01A2-7.02B2-6.44C2。
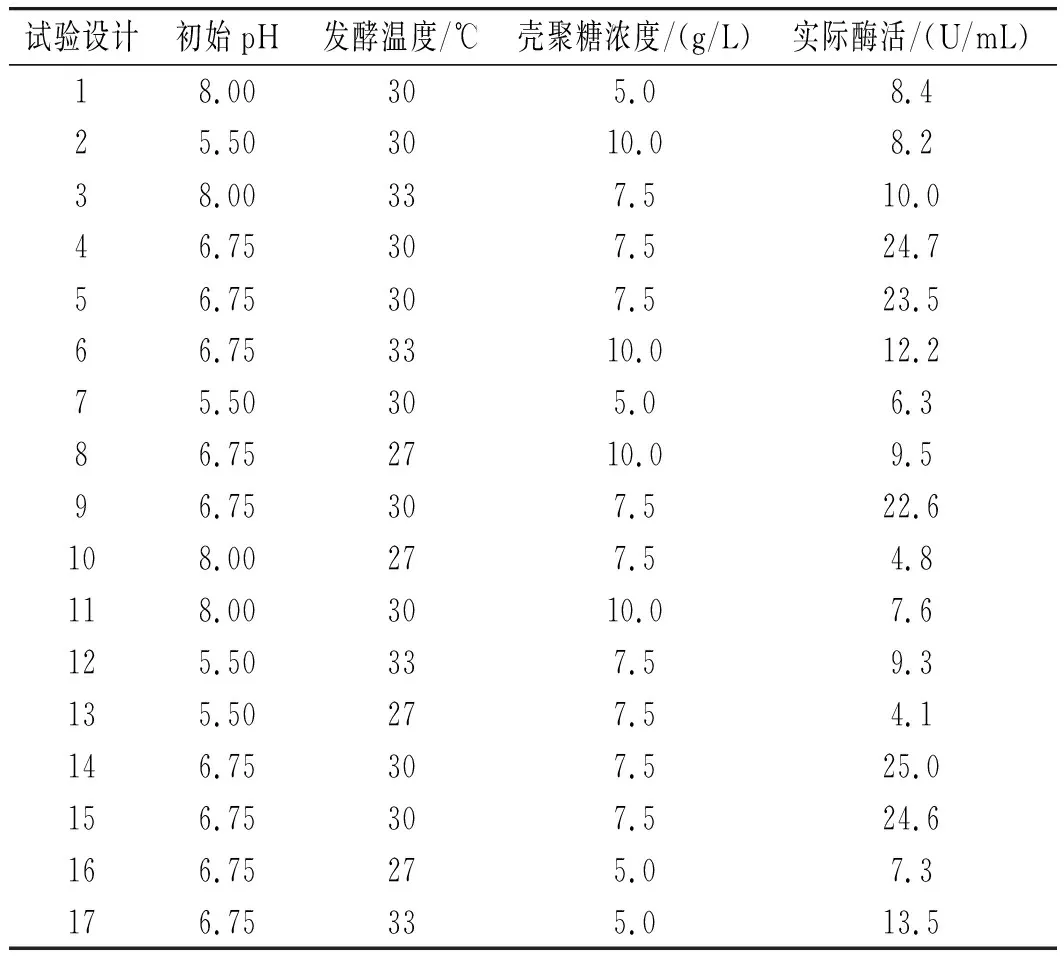
表7 Box-Behnken试验数据及结果Table 7 Box-Behnken test data and results
分别对模型的方差和显著性进行统计分析,结果见表8。
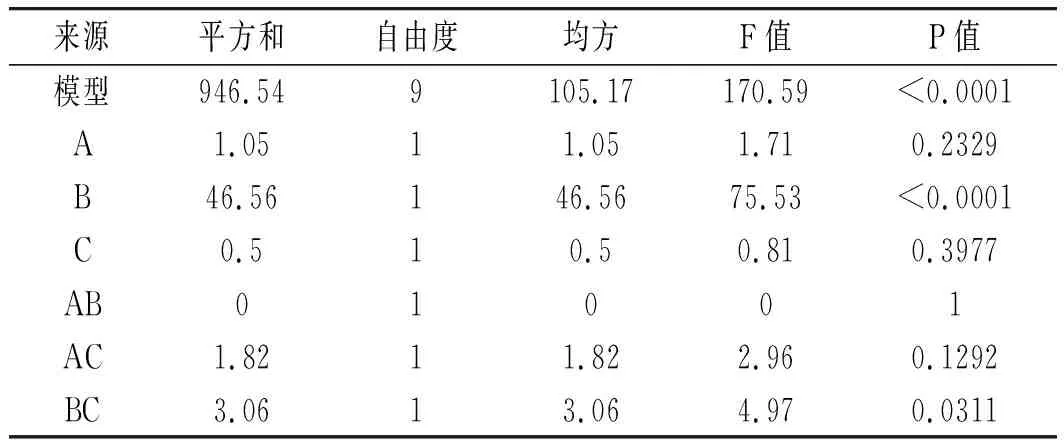
表8 Box-Behnken试验回归模型方差分析Table 8 Variance analysis of Box-Behnken test regression model

续 表
回归模型P<0.0001,表明回归方程拟合显著,失拟项的P不显著,说明模型误差较小。模型的决定系数R2=0.9955,修正系数RAdj2=0.9896,说明试验数据变化可以用该模型来解释且模型显著性较好。
2.6.4 响应面因素之间的交互作用
运用响应面Design Expert V8.0.6软件对试验结果进行拟合,得到影响SH-50菌株产酶活性两因素之间的等高线图及三维立体图,并由此判断交互影响程度,结果见图9。
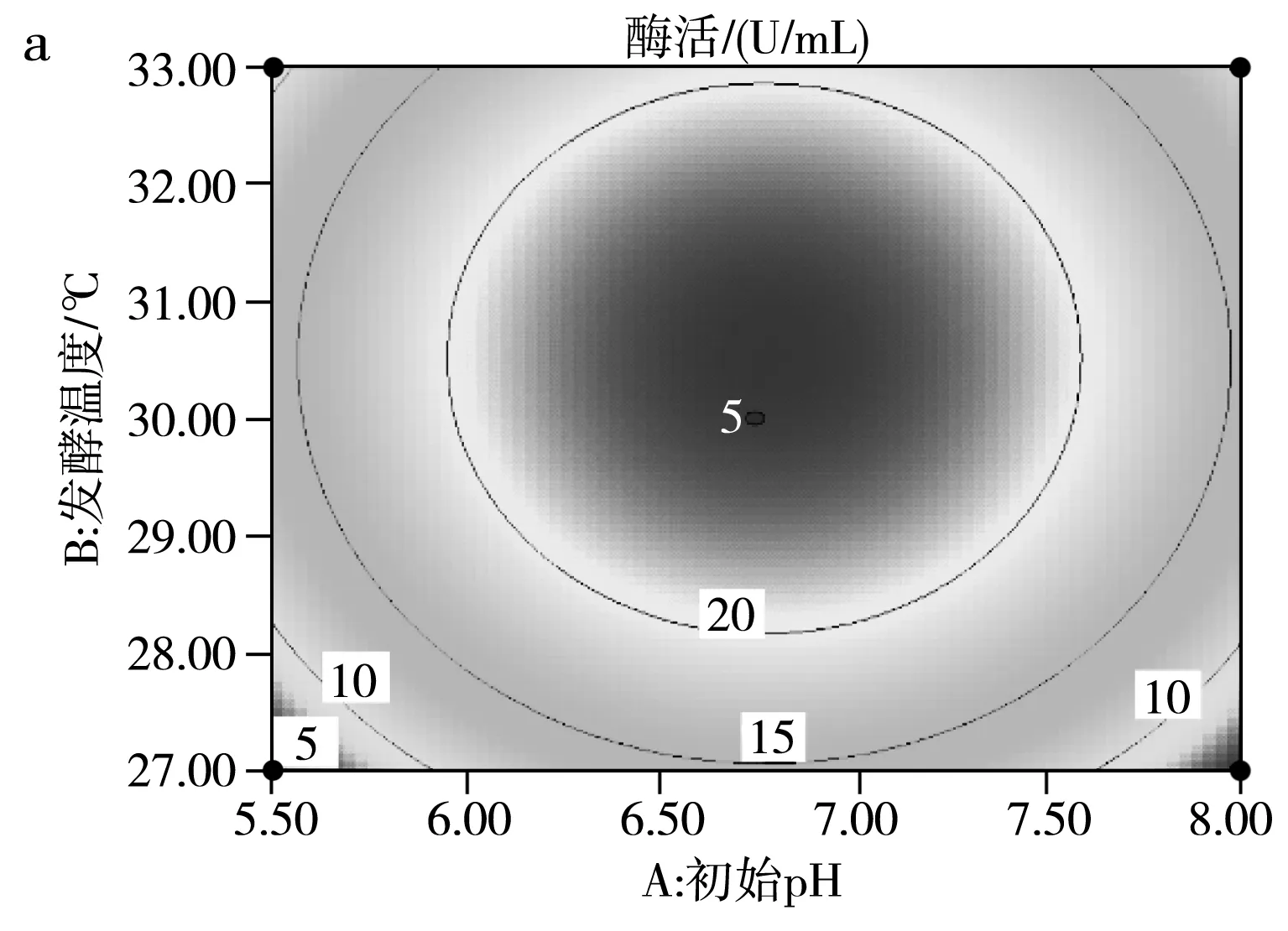



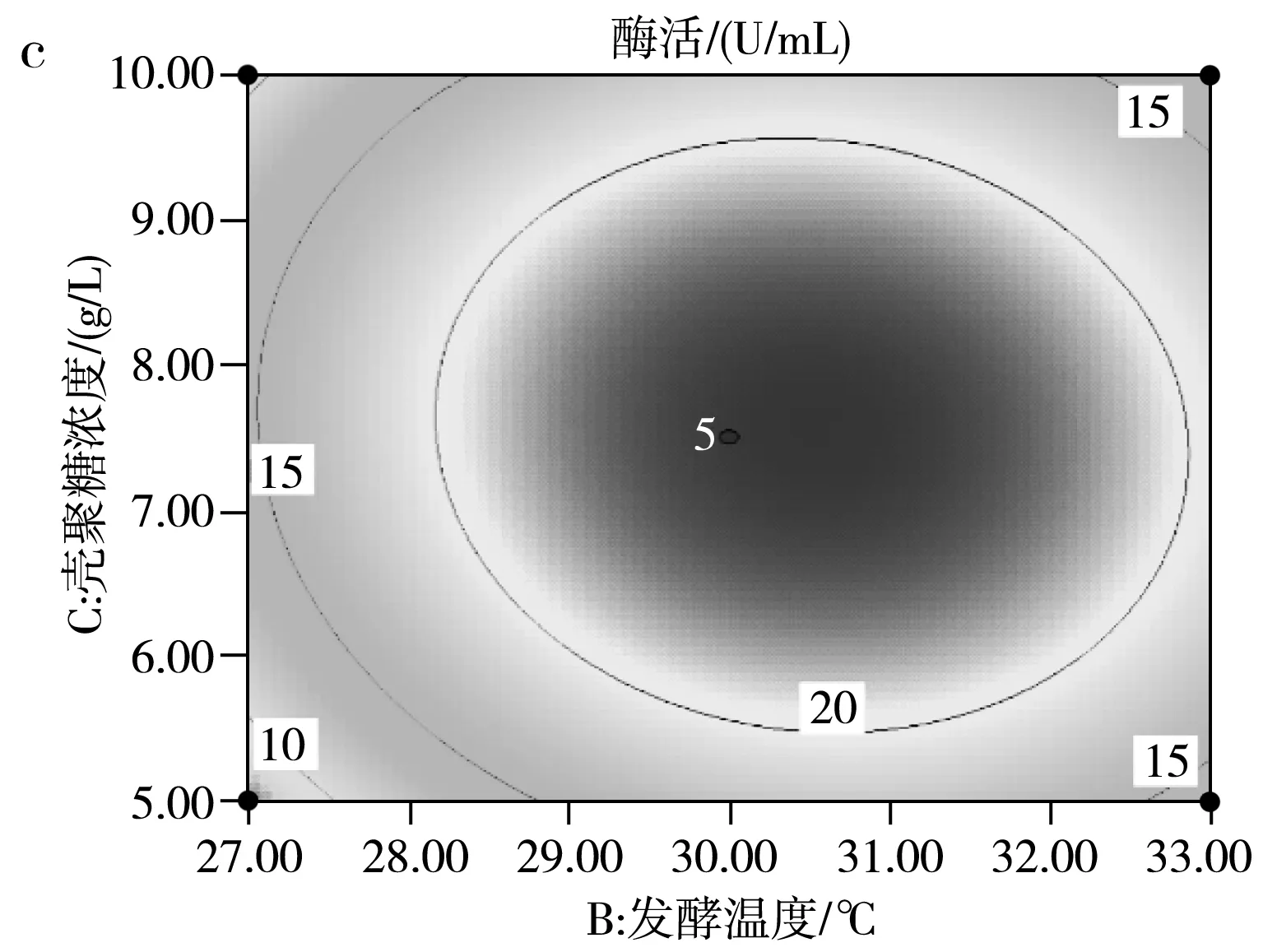

图9 发酵温度、初始pH、壳聚糖浓度两两因素对SH-50菌株 产酶影响的等高线图及响应面三维图Fig.9 Contours and response surface 3D diagrams of the effects of interaction of fermentation temperature, initial pH and chitosan concentration on enzyme production of SH-50 strain
由图9中a的等高线图可知,(B)发酵温度和(A)初始pH两因素交互作用并不明显,由图9中a的三维立体图可知,随着发酵温度和初始pH的增高,SH-50菌株所产壳聚糖酶的酶活先升高后降低,存在中心最大值,中心点即两因素之间的最适条件。由图9中b的等高线图可知,(A)初始pH和(C)壳聚糖浓度两因素之间交互作用不明显,同样存在条件中心点。由图9中c的等高线图可知,(B)发酵温度和(C)壳聚糖浓度两因素存在明显交互作用,同样存在条件中心点。综上可知,在pH 6.5~7.0、温度30~31 ℃、壳聚糖浓度7.5~8 g/L的范围内,存在3个因素间最优产酶条件。
2.6.5 回归模型的验证
响应面预测SH-50菌株产酶活性最高的条件为:初始pH 6.77,发酵温度30.52 ℃,壳聚糖浓度7.52 g/L,预测酶活为24.29 U/mL。实际试验中设置初始pH 6.75,发酵温度30.5 ℃,壳聚糖浓度7.52 g/L,重复3次试验测得平均酶活为26.6 U/mL,与预测值较为接近,说明该模型具有较高可信度。
3 结果与讨论
壳聚糖酶的概念是由Shimosaka等在1973年首次提出,于2004年被国际生物化学酶学委员会命名为壳聚糖酶(EC3.2.1.132壳聚糖N-乙酰氨基葡萄糖水解酶)。该研究从海南三亚虾蟹养殖区土壤中筛选到一株高效产壳聚糖酶的菌株SH-50,结合菌株的生理生化特性及16S rDNA序列,初步鉴定该菌株为松江菌属,Mitsuariasp.是2005年建立的一个新属,归属β-变形菌门[20],最早在日本松江市被发现。
响应面分析法(RSM)是一种优化生物发酵过程的综合技术,能够对微生物发酵影响因素及水平的交互作用进行较好的优化和评价[21],本研究通过响应面法对该菌株产酶条件进行优化,得到的最佳发酵条件为:壳聚糖浓度7.52 g/L,氯化钠4.0 g/L,硫酸镁1.0 g/L,磷酸氢二钾4.0 g/L,温度30.5 ℃,初始pH 6.75,装液量100 mL/250 mL,接种量1%,在180 r/min条件下发酵12 h,粗酶液酶活为26.6 U/mL,优化后的产酶活性较初始产酶活性提高了5.3倍。目前Mitsuariasp.菌属的菌株主要应用在生物防治及生物修复等领域,在壳聚糖酶领域的研究并不多,胡远亮等[22]对Mitsuariasp. 141-2菌株的突变株进行产酶优化后,得到的壳聚糖酶活性为3.631 U/mL。张馨月等[23]通过响应面法优化了一株产壳聚糖酶的淡紫紫孢菌的发酵条件,得到其发酵5.5 d时的壳聚糖酶活为16.80 U/mL。孙玉英等[24]通过正交试验优化Cellulophagasp. M5菌株的产酶条件,使其在发酵84 h后产酶活性达到6.67 U/mL。相比其他菌株,该研究中的SH-50菌株产酶活性达到26.6 U/mL,且产酶周期仅为12 h,产酶效率高。值得注意的是,大多数壳聚糖酶属于诱导酶,所以将壳聚糖作为碳源时需合理考虑其使用浓度,黏度过高易产生大量气泡从而成为大规模发酵中的限制因素,SH-50菌株产酶培养基中壳聚糖的浓度仅为7.52 g/L,酵母粉仅为1.0 g/L,不仅培养基黏度低,而且所需原料成本低。其次,SH-50菌株最适产酶温度为30.5 ℃,pH为6.75,发酵条件温和且易实现。因此,SH-50菌株已经具有工业化的应用能力。
生物酶解法制备低聚壳聚糖的过程既不存在环境风险也不会引入对人体有害的物质,是工业化生产食品级低聚壳聚糖的首选。冯林慧等[25]将壳聚糖作为一种天然防腐剂对食品中容易滋生的李斯特菌、金黄色葡萄球菌、绿脓杆菌、白色假丝酵母及黑曲霉进行抑菌试验,发现一定浓度的壳聚糖具有良好的抑菌效果,且对绿脓杆菌的抑制效果最为明显。刘安等[26]使用壳聚糖作为罗汉果及陈皮浸提液的脱色剂,发现低浓度的壳聚糖具有良好的脱色功能,可以显著提高浸提液的透光率及色度。苏维发等[27]发现在猪饲料中添加微量的低聚壳聚糖可以提高猪机体的免疫力、抗氧化功能、肠道黏膜形态,进而改善猪肉品质。尽管低聚壳聚糖的聚合度、分子量、水溶性、生物活性均优于壳聚糖[28],但目前仍不能确定其中单一组分的具体功能。新型生物酶制剂的开发研究有望为日后生产特定功能的食品添加剂提供一定的理论依据。

