前列腺素E2 促进损伤肠黏膜修复的研究进展
乐梦真 范汉程 朱清仙 曾慧红 邵立健
肠道黏膜上皮处于不断的再生-凋亡循环,更新周期通常为3~5 d。肠隐窝底部的肠道干细胞(ISC)具有自我更新与多向分化为各种肠道上皮细胞(IEC)的潜能,当肠黏膜上皮受到损伤时,这种潜能对于维持肠黏膜屏障完整性至关重要。另外,当受炎症和辐射等刺激时,ISC 及IEC 受到损伤,若存活的ISC 不足以补充缺失的IEC,肠黏膜屏障将会受损,从而导致各种消化道疾病。肠黏膜损伤情况下,体内多种物质参与促进肠黏膜损伤的修复,如前列腺素E(PGE)、IL-6、胰岛素样生长因子-1(IGF-1)、血管心外膜活性物质(BVES)等。这些物质促进黏膜修复机制及激活的信号通路不尽相同,但作用的共同点都是通过促进肠隐窝底部的ISC 增殖分化,从而促进损伤肠黏膜的修复。但在此修复过程中,如果相关通路的某些关键基因发生突变,将导致ISC 恶性增殖乃至肠道肿瘤的发生。因此,ISC 的生长调控是近年来肠道疾病防治的研究热点。随着PGE对成体干细胞(包括ISC 等)作用的深入研究, PGE促进损伤肠黏膜修复方面的研究也有了明显的进展,由于篇幅限制,本文主要就PGE在病理条件下对肠道黏膜损伤的修复作用及其对ISC 功能的影响做一综述。
一、PGE2 的合成及其受体在肠道中的分布
PGE可由多种类型细胞经一系列酶促反应产生,细胞膜上的膜磷脂在磷脂酶A2(PLA2)的作用下释放出花生四烯酸(AA)。在环氧合酶(COX)催化下,AA 被氧化生成前列腺素G(PGG)和前列腺素H(PGH), PGH作为前列腺素合成的中间产物,在特定前列腺素E 合成酶(PGES) 作用下生成PGE(图1)。
COX 作为PGE形成过程中的关键酶,有两种同工酶:COX-1 和COX-2,但这两种同工酶在肠道的表达及其作用有较大的差异。Xiao 等(2017年)在小鼠实验中发现,正常情况COX-1 在包括ISC 在内的所有隐窝细胞中持续性表达,COX-1 介导的PGE在肠腔内发挥保护肠黏膜屏障、维持肠上皮完整性的作用,使肠黏膜在日常生活中免受胃酸、药物等刺激,保证肠黏膜上皮持续更新。传统NSAID 如阿司匹林由于抑制COX-2 的同时也抑制了COX-1,使COX-1 对肠黏膜的保护作用受到破坏,从而增加了溃疡等各种胃肠道不良反应的发生风险。COX-2 在正常肠道细胞内表达很少,主要在炎症和肿瘤等病理刺激下呈诱导性表达。COX-2 在炎症和辐射中能促进损伤肠黏膜的修复,而在肿瘤中则促进其发生发展。以上研究结果表明在生理和病理条件下,表达COX-1 或COX-2 在肠黏膜损伤修复中起重要作用。
PGE在体内发挥作用是通过与前列腺素E 受体(EP)结合实现。EP 受体属G 蛋白偶联受体(GPCR),有EP1、EP2、EP3 和EP4 四种。EP1 和EP2 可以分别激活磷脂酶C(PLC)和环磷酸腺苷(cAMP),导致正信号转导,激活相关信号通路,促进细胞增殖;EP3 则负向调节cAMP 水平,起到相反的作用;而EP4 可以激活cAMP 和磷脂酰肌醇3 激酶(PI3K)两条途径,激活相关信号通路,促进细胞增殖 (图1)。各类型EP 受体在肠道中的表达水平有所不同,正常情况下,小鼠结肠固有层细胞表达所有EP 受体,隐窝细胞只表达EP2和EP4,而小鼠小肠表达低水平EP 受体。近期笔者团队也证明了小鼠肠隐窝细胞表达EP2 和EP4,并证实了氟尿嘧啶作用下肠隐窝细胞内的EP2 表达升高,但EP4 的表达未受影响。在炎症等刺激下,小肠隐窝细胞可高表达EP2 和EP4,PGE与其结合可促进隐窝细胞增殖并修复损伤的肠黏膜。但病理条件下,小肠隐窝细胞EP 受体表达的作用未知,ISC 是否表达EP 受体及其意义值得探讨。
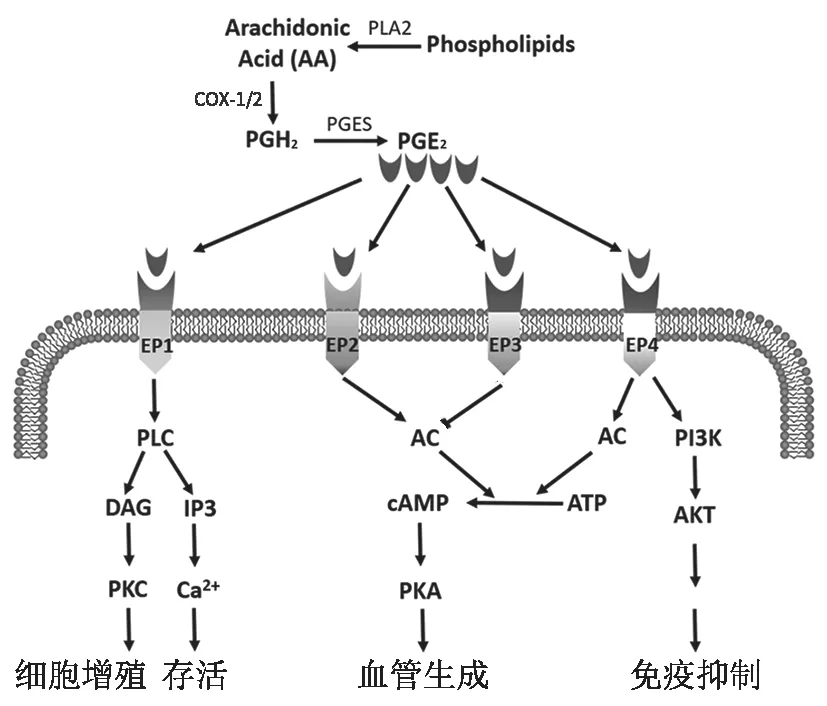
图1 PGE2 的合成及胞内相关信号通路
二、肠黏膜结构及其形成的调节因素
正常肠黏膜由肠绒毛与肠隐窝构成,肠隐窝底部的ISC 能够自我更新与分化为多种成熟肠道细胞,构成绒毛与隐窝结构的细胞支架。在ISC 增殖分化过程中,ISC 先增殖产生各种早期祖细胞-短暂扩增细胞(TA),紧接着TA 细胞快速分裂,并沿肠隐窝-绒毛轴纵向迁移与定向分化为各种成熟肠道细胞,吸收细胞、杯状细胞和内分泌细胞向上迁移,构成绒毛结构,而潘氏细胞则向下迁移至隐窝底部,与ISC、TA 细胞共同构成肠隐窝结构(图2)。哺乳动物肠隐窝内有两种不同类型的ISC,一类位于隐窝底部,其分布于潘氏细胞之间,更新迅速,能被富含亮氨酸重复单位的G蛋白偶联受体5(Lgr5)、嗅素4(Olfm4)和无刚毛-盾片样蛋白2(Ascl2)等标记,主要受Wnt信号通路调节,对辐射刺激敏感,称为活性干细胞(A-ISC)或隐窝底部柱状细胞或Lgr5ISC(另有说法为Lgr5ISC 位于结肠隐窝底部,小肠隐窝+4 区);另一类位于隐窝底部潘氏细胞上方的+4区,其更新缓慢,能够被B 淋巴细胞特异的莫洛尼鼠白血病病毒插入位点-1(Bmi1)、多亮氨酸重复区免疫球蛋白样蛋白1(Lrig1)、唯同源异型结构域蛋白X(Hopx)和小鼠端粒酶逆转录酶(mTert)等标记,主要由骨形态发生蛋白(BMP)信号通路调节,Wnt 信号通路处于抑制状态,有辐射抵抗作用,称为静止干细胞(Q-ISC) 或标记滞留细胞。除以上标记物外,近年来发现有A-ISC 与Q-ISC 共表达标记物,如干细胞RNA 结合蛋白Musashi1 和Mex-3 同源蛋白A(Mex-3A)等。在生理情况或肠黏膜损伤较轻时,肠黏膜自我更新与修复主要由Lgr5ISC 介导,在肠黏膜受到严重损伤,存活的Lgr5ISC 不足以维持肠黏膜完整性时,一部分Q-ISC 可以转化为Lgr5ISC,以促进肠道细胞再生与损伤黏膜的修复。
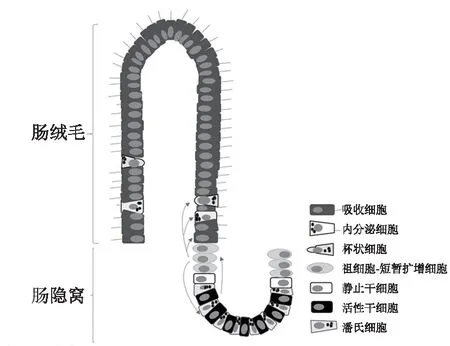
图2 ISC 在隐窝底部的分布及分化
生理情况下,肠黏膜上皮完整性主要由ISC维持,而ISC 的增殖分化受多种信号通路的精确调控,主要有Wnt/β-连环素(β-catenin)、BMP和Notch 等信号通路。其中,Wnt 信号通路是调控A-ISC 生长增殖的主要通路,而BMP、Notch通路主要调控TA 分化。Wnt 通路参与了多种肠道疾病的发生发展,且在肠黏膜损伤的修复中发挥主要作用,因此了解Wnt 通路调节机制对于研究损伤肠黏膜修复具有重要意义。隐窝周围肌成纤维细胞分泌R-脊椎蛋白1(R-spondin1),隐窝底部潘氏细胞分泌Wnt3,这些蛋白与相应受体结合后激活Wnt 信号通路,稳定细胞内β-catenin,β-catenin 通过激活T 淋巴细胞因子4(TCF4)促进细胞增殖。肠隐窝内一种轴蛋白Axin,可以结合β-catenin、糖原合成酶激酶-3β(GSK-3β)与结肠腺瘤息肉蛋白(APC)形成大分子复合物,通过影响β-catenin 水平对Wnt 通路进行负性调节。GSK-3β 和APC 与Axin 结合后促进β-catenin磷酸化,从复合物脱离并降解,GSK-3β 也可以磷酸化APC,暴露APC 上的β-catenin 结合位点,使APC 与β-catenin 亲和力增加,更加有利于β-catenin 降解,以此负性调节Wnt 信号通路,抑制Wnt/β-catenin 促细胞增殖作用。正常情况下,Wnt/β-catenin 信号通路的正性与负性调控处于动态平衡,保证ISC 的生理性增殖,从而维持肠黏膜的正常结构。如负性调控通路中某些基因突变或缺失,β-catenin 堆积,将导致Wnt 信号通路过度激活,使ISC 增长失控,形成肠道肿瘤。因此,调控Wnt 信号通路为研究肠黏膜损伤修复与肠道肿瘤靶向治疗的关键点。
三、PGE2 促进损伤肠黏膜修复及其机制
完整的肠黏膜屏障保证机体消化道功能处于正常状态。在慢性炎症、药物、辐射以及微生物入侵等各种刺激下,肠黏膜遭到破坏,导致肠黏膜表面溃疡形成等病理变化,肠黏膜屏障的保护功能受到削弱,使机体产生腹泻和便血等消化道症状。因此,缓解此类临床症状的关键在于促进损伤肠黏膜的修复。
Hanson 等(1983 年)就证实了PGE可以促进照射损伤后的肠上皮增殖,但由于当时实验条件限制,PGE促进肠上皮增殖的具体机制并不清楚。近年来,随着科技的进步及实验技术的提高,对PGE促进损伤肠黏膜修复的研究有了很大进展。由于炎症性肠病(IBD)与放射、化学治疗导致的胃肠道综合征(RIGS)在临床中极为常见,因此在相关实验中,以药物诱导的肠道炎症及放射治疗诱导的肠黏膜损伤模型最为常见。
在既往研究中,Singer 等(1998 年)发现IBD患者肠组织内COX-2 和PGE水平明显升高,PGE作为一种炎症介质,参与IBD 炎症反应。因此临床多采用NSAID 来抑制COX,减少PGE产生,缓解肠道炎症。临床中发现,长期使用NSAID 胃肠道会出现溃疡和出血等不良反应,导致IBD 迁延不愈甚至病情恶化。近些年,人们对NSAID 导致肠黏膜损伤的机制进行了研究,发现NSAID 对肠黏膜的破坏与其抑制PGE产生有关。Lai 等(2015 年)在实验中发现用瑞巴匹特和阿司匹林共同处理小鼠后,阿司匹林导致的小肠损伤明显减轻,瑞巴匹特保护肠黏膜的这种作用与其诱导肠细胞内COX-2 表达和PGE产生有关。有研究显示PGE通过肠黏膜上皮的EP4 抑制上皮坏死性凋亡并诱导结肠炎的消退。另外,在其他方式导致的小鼠实验性肠炎实验中,Hang 等(2015 年)、Chen 等(2015 年)发现,抑制PGE降解酶减少PGE代谢或使用药物促进PGE产生后,肠道炎症及黏膜损伤得到缓解;在稳态条件下,PGE信号通路对ISC 增殖至关重要(如Lgr5干细胞),并诱导干细胞向肠细胞分化。以上研究均表明,PGE除作为炎症因子参与肠道炎症反应外,还能够促进损伤的肠道黏膜修复,其可能机制为PGE与其EP 受体结合激活Wnt/β-catenin 信号通路,促进肠隐窝内TA 与ISC 增殖分化,从而减少上皮细胞凋亡,修复黏膜损伤。此机制的发现,为IBD的治疗提供了新的药物研究方向。
放射治疗对机体造成的损伤复杂多样,其中辐射诱导的RIGS 是临床放射治疗最常见的不良反应,由于放射治疗对机体的损伤机制还不清楚,因此目前仍缺乏有效缓解RIGS 的药物。近些年,电离辐射(IR)导致肠黏膜损伤的研究有了明显进展。目前的研究认为,IR 导致ISC(尤其是Lgr5ISC)的凋亡是RIGS 的始发因素。笔者之前的研究表明外源性PGE促进化学治疗所致的肠损伤的恢复。这是通过16, 16-二甲基前列腺素E(dmPGE)治疗促进ISC 的增殖和分化实现的。Shao 等(2008 年)、Elizabeth 等(2012 年)以及Parthasarathy 等(2016 年)发现,照射会诱导小鼠体内PGE含量升高,而升高的PGE增加了隐窝内增殖细胞数量与促进了肠黏膜的修复;有研究报道外源性脂肪来源的间充质干细胞(MSC)对肠道的放射损伤也有治疗作用,其通过激活 COX-2-PGE信号轴进行修复。Chen 等(2015 年)发现,用PGE类似物dmPGE处理照射后的小鼠,发现肠隐窝内增殖期细胞增多,照射诱导的肠道细胞凋亡缓解;用缩宫素处理照射小鼠后,小鼠存活率升高,肠道细胞凋亡率下降,且缩宫素的这种作用与其促进COX-2 的表达与PGE生成有关。PGE可以通过激活Wnt/β-catenin 信号通路促进损伤肠黏膜修复。Miyoshi 等(2017 年)在对结肠镜检导致小鼠肠黏膜损伤的模型中也得以验证。以上研究提示,PGE可以缓解辐射导致的肠黏膜损伤,其机制与其促进炎症损伤肠黏膜修复机制相似,PGE通过与其EP 受体结合,激活Wnt/β-catenin 信号通路,使隐窝内处于增殖期的TA 与ISC 增多,从而促进上皮细胞更新,修复损伤黏膜。由于导致IRGS 的因素主要为IR 导致Lgr5ISC损伤与凋亡,那么PGE修复IRGS 的机制是否与Lgr5ISC 直接相关?通过查阅以上文献采用的研究方法,笔者发现上述实验是用5-溴脱氧尿嘧啶核苷(BrdU)或增殖细胞核抗原(PCNA)标记增殖细胞的方式判定PGE对增殖细胞的作用,以及提取肠组织或肠隐窝中的相关蛋白或RNA 来探究其作用机制,然而这种方法并不能直接证明PGE是通过作用于Lgr5ISC 而发挥肠黏膜损伤的修复作用。因此,ISC 是否表达EP 受体?ISC 表达哪类EP 受体?PGE是否直接结合ISC 表面EP 受体来促进肠黏膜修复?这些问题值得深入探索。
四、PGE2/Wnt 通路和ISC 靶向治疗现况与前景
PGE作为炎症因子与促细胞增殖物质,在肠黏膜损伤的修复中起着双刃剑的作用。一方面,抑制PGE产生,有助于减轻炎症,而过度或长期减少PGE产生,将削弱PGE促进ISC 增殖的作用,影响肠黏膜更新,破坏肠黏膜完整性。另一方面,在克罗恩病患者来源的小肠中,TNF-α 导致 Lgr5干细胞功能障碍,外源性 PGE治疗恢复了 Lgr5干细胞的功能,而PGE大量产生,将使Wnt 通路过度激活,导致ISC 增殖失控,如PGE/Wnt 通路中关键基因PlA2g2a(编码PLA2)、APC(编码APC)等发生突变,将促使ISC 转化为肿瘤干细胞,导致肠道肿瘤的发生。且对于某些可以使体内PGE升高的肿瘤,如宫颈癌的放射性治疗中,过度使用PGE缓解RIGS,将降低该类肿瘤放射治疗的敏感性,削弱放射治疗疗效。因此,探究PGE最佳给药剂量、时间及Wnt 信号通路最佳激活程度,对于修复损伤肠黏膜及最大化减少其带来的不良反应尤为重要。
干细胞治疗一直是近年来研究的热点,MSC具有多向分化能力和免疫调节功能,对于治疗IBD方面具有独特的优势。随着干细胞研究的兴起,有研究用MSC 移植的方式来治疗实验性肠炎,并发现PGE/Wnt 通路在其中发挥了重要作用,MSC以自分泌的方式分泌PGE,通过激活Wnt 信号通路促进自身增殖,以此促进肠上皮更新。ISC 移植能否成为新的干细胞治疗研究方向?Yui 等用腔内移植方式将ISC 移植到小鼠体内,发现被移植的ISC 能够很好地在肠上皮组织中增殖分化,参与构建正常的隐窝结构并覆盖葡聚糖硫酸钠(DSS)诱导肠炎中的溃疡损伤面,ISC 移植治疗中PGE/Wnt 通路是否在其中发挥重要作用,这为将来ISC 移植治疗的深入研究提供了重要的思路。
虽然ISC 移植治疗对于肠黏膜损伤具有直接修复作用,但也有文献指出,MSC 移植用于治疗RIGS 时,MSC 分泌的PGE可能会促进原有肿瘤生长或降低肿瘤放射治疗敏感性,因此,干细胞治疗缓解RIGS 具有一定的局限性。对此,针对Wnt 信号通路的分子靶向治疗已成为近年的研究热点。Zhou 等发现,用Wnt 激动剂R-spondin 1 和其在Lgr5ISC 上的受体Slit2 蛋白共同处理照射损伤的小鼠后,辐射诱导的ISC 凋亡明显减少,而且小鼠DSS 诱导的多发性肠腺瘤放射治疗敏感性并未下降。Bhanja 等发现,一种分子制剂BCN057可以激活Wnt /β-catenin 信号通路,促进Lgr5ISC再生,从而缓解RIGS,且人结肠癌组织与小鼠腹部皮下肿瘤放射治疗敏感性并未受到影响。以上研究提示,通过激活Wnt 信号通路的相关治疗,可以在不影响肿瘤放射化学治疗敏感性的前提下,促进ISC 增殖,缓解RIGS。但相关实验仍停留在动物实验或体外实验阶段,要使其投入临床正式使用,还需要大量动物及临床实验对其可行性及可能带来的不良反应进行探索。
干细胞治疗作为新兴研究方向,在肠道疾病的治疗中有着非常重要的临床意义,是未来肠道疾病防治研究的趋势。但干细胞治疗对相关实验技术要求较高,ISC 体外培养方案还不十分完善,目前很多设想还停留在细胞或动物实验阶段,临床可行性还不确定。而PGE是经FDA 批准可用于临床的药物,经过长期临床应用,人们对PGE相关作用机制及不良反应已经有了一定的认识,因此,探究PGE在修复肠黏膜损伤中的最佳给药剂量与时间有着更为实际的研究意义。
五、结 语
大量研究证明,PGE可以激活Wnt/β-catenin信号通路促进TA/ISC 增殖,从而修复各种刺激造成的肠黏膜损伤,促进肠黏膜屏障重建。因此,通过调节PGE水平及Wnt 活性,调控ISC 增殖分化,也许能预防和缓解甚至治疗肠黏膜损伤相关疾病。但还有许多未知的科学问题值得深入研究,如ISC是否表达EP 受体?表达哪些EP 受体?PGE是否直接作用ISC 表面EP 受体?PGE长时程作用于ISC 的利弊?PGE长时程应用和肠道肿瘤关系如何?PGE与ISC 表面EP 受体结合后除激活Wnt信号通路外,其他调节ISC 病理生理的信号通路(如Notch 和BMP 等)有何变化?这些问题的解决将为正确使用PGE提供依据,同时为联合其他药物改善肠黏膜损伤提供理论基础。

