榆林沙土区马铃薯根层土壤因子、微生物数量及酶活性特征
谢 奎,张 腾,李卓远,密菲瑶,李 源,张 帆,王秀康
(延安大学生命科学学院,陕西 延安 716000)
马铃薯(SolanumtuberosumL.)属茄科,一年生草本植物,是全球第四大重要的粮食作物,仅次于小麦、稻谷和玉米[1]。马铃薯是比小麦、水稻、玉米能获得更多的碳水化合物、蛋白质、纤维素、胡萝卜素、抗坏血酸等营养物质,且具有很大增产潜力的高产作物。其本身含有丰富的矿质元素,每100 g马铃薯中含Ca 11~60 mg,P 15~68 mg,Fe 0.4~4.8 mg, 硫胺素0.03~0.07 mg, 核黄素0.03~0.11 mg, 尼克酸0.4~1.1 mg[2],通过食用马铃薯来补充人体所需营养成为更多人的选择[3]。马铃薯除了食用之外,还可广泛用于化工、医药、动物饲料和生物燃料等领域[4-5]。中国是马铃薯生产第一大国,全球马铃薯产量的23%都来自中国,对保障粮食安全、贫困地区脱贫增收及振兴地区经济而言,保障马铃薯产业的发展有着十分重要的现实意义[6]。
植物的生长与土壤质量密切相关,根际微生物是土壤的重要成分,参与了根际微系统的许多生物化学反应,对土壤中的肥力演变、有机质分解、养分的分解、循环和转化起到了关键性作用[7]。良好的土壤环境是作物生长发育的重要条件,土壤pH值、有机质、氮磷钾等土壤因子和土壤微生物是评价土壤质量的重要指标。Velasquez等[8]研究发现,长期施肥可降低土壤微生物数量,这可能与土壤肥料残余量有关。谭周进等[9]研究表明,植物会将5%~20%的光合作用产物释放到土壤中,用于建立植物与微生物的相互作用,这些相互作用可以增加植物对矿质养分的利用率或促进植物激素的产生。Turner等[10]研究发现,微生物通过固氮及溶磷、解钾等作用可有效改善土壤中的养分条件,有利于植物的生长。谭雪莲等[11]研究表明,土壤中细菌和放线菌数量随马铃薯连作年限的增加呈下降趋势,真菌呈上升趋势。王桂红等[12]研究发现,玉米和牧草典型种植模式下,随着土层加深土壤微生物量呈下降趋势。土壤酶活性是土壤中生物活性的综合指标,反映了土壤酶催化物质转化的能力,能够反映土壤养分转化及土壤环境变化状况[13]。王丽红等[14]研究发现,马铃薯轮作时,土壤过氧化氢酶活性有增加的趋势,蔗糖酶活性提高,且在马铃薯成熟期提高幅度最大。Baldrian等[15]研究发现,土壤有机碳可以作为酶的载体,较高有机碳可以促进土壤中微生物的活动和酶的合成。Feng等[16]研究发现,在土壤垂直方向上,土壤酶活性普遍随着土壤深度的增加而降低,在有机质含量高、根系多、土壤微生物及动物活跃的土层,土壤酶活性高,而在有机质含量低、根系少、微生物及动物少的土层,土壤酶活性低。Sardans等[17]研究表明,当土壤湿度降低21%,脲酶活性降低10%~67%。综上表明,土壤微生物和土壤酶在植物生长过程中发挥着重要的作用,土壤水分、pH值、氮磷钾、有机质等土壤因子和土壤微生物、土壤酶密切相关,它们共同作用、相互影响[18],共同促进了植物的生长。因此,探明马铃薯根层土壤因子、微生物分布、土壤酶活性特征意义重大。
目前,对马铃薯土壤微生物生态结构的研究已有一些报道,但多集中在不同种植方式、施肥等对微生物的影响,而我国沙土区马铃薯根层土壤因子与微生物数量以及酶活性特征相关研究还未见报道。本研究以榆林沙土区16个马铃薯品种为研究对象,揭示马铃薯土壤因子、土壤微生物数量、土壤酶活性的变化特征,并分析土壤因子、土壤微生物、土壤酶活性、块茎产量与品质的相关性,为优化马铃薯田间管理和优良种质资源开发提供科学的理论指导。
1 材料与方法
1.1 试验区概况
试验在陕西省榆林市现代农业科技示范园马铃薯试验站进行,试验站位于东经109°45′30″,北纬38°22′37″,海拔高度1 100 m,试验地所在区域属干旱半干旱大陆性季风气候,全年降水集中在6、7、8月份,年平均降水量400 mm,蒸发量1 900 mm,年日照时数2 900 h,年均气温8.6℃。试验区土壤为沙质土壤,土壤pH值为8,土壤容重为1.38 g·cm-3,土壤有机质含量为3.46 g·kg-1,土壤碱解氮含量为14.32 mg·kg-1,土壤铵态氮含量为5.8 mg·kg-1,土壤硝态氮含量为2.1 mg·kg-1,土壤有效磷含量为6.2 mg·kg-1,土壤速效钾含量为67.4 mg·kg-1。
1.2 试验设计
试验材料为16个马铃薯品种,分别为1014(T1)、沙杂15号(T2)、青薯5号(T3)、丽薯6号(T4)、中薯20号(T5)、希森6号(T6)、陇薯3号(T7)、华颂11号(T8)、庄薯3号(T9)、华颂7号(T10)、中薯10号(T10)、华颂33号(T12)、华颂35号(T13)、陇薯10号(T14)、Shepody(T15)、华颂34号(T16),马铃薯于2020年4月28日种植,9月20日收获。
田间马铃薯滴灌施肥设备采用液压比例施肥泵装置控制,设备主要由水源 、水泵、比例施肥泵和输配水管道系统等组成,滴灌施肥时将肥料溶于水中,通过施肥罐进行施肥。根据当地经验选用滴灌所用肥料,分别选用尿素、磷酸二铵和硝酸钾混合配比施用,含量为N 46.4%;N 18%、P2O546%;N 13.5%、K2O 18%。施肥采用同一施肥水平滴管,根据当地推荐施肥水平设N-P2O5-K2O为200-80-300 kg·hm-2。根据马铃薯生长特性,在苗期、块茎形成期、块茎膨大期、淀粉积累期和成熟期施肥量分别为0%、20%、50%、30%和0%。
本试验统一使用机械起垄种植,每小区2垄,小区长20 m,宽1.8 m,垄底宽90 cm,株距25 cm,种植密度为45 000株·hm-2。各处理土壤状况、种植密度、施肥水平、田间管理均相同。播种时用70%乙醇消毒过的刀切开马铃薯块茎,每块留2~4个芽眼,种植深度8~10 cm,植株成熟后统一收获。
1.3 样品采集和测定
1.3.1 块茎产量和品质 马铃薯于2020年9月20日采样,每个品种随机选取5株,称量块茎重量后计算产量。选择各处理中无病害的块茎,部分样品用于测定鲜样指标,部分样品杀青烘干至恒重后打粉,过筛待用。块茎淀粉含量采用蒽酮法测定,可溶性总糖含量采用蔥酮比色法测定,粗蛋白质含量采用考马斯亮蓝G-250染色法测定,维生素C含量采用钼蓝比色法测定。
1.3.2 土壤理化性质 收获马铃薯块茎当天采取土壤样品,每个马铃薯种植区中随机选取5个点,取6个深度土样,每个深度为10 cm,采土深度为0~60 cm,样品阴干,过筛后待用。土壤pH值采用雷磁PHB-4便携式pH计测定,碱解氮采用碱解扩散法测定,速效磷采用NaHCO3浸提钼锑抗比色法,速效钾采用NH4OAc浸提火焰光度法测定,有机质含量采用重铬酸钾-硫酸外加热法测定[19]。
1.3.3 土壤酶及微生物 土壤过氧化氢酶活性采用高锰酸钾滴定法测定;土壤蔗糖酶活性采用3-5-二硝基水杨酸比色法测定; 脲酶活性采用苯酚钠比色法测定[20]。
土壤微生物数量的测定采用稀释涂布平板计数法。细菌数量采用牛肉膏蛋白胨琼脂培养基; 真菌数量采用马丁-孟加拉红琼脂培养基; 放线菌数量采用高氏一号琼脂培养基。接种后,用无菌涂布器均匀涂布,细菌培养皿于37℃恒温培养箱倒置培养 2~3 d后进行计数,真菌培养皿于28℃恒温培养箱倒置培养3~4 d进行计数,放线菌培养皿于28℃恒温培养箱倒置培养5~7 d后进行计数并计算结果[20]。
1.4 数据统计与分析
使用Excel软件进行数据整理,用SPSS 25.0、Canoco 5软件进行分析处理,用Origin 2021进行图像绘制。
2 结果与分析
2.1 马铃薯根层土壤酶活性特征
马铃薯土壤酶活性在0~20、20~40 cm和40~60 cm土层分布特征如表1~3所示。过氧化氢酶活性随着土壤深度的增加呈现降低的趋势(表1),0~20、20~40、40~60 cm土层过氧化氢酶活性平均值分别为5.42、5.26、4.21 ml·g-1,0~20 cm土层比40~60 cm土层高28.74%。在0~20 cm土层,T1土壤过氧化氢酶活性最高,为6.10 ml·g-1, T14最低,为4.73 ml·g-1,T1比T14高了28.96%,差异达显著水平,T1与T2、T3无显著性差异。在20~40 cm土层,T3土壤过氧化氢酶活性最高,为6.16 ml·g-1,T1最低,为4.43 ml·g-1。在40~60 cm土层,T6土壤过氧化氢酶活性最低,其他处理无显著性差异。土壤过氧化氢含量平均值,T3最高,T5最低,T3比T5高25.83%。
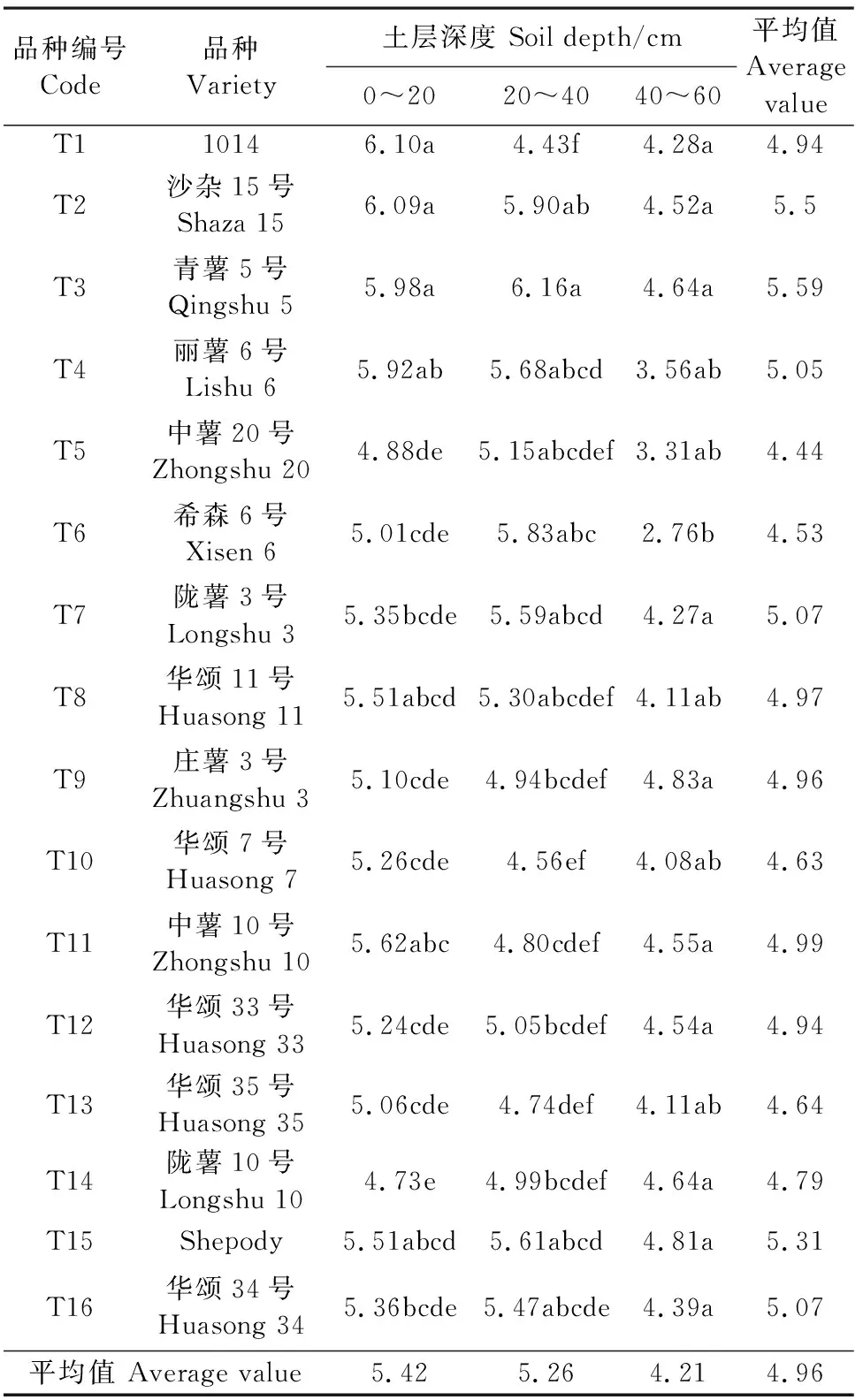
表1 马铃薯根层土壤H2O2酶活性/(ml·g-1)Table 1 H2O2 enzyme activity in potato root layer
脲酶活性随着土壤深度的增加呈现降低的趋势(表2),0~20 cm土层脲酶活性平均值为0.89 mg·g-1·24h-1,20~40 cm土层为0.78 mg·g-1·24h-1,40~60 cm土层为0.33 mg·g-1·24h-1,0~20 cm土层比20~40、40~60 cm土层分别高14.10%、169.70%。在0~20 cm土层,T4土壤脲酶活性最高,为1.13 mg·g-1·24h-1,T13最低,为0.63 mg·g-1·24h-1,T1比T13高79.37%,T1和T13土壤脲酶具有显著性差异。在20~40 cm土层,T14土壤脲酶活性最高,为1.40 mg·g-1·24h-1,T13最低,为0.52 ml·g-1。在40~60 cm土层,T6土壤脲酶活性最低,其他处理无显著性差异。在0~60 cm土层,T14脲酶活性最高,比T13高89.90%。

表2 马铃薯根层土壤脲酶活性/(mg·g-1·24h-1)Table 2 Urease activity in potato root layer
蔗糖酶活性随着土壤深度的增加呈现先增加后降低的趋势(表3),0~20 cm土层脲酶活性平均值为5.61 mg·g-1·24h-1,20~40 cm土层为6.86 mg·g-1·24h-1,40~60 cm土层为4.30 mg·g-1·24h-1,0~20、20~40 cm土层比40~60 cm土层分别高30.47%、59.53%。在0~20 cm土层,T10土壤蔗糖酶活性最高,为12.40 mg·g-1·24h-1,其次为T4,T7最低,为3.51 mg·g-1·24h-1,T10比T7高253.28%,T10和T7具有显著性差异。在20~40 cm土层,T4土壤蔗糖酶活性最高(12.26 mg·g-1·24h-1),其次为T2、T7、T10,T15和T11含量较低,与T2、T7和T10具有显著性差异。在40~60 cm土层,T2土壤蔗糖酶活性最高,为7.15 mg·g-1·24h-1,其次为T6、T4,T14最低,为1.33 mg·g-1·24h-1。在0~60 cm土层中,T10蔗糖酶活性最高,比T11高218.30%。
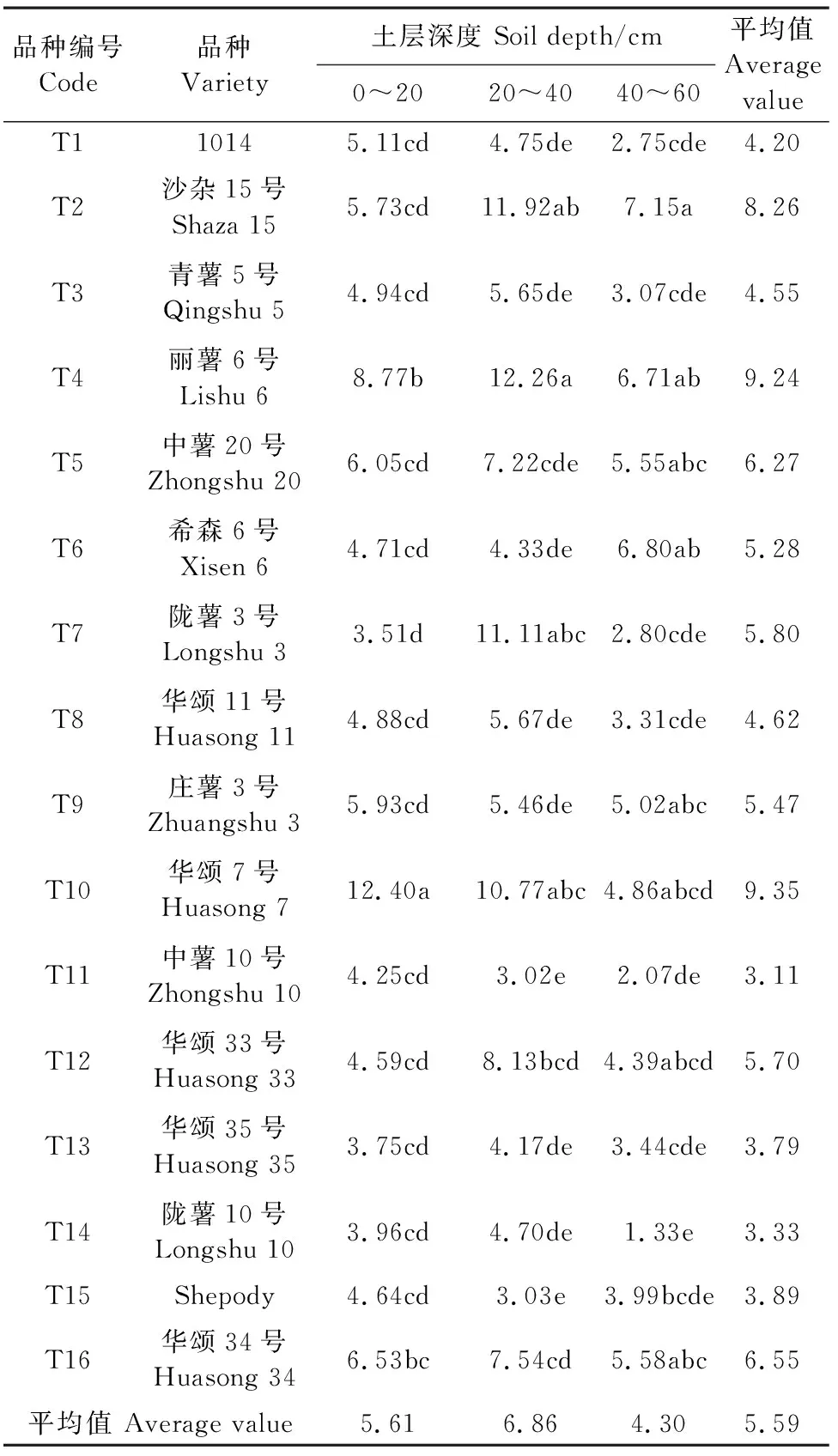
表3 马铃薯根层土壤蔗糖酶活性/(mg·g-1·24h-1)Table 3 Invertase activity in potato root layer
2.2 马铃薯根层土壤微生物数量特征
由图1可知, 0~20 cm和20~40 cm土层土壤中细菌、真菌和放线菌数量具有差异性。随着土壤深度的增加土壤细菌、真菌和放线菌数量呈现减少的趋势,0~20 cm土层土壤中细菌、真菌、放线菌的数量分别为107.23×104cfu·g-1、23.48×102cfu·g-1、6.31×104cfu·g-1,20~40 cm土层分别为49.02×104cfu·g-1、11.69×102cfu·g-1、3.80×104cfu·g-1,土壤中细菌、真菌、放线菌的数量0~20 cm土层比20~40 cm土层分别高29.89%、100.85%、66.05%。由表4可知,在土壤细菌、真菌和放线菌中,土壤细菌的数量占据绝对优势,真菌和放线菌数量相对较少,细菌数量占微生物总数的83.11%~97.28% ,其次是放线菌,占微生物总量的2.49%以上,真菌在三类微生物中占比最少,占比为0.13%~0.44%。微生物总数最多的是T11,其次是T6,最少的为T14。
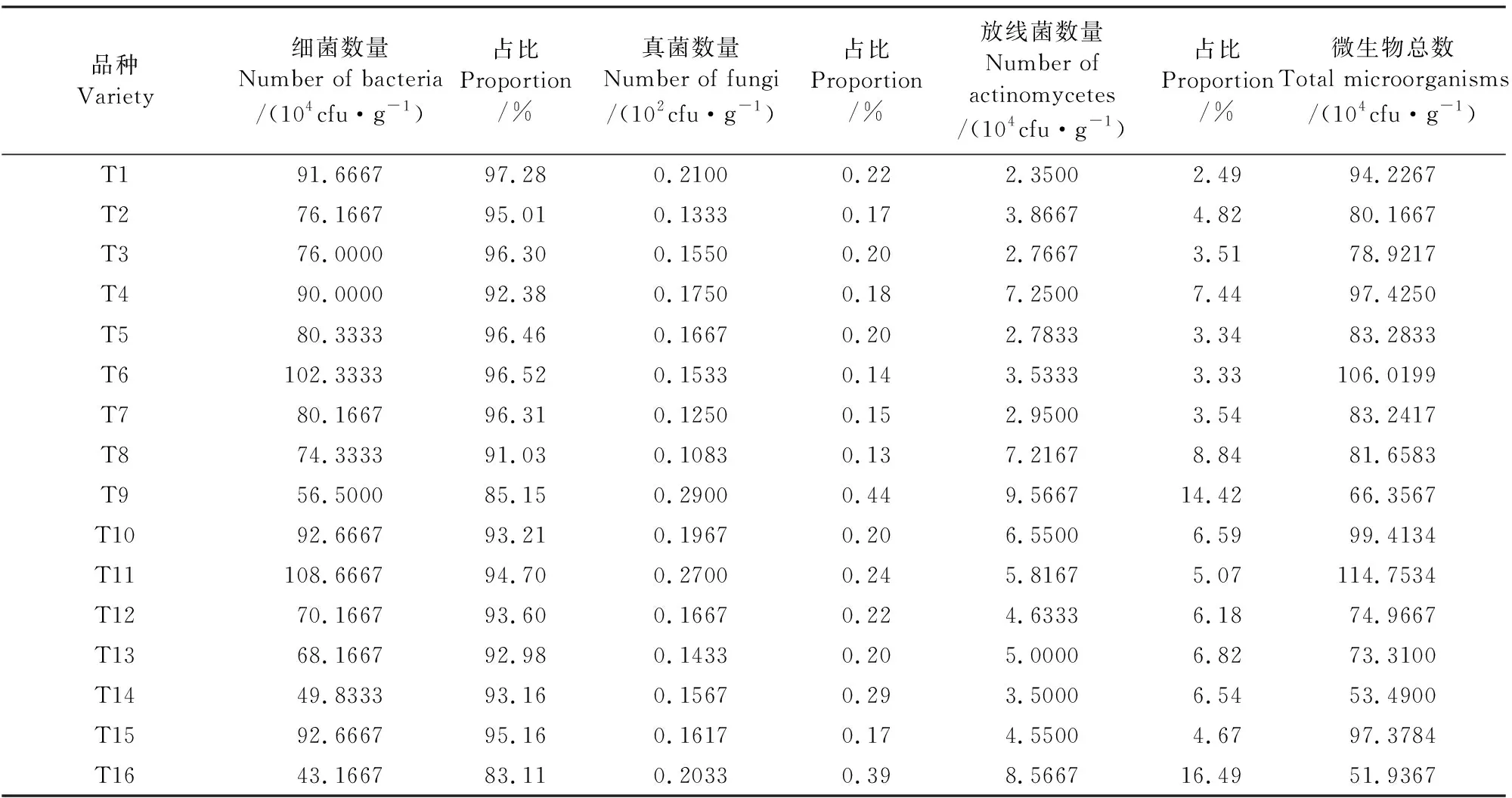
表4 马铃薯根层0~40 cm土层土壤微生物数量Table 4 Number of soil microorganisms in potato root layer 0~40 cm soil
由图1(A)可知,在0~20 cm土层,T11、T4、T5土壤中细菌数量平均值较大,分别为150.33×104cfu·g-1、143.67×104cfu·g-1、142.67×104cfu·g-1。在20~40 cm土层,T10土壤中细菌数量平均值最大,为76.67×104cfu·g-1。在0~40 cm土层,T11土壤中细菌数量最多,在三类微生物数量中占比94.70%,其次为T6,T16土壤中细菌数量最少,T16与T11有显著性差异,T11比T16高172.83%。
由图1(B)可知,在0~20 cm土层,T11、T9、T16土壤中真菌数量较大,分别为44.67×102、40.00×102、36.00×102cfu·g-1,T7、T8较小,与T11、T9、T16具有显著性差异。在20~40 cm土层,T9土壤中真菌数量最大,为18.00×102cfu·g-1,与其他处理有显著性差异。在0~40 cm土层,T9 、T11土壤中真菌数量较多,为29.00×102cfu·g-1和27.00×102cfu·g-1, 占比分别为0.44%、0.24%,T8最少,T9 、T11比T8高167.77%、140.07%。
由图1(C)可知,在0~20 cm土层,T4、T16土壤中土壤放线菌数量较大,分别为11.73×104cfu·g-1、12.67×104cfu·g-1,其次为T9、T8,T1土壤中放线菌数量较小,为3.00×104cfu·g-1。在20~40 cm土层,T9土壤中真菌数量最大,为9.30×102cfu·g-1,T2、T3、T7较小,与其他处理有显著性差异。在0~40 cm土层,T9土壤中放线菌数量最多,为19.13×104cfu·g-1,占比为14.42%,T1、T3、T5、T7较少,与其他处理有显著性差异。
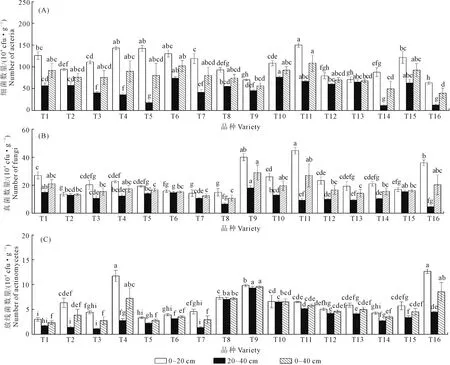
图1 马铃薯根层土壤微生物数量Fig.1 Number of microorganisms of soil in potato root layer
2.3 马铃薯根层土壤因子分布特征
2.3.1 土壤含水量、pH值、电导率 不同品种马铃薯根层土壤水分分布规律如图2所示。随着土壤深度的增加,土壤含水量呈现先增大后减小的趋势,在0~20 cm土层土壤含水量呈递增趋势,20~40 cm土层土壤含水量普遍较高,40~60 cm土层出现下降趋势。T7处理30~40 cm土层含水量最大,为9.48%,T4处理50~60 cm土层含水量最小,为2.16%。

图2 马铃薯根层土壤含水量Fig.2 Soil water content in potato root layer
T13土壤含水量平均值最高,其次是T7、T13,T4土壤含水量平均值最低。马铃薯土壤含水量平均值在0~20 cm土层为5.46%,20~40 cm土层为7.01%,在40~60 cm土层为5.93%,20~40 cm土层比0~20 cm土层高28.39%,20~40 cm土层比40~60 cm土层高18.21%。
不同品种马铃薯根层pH值分布规律如表5所示。随土层深度的增加土壤pH值呈现先减小后增加的趋势,0~20 cm土层pH值最高,比20~40 cm土层高2.02%,比40~60 cm土层高0.12%。在0~60 cm土层,16个马铃薯品种土壤pH值在8.30~8.79范围内,T9土壤pH最高,为8.79,其次是T10、T8,T11土壤pH值相对较低。
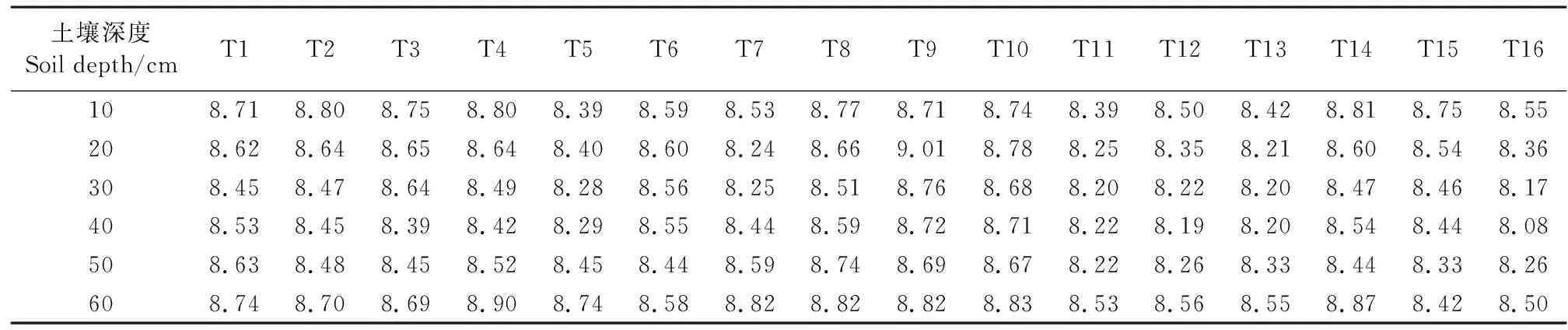
表5 马铃薯根层土壤pH值特征Table 5 Characteristics of soil pH value in potato root layer
不同品种马铃薯根层土壤电导率分布规律如表6所示。随土层深度的增加土壤电导率值呈现先增大后减小的趋势, 20~40 cm土层电导率比0~20、40~60 cm土层电导率分别高45.21%、40.48%。T2土壤电导率的平均值最高,T9最低,T2比T9高93.03%。
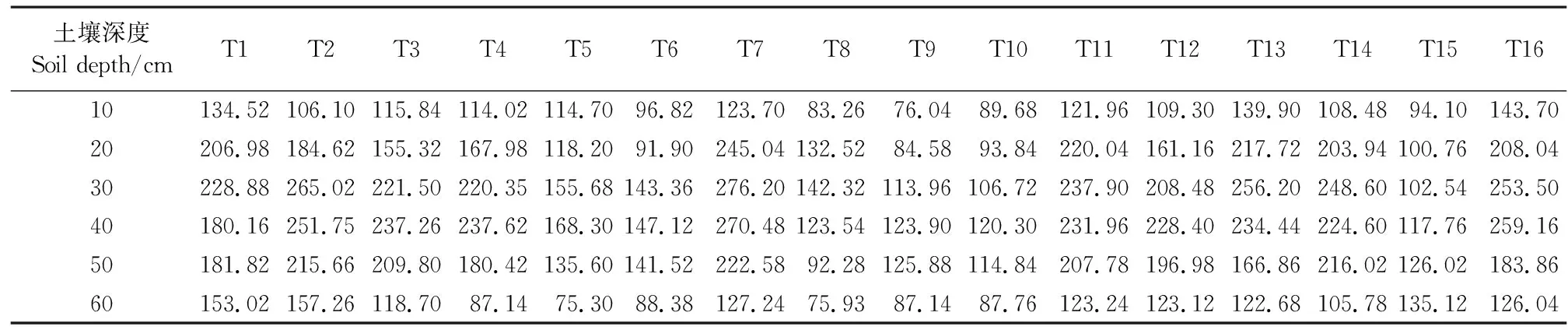
表6 马铃薯根层土壤电导率/(μS·cm-1)Table 6 Soil conductivity in potato root layer
2.3.2 土壤碱解氮、有效磷、速效钾、有机质含量 由图3A可知, T2在0~60 cm土层碱解氮累积值最高,为90.43 mg·kg-1,T3次之,为82.83 mg·kg-1,T9最低,为49.41 mg·kg-1,T2比 T9高83.02%。土壤碱解氮含量随土壤深度的增加呈现下降趋势,土壤碱解氮主要积累于土壤0~40 cm土层,在40~60 cm土层出现最低值。0~20 cm土层碱解氮含量平均值为25.35 mg·kg-1,20~40 cm土层碱解氮含量平均值为25.24 mg·kg-1,40~60 cm土层碱解氮含量平均值为16.68 mg·kg-1,0~20 cm土层比20~40 cm土层碱解氮含量高0.43%,0~20 cm土层比40~60 cm土层碱解氮含量高51.98%。
由图3B可知,马铃薯根层土壤有效磷含量随土层深度增加而下降,0~20 cm土层有效磷含量平均值为28.85 mg·kg-1,比20~40 cm土层高50.97%,比40~60 cm土层高117.74%。T12土层有效磷含量累积值最高,其次是T14,T4、T5、T6、T7和T11累积含量较低。
由图3C可知,在0~20 cm土层中,T16速效钾含量平均值最高,为263.30 mg·kg-1,T4最低,为138.30 mg·kg-1,T16比T4高了90.38%。在20~40 cm土层中,T16速效钾含量平均值最高,为152.40 mg·kg-1,T4土层速效钾含量平均值最低,T16比T4高了68.77%。在40~60 cm土层中,T1、T15速效钾含量平均值较高,T4土层速效钾含量平均值最低。土壤速效钾含量随土壤深度的增加呈现下降趋势,0~20 cm土层速效钾含量平均值为178.93 mg·kg-1,比20~40 cm和40~60 cm土层分别高35.93%和126.15%。在0~60 cm土层中,T16土壤速效钾含量累积值最高,为490.80 mg·kg-1, T4土壤速效钾含量累积值最低,为287.50 mg·kg-1, T16比T4高70.71%。
由图3D可知,马铃薯根层土壤有机质含量随土层深度增加呈现下降趋势,0~20 cm土层有机质含量平均值为5.05 g·kg-1,20~40 cm土层有机质含量平均值为4.42 g·kg-1,40~60 cm土层有机质含量平均值为2.35 g·kg-1,0~20 cm土层比20~40、 40~60 cm土层分别高14.51%、114.89%,有机质主要集中分布在0~40 cm土层。从不同品种马铃薯来看,T9在0~60 cm土层有机质含量累积值最高,为16.30 g·kg-1,T13最低,T9比T13高90.87%。
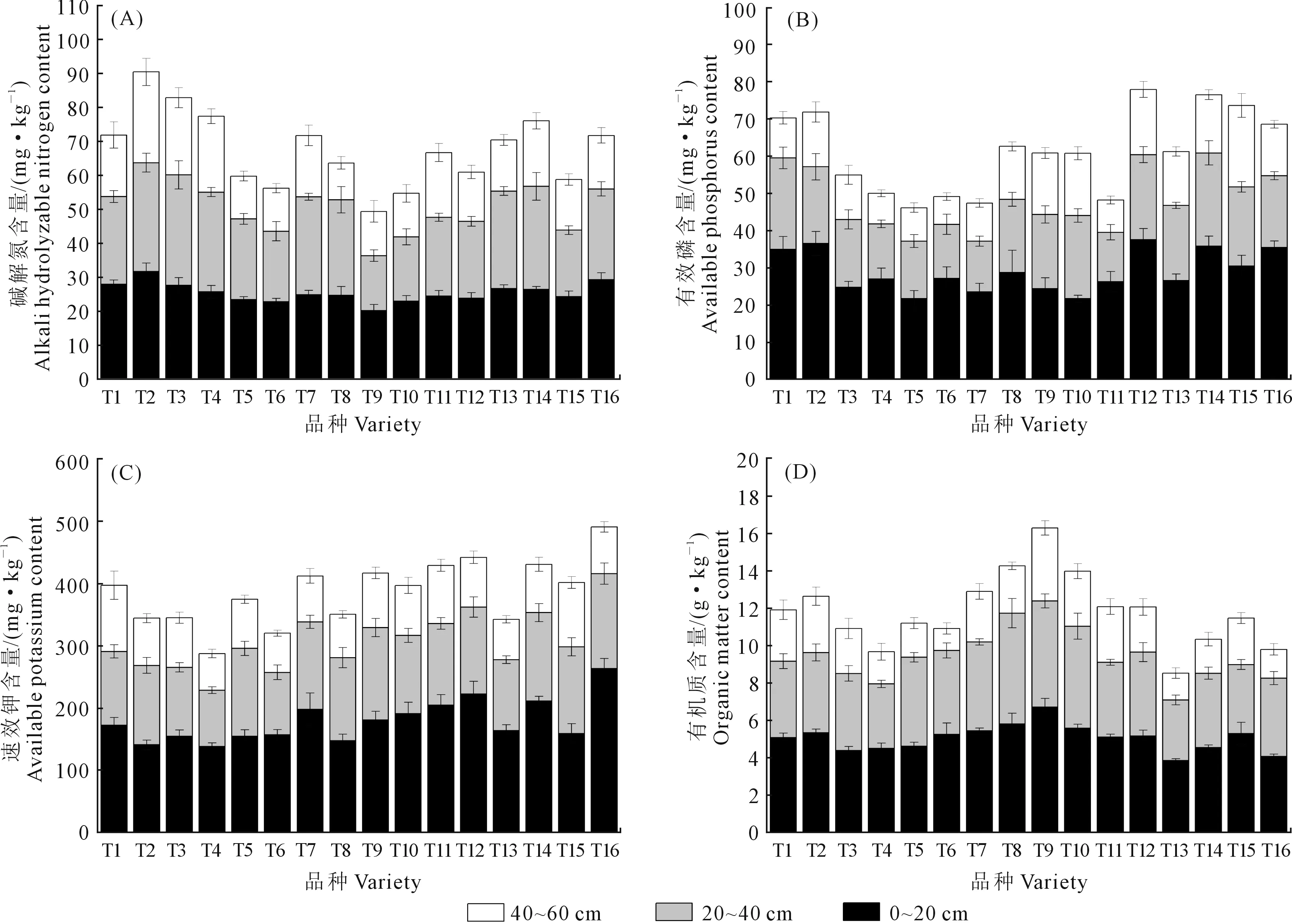
图3 马铃薯根层土壤碱解氮、有效磷、速效钾、有机质含量Fig.3 Contents of alkali hydrolyzable nitrogen, available phosphorus, available potassium and organic matter in potato root layer soil
2.4 不同品种马铃薯产量和品质差异
不同品种马铃薯块茎的产量和品质差异如图4所示。不同品种马铃薯的产量具有差异性,T5产量最高,为77.97 t·hm-2,其次是T11。T5产量比T1高333.16%,比T2、T3、 T4、 T6、 T7、T8、 T9、 T10、 T11、 T12、T13、T14、T15、T16分别高183.42%、264.68%、43.91%、11.85%、141.92%、38.05%、200.86%、70.05%、8.53%、183.42%、139.76%、95.22%、61.63%、123.54%。T1和T3产量较低,与其他处理有显著性差异。T11蛋白质含量最高,为1.36 g·100g-1,其次是T 2 、T 8 、T 9、 T15,分别为1.29、1.27、1.19、1.15 g·100g-1,T13最低,T11比 T13高277.78%。T11淀粉含量最高,为13.35%,其他马铃薯品种块茎淀粉含量在7.82%~10.14%,T11与其他品种具有显著性差异。T4 、T8、T13可溶性总糖含量较高,与其他品种有显著性差异,其中T13最高,其次为T4、T8, T13比T2高477.78%。T15维生素C含量最高,为11.54 mg·100g-1,其次是T11、T2,T4、T9含量较低, T4、T9与其他品种有显著性差异。不同品种马铃薯块茎褐变强度具有差异性,T1褐变强度最大,其次为T11,T12、T13、T16较小,T1比T11高47.35%,比T16高347.12%。
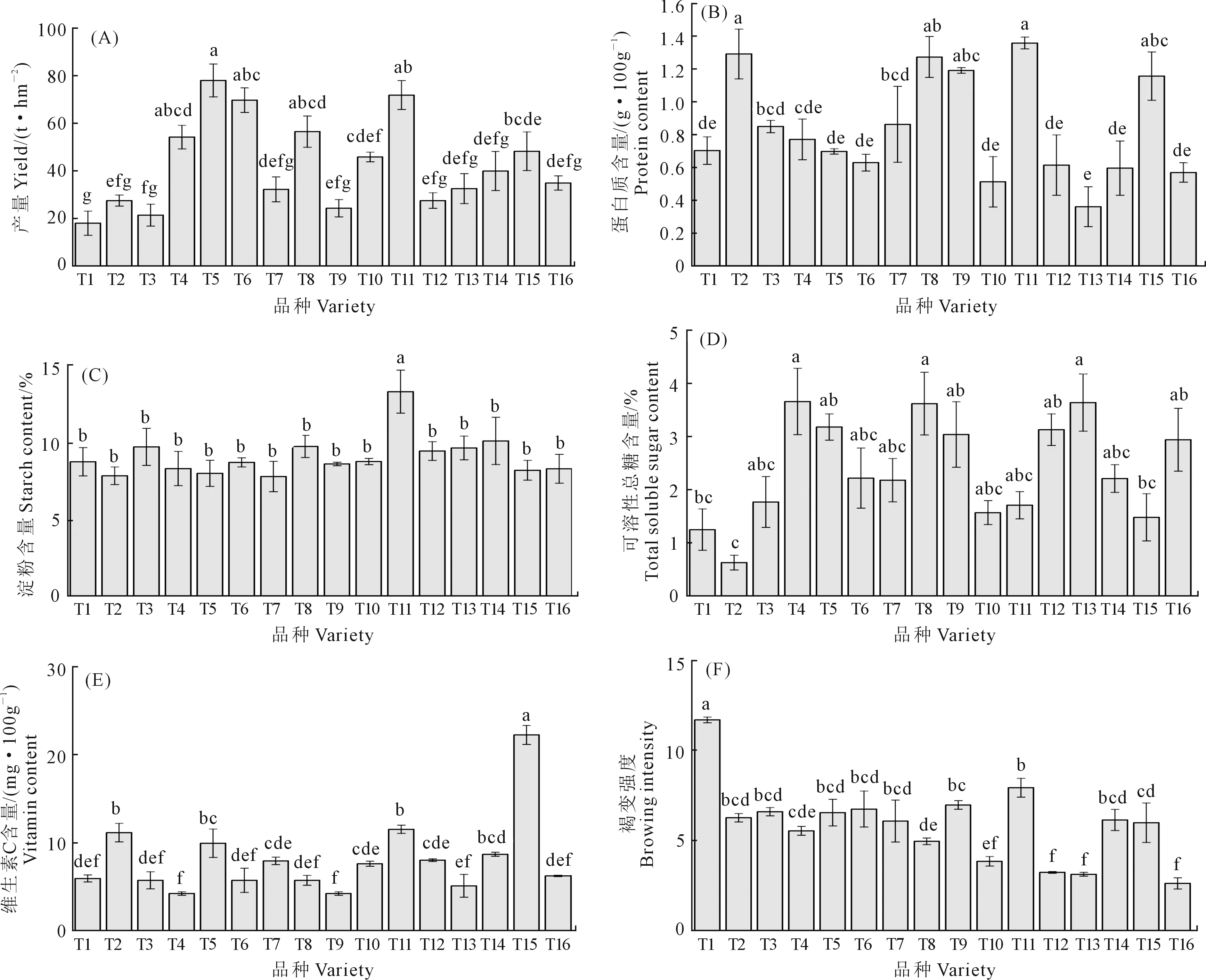
图4 马铃薯块茎产量和品质Fig.4 Potato tuber yield and quality
2.5 马铃薯根层土壤养分与土壤酶活性、微生物的关系
2.5.1 土壤酶活性、微生物数量与土壤因子相关性分析 由表7可知,马铃薯根层土壤过氧化氢酶与土壤电导率、碱解氮、有效磷、速效钾、有机质、脲酶、细菌、真菌之间呈极显著正相关(P<0.01),与土壤含水量、蔗糖酶、放线菌呈显著正相关(P<0.05)。土壤脲酶与土壤电导率、碱解氮、有效磷、速效钾、有机质、蔗糖酶、细菌、真菌之间呈极显著正相关(P<0.01)。土壤蔗糖酶与土壤碱解氮、有机质之间呈极显著正相关(P<0.01)。土壤细菌与土壤碱解氮、有效磷、速效钾、有机质、真菌、放线菌之间呈极显著正相关(P<0.01)。土壤真菌与土壤有效磷、速效钾、有机质、放线菌之间呈极显著正相关(P<0.01)。土壤放线菌与土壤有效磷、速效钾、有机质之间呈极显著正相关(P<0.01)。马铃薯块茎淀粉含量与蔗糖酶活性呈显著负相关(P<0.05)。可溶性总糖含量与放线菌数量呈显著正相关(P<0.05)。褐变强度与pH值、细菌数量呈显著正相关(P<0.05),与土壤含水量、放线菌数量呈极显著负相关(P<0.01),与蔗糖酶活性呈显著负相关(P<0.05)。块茎产量与细菌数量呈极显著正相关(P<0.01),与含水量、电导率呈极显著负相关(P<0.01)。
2.5.2 马铃薯根层土壤因子与土壤酶活性、微生物数量冗余分析 不同品种马铃薯土壤酶活性与土壤因子冗余分析结果(图5、表8、表9)表明,RDA排序的前两轴保留了土壤酶数据总方差的23.39%,共解释了土壤酶活性与土壤因子关系总方差的99.73%,碱解氮的贡献率最高,为55.0%,其次为有机质。土壤因子对土壤酶活性的影响大小为:碱解氮>有机质>有效磷>pH值>速效钾>含水量>电导率,土壤碱解氮、有机质对过氧化氢酶、脲酶影响较大,土壤电导率对土壤蔗糖酶影响较大,pH值与3种酶活性均呈负相关。土壤中碱解氮和有机质是土壤过氧化氢酶和脲酶活性变化的主要驱动因子。
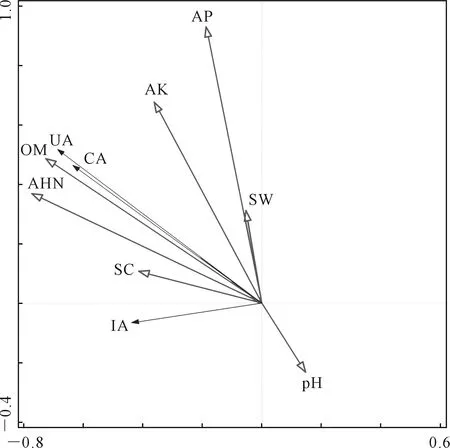
注:SW-土壤含水量,SC-土壤电导率,AHN-土壤碱解氮,AP-土壤有效磷,AK-土壤速效钾,OM-土壤有机质,CA-土壤过氧化氢酶,UA-脲酶,IA-蔗糖酶。下同。Note:SW-soil water content, SC-soil conductivity, AHN-soil alkali hydrolyzable nitrogen, AP-soil available phosphorus, AK-soil available potassium, OM-soil organic matter, CA-soil H2O2 enzyme, UA-urease, IA-invertase. The same below.图5 马铃薯根层土壤酶活性与土壤因子RDA排序Fig.5 Ranking of soil enzyme activity and soil factor RDA
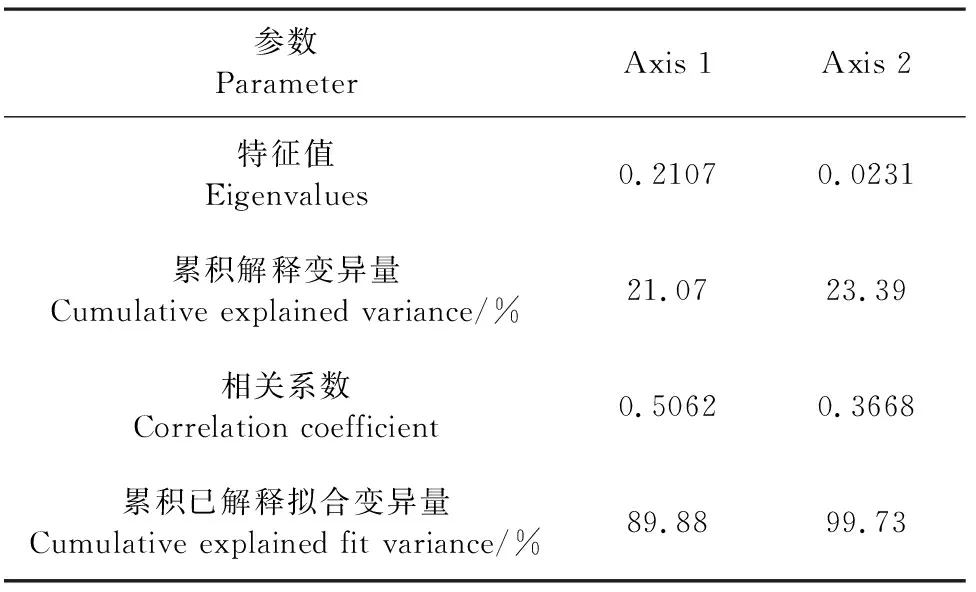
表8 马铃薯根层土壤因子与土壤酶RDA分析结果Table 8 RDA analysis results of soil factors and soil enzymes
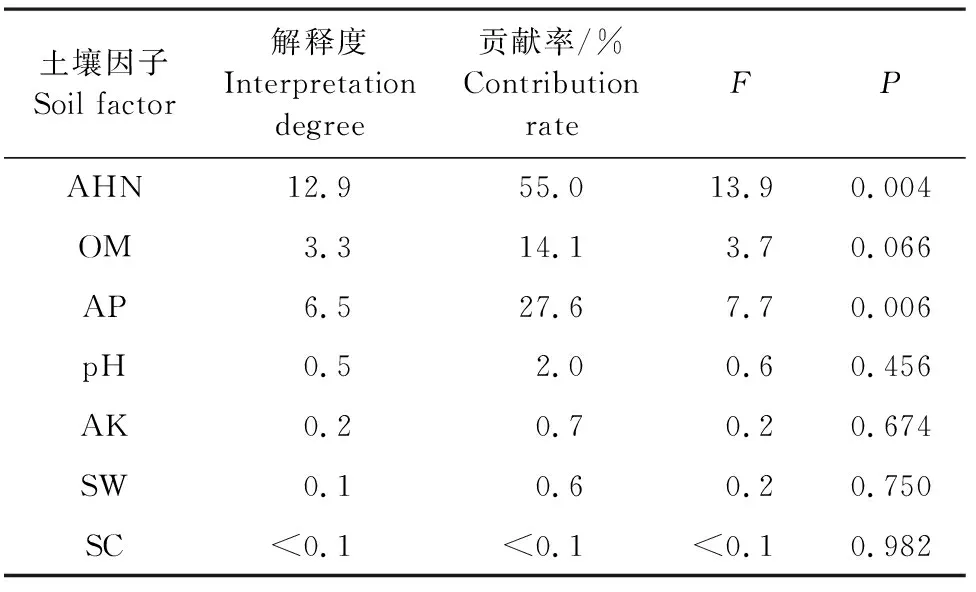
表9 马铃薯根层土壤酶相关土壤因子RDA结果Table 9 RDA results of soil enzyme related soil factors
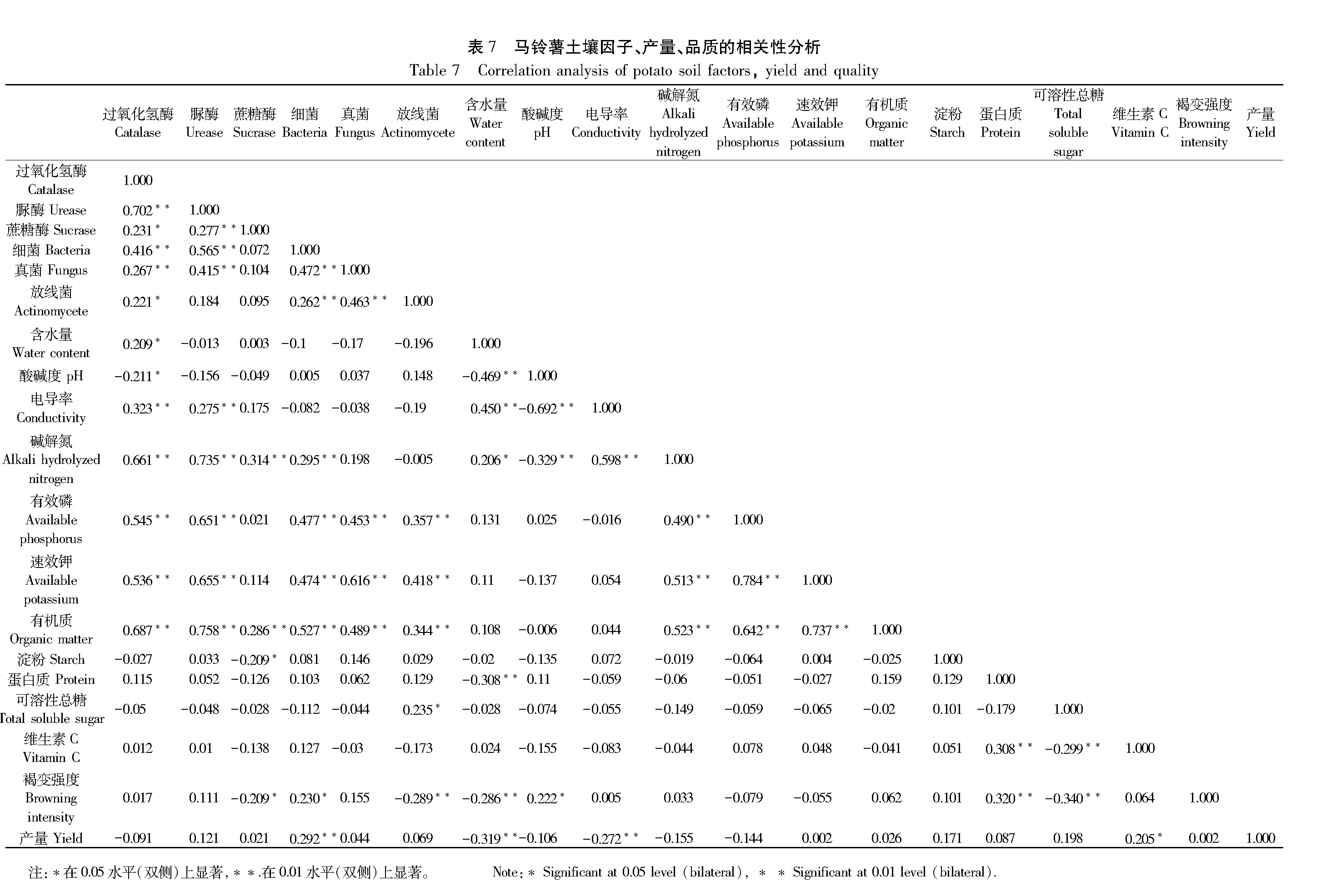
不同品种马铃薯土壤微生物数量与土壤因子冗余分析结果(图6、表10、表11)表明,RDA排序的前两轴保留了土壤微生物数据总方差的36.6%,共解释了土壤微生物数量与土壤因子关系总方差的99.94%。有机质的贡献率最高,为75.1%。土壤细菌与土壤有机质、有效磷显著相关,土壤真菌和放线菌之间呈显著相关,土壤真菌、放线菌与速效钾显著相关。土壤中有机质和有效磷是土壤细菌数量变化的主要驱动因子,速效钾是土壤真菌、放线菌数量变化的主要驱动因子。
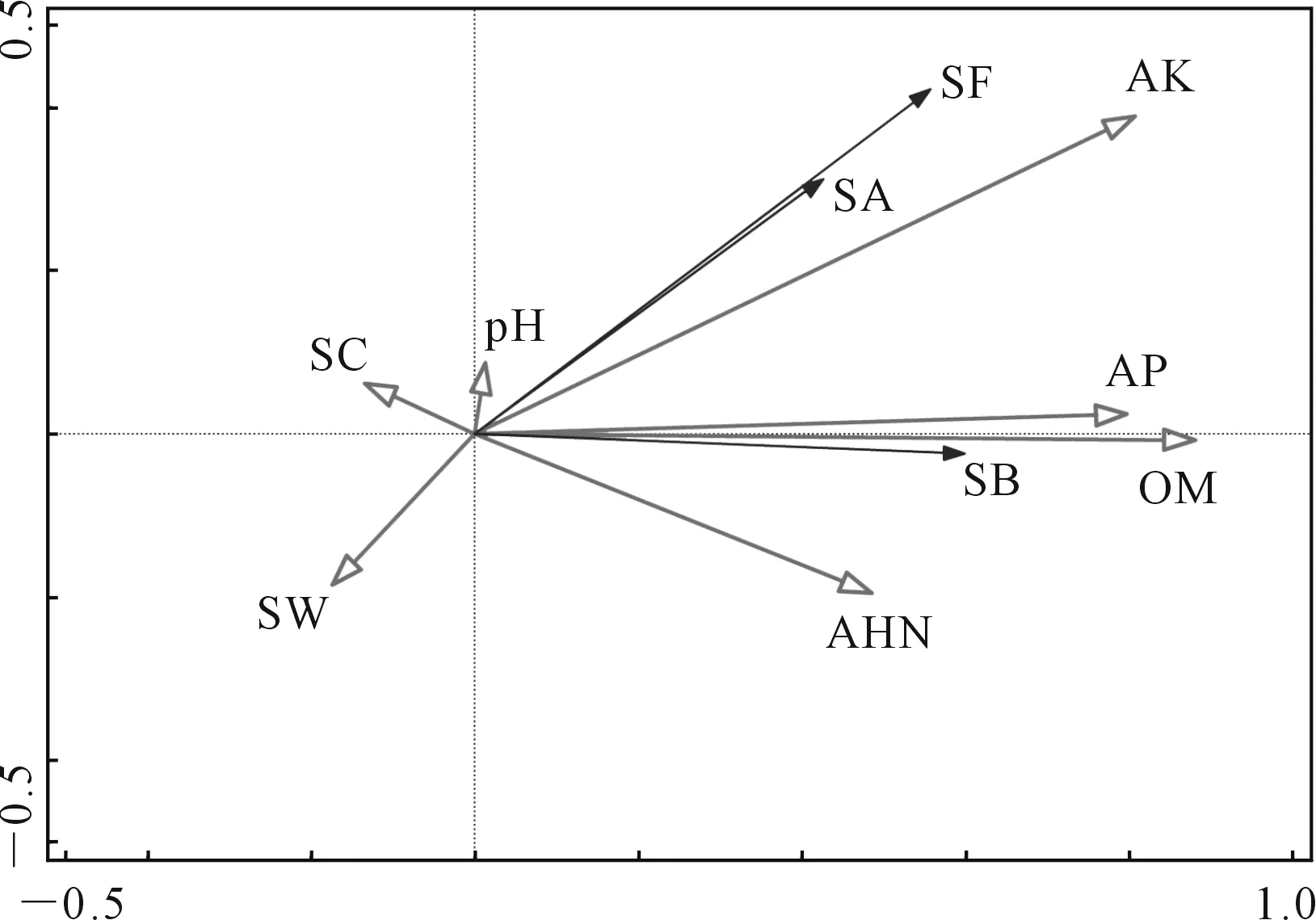
注:SB-土壤细菌, SF-土壤真菌, SA-土壤放线菌。Note: SB-soil bacteria, SF-soil fungi, SA-soil actinomycetes.图6 马铃薯根层土壤微生物数量与土壤因子RDA排序Fig.6 The number of soil microorganisms in potato root layer and the ranking of soil factors by RDA
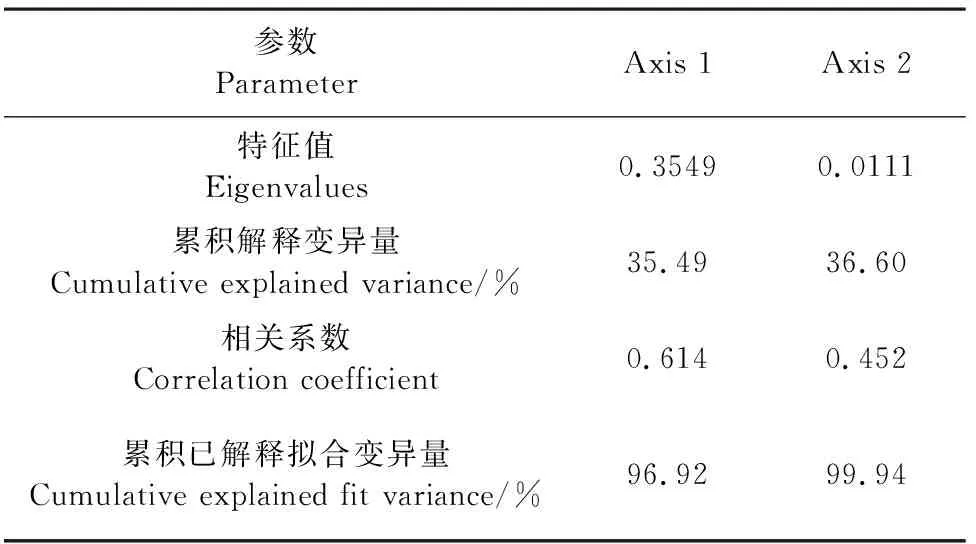
表10 马铃薯根层土壤因子与土壤微生物RDA分析结果Table 10 RDA analysis results of soil factors and soil microorganisms in potato root layer
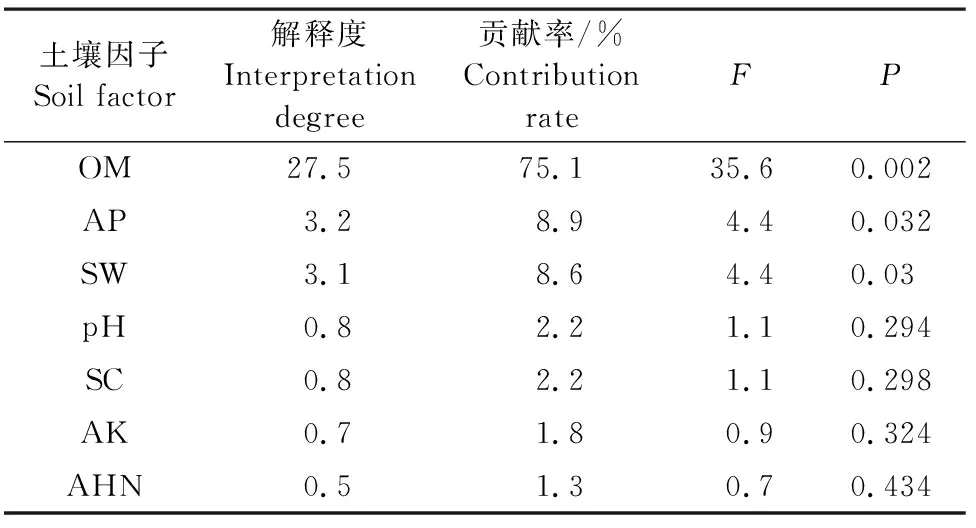
表11 马铃薯根层土壤微生物相关土壤因子RDA结果Table 11 RDA results of soil microbial related factors in potato root layer
3 讨 论
在沙质土壤中,土壤养分利用效率低,土壤理化性质、酶活性、微生物数量能够在一定程度上反映土壤质量状况,从而可以更准确地为农田管理提供参考。 有研究表明,土壤酶主要来源于土壤微生物、植物和动物,土壤酶是土壤质量的生物活性指标, 可以用来评价土壤肥力[21]。土壤酶、土壤微生物作为评价土壤肥力的指标, 比单纯通过土壤养分来评价土壤肥力更加全面和灵敏[22]。本研究表明,不同品种马铃薯土壤过氧化氢酶活性均随土壤深度的增加呈降低的趋势,与孙慧等[23]的研究结果相似,土壤脲酶活性呈下降趋势,这与温晓霞等[24]研究结果一致。本研究发现,相比0~20 cm土层,在20~40 cm土层T2 、T3、 T4、 T5 、T8、 T12、 T13 、T14 、T16土壤蔗糖酶活性均出现不同程度升高,土壤蔗糖酶活性随土壤深度的增加呈现先升高后降低的趋势,这与温晓霞等[24]的研究结果不同,这可能与不同品种马铃薯对土壤蔗糖酶的影响有关。土壤酶活性的高低,可以直接反映土壤中生物活性以及土壤化学性质的转化能力[25]。土壤中不同酶的活性与土壤的理化性质显著相关,但影响土壤酶活性的主要土壤因子却各不相同[26-27]。本研究发现,土壤过氧化氢酶、脲酶与土壤碱解氮、有效磷、速效钾、有机质均极显著相关,土壤蔗糖酶与土壤碱解氮、有机质极显著相关。
土壤氮磷钾含量、有机质含量、pH值等化学性状是评价土壤质量的重要指标,土壤微生物数量、酶活性和土壤理化指标密切相关,土壤微生物数量、酶活性对土壤氮磷钾的循环有着重要作用。细菌是土壤微生物中数量最多的一个微生物类群,参与有机质的分解,氨化作用等[28]。真菌在土壤碳素和氮素循环过程中起着巨大作用,主要参与土壤中有机质的分解、腐殖质的形成、氨化作用以及团聚体的形成等[29]。放线菌与土壤肥力以及有机质转化和植物病害防治有着密切关系[14]。本研究表明,无论马铃薯品种是否有差异,土壤细菌数量在三类微生物中占绝对优势,其次是放线菌,最后为真菌,这一结论与谭宏伟等[30]的研究结论相一致。不同品种马铃薯的三类微生物之间有显著性差异,这说明不同品种马铃薯和土壤养分共同决定了土壤微生物数量的多少。马铃薯土壤细菌、真菌的数量与过氧化氢酶、脲酶活性呈极显著相关,与土壤有机质有效磷、有效钾呈极显著相关,说明这些因素之间相互影响共同促进了马铃薯的生长[31]。马铃薯属于喜钾作物,生长发育、块茎中淀粉的积累以及光合产物的运输等都离不开钾。本研究发现,马铃薯土壤速效钾的含量与土壤过氧化氢酶、脲酶、细菌、真菌、放线菌均呈极显著相关,而榆林沙土区土壤中钾含量不足,在农业生产中,建议应考虑土壤钾素输入与输出之间的平衡。
本研究表明,马铃薯块茎产量与土壤细菌呈极显著正相关,可溶性总糖与土壤放线菌呈显著正相关,即较高的土壤细菌、土壤放线菌有利于块茎产量、可溶性总糖含量的提高,农业生产上可通过改变土壤细菌、放线菌的数量的方式来提高土壤养分,从而影响马铃薯块茎品质。本研究中,T11土壤细菌、真菌、放线菌数量相对较多,产量、淀粉、蛋白质、维生素含量也较高,是一个综合指标较好的马铃薯品种。马铃薯块茎褐变强度与土壤细菌呈正相关,其中的原因可能是土壤细菌增多,对土壤质量影响较大,影响马铃薯块茎的褐变强度,农业生产上应该综合考虑土壤细菌丰度的范围。马铃薯品质和土壤微生物、酶的关系是一个相对复杂的问题,在以后的研究中,应着重考虑马铃薯块茎元素含量与土壤养分、土壤酶、土壤微生物之间的关系。
4 结 论
从酶活性和微生物数量的来看,在0~60 cm土层中,榆林沙土区马铃薯土壤过氧化氢酶和脲酶活性随着土壤深度的增加均呈现降低的趋势,蔗糖酶活性呈现先增加后降低的趋势。在0~40 cm土层中,土壤细菌、真菌、放线菌数量随着土壤深度的增加均呈现减少的趋势,0~20 cm土层细菌、真菌、放线菌数量比20~40 cm土层高了29.89%、100.85%、66.05%。土壤过氧化氢酶活性与土壤碱解氮、有机质、有效磷、速效钾含量呈极显著正相关;土壤脲酶与土壤电导率、碱解氮、有效磷、速效钾、有机质含量呈极显著正相关;土壤蔗糖酶活性与土壤碱解氮、有机质含量呈极显著正相关;土壤细菌数量与土壤有机质、有效磷、速效钾、碱解氮含量呈极显著正相关,土壤真菌数量与速效钾、有机质、有效磷含量呈极显著正相关,放线菌数量与土壤速效钾、有机质、有效磷含量呈极显著正相关。榆林沙土区马铃薯根层土壤碱解氮、有效磷、速效钾、有机质含量随土层的加深呈下降趋势,0~20 cm土层碱解氮含量平均值为25.35 mg·kg-1,比20~40、40~60 cm土层含量高0.43%、51.98%。有效磷、速效钾含量前三的品种分别为:T16>T12>T1、T15>T9>T14。不同品种马铃薯产量、品质和土壤微生物之间存在相互关系,马铃薯块茎产量与土壤细菌呈极显著正相关,可溶性总糖与土壤放线菌呈显著正相关。

