刺梨及其活性成分对2型糖尿病小鼠糖脂代谢的影响
陈 超,谭书明,王 画,杨 笙,代晓桐
(贵州大学酿酒与食品工程学院,贵州省农畜产品贮藏与加工重点实验室,贵州 贵阳 550025)
2型糖尿病(type 2 diabetes mellitus,T2DM)是一类由于摄入过多高糖高脂食品、缺乏运动导致的胰岛素抵抗和胰岛B细胞功能缺陷的代谢性疾病。据国际糖尿病联盟报道,自2015年以来全球患糖尿病的人数已达到4.25亿,预测到2045年将达到7亿,其中我国患者已达1.1亿,居世界首位。目前一些降血糖药物可能引起不同的副作用,如二甲双胍、瑞格列奈会造成恶心、呕吐,阿卡波糖会造成胃疼等,从植物中提取天然降血糖活性成分代替人工合成同类物质,可提高安全性,降低副作用。
刺梨(Tratt)广泛分布于西南地区,其中以贵州为主,是一种蔷薇科野生植物。刺梨中含有丰富的黄酮和多糖。黄酮、多糖具有抗氧化、降血糖、降血脂等功能活性;孔晓妮等研究发现翻白草总黄酮能通过磷脂酰肌醇-3-激酶/蛋白激酶(phosphatidylinositol 3-kinase/protein kinase,PI3K/Akt)途径改善T2DM小鼠糖脂代谢紊乱和胰岛素抵抗;杨玉玲等研究发现洋甘菊总黄酮能降低T2DM小鼠血糖水平、促进胰岛素分泌、改善糖耐量异常;王生亚等研究发现青稞多糖能改善T2DM小鼠氧化应激、修复胰腺组织损伤;郎茜等研究发现杜仲叶多糖能改善T2DM大鼠胰岛素分泌不足、氧化应激并降低高血糖因子(Caspase-3、p38丝裂原活化蛋白激酶(p38 mitogen-activated protein kinase,p38 MAPK))在肝脏中表达。本课题组前期研究发现刺梨原汁对改善糖脂代谢紊乱的效果良好,但刺梨中的活性成分对糖脂代谢影响的研究鲜有涉及,故本研究进一步探讨刺梨干粉(Tratt,RRT)、刺梨总多糖提取物(Tratt olysaccharide extraction,RPS)、刺梨总黄酮提取物(Tratt flavonoid extraction,RF)对T2DM小鼠糖脂代谢的影响。
1 材料与方法
1.1 动物、材料与试剂
60 只体质量为(20±2)g的健康雄性昆明小鼠由长沙市天勤生物技术有限公司提供,生产许可证号:SCXK(湘)2019-0014。小鼠饲养在通风良好、室温(23±2)℃、相对湿度45%~65%、12 h/12 h明暗交换的环境中,自由摄食饮水。
刺梨品种为‘贵农5号’,采摘于2020年9月上旬、贮存于-80 ℃环境,实验所用刺梨均为同一型号、同一批次,购自于贵州宏财聚农投资有限公司。
链脲佐菌素(streptozotocin,STZ) 美国Sigma公司;盐酸二甲双胍(纯度97%) 上海麦克林生化科技有限公司;纤维素酶(活力>400 U/mg) 北京恒远博泰生物科技有限公司;总蛋白定量测试盒、甘油三酯(triacylglycerol,TG)测定试剂盒、总胆固醇(total cholesterol,TC)测定试剂盒、高密度脂蛋白胆固醇(high-density lipoprotein cholesterol,HDL-C)测定试剂盒、低密度脂蛋白胆固醇(low-density lipoprotein cholesterol,LDL-C)测定试剂盒、丙二醛(malondialdehyde,MDA)测定试剂盒、超氧化物歧化酶(superoxide dismutase,SOD)测定试剂盒、过氧化氢酶(catalase,CAT)测定试剂盒 南京建成生物科技有限公司;肝糖原测定试剂盒、葡萄糖激酶(glucokinase,GK)酶联免疫试剂盒、过氧化物酶体增殖物激活受体-γ(peroxisome proliferators-activated receptor-γ,PPAR-γ)酶联免疫试剂盒 上海侨杜生物科技有限公司。
1.2 仪器与设备
SpectraMax190连续波长多功能酶标仪 美国Molecular Devices公司;H1-16KR高速冷冻离心机 湖南可成仪器设备有限公司;DY89-II电动玻璃匀浆机 宁波新芝生物科技股份有限公司;YD-202组织切片机 浙江金华益迪医疗设备厂;LGJ-10真空冷冻干燥机 北京松源华兴科技发展有限公司;UV9000S紫外分光光度计上海元析仪器有限公司;RE-52AA旋转蒸发器 上海亚荣生化仪器厂;研磨仪 德国Janke & Kunkel公司;恒流泵 苏州辰傲电子科技有限公司。
1.3 方法
1.3.1 RRT、RPS、RF的制备
RRT:称取适量刺梨真空冻干72 h,高速研磨成干粉待用。
RPS:参考文献[5,20-23]的方法,取适量RRT按照料液比1∶15溶于超纯水,按RRT质量加入0.25%纤维素酶反应1 h后放入超声设备,功率300 W、温度50 ℃提取40 min,抽滤得澄清滤液,旋转蒸发干后加入无水乙醇,醇沉液置于4 ℃冰箱静置12 h后,4 ℃、8 000 r/min离心10 min,保留沉淀,沉淀加入超纯水配成6 mg/mL溶液;预处理D101大孔树脂后,称取适量大孔树脂装柱,将粗多糖水溶液按1.5 mL/min流速进样,加入超纯水洗涤至洗涤液无色为吸附完毕,加入体积分数70%乙醇溶液按照1.5 mL/min洗脱并收集洗脱液,经旋转蒸发、冻干得RPS待用。多糖标准曲线参考叶润等的方法绘制,标准曲线方程为=0.252 5+0.014 9(=0.997 1),经标准曲线方程计算得RPS中多糖质量分数为71%。
RF:参考文献[25-29]的方法,取适量RRT按照料液比1∶13溶于体积分数70%乙醇溶液中,按RRT质量加入0.25%纤维素酶反应1 h后放入超声设备,功率300 W、温度50 ℃提取40 min,抽滤得澄清滤液,滤液旋转蒸发冻干得黄酮粗提物;预处理AB-8大孔树脂,将适量大孔树脂填充到层析柱中,黄酮粗提物按照2.5 mg/mL溶于超纯水并微波5 min保证充分溶解,抽滤,滤液按1.5 mL/min流速进样,加入超纯水洗涤直至洗涤液透明无色为吸附完毕,将体积分数70%乙醇溶液按1.5 mL/min流速进样洗脱并收集洗脱液,旋转蒸发冻干得RF待用。黄酮标准曲线绘制参考周艺等的方法。经过测定,芦丁标准曲线方程为=0.183 7+0.005(=0.999 1),经标准曲线方程计算得RF中黄酮质量分数为51%。
1.3.2 动物分组与处理
动物实验经贵州大学动物实验伦理委员会批准(编号:EAE-GZU-2020-P010),符合动物实验伦理。基础饲料适应性饲喂1 周后,根据小鼠体质量随机分为空白组(=8)和高脂高糖组(=52),空白组喂普通饲料,高脂高糖组采用表1配方喂养4 周后,除空白组外,其余各组12 h禁食不禁水后注射50 mg/kgSTZ,每3 d注射1 次,注射3 次造模结束,造模期间自由饮食饮水,造模10 d后,禁食12 h剪尾采血,测定空腹血糖值(fasting blood glucose,FBG),高于11.1 mmol/L视为造模成功。造模成功后的小鼠分为5 组(=8),分别为模型组、阳性组(灌胃200 mg/kg盐酸二甲双胍)、RRT组(灌胃400 mg/kgRRT)、RPS组(灌胃200 mg/kgRPS)、RF组(灌胃200 mg/kgRF)。将盐酸二甲双胍、RRT、RPS、RF按照纯度换算成净质量,分别溶于生理盐水配制灌胃溶液,根据小鼠体质量调整灌胃剂量,每日同时间灌胃,模型组与空白组灌胃等量生理盐水。空白组给予基础饲料,其他组给予高脂高糖饲料。实验期间小鼠自由饮食饮水,每周记录进食量、饮水量和体质量,干预周期28 d。

表1 高脂高糖饲料配方Table 1 Formulation of high-fat and high-sugar diet
第29天,小鼠禁食不禁水12 h,摘眼球取血于离心管中,3 500 r/min、4 ℃离心15 min,吸取上层血清置入新离心管中转入-80 ℃冰箱中待测。小鼠脱颈处死,迅速解剖去除肝脏、肾脏、脾、白色脂肪及棕色脂肪并准确称质量;白色脂肪位于腹膜内、肠系膜上、附睾周围及皮下,呈白色。棕色脂肪位于肩胛下、主动脉周围、纵膈及颈部组织,为暗红色小颗粒。用生理盐水洗去肝脏污血并将其等切分为6 份,5 份锡纸包裹放入液氮并迅速转入-80 ℃冰箱待测,1 份装入固定液中用于病理学观察。
1.3.3 指标测定
1.3.3.1 FBG的测定
分别在灌胃结束后的第0、7、14、21、28天,禁食不禁水6 h,剪尾采血,并使用血糖仪测定空腹FBG。
1.3.3.2 口服糖耐量测定
灌胃28 d后禁食不禁水12 h,6 组小鼠均按照2.00 g/kg剂量灌胃葡萄糖溶液,剪尾取血测量0、0.5、1 h和2 h时的血糖浓度。血糖曲线下面积(area under curve,AUC)根据公式(1)计算。

式中:、、和是灌胃葡萄糖溶液后0、0.5、1 h和2 h的血糖浓度/(mmol/L)。
1.3.3.3 脏器指数的测定
脏器指数根据公式(2)计算。

式中:为小鼠脏器质量/g;为小鼠体质量/g。
1.3.3.4 理化指标测定
血清中的TC、TG、LDL-C、HDL-C及肝脏中的MDA、CAT、SOD、肝糖原、GK、PPAR-γ水平测定均按照试剂盒说明书进行。
1.3.3.5 肝脏组织切片分析
解剖摘取各组小鼠肝脏,经质量分数4%多聚甲醛溶液固定,固定状态良好后,进行修剪、脱水、包埋、切片、染色、封片制作切片,苏木精-伊红(hematoxylineosin,HE)染色,光学显微镜下放大200 倍观察肝脏组织结构,按表2五级分法进行肝脏病变程度分析,分数越高代表病变程度越高。

表2 肝脏病理观察评分标准Table 2 Scoring criteria for liver pathological observation
1.4 数据统计与分析
使用SPSS 22.0软件进行数据统计与分析,结果以平均值±标准差表示,组间分析比较用单因素方差分析,并采用Duncan法进行组间两两比较,<0.05表示差异显著。
2 结果与分析
2.1 RRT、RPS、RT对T2DM小鼠体质量、进食量、饮水量的影响
由表3可知,干预28 d后,空白组与模型组体质量差异显著(<0.05),说明T2DM导致小鼠体质量下降。经阳性药物和样品干预后,阳性组体质量与第0天接近,维持稳定,与模型组差异显著(<0.05);RRT组、RPS组体质量下降趋势相比模型组有所减缓,RF组小鼠在第28天时体质量显著高于模型组(<0.05)。结果表明,RRT、RPS、RF均能改善T2DM小鼠体质量下降现象,效果依次为RF>阳性药物>RPS>RRT。

表3 各组小鼠实验28 d期间内初体质量、末体质量及体质量变化(n=8)Table 3 Initial and final body mass of mice from each group and changes in body mass of mice over the 28-day experimental period (n = 8)
由图1可知,空白组进食量、饮水量均在正常范围;与空白组比,模型组进食量、饮水量显著增加82.6%和196.6%(<0.05)。经阳性药物和样品干预后,与模型组比,阳性组进食量、饮水量分别显著下降30.9%和44.7%(<0.05),RRT组、RPS组、RF组进食量分别显著下降10.2%、20.7%、25.8%,饮水量分别显著下降11.3%、24.2%、42.5%(<0.05)。结果说明RRT、RPS、RF均可显著改善T2DM小鼠多饮多食现象(<0.05),阳性药物、RPS和RF改善进食量效果相近,阳性药物和RF改善饮水量效果相近,总体效果依次为阳性药物>RF>RPS>RRT。

图1 各组小鼠进食量(A)和饮水量(B)的变化(n=8)Fig. 1 Changes in food (A) and water (B) intake of mice in each group (n = 8)
2.2 RRT、RPS、RF对T2DM小鼠脏器指数的影响
由表4可知,模型组肝脏指数显著高于空白组(<0.05),经阳性药物和样品干预后,与模型组相比,阳性组肝脏指数显著下降19.5%(<0.05),RRT组、RPS组、RF组肝脏指数分别显著下降15.0%、15.1%、22.0%(<0.05),说明RRT、RPS、RF均能降低肝脏指数。糖尿病肾病是糖尿病中常见的微血管并发症,肾脏指数对评价糖尿病具有一定参考价值。与空白组比,模型组肾脏指数显著上升(<0.05),经阳性药物和样品干预后,与模型组比,阳性药物组、RRT组、RPS组、RF组肾脏指数明显下降,其中RRT组、RF组与模型组差异显著(<0.05)。与空白组比,模型组脾脏指数显著上升(<0.05)。经阳性药物和样品干预后,与模型组比,阳性组、RRT组脾脏指数明显下降,RPS组、RF组脾脏指数显著下降(<0.05)。结果表明,RRT、RPS、RF能够抑制机体脏器增大;这与Gao Yue等研究糙米酚类物质对T2DM小鼠肝脏指数影响和陆敏涛等研究花椒麻素对T2DM小鼠脏器指数影响的结果相一致。

表4 各组小鼠脏器指数(n=8)Table 4 Organ indices of mice in each group (n = 8)
2.3 RRT、RPS、RF对T2DM小鼠血清TC、TG、LDL-C、HDL-C浓度的影响
由表5可知,与空白组比,模型组血清TC、TG、LDL-C水平显著升高(<0.05),HDL-C水平显著下降(<0.05),说明T2DM导致小鼠血脂代谢紊乱。经阳性药物和样品干预后,与模型组相比,阳性组TC、TG、LDL-C水平分别显著下降39.8%、28.5%、41.1%(<0.05),HDL-C水平显著增加49.7%(<0.05);RRT组、RPS组、RF组TC水平分别显著下降17.0%、21.4%、33.4%(<0.05);RRT组、RPS组TG水平分别下降21.2%、11.9%,RF组TG水平显著下降46.4%(<0.05);RRT组LDL-C水平下降14.3%,RPS组、RF组LDL-C水平分别显著下降26.8%、33.9%(<0.05);RRT组、RPS组、RF组HDL-C水平分别显著上升25.9%、51.7%、56.5%(<0.05)。结果表明,RRT、RPS、RF均能改善T2DM小鼠血脂代谢紊乱、维持血脂水平稳定,RF总体效果与阳性药物相近。

表5 各组小鼠血清相关指标变化(n=8)Table 5 Changes in serum lipid indices of mice in each group (n = 8)
2.4 RRT、RPS、RF对T2DM小鼠脂肪分化因子PPAR-γ含量和脂肪质量的影响
由图2A可知,与空白组相比,模型组小鼠PPAR-γ含量显著增加86.3%(<0.05)。经阳性药物和样品干预后,与模型组比,阳性组PPAR-γ含量显著降低31.5%(<0.05),RRT组降低12%,RPS组、RF组分别显著降低17.2%和33%(<0.05)。
由图2B可知,与空白组相比,模型组小鼠白色脂肪质量显著增加28%(<0.05)。经阳性药物和样品干预后,与模型组比,阳性组白色脂肪质量显著下降40.3%(<0.05),RRT组、RPS组分别下降2.5%、18.3%,RF组显著下降34.8%(<0.05)。与空白组比,模型组棕色脂肪质量显著降低68.1%(<0.05)。经阳性药物和样品干预后,与模型组相比,阳性组棕色脂肪质量显著增加113.1%(<0.05),RRT组增加27.84%,RPS组、RF组分别显著增加82.9%和144.3%(<0.05)。
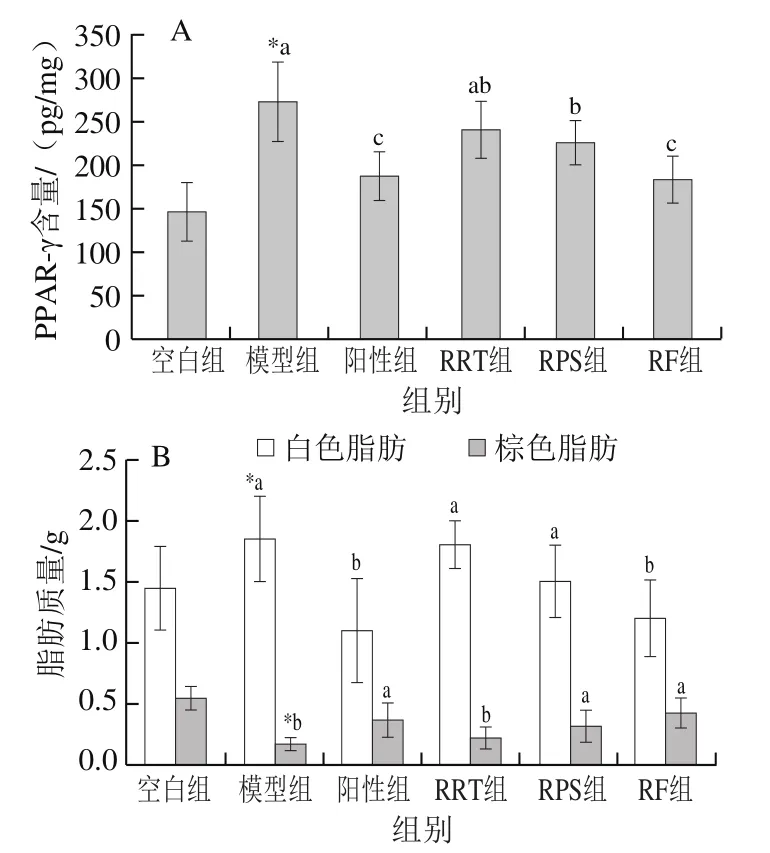
图2 各组小鼠肝脏PPAR-γ含量变化(A)和白色脂肪、棕色脂肪质量(B)(n=8)Fig. 2 Changes of PPAR-γ contents in the liver (A) and white fat and brown fat contents (B) of mice in each group (n = 8)
以上结果说明,T2DM小鼠肝脏中PPAR-γ含量增加,导致小鼠体内白色脂肪堆积;RRT、RPS、RF能抑制脂肪合成因子PPAR-γ在肝脏中的表达从而减少白色脂肪堆积,并增加棕色脂肪的质量,总体效果依次为RF>阳性药物>RPS>RRT。这与管巧丽、史纪芳等研究发现活化AMPK可通过抑制PPAR-γ途径调控3T3-L1脂肪细胞中脂滴蓄积以及Wang Lei等研究发现刺梨总多糖对白色脂肪堆积具有改善作用的结果相一致。
2.5 RRT、RPS、RF对T2DM小鼠FBG的影响
由图3可知,空白组在干预期间FBG持续稳定,且在正常范围(3.9~6.1 mmol/L);模型组第28天 FBG相比第0天增加23.64%,达到24.44 mmol/L。阳性组FBG前14 d缓慢增长后下降,第28天降到11.63 mmol/L,RRT组、RPS组FBG变化趋势和阳性药物组相似,第28天分别降到14.53 mmol/L和13.03 mmol/L;RF组FBG呈稳定下降趋势,第28天降到11.13 mmol/L。结果表明,RRT、RPS、RF虽未能将FBG降到正常范围,但相比模型组均明显降低。这与安玉红等研究发现刺梨果酒降低T2DM小鼠FBG的结果相一致。

图3 各组小鼠28 d实验期间空腹FBG变化(n=8)Fig. 3 Changes in fasting blood glucose levels of mice in each group during the 28-day experimental period (n = 8)
2.6 RRT、RPS、RF对糖尿病小鼠口服糖耐量的影响
由图4A可知,灌胃葡萄糖溶液后,空白组血糖浓度在0.5 h内短暂上升后迅速下降,2 h时已恢复至初始值。模型组血糖浓度持续升高,1 h后才缓慢下降,2 h时未恢复到初始值;阳性组血糖浓度变化趋势与空白组相似,2 h时与初始值仅相差14.1%;RRT组血糖浓度变化趋势与模型组相似,2 h时未恢复到初始值;RPS组、RF组血糖浓度变化趋势均与阳性药物组相似,2 h后血糖浓度与初始值相近。结果表明,阳性药物、RPS、RF改善糖耐量效果相近,明显优于RRT。
由图4B可知,与空白组相比,模型组AUC显著上升305.4%(<0.05);与模型组比,阳性组AUC显著下降46.4%(<0.05),RRT组下降7.6%,与模型组差异不显著(>0.05),RPS组、RF组AUC分别显著下降39.9%和30.6%(<0.05),均与阳性药物组差异不显著(>0.05)。结果表明,改善糖耐量异常能力依次为阳性药物>RPS>RF>RRT。

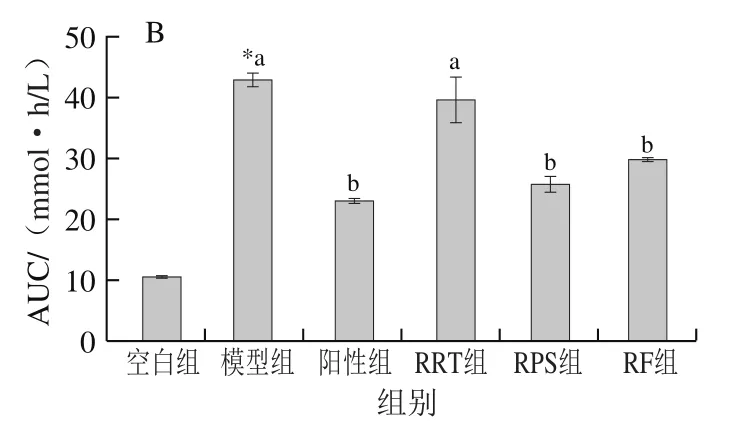
图4 治疗期间各组小鼠糖耐量(A)和AUC(B)的变化(n=8)Fig. 4 Glucose tolerance (A) and area under the blood glucose-time curve (AUC) (B) of mice in each group during experimental period (n = 8)
2.7 RRT、RPS、RF对小鼠肝脏GK活力和肝糖原含量的影响
当机体内血糖水平过高时,GK能促进葡萄糖分解、肝糖原合成、调节血糖水平。由图5A可知,与空白组相比,模型组GK活力显著下降42.8%(<0.05),经阳性药物和样品干预后,与模型组相比,阳性组GK活力显著增加43.2%(<0.05),RRT组增加12.2%,RPS组、RF组分别显著增加32.1%和47.1%(<0.05)。结果表明,RRT、RPS、RF均能上调肝脏GK活力,阳性药物、RPS和RF效果均显著优于RRT,RF效果最佳。这与刘丹奇等研究发现红茶、枸杞、桑叶多糖能提高T2DM小鼠肝脏GK活力的结果相一致。
T2DM会造成小鼠糖异生增多、GK活力降低,导致肝糖原含量下降。由图5B可知,相比空白组,模型组肝糖原含量显著下降67.5%(<0.05),经阳性药物和样品干预后,与模型组相比,阳性组肝糖原含量显著增加159%(<0.05),RRT组、RPS组、RF组分别显著增加30.2%、45.6%、135.4%(<0.05)。RF和阳性药物效果相近,且显著优于RRT、RPS。结果表明,RF、RPS、RRT均能改善糖尿病肝糖原含量减少现象,RF效果最佳。这与Liu Kang、Wang Yudan等的研究结果相一致。
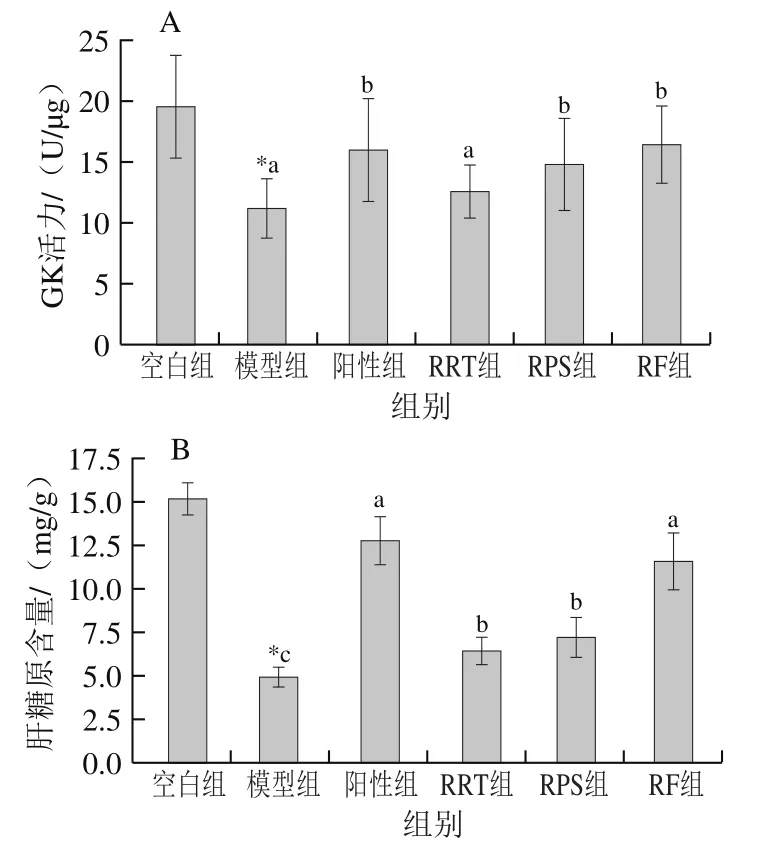
图5 各组小鼠肝脏GK活力(A)和肝糖原含量(B)的变化(n=8)Fig. 5 GK activity (A) and liver glycogen content in the liver (B) of mice in each group (n = 8)
2.8 RRT、RPS、RF对小鼠肝脏氧化应激、损伤的影响
T2DM会导致MDA、有毒过氧化物在肝脏中大量堆积和SOD活力降低,从而引发肝脏应激损伤和胰岛B细胞损伤。由表6可知,与空白组相比,模型组MDA含量显著增加82.4%(<0.05)。经阳性药物和样品干预后,与模型组相比,阳性组MDA含量显著降低32.9%(<0.05);RRT组、RPS组、RF组分别显著下降18.7%、17.1%、46.2%(<0.05)。RF效果优于阳性药物且显著优于RRT、RPS。

表6 RRT、RPS、RF对小鼠肝脏MDA、CAT、SOD水平的影响(n=8)Table 6 Effects of RRT, RPS, and RF on the levels of MDA, CAT, and SOD in the liver of mice (n = 8)
与空白组相比,模型组CAT活力显著下降49.7%(<0.05)。经阳性药物和样品干预后,与模型组相比,阳性药物组CAT活力显著增加43.3%(<0.05),RRT组、RPS组、RF组CAT活力分别增加10.3%、33.4%、59.1%。RF效果优于阳性药物、RPS且显著优于RRT。
与空白组相比,模型组SOD活力显著下降69.5%(<0.05),经阳性药物和样品干预后,与模型组相比,阳性药物组SOD活力显著增加103.6%(<0.05),RRT组、RPS组、RF组分别显著增加37.4%、73.2%、132.7%(<0.05)。RF效果显著高于阳性药物、RRT、RPS(<0.05)。结果表明,RRT、RPS、RF均能抗氧化应激、修复肝脏细胞,RF效果最佳。这与董华强等研究发现多穗黄酮根皮苷能改善T2DM小鼠氧化应激的结果相一致。
2.9 肝脏病理学分析结果
由图6和表7可知,空白组肝脏排列整齐,未发生脂肪变性、水肿和发炎。模型组肝细胞排列紊乱、高度水肿、胞体变大、胞质疏松、大量肝细胞脂肪变性、胞质中可见大小不一的圆形空泡,轻微发炎。经阳性药物和样品干预后,阳性组肝细胞排列尚整齐,肝细胞轻微空泡变性,胞体中度肿胀,未发炎;RRT组肝细胞排列尚整齐,胞质中可见大小不一的圆形空泡,大量肝细胞脂肪变性、中度水肿、未发炎;RPS组肝细胞排列尚整齐,中度水肿,肝细胞轻微脂肪变性,胞质中可见大小不一的圆形空泡,未发炎;RF组肝细胞排列尚整齐,少量细胞发生气球样变,胞体轻微肿胀,胞质空泡化,未发生脂肪变性和发炎。

图6 小鼠肝脏病理学分析Fig. 6 Liver pathological analysis of mice
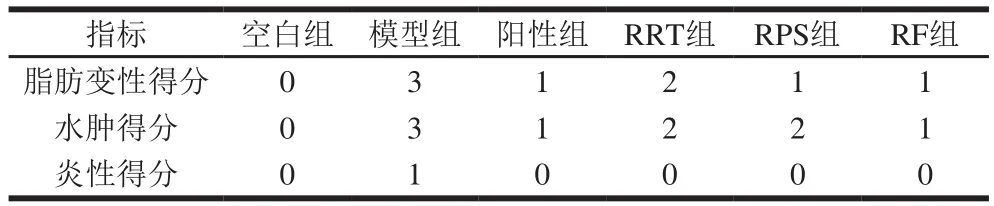
表7 各组小鼠肝脏病变程度(n=8)Table 7 Degree of liver lesions in each group of mice (n = 8)
3 讨 论
本实验采用高脂高糖饲料联合STZ建立T2DM模型,探究RRT、RPS、RF对T2DM小鼠糖脂代谢紊乱的影响。“三多一少”为糖尿病典型症状。经样品干预后,RRT组、RPS组、RF组“三多一少”现象均明显改善,其中RF对体质量减轻、进食量增多、饮水量增多改善效果强于RRT、RPS。脏器指数对衡量机体健康尤为重要,它是机体内某脏器质量与机体总质量的比值,脏器指数过大或过小都会影响机体健康,RRT、RPS、RF均能改善肝脏指数、肾脏指数、脾脏指数增大现象。
T2DM患者通常患有不同程度的脂代谢紊乱,高血脂是引起胰岛素分泌异常或胰岛素受体抵抗的原因之一,TC、TG、LDL-C含量升高,HDL-C含量减少是血脂升高、动脉粥样硬化的主要原因。RRT对TC、HDL-C改善效果显著(<0.05),RPS对TC、LDL-C、HDL-C改善效果显著(<0.05),RF对TC、TG、LDL-C、HDL-C改善效果均显著(<0.05);说明RF改善脂代谢紊乱能力优于RPS、RRT。PPAR-γ主要表达于脂肪组织和免疫系统,与机体免疫、脂肪细胞分化、胰岛素抵抗均有关系;研究发现T2DM小鼠肝脏组织中PPAR-γ表达量均会增加,导致白色脂肪堆积和血脂水平升高。本研究结果表明,RRT、RPS、RF均对PPAR-γ表达有抑制作用,RF抑制效果优于阳性药物,RRT、RPS抑制效果显著低于阳性药物(<0.05)。白色脂肪组织是机体内储存过剩能量的重要场所,棕色脂肪在机体内负责分解白色脂肪并加快机体新陈代谢。RRT、RPS、RF均能通过抑制PPAR-γ的分化从而降低白色脂肪堆积、增加棕色脂肪含量,总体治疗效果依次为RF>阳性药物>RPS>RRT。
T2DM是一种慢性内分泌疾病,血糖水平升高是该疾病最主要的特征;发病后患者的血糖指标长期处于异常导致人体器官组织损伤,若不及时改善会导致各种并发症。目前国际糖尿病诊断标准为正常人FBG在3.3~6.1 mmol/L之间,若大于11.1 mmol/L则视为血糖超标,故FBG是重要的检测指标之一。结果显示,第8天时RRT组、RPS组、RF组相比模型组FBG明显下降,其中RF效果最佳。糖耐量是指机体对血糖的调节能力,当机体突然摄入大量葡萄糖时,机体快速分泌胰岛素、合成肝糖原使体内血糖下降到正常水平。糖耐量异常是指机体口服大量葡萄糖后胰岛B细胞无法迅速做出反应,口服糖2 h后血糖浓度依然未降到正常范围。阳性药物组、RRT组、RPS组、RF组相比模型组AUC分别下降46.4%、7.6%、39.9%、30.6%,干预效果依次为阳性药物>RPS>RF>RRT。
GK是机体内调节血糖代谢的关键酶,主要在人体肝脏和胰腺中表达,可作为葡萄糖传感器感知葡萄糖浓度的变化、促进葡萄糖分解和肝糖原合成、维持机体血糖平衡。T2DM患者肝脏GK活性降低、肝糖原含量减少、激素分泌异常导致血糖水平失衡,血糖升高,故激活GK能促使血糖含量减少、肝糖原含量增多。RRT、RPS、RF组相比模型组GK活力分别增加12.2%、32.1%、47.1%,肝糖原含量分别增加30.2%、45.6%、135.4%。RF效果均最佳,说明RF是刺梨激活GK、促进肝糖原合成的主要活性成分。
植物提取物在降血糖同时具有强抗氧化活性。MDA由生物体内自由基作用在脂质中发生过氧反应产生,具有细胞毒性从而导致胰岛B细胞损伤。SOD能够有效清除超氧阴离子自由基,减少肝脏细胞损伤。CAT是一种过氧化物分解酶,可将有毒过氧化物还原为无毒羟基化合物从而保护肝脏细胞。机体内源性抗氧化防御机制和DNA修复系统不堪重负时会导致胰岛B细胞功能障碍,故减少氧化应激能改善糖代谢紊乱。阳性药物、RRT、RPS、RF均能减少肝脏中MDA含量,RF效果最佳。阳性药物、RPS和RF增加CAT活力效果相近且均显著优于RRT,RF效果最佳。阳性药物、RRT、RPS和RF对增加SOD活力效果均有显著差异(<0.05),干预效果依次为RF>阳性药物>RPS>RRT。肝脏病理观察结果表明,阳性药物、RRT、RPS、RF均能改善肝细胞排列紊乱、水肿、发炎现象,阳性药物、RPS、RF对肝脏脂肪变性改善效果明显优于RRT。
综上,RRT、RPS、RF能通过降低进食量、饮水量、调节脏器指数、调节血糖血脂、抑制PPAR-γ分化、减少白色脂肪堆积、提高GK活力、增加肝糖原含量、修复肝脏氧化损伤、改善肝细胞水肿和脂肪变性等从而改善T2DM小鼠糖脂代谢紊乱。RPS、RF总体效果优于RRT,RF对糖脂代谢紊乱、氧化应激改善效果优于RPS,RPS对糖耐量异常改善效果优于RF。以上结果表明,RPS、RF可能作为有效改善T2DM的功能成分,下一步应继续研究RPS、RF调节糖脂代谢紊乱的具体作用机制。

