高温肉制品杂环胺防控及体内代谢调控研究进展
薛桂中,黄现青,2,宋莲军,2,*,乔明武,2,赵建生,马相杰,徐俊涛
(1.河南农业大学食品科学技术学院,河南 郑州 450002;2.河南省食品加工与流通安全控制工程技术研究中心,河南 郑州 450002;3.河南双汇投资发展股份有限公司,河南 漯河 462000)
肉制品作为人类不可缺少的重要能量来源物质,在人们饮食结构中占有重要地位。我国是肉制品生产和消费大国,据统计,2020年我国肉类总产量为7 639万 t,其中高温肉制品产量高达4 971万 t,占肉制品总产量的65.08%。高温肉制品因具有独特的色、香、味、形而闻名于世。我国高温肉制品主要有北京烤鸭、新疆烤羊肉串、万州烤鱼、哈尔滨红肠等;国外高温肉制品主要有德国法兰克福香肠、土耳其烤肉、阿比让烤肉等。
高温肉制品加热过程中主要发生的化学反应包括脂质氧化、蛋白质变性和美拉德反应。脂肪的适度氧化有利于高温肉制品香气形成;蛋白质变性不仅有利于氨基酸的吸收利用,同时也对产品风味有较大贡献;而美拉德反应除了能增添高温肉制品的香味外,还能赋予其诱人的色泽。但是,随着熟制温度的升高与加热时间的延长,熟肉制品表面褐变程度加剧直至变黑,同时也会产生一些对人体有害物质等,如杂环胺、多环芳烃等。其中,杂环胺由于具有强致畸、致癌性、致突变性,过量摄入后会对人体健康产生严重毒害作用。因此,高温肉制品加工过程中杂环胺的形成规律、控制技术、体内代谢等相关问题越来越受到研究者和消费者的关注与重视。
目前,杂环胺防控方法主要以热加工过程中为主,但摄入体内后应如何调控的相关研究较少,所以,本文从热加工过程中杂环胺形成机制、危害、抑制方法以及摄入体内后减控杂环胺在体内消化吸收、调节杂环胺在体内代谢途径等研究进展进行阐述,旨在寻找抑制杂环胺有效可行的防控方法和措施。
1 杂环胺概述
1.1 杂环胺结构及类别
杂环胺是肉制品经过高温加热后,其中的葡萄糖、肌酸、肌酸酐、氨基酸等会发生化学反应后生成一类具有致癌性、致突变的芳香族杂环化合物,其结构至少含有一个芳香环和有氮原子组成的有机分子,因此也被称为杂环芳香胺(heterocyclic aromatic amines,HAAs)。根据加热温度和化学结构的不同,主要分为两大类及多个小类,加工温度为100~300 ℃之间形成的杂环胺主要为氨基咪唑氮杂芳烃类杂环胺(amimidazolazine heterocyclic amines,AIAS),也称为热型杂环胺及极性杂环胺;当加工温度高于300 ℃形成的杂环胺主要为氨基咔啉类杂环胺(amino-carbolines,ACS),也称为热解型杂环胺及非极性杂环胺,其具体分类及化学结构如图1所示。
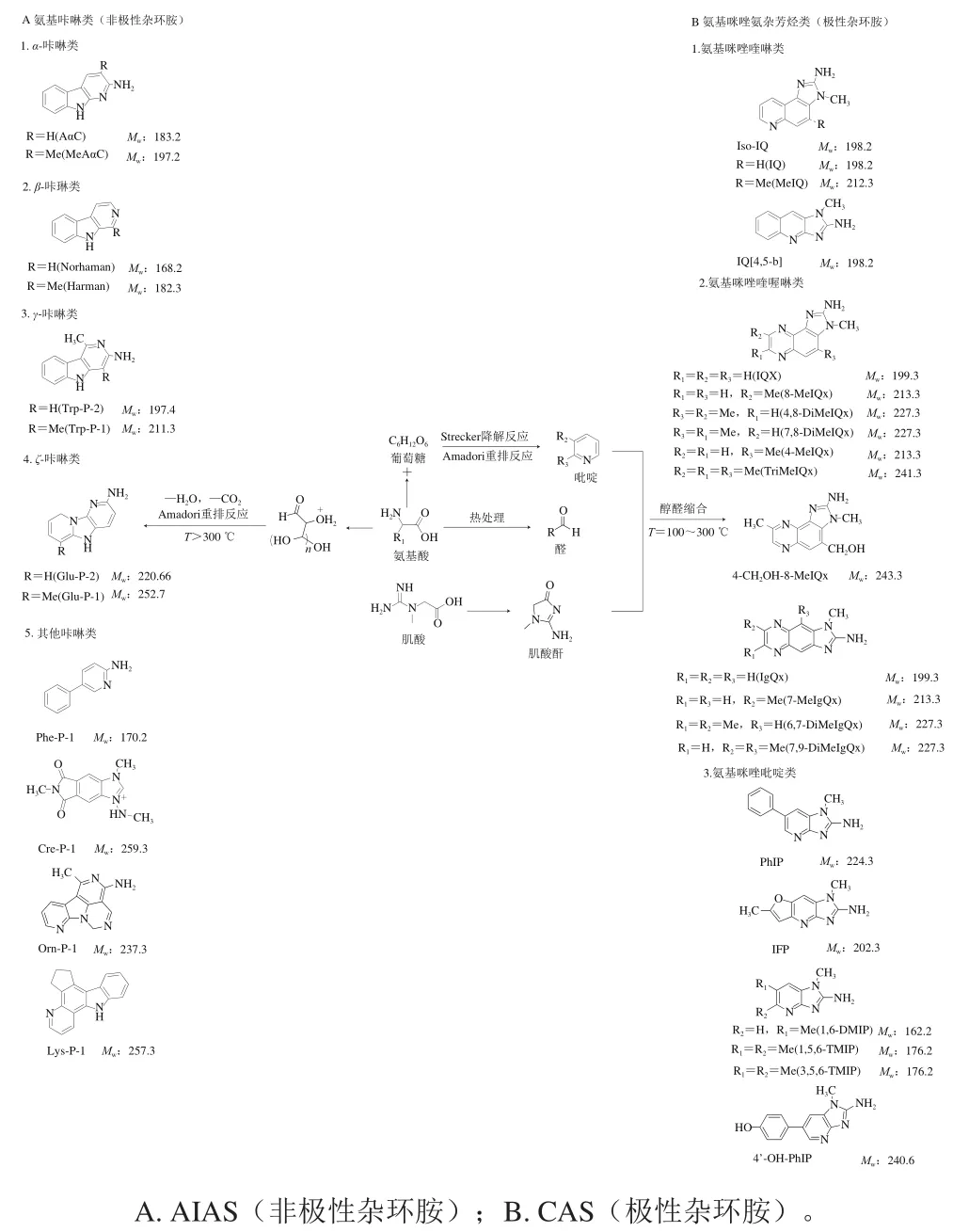
图1 杂环胺的分类与化学结构[3]Fig. 1 Classification and chemical structures of heterocyclic amines[3]
1.2 杂环胺生物毒性
流行病学研究表明,大量摄入高温肉制品会增加癌症的风险从而影响人体健康。基于国际癌症研究机构根据大量调查结构表明,几乎所有的杂环胺都有致癌性,按照致癌程度分为5个级别,分别为1级(明确致癌性)、2A级(较高致癌性)、2B级(较低致癌性)、3级(致癌性未分类)和4级(无致癌性)。根据不同杂环胺致癌作用的差异,国际癌症研究机构将2-氨基-3,4-二甲基-咪唑并[4,5-f]-喹啉(2-amino-3,4-dimethylimidazo[4,5-f]quinoline,MeIQ)、2-氨基-3,4-二甲基-咪唑并[4,5-f]-喹喔啉/2-氨基-3,8-二甲基-咪唑并[4,5-f]-喹喔啉(2-amino-3,8-dimethylimidazo[4,5-f]quinoxaline,MeIQx)、2-氨基-1-甲基-6-苯基咪唑并[4,5-b]-吡啶(2-amino-1-methyl-6-phenylimidazo[4,5-b]pyridine,PhIP)、2-氨基-9-吡啶并[2,3-b]吲哚(2-amino-9-pyrido[2,3-b]indole,AαC)、2-氨基-3-甲基-9-吡啶并[2,3-b]吲哚(2-amino-3methyl-9-pyrido[2,3-b]indole,MeAaC)、3-氨基-1,4-二甲基-5-吡啶并[4,3-b]吲哚(3-amino-1,4-dimethyl-5-pyrido[4,3-b]indole,Trp-P-1)和3-氨基-1-甲基-5-吡啶并[4,3-b]吲哚(3-amino-1-dimethyl-5-pyrido[4,3-b]indole,Trp-P-2)列为2B类潜在致癌物,把2-氨基-3-甲基-咪唑并[4,5-f]-喹啉(2-amoin-3-methy benzimidazole and [4,5-f]quinoline,IQ)列为2A类可能致癌物。除此之外,多种癌症发生与杂环胺摄入量也有着密切关系,当杂环胺总摄入量超过41.4 ng/d时会增加直肠癌的风险,且女性患直肠癌风险要高于男性。目前,我国以及国际上暂未制定食品中杂环胺最大残留量标准,但鉴于杂环胺的生物毒性,应最大程度上减少或降低其在食品中的生成量。
2 高温肉制品加工过程中杂环胺形成途径
2.1 AIAS形成途径
AIAS形成主要是肉中肌酸在加热条件下形成肌酸酐,葡萄糖与氨基酸等在100~300 ℃高温下发生Strecker降解反应后,通过Amadori重排等一系列复杂化学反应形成吡嗪、吡啶类化合物,再与醛类、肌酸酐等发生Aldol-反应形成氨基咪唑喹啉、喹喔啉、吡啶类杂环胺等,具体详细过程见图2。由于AIAS(IQ型)形成途径较多,但最主要的两种形成途径为,一是通过自由基途径形成AIAS。Milic等研究结果表明,氨基咪唑喹喔啉形成主要分为两个阶段:1)反应初期,葡萄糖随着温度的升高降解生成二基化合物,与氨基酸发生Strecker降解反应后形成吡啶、吡嗪类自由基;2)反应后期,这些吡啶、吡嗪类自由基通过Amadori重排等一系列复杂化学反应形成吡嗪、吡啶类化合物再与肌酸酐反应形成AIAS。二是通过美拉德途径形成AIAS。肉成分中含有一些形成杂环胺的前体物质如氨基酸、肌酸等,随着热加工温度的进行,葡萄糖降解形成二基化合物后与氨基酸发生Strecker降解反应形成吡嗪类衍生物、吡啶类衍生物,通过进一步氧化、脱水等一系列化学反应形成吡嗪、吡啶类化合物,再与醛类、肌酸酐发生Aldol-反应生成氨基咪唑喹啉、喹喔啉、吡啶类极性杂环胺。
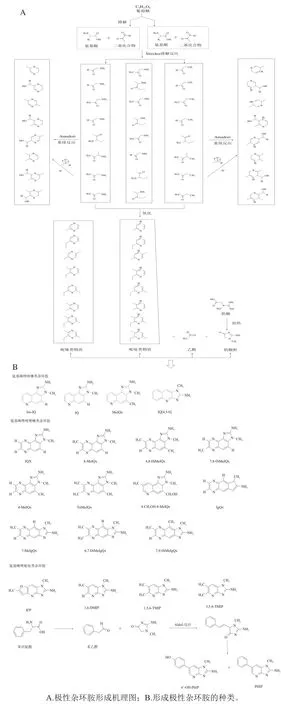
图2 喹啉类、喹喔啉类、吡啶类杂环胺的形成途径Fig. 2 Formation pathways of heterocyclic amines including quinolines,quinoxalines and pyridines
PhIP是高温肉制品加工中最常见也是生成量最多杂环胺之一,相对于其他杂环胺相关报道及研究进展,PhIP形成机理研究也更为深入。Zochling、Cheng和Zamora等研究了PhIP的形成过程,结果表明,苯丙氨酸和肌酸酐是形成PhIP的重要前体物质,苯丙氨酸通过加热形成苯乙醛(中间产物),苯乙醛与肌酸酐会发生一系列化学反应形成醇醛缩合产物,然后通过氧化形成PhIP。也有研究表明,除苯丙氨酸之外,部分氨基酸(亮氨酸、异亮氨酸、酪氨酸)与肌酸酐在高温下可以形成PhIP;在美拉德反应中葡萄糖起着重要的作用,随着温度逐渐提升,葡萄糖降解形成二基化合物,与氨基酸发生Strecker降解反应后再与肌酸酐、醛类化合物发生一系列化学反应最终形成PhIP。
2.2 ACS形成途径
ACS主要分为4大类:-咔啉类(AαC、MeAαC)、-咔啉类(Trp-P-1、Trp-P-2)、-咔啉类(Glu--1、Glu--2)、-咔啉类(1-甲基-9-吡啶并[3,4-b]吲哚(harmane)和9-吡啶并[3,4-b]吲哚(norharmane)),-咔啉类、-咔啉类、-咔啉类杂环胺形成温度通常超过300 ℃,由氨基酸直接热解产生,因此这类被称为“热解型杂环胺”,又称非极性杂环胺。目前,对于-咔啉类、-咔啉类、-咔啉类杂环胺形成途径尚不明确,需要进一步研究。而-咔啉类(1-甲基-9-吡啶并[3,4-b]吲哚和9-吡啶并[3,4-b]吲哚)形成途径较为明确,Quan Wei、Bertrand和薛桂中等进行了相关研究,但大部分非极性杂环胺整体形成机制尚不清楚。美拉德反应初期,肉中所含有的醛糖与氨基酸在高温下会发生脱水反应形成Schiff’s底物(醛糖胺),醛糖胺通过Amadori重排反应形成Amadori化合物,当pH>7时会发生断裂形成二基化合物,与半胱氨酸发生脱水、脱二氧化碳等一系列化学反应形成2-巯基乙醛和-氨基羰基化合物,而生成的中间产物与硫化氢反应生成乙醛、氨气等物质;反应末期,色氨酸主要通过两种途径形成Norharmane和Harmane:1)色氨酸在高温下通过Amadori重排反应形成Amadori化合物,再通过Pictet-Spengler环化反应形成四氢-咔啉,最后再通过分子内亲核取代及氧化反应形成-咔啉(Norharmane和Harmane)杂环胺;2)色氨酸与醛类在高温下形成中间产物,在环氧孤对电子作用下进行β消除反应,形成共轭氧鎓离子中间体,再通过分子内亲核取代形成-咔啉,具体过程见图3。
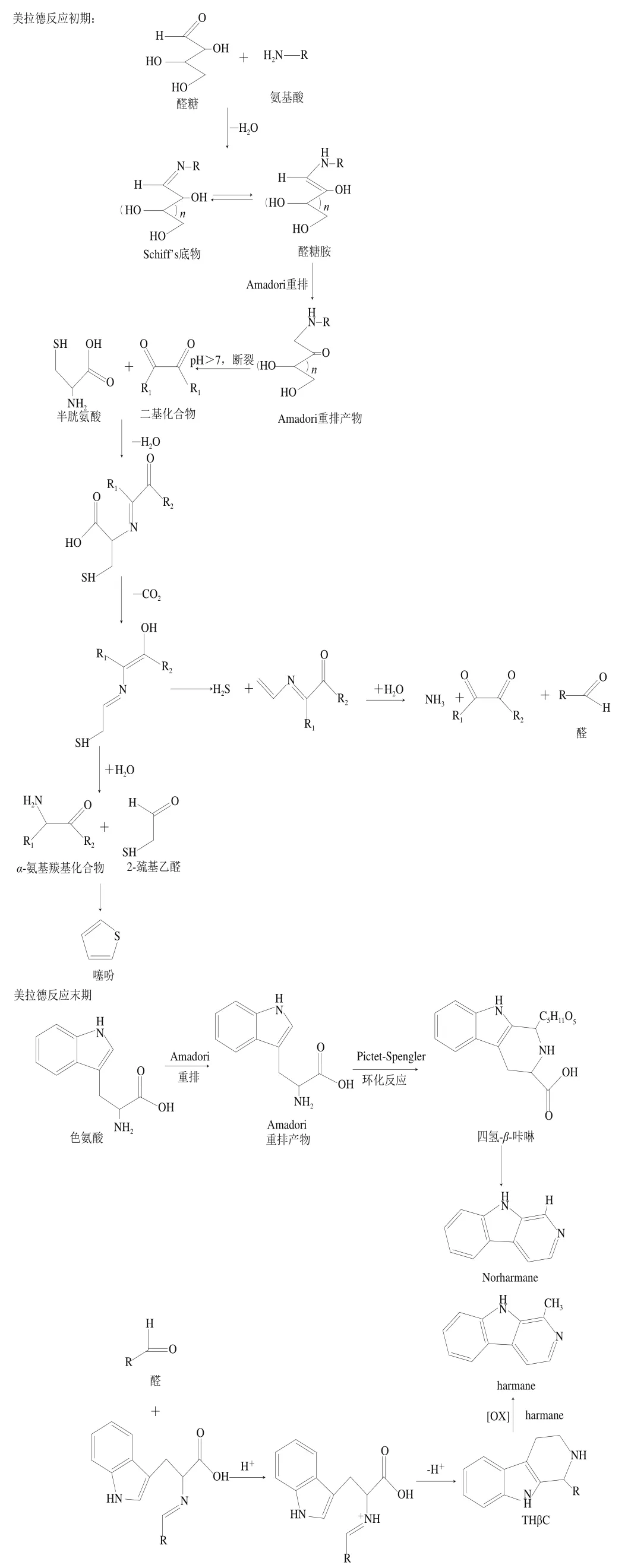
图3 Norharmane和Harmane杂环胺形成途径Fig. 3 Formation pathways of heterocyclic amines including norharmanes and harmanes
3 高温肉制品加工过程中杂环胺防控方法
3.1 合理选择热加工方式
人们在熟肉加工时,会选择不同热加工方式如烤制、熏制、炸制等。杨钊宇等的研究结果表明,炸制温度为160 ℃时鸡肉饼中测得总杂环胺含量为1.19 ng/g,当温度升高为200 ℃时,总杂环胺含量上升为7.38 ng/g,增加了5.2 倍,且随着炸制温度的升高,鸡肉饼中总杂环胺含量逐渐增加。Bula等研究发现,烤制温度为180 ℃烤制猪肉时测得总杂环胺含量为0.4 ng/g,当温度升高为220 ℃时,总杂环胺含量上升为1.6 ng/g,增加了3 倍,且随着烤制温度的升高,烤肉中总杂环胺含量逐渐增加。Ozsarac等采用了气炉和电炉两种不同方式烤制肉串,结果表明,电炉烤制肉串时测得总杂环胺含量为1.348 ng/g,当选用气炉烤制时,总杂环胺含量升高至2.335 ng/g,增加了近1 倍,气炉烤制方式下产生的杂环胺总含量显著高于电炉烤制方式。Yang Diaodiao等研究熏制方式加工香肠并测定杂环胺含量变化,结果表明,熏制温度为50 ℃时总杂环胺含量为330.31 ng/g,当温度升高为60 ℃时,测得总杂环胺含量为424.96 ng/g,总杂环胺生成量比原来提高1.5 倍,且随着熏制温度的升高,香肠中总杂环胺含量逐渐增加。由此可知,热加工方式是影响高温肉制品中杂环胺生成的重要因素,当选用不同烤制方式加工时,高温肉制品中的杂环胺生成量也有所不同。
综上,从杂环胺在热加工过程中的形成速率及生成量来说,高温肉制品热加工方式首先应选择熏制热加工方式,其次是烤制热加工方式,最后是炸制热加工方式,在既保证高温肉制品良好的色泽与口感等品质前提下,又最大程度上降低杂环胺的生成。
3.2 合理选择原辅料种类及添加量
3.2.1 合理选择食用油
Pan Teng等采用3种不同类型的食用油炸制猪肉并测定总杂环胺含量,与空白组相比,大豆油炸制组测得总杂环胺含量为11.14 ng/g,猪油炸制组测得总杂环胺含量为14.12 ng/g,棕榈油炸制组测得总杂环胺含量14.27 ng/g,与空白组相比,杂环胺总生成量显著增加。Ekiz等选用7种不同类型的食用油炸制猪肉丸并测定总杂环胺含量,与空白组相比,葵花籽油炸制组测得总杂环胺含量为34.91 ng/g,榛子油炸制组测得总杂环胺含量为30.43 ng/g,菜籽油炸制组测得总杂环胺含量为35.73 ng/g,混合植物油炸制组测得总杂环胺含量为43.71 ng/g,玉米油炸制组测得总杂环胺含量为39.85 ng/g,橄榄油炸制组测得总杂环胺含量为40.05 ng/g,橄榄油(天然压榨)炸制组测得总杂环胺含量为39.23 ng/g,与空白组相比,总杂环胺生成量显著增加。
对于食用油种类来说,在相同的热加工方式条件下,使用不同种类食用油加工的熟肉制品中杂环胺总量也大不相同。当选用大豆油、猪油及棕榈油炸肉时,测得大豆油油炸组熟肉中总杂环胺含量为11.14 ng/g,增加了2 倍;猪油油炸组熟肉中总杂环胺含量为14.12 ng/g,增加了2.75 倍;棕榈油油炸组熟肉中总杂环胺含量为14.27 ng/g,增加了近3 倍,且生成杂环胺含量为棕榈油>猪油>大豆油。此外,选用葵花籽油、榛子油、菜籽油、混合植物油、玉米油、橄榄油、橄榄油(天然压榨)炸肉丸子,且总杂环胺生成量为混合植物油>橄榄油>玉米油>橄榄油(天然压榨)>菜籽油>葵花籽油>榛子油。
3.2.2 适当添加糖及金属阳离子
部分氨基酸(苯丙氨酸、色氨酸、亮氨酸、异亮氨酸)、肌酸、肌酸酐、糖类是形成杂环胺的重要前体物质,它们在高温下会发生Strecker降解和Amadori重排反应形成Amadori化合物,再通过一系列复杂的化学反应最终形成杂环胺。在这些前体物质之中,糖类和肌酸酐能够显著影响杂环胺的形成。研究发现,以原料肉总重量为基础,糖添加量为9%时,杂环胺总含量增加了85%,当糖添加量为14%时,杂环胺总含量降低了70%,且糖含量超过肌酸酐含量时,对杂环胺的生成起到抑制作用。这是由于在美拉德反应中,过量的糖会优先形成5-羟甲基-2-糠醛,通过与肌酸酐反应从而抑制杂环胺的形成;此外,糖的种类不同也会对杂环胺的生成影响也不相同。Hasnol等选用3种添加不同种类的糖腌制鸡肉进行烤制,并测定总杂环胺含量,结果表明,与空白组相比,蔗糖添加量为95.1%腌制组测得总杂环胺含量为125.8 ng/g,蔗糖添加量为92.7%腌制组测得总杂环胺含量为102.34 ng/g,添加30.2%(质量分数)葡萄糖与添加34.4%(质量分数)果糖的蜂蜜腌制组测得总杂环胺含量为83.53 ng/g,富含葡萄糖与果糖的蜂蜜腌制组抑制杂环胺效果优于蔗糖腌制组。部分氨基酸(苯丙氨酸、色氨酸等)是形成杂环胺的重要前体物质,降低苯丙氨酸、色氨酸的含量也可以起到抑制杂环胺的形成。同时,加入金属阳离子也能够起到抑制杂环胺的形成。Yu Di等研究金属阳离子对PhIP形成影响,结果表明,当加入80 μmol/L Fe和Fe时,PhIP抑制率分别为67.78%和94.78%,与空白组相比,抑制率显著升高。
糖类、部分氨基酸、肌酸、肌酸酐等是形成杂环胺的重要前体物质,添加不同种类和适量的糖以及加入适量浓度的金属阳离子有效抑制前体物质生成,这是因为苯丙氨酸加热条件下形成苯乙醛,肌酸在加热条件下形成肌酸酐,金属离子(Fe、Fe)与肌酸酐上的氨基发生取代反应,而过量的糖在加热条件下则会优先形成5-羟甲基-2-糠醛,二者均能阻断中间产物与肌酸酐发生反应从而抑制杂环胺的形成。
3.2.3 适当添加天然香辛料及抗氧化剂
如上文所述,高温肉制品加工过程中杂环胺主要通过通过自由基途径和美拉德反应形成。极性杂环胺可以通过自由基途径形成,非极性杂环胺主要以美拉德反应形成。美拉德反应初期,苯丙氨酸在加热条件下形成苯乙醛(中间体产物),会加速与肌酸酐反应生成杂环胺。因此,清除自由基和中间体产物从而抑制或减少杂环胺的生成。Sepahpour等烤牛肉时分别加入姜黄粉、咖喱叶、火炬姜粉和柠檬草并测定总杂环胺含量,结果表明,4种香辛料对杂环胺的抑制效果姜黄粉>柠檬草>火炬姜粉>咖喱叶。Zeng Maomao等在制作烤牛肉馅饼时加入不同添加量的辣椒提取物并测定总杂环胺含量,结果表明,与空白组相比,辣椒提取物添加量为0.5%时测得抑制效果为46%,当添加量为1.5%时测得抑制效果为24%,且杂环胺的抑制效果随着辣椒提取物添加量增加而逐渐降低。Chen Shujuan等研究不同添加量甘蔗糖蜜对PhIP形成影响,结果表明,与空白组相比,甘蔗糖蜜添加量为0.005%时测得抑制率为24.14%,当添加量0.08%时测得抑制率为59.80%,且随着甘蔗糖蜜添加量的增加对杂环胺的抑制效果逐渐升高。此外,菊花提取物、竹叶提取物、花椒叶提取物等天然抗氧化剂均能有效降低杂环胺生成量。对于中间体产物来说,由于杂环胺形成过程十分复杂,但它们都会生成共同的中间产物苯乙醛,黄酮类物质、酰胺类物质均能够与苯乙醛反应生成加合物,从而抑制或减少杂环胺的形成。李利洁研究微波烤制牛肉中加入不同浓度槲皮素对杂环胺生成量的影响,结果表明,与空白组相比,槲皮素添加量为0.2 mg/mL时抑制率为24%,当添加量为0.8 mg/mL时抑制率为80%,随着槲皮素添加量的增加对杂环胺的抑制效果逐渐增强。张梦茹在烤牛饼中加入不同添加量的黑胡椒和胡椒碱后并测定总杂环胺含量,结果表明,与空白组相比,黑胡椒添加量为0.5%时抑制率为42%,当添加量为1.5%时抑制率为25%;而胡椒碱添加量为0.005%时抑制率为62%,当添加量为0.015%时抑制率为56%,且二者随着添加量增加对杂环胺的抑制效果逐渐降低。
在原料肉腌制过程中加入姜黄、辣椒提取物、甘蔗糖蜜提取物等天然香辛料及提取物均能显著降低杂环胺的生成,同时槲皮素、黑胡椒和胡椒碱等黄酮及酰胺类物质也能够显著抑制杂环胺的生成,这是因为香辛料成分中含有酚类化合物,其酚类结构化合物上的羟基具有自由基清除能力,从而起到抗氧化作用;而黄酮类和酰胺类物质能够与中间产物苯乙醛发生反应,生成苯乙醛加合产物,从而抑制杂环胺的形成。
4 杂环胺摄入体内后代谢调控方法
杂环胺通常在高温肉制品加工过程中形成,具有一定的生物毒性,长期摄入会在体内蓄积从而对人体造成健康危害。虽然选取不同的方法抑制杂环胺的生成,如合理选择热加工方式、原辅料种类和添加量、食用油及适当添加糖、金属阳离子、天然香辛料及抗氧化剂等均可有效减少其杂环胺生成量,但在加工过程仍不可避免杂环胺的形成,最终会以产品形式流向市场,供人们消费食用。人们长期过多摄入高温肉制品时,成分中的杂环胺则经小肠吸收后经血液运输至肝脏、淋巴组织等器官,造成体内蓄积从而引起致突变和致癌性。因此,需要研究杂环胺摄入体内的消化过程,并对代谢途径加以控制,从而减少杂环胺在体内产生的毒性危害。
4.1 减控杂环胺在体内的消化吸收
人体摄入食物后,各种成分在消化道以后会发生一系列复杂物理、化学及微生物消化作用被分解成小分子物质,然后通过消化道黏膜(主要部位为小肠)进入血液或淋巴液被机体细胞所吸收利用,只有被吸收利用的物质才能对机体产生有利或有害作用。Raman等选用马铃薯、麦麸、燕麦3种不同膳食纤维研究其对杂环胺生成量的影响,结果表明,与空白组相比,3种膳食纤维对杂环胺的抑制效果依次为马铃薯纤维>麦麸>燕麦纤维。Persson等研究不同膳食纤维对总杂环胺生成量的影响,结果表明,与空白组相比,马铃薯纤维添加组抑制率为83%,麦麸添加组抑制率为78%,二者均有效降低了杂环胺的含量。Funk等在模拟小肠的条件下,运用改性后木质纤维玉米细胞壁吸附杂环胺,研究发现经木质纤维玉米细胞壁吸附的杂环胺不会被小肠所吸收,且随木质纤维排出体外,因此可以运用木质纤维吸收大量疏水性的杂环胺,如PhIP、MeAαC从而降低杂环胺在人体消化吸收率。Willenberg等在Caco-2细胞肠道模型中研究可溶性白藜芦醇纤维对杂环胺吸附影响,结果表明,白藜芦醇纤维可以吸附水溶性杂环胺(PhIP)并随之排出体外,从而降低杂环胺的吸收率。
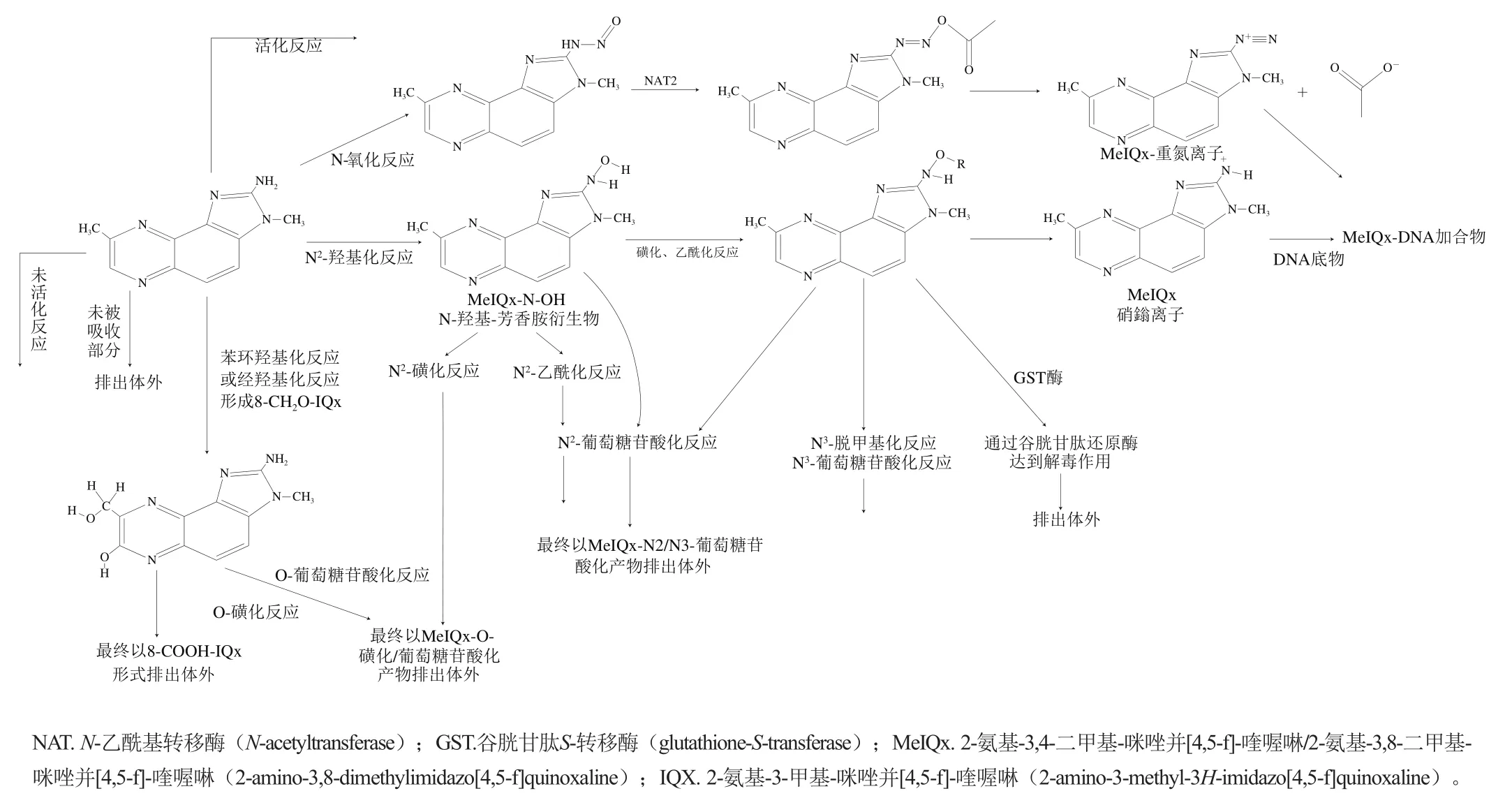
图4 极性杂环胺体内代谢途径Fig. 4 Metabolic pathways of polar heterocyclic amines in the body
人体摄入食物后,食物在消化道会发生一系列复杂物理、化学及微生物消化作用从而被分解成小分子物质,通过消化道黏膜进入血液或淋巴液被机体细胞所吸收利用。因此,当摄入一定高温肉制品后,可以摄取富含纤维类粗粮(如燕麦、马铃薯、麦麸等)以及富含白藜芦醇的食物(如葡萄、桑葚、花生等)。富含纤维类粗粮可以有效降低杂环胺在体内的吸收率;而可溶性白藜芦醇纤维对水溶性杂环胺(PhIP)吸收率较高且会与之结合并排出体外,从而有效降低杂环胺消化吸收率。另外,尽管目前胃肠道动态模型的建立已经趋于成熟,但由于不能模拟在人体胃肠道消化吸收过程中的其他干预条件,如微生物菌群、免疫系统以及激素的释放,仍需要进一步进行体内代谢及动物实验研究与验证。
4.2 调节杂环胺在体内代谢途径
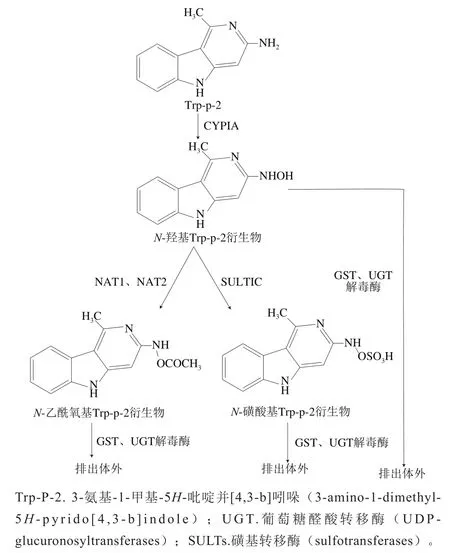
图5 非极性杂环胺体内代谢途径Fig. 5 Metabolic pathways of nonpolar heterocyclic amines in the body
4.2.1 降低杂环胺活性
杂环胺具有一定的生物活性,当人体摄入并经小肠吸收后通过血液运输至肝脏,在体内长期蓄积会对人体造成危害。因此,可以采用天然的活性物质如益生菌、叶绿素、硫代葡萄糖苷等与杂环胺结合,从而降低杂环胺生物活性。Narushima等研究接入保加利亚乳杆菌subsp(bulgaricus 2038)和嗜热链球菌subsp(thermophilus strain 1131)的酸奶对杂环胺致癌性的影响,动物实验结果表明,与空白组相比,治疗两周之后益生菌添加组的小白鼠结肠中的HAAs数量降低了52.8%,从而有效地抑制结肠癌的发生。十字花科植物甘蓝能够产生一种具有生物活性的化学物质硫代葡萄糖苷,它可以在内源性黑芥子酶和修饰蛋白作用下降解形成具有抗癌活性的异硫氰酸酯,异硫氰酸与杂环胺的氨基结合形成硫脲,抑制杂环胺形成具有基因毒性的杂环胺-氮-羟基(HAAs-N-OH)衍生物,从而减少癌症的发生。除此之外,Sugiyama等研究叶绿素与壳聚糖对Trp-p-2杂环胺-DNA加合产物的影响,动物实验结果表明,与空白组相比,叶绿素和壳聚糖添加量为1%时形成的Trp-p-2-DNA加合物生成量为2.50,降低了66.21%;叶绿素和壳聚糖添加量为2%时形成的Trp-p-2-DNA加合物生成量为0.50,降低了93.24%;叶绿素和壳聚糖添加量为3%时形成的Trp-p-2-DNA加合物生成量为0.16,降低了97.84%,且随着添加量的增加对Trp-p-2-DNA加合物抑制率逐渐升高。
益生菌细胞壁中的肽聚糖可以与杂环胺之间进行阳离子交换,使其结合在细胞壁上,降低杂环胺的生物活性,最终通过粪便形式排出体外;杂环胺的毒性是由于与DNA反应生成杂环胺-DNA(HAAs-DNA)加合物,而叶绿素可以抑制加合物的形成;甘蓝中的异硫氰酸酯可以与杂环胺的氨基结合形成硫脲,从而抑制HAAs-N-羟基衍生物的形成。因此,可以采用益生菌、叶绿素、硫代葡萄糖苷等天然的活性物质直接与杂环胺结合使其失去活性,从而达到减少癌症的发生。
4.2.2 抑制杂环胺活化过程
杂环胺的生物毒性取决于在体内的代谢活化过程,而细胞色素P450(cytochrome P450,CYP450)酶在其中起着重要作用,因此抑制杂环胺活化过程主要是对其负责代谢活化的CYP酶进行作用从而控制其在体内代谢反应。Chevereau等研究人工合成的磺酸转移酶1A1和-乙酰转移酶2在杂环胺代谢活化过程以及运用重组V79细胞对基因毒性的影响,结果表明,运用V79-hCYP1A2重组细胞可以抑制AαC、2-氨基-6-甲基二吡啶并[1,2-a:3’,2’-d]咪唑(Glu-P-1)、MeAαC、2-氨基二吡啶并[1,2-a:3’,2’-d]咪唑(Glu-P-2)、Trp-P-2杂环胺在体内代谢活化产生影响,从而抑制基因毒性产生。Sekimoto等研究在人体HepG2细胞中运用芳香烃受体(aryl hydrocarbon receptor,AhR)和CYP1A酶对杂环胺诱导能力的影响,结果表明,CYP1A酶可以对MeAαC、2-氨基-3-甲基-咪唑并[4,5-f]-喹啉(IQ)、MeIQx的活化过程产生影响,从而抑制基因毒性的产生。Viegas等研究黄腐酚在人肝癌细胞中对HAAs MeIQx和PhIP基因毒性作用的影响,结果表明,黄腐酚随着添加量的增加会使葡萄糖醛酸转移酶(UDP-glucuronosyltransferases,UGT)含量增多,从而降低杂环胺代谢及抑制基因毒性的产生。
CYP450酶在整个代谢活化过程中也起着重要的作用。在CYP450酶催化作用下,杂环胺环外氨基的N发生氧化反应形成氮-羟基-杂环胺(N-OH-HAAs)衍生物,之后会通过乙酰化反应和磺化反应形成-乙酰基杂环胺衍生物和-磺酸基杂环胺衍生物进一步与DNA结合形成DNA-杂环胺(DNA-HAAs)加合物,最终的加合物会产生基因毒性。因此,可以采用重组V79细胞、CYP1A酶、黄腐酚等物质来抑制CYP450酶活性,从而降低杂环胺体内代谢活化及抑制基因毒性的产生。
4.2.3 酶降低杂环胺遗传毒性
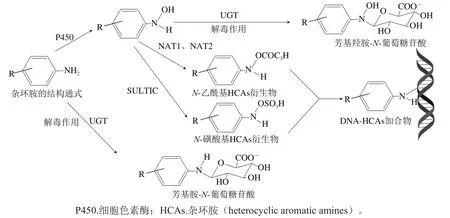
图6 酶在人体代谢中对杂环胺解毒机制Fig. 6 Mechanism of enzymatic detoxification of heterocyclic amines in the body
杂环胺具有一定的遗传毒性,在体内长期蓄积会对人体造成致癌及致突变性。因此,可以采用UGT和GST抑制杂环胺衍生物的生成,从而有效降低其遗传毒性,具体过程见图6。Cai Tingting等研究UGT对杂环胺遗传毒性的影响,结果表明,UGT对极性和非极性杂环胺如AαC、PhIP等均起到解毒作用,从而有效降低杂环胺的遗传毒性。Tang Yijin等研究UGT对AαC非极性杂环胺遗传毒性的影响,结果表明,UGT对非极性杂环胺AαC起到解毒作用,从而能有效降低在人体中的遗传毒性。Huber等在大鼠器官中加入咖啡研究其对UGT和GST及杂环胺遗传毒性的影响,结果表明,咖啡中的咖啡因能提高UGT和GST的解毒活性,有效降低DNA-杂环胺(DNAHAAs)加合物形成,减少其遗传毒性。
杂环胺是通过细胞色素P450在单加氧酶的催化反应下,使得外环氨基上的N发生氧化反应生成氮-羟基-杂环胺(N-OH-HAAs)衍生物,再进一步发生乙酰和磺化反应生成-乙酰基/-磺酸基衍生物,最后与DNA分子结合形成DNA-杂环胺(DNA-HAAs)加合物表现出一定的基因毒性。而UGT和GST的加入可以降解杂环胺代谢产物,具有解毒作用,从而降低杂环胺的遗传毒性。
4.2.4 运用NER
杂环胺的遗传毒性机理主要通过其氧化生成氮-羟基-杂环胺(N-OH-HAAs)衍生物,最后与DNA分子结合形成DNA-杂环胺(DNA-HAAs),加合物从而表达出一定的基因毒性。因此,可以采用NER对表达基因进行修复,切除表达基因中形成DNA-HAAs加合物部分,从而有效控制杂环胺的遗传毒性。Mu Hong等采用NER处理DNA加合物,结果表明,利用NER可以有效切除DNA加合物部分,从而抑制DNA加合物的遗传毒性。Fahrer等研究采用NER对DNA-PhIP加合物的影响,结果表明,利用NER可以从表达基因中有效切具有高度致癌DNA-PhIP加合部分,从而抑制DNA-PhIP加合物的遗传毒性。
DNA-杂环胺(DNA-HAAs)加合物遗传毒性最有效调控方法是采用NER。主要步骤:1)识别DNA-HAAs加合物所在位置;2)通过DNA解旋酶使DNA-HAAs加合物解旋变成单链DNA,之后切割具有遗传毒性DNA-HAAs加合物的基因片段;3)DNA聚合酶会填充切割部位,重新形成无基因毒性的DNA双螺旋分子,从而有效抑制DNA-HAAs加合物的遗传毒性。
5 结 语
本文综述了高温肉制品在热加工过程中杂环胺的形成途径、体内代谢途径以及防控方法,并对其进行了总结(图7)。肉制品热加工过程中形成杂环胺的途径主要有两条,一是通过自由基途径和美拉德反应形成AIAS;另一途径是通过美拉德反应形成ACS。而杂环胺进入机体后毒性效应途径主要为在单加氧酶的作用下生成氮-羟基-杂环胺(N-OH-HAAs)衍生物,之后与DNA分子结合形成DNA-杂环胺(DNA-HAAs)加合物,从而产生“三致”毒性。基于此,提出肉制品加工应合理选择加热方式,合理选择用油,适当添加糖、金属阳离子、天然香辛料、抗氧化剂等,从而尽量降低杂环胺的产生。杂环胺被摄入后应通过降低活性、抑制活化过程、酶解解毒、NER等方法减少其在体内消化吸收,调节其体内代谢过程,从而降低其毒性效应。
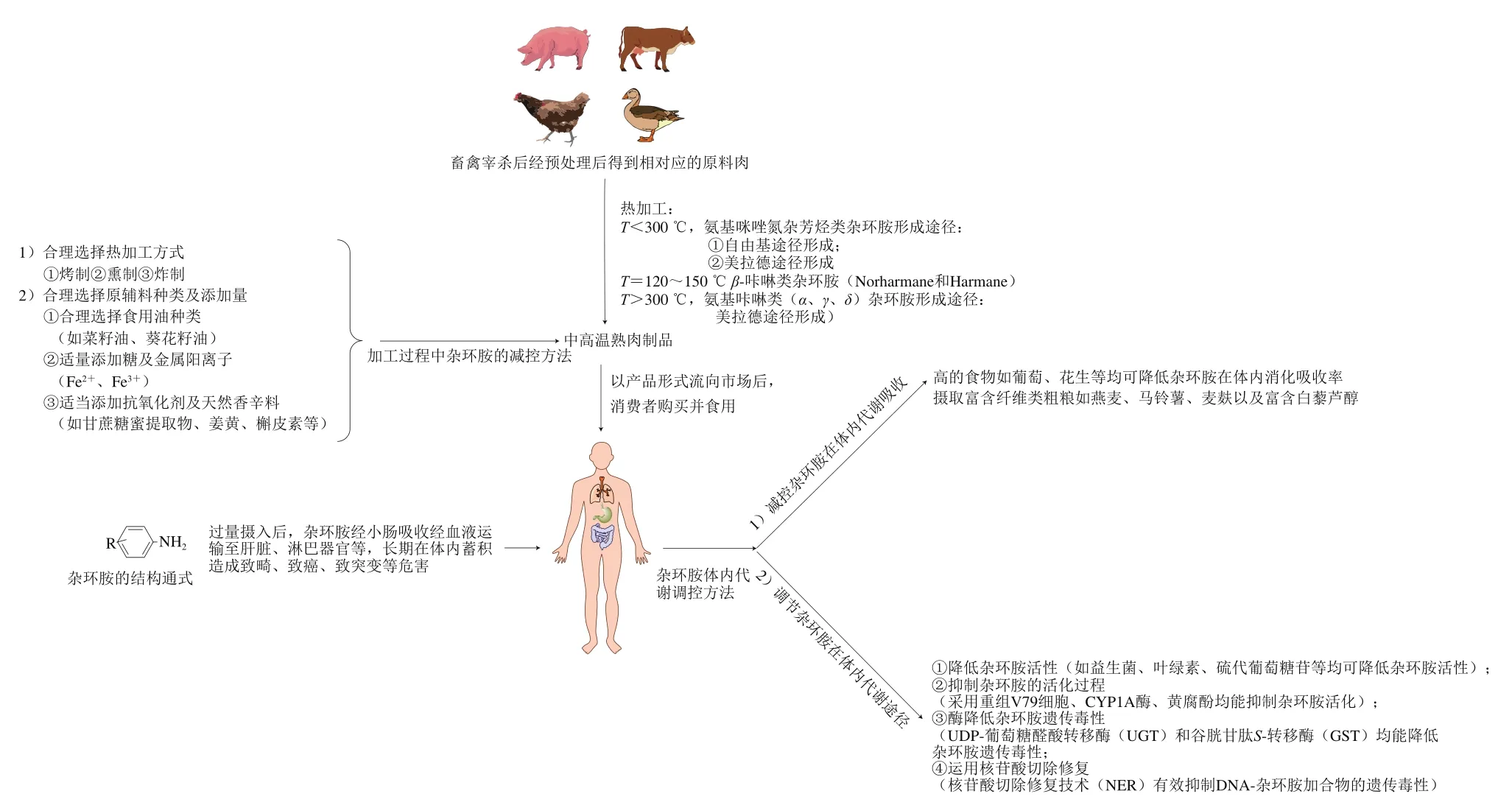
图7 加工过程及体内代谢杂环胺防控方法Fig. 7 Processing and prevention methods of heterocyclic amines in body metabolic
近年来,蒸汽辅助焙烤、过热蒸汽烤制等新型烤制技术正逐渐应用在高温肉制品的热加工中,热加工方式的创新,获得了更加安全的产品品质,但这些新型烤制技术对于杂环胺的减控机制有待进一步明确,效果有待进一步提高。DNA-杂环胺加合反应与生物活性及解毒作用有着密切关系,随着蛋白质组学、脂质组学及代谢组学、人体生物监测技术等快速发展,从杂环胺与DNA等加合反应方面进行深入系统的研究,必将为杂环胺的有效控制提出更多的技术与办法。

