减毒狂犬病病毒CTN181-3株免疫学特性研究
石磊泰,邹 剑,李玉华,俞永新
狂犬病是一种由狂犬病病毒感染引起的自然疫源性疾病,人和所有温血动物都可能被感染。狂犬病的潜伏期一般为1~3个月,发病后都会出现致命的脑脊髓炎。到目前为止,还没有特效治疗药物,唯一有效的方法就是接种疫苗。据80多个狂犬病流行国家的调查数据,犬是最危险的宿主。在这些地区,每年有3万多人因疯犬咬伤致死。超过98%的人类狂犬病病例是由犬传播的,90%以上接受暴露后疫苗接种的人口居住在犬类狂犬病流行的地区[1]。因此,在控制和消灭人类狂犬病的根本措施中,除了对人进行有效的疫苗接种外,还需要对犬进行大规模免疫。该方法已在多个国家和地区应用并取得明显效果。由于犬肌肉注射疫苗的难度和局限性,世界卫生组织(WHO)提倡和鼓励动物特别是犬类口服免疫的发展和应用。
在西欧、中欧、加拿大和美国大部分地区应用减毒活疫苗通过诱饵投放的方式口服免疫野生动物,已成功消除当地的狐狂犬病并达到减少和控制人狂犬病的效果[2-4]。同时,WHO极力鼓励研究和发展安全有效的犬用诱饵口服疫苗用于家犬,并已制定了现场应用口服犬用疫苗指南[5],一些高度减毒的减毒株如SAG2和VRG株已被WHO建议用于流浪犬的口服免疫[6-7],并已在很多国家广泛应用[8-10]。
我们实验室对犬用口服狂犬病减毒活疫苗的研究早在20世纪80年代就开始了,并且已经培育出一种毒力较小的减毒株CTN-181[11]。但CTN-181对4周以下的小鼠有致病性[12],而且该病毒具有异质性和遗传稳定性差等缺点。为了进一步筛选出同质性更高、减毒特性更稳定、免疫原性更好的减毒株,我们将狂犬病毒减毒株CTN-181通过豚鼠颌下腺传3代,用BHK21细胞空斑纯化,共筛选出20 个病毒空斑。不同病毒对3周龄小鼠的毒力差异很大,较高者的病毒滴度达到3.16 lgLD50/mL,较低者则无致病性[13]。无致病性的空斑病毒共有3株,我们将其中一株CTN181-3用于暴露前和暴露后免疫学研究,以揭示CTN181-3的生物学特性。
1 材料与方法
1.1 毒种和细胞 狂犬病毒CTN181-3株,病毒颗粒浓度为6.60lgPFU/mL,由本室筛选并-80 ℃保存[11,14];狂犬病毒CVS攻击毒株,1976年10月从世界卫生组织引进[15],病毒滴度为6.5 lgLD50/mL, -80 ℃保存;BSR细胞(81代)由巴斯德研究所提供,由我室传代保存。
1.2 实验动物 BALB/c小鼠,SPF级,10~12 g,由中国食品药品检定研究院动物繁育场提供;8周龄雌性金黄地鼠,SPF 级,由北京维通利华实验动物技术有限公司提供。所有动物实验操作均遵循我国《实验动物管理条例》有关动物福利的要求。
1.3 暴露前免疫
1.3.1 小鼠口腔/肌肉接种 用CTN181-3对10~12 g BALB/c小鼠进行口腔免疫/肌肉1次,0.1 mL/只,每种途径各免疫40只;免后4 d、7 d、14 d、21 d和28 d分别取6只小鼠眼球采血/取脾,用快速免疫荧光灶抑制试验[18](RFFIT)法分别测每只小鼠的血清中和抗体水平;用固相酶联免疫斑点技术(ELISPOT)法分别测每只小鼠的细胞免疫水平,计算均值。28 d时对剩余的10只小鼠, CVS融化后稀释 10 倍取 140 μL 加到 60 mL 稀释液中混匀,即为脑内攻击毒,每只脑内注射0.03 mL,病毒攻击量为1.5 lgLD50/只小鼠;以CVS固定毒作脑内攻击,观察保护效果。
1.3.2 金黄地鼠口腔/肌肉接种 用CTN181-3对8周龄金黄地鼠进行口腔免疫/肌肉1次,0.1 mL/只,每种途径各免疫6只,免后14 d、28 d分别进行心脏采血,用RFFIT法分别测血清中和抗体水平;于28 d用CVS肌肉接种攻击,攻击部位为左后肢肌肉。取融化后的CVS稀释100倍即为肌肉攻击毒,每只肌肉注射0.1 mL,病毒攻击量为3.5 lgLD50/ 只金黄地鼠;以CVS固定毒作脑内攻击,观察保护效果。
1.4 暴露后免疫 以3.5 lgLD50/只病毒量的狂犬病攻击毒CVS对金黄地鼠肌肉感染进行攻击暴露,暴露6 h后进行疫苗免疫,免疫部位与暴露部位相同,分别按以下程序免疫CTN181-3两组,一组用vero细胞灭活狂犬病疫苗,另一组用灭活苗+狂犬病免疫球蛋白,每只0.1 mL。CTN181-3的病毒滴度为6.60 lgPFU/mL;Vero细胞灭活苗效价为5.1 IU/mL;狂犬病免疫球蛋白(效价181 IU/mL)按20 IU/kg体重注射量计算(金黄地鼠按120 g/只计算),每只注射30 μL;对照组接种PBS溶液。观察期为21 d,免疫程序如表1。
表1 暴露后研究免疫程序Tab.1 Immunization procedure of post-exposure study
2 结 果
2.1 CTN181-3株不同途径免疫的抗体应答
2.1.1 不同途径免疫小鼠后的抗体应答水平 对小鼠而言,无论口腔免疫还是肌肉免疫,仅免疫1次,均表现十分良好的抗体应答。肌肉免疫后4 d,抗体阳转率约为50%,至7 d时100%阳转。口腔免疫虽然抗体增长较慢,但免后14 d抗体亦全部阳转,几何平均滴度(GMT)为1.34 IU/mL,至28 d GMT高达12.3 IU/mL,实验结果见图1。
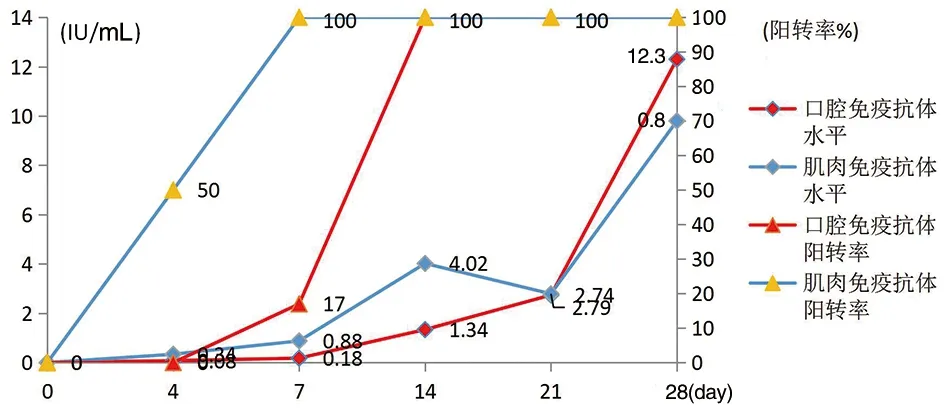
图1 不同途径免疫小鼠后的抗体应答动态Fig.1 Dynamics of antibody response after different route of immunization in mice
2.1.2 不同途径免疫金黄地鼠后的抗体应答水平 对金黄地鼠而言,无论口腔免疫还是肌肉免疫,仅免疫1次,均表现十分良好的抗体应答,口腔免疫后14 d的阳转率为100%,GMT为5.0 IU/mL,免后28 d时抗体水平略有下降,阳转率为50%,GMT为0.70 IU/mL;肌肉免疫后14 d的阳转率为100%,GMT为5.9 IU/mL,免后28 d时抗体水平进一步提高,阳转率均为100%,GMT大于11.0 IU/mL,见表2。

表2 金黄地鼠对CTN181-3不同途径、不同时间的抗体应答水平Tab.2 Antibody response level of golden hamster to different routes and time of CTN181-3
2.2 CTN181-3株不同途径免疫小鼠后的细胞免疫应答
2.2.1 口腔免疫后的细胞免疫应答 CTN181-3株口腔免疫小鼠1次,7 d后开始产生有统计学差异的IFN-γ(图2)和IL-2(图3),7 d后应答水平均继续升高。
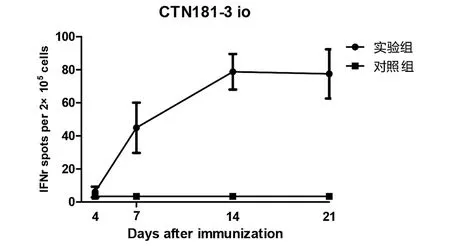
图2 小鼠口腔免疫CTN181-3株后的IFN-γ水平动态Fig.2 IFN-γ levels in mice after oral immunization with CTN181-3 strain
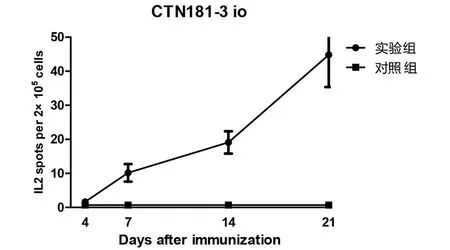
图3 小鼠口腔免疫CTN181-3株后的IL-2水平动态Fig.3 IL-2 levels in mice after oral immunization with CTN181-3 strain
2.2.2 肌肉免疫后的细胞免疫应答 CTN181-3株肌肉免疫小鼠1次,7 d开始产生有统计学差异的IFN-γ(图4)和IL-2(图5)免疫应答,7 d后应答水平继续升高。
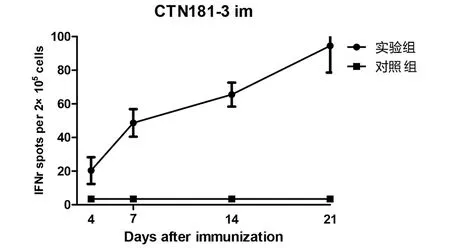
图4 小鼠肌肉免疫CTN181-3株后的IFN-γ水平动态Fig.4 IFN-γ levels in mice after immunized with CTN181-3 strain
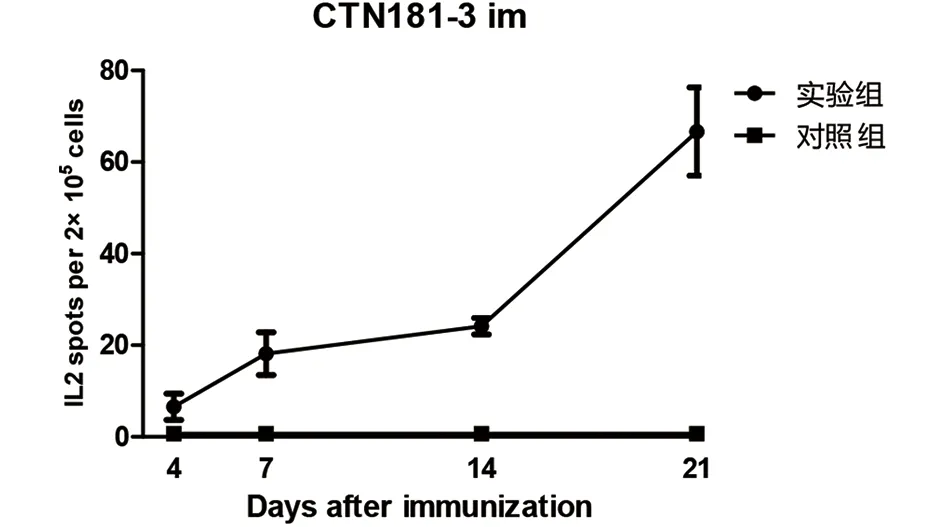
图5 小鼠肌肉免疫CTN181-3株后的IL-2水平动态Fig.5 IL-2 levels in mice after immunized with CTN181-3 strain
2.3 CTN181-3株的保护效果
2.3.1 暴露前免疫保护效果 CTN181-3株通过口腔和肌肉两种免疫途径,仅免疫1次,28 d后小鼠经脑内,金黄地鼠经肌肉CVS攻击,两种免疫途径小鼠的保护率均为100%,金黄地鼠的保护率分别为67%和100%,口腔免疫的保护力较低,可能与金黄地鼠体重比小鼠大得多而接种量相同有关,结果见表3。

表3 CTN181-3对小鼠和金黄地鼠不同免疫途径的保护力Tab.3 Protective effects of CTN181-3 on different pathways in mice and golden hamster
2.3.2 暴露后免疫保护效果 CVS病毒攻击8周龄金黄地鼠后6 h,按不同分组进行免疫,免疫后逐日观察,记录动物的发病死亡情况,到观察期结束,分别计算各组动物的保护率。结果见表4。
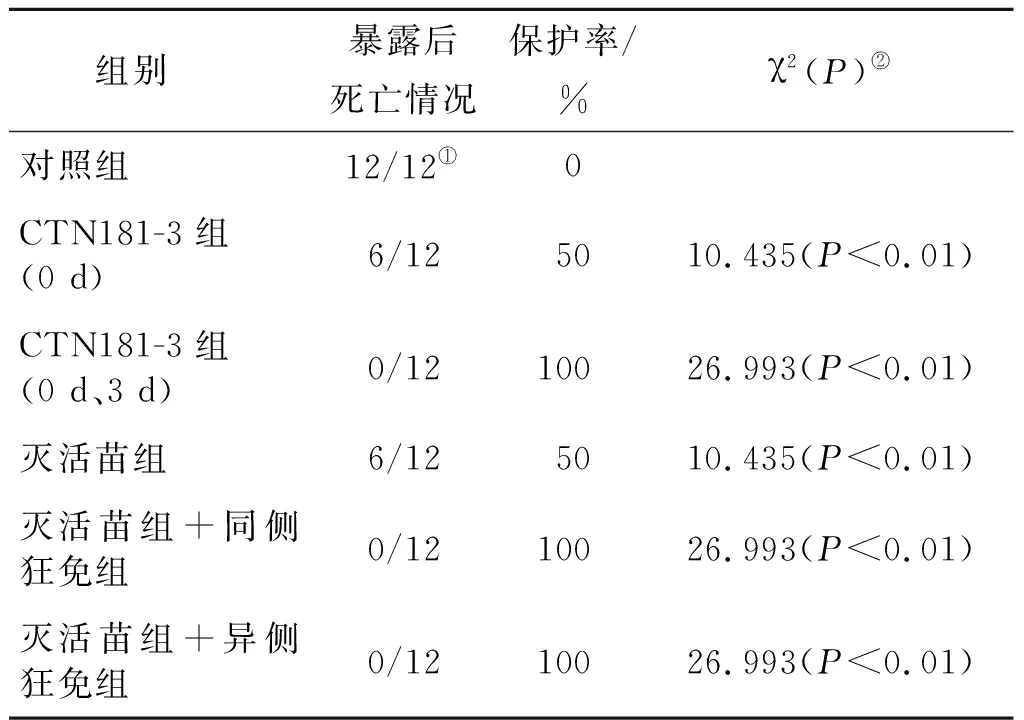
表4 CTN181-3对金黄地鼠暴露后免疫的保护效果Tab.4 Protective effect of CTN181-3 strain in golden hamster by post-exposure treatment(PET)
为更直观地表示金黄地鼠暴露后用不同疫苗免疫的保护情况,绘制存活率曲线,见图6。
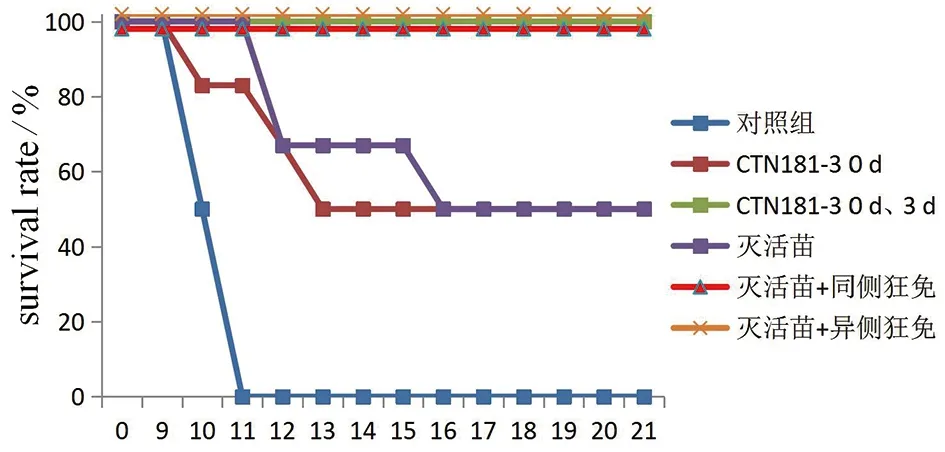
t/d图6 金黄地鼠暴露后用不同疫苗免疫的保护率Fig.6 Survival rate of golden hamster with different vaccines after exposure to rabies virus
表4和图6的结果显示,暴露狂犬病毒后,对照组的金黄地鼠用PBS溶液免疫,在暴露后第10 d和第11 d全部死亡,保护率为0;减毒株CTN181-3在0 d免疫1次,其保护率即能达到50%,若在3 d再加强免疫1次保护率可上升到100%;灭活苗组分别在0 d、3 d、7 d和14 d各免疫1次,保护率仅为50%;灭活苗组在0 d时使用狂犬病免疫球蛋白,无论在暴露同侧还是异侧使用,暴露后的保护率均能到达100%。然而,值得注意的是,减毒株CTN181-3在0 d免疫1次的保护率与灭活苗免疫4次对动物的保护率相当,可达50%。
3 讨 论
CTN181-3株具有很好的免疫原性,小鼠或金黄地鼠无论是口腔或肌肉免疫1针后,14 d的中和抗体阳转率均达100%,GMT达5 IU/mL以上,28 d后抗体水平升高达10 IU/mL以上,并对CVS固定毒的攻击保护率为67%~100%。
除了体液免疫,细胞免疫也是重要的免疫屏障。接种狂犬病疫苗后细胞因子的释放,已经在小鼠和人类中研究过[16-17]。CTN181-3株表现出明显的诱发细胞免疫的能力,用CTN181-3株口腔免疫或肌肉免疫小鼠后7 d后开始有统计学差异的IFN-γ和IL-2产生,说明疫苗免疫后早期(7 d)以IFN-γ和IL-2为代表的细胞免疫即已开始介入免疫保护效应。在接种 SAG2 的狐狸中也观察到减毒株诱导的细胞免疫现象。用 SAG2 免疫狐狸后,IFN-γ随之增加[18]。有研究描述了接种狂犬病疫苗早期后在体内诱导出大量IFN-γ,提示细胞因子作为生物体的一线防御机制发挥重要的抗病毒作用[19]。Barkhouse等的一项研究表明,IFN-γ的表达不仅可以提高疫苗的安全性,还可以提高暴露前后的有效性[20]。IL-2作为T细胞生长因子可诱导T细胞增殖,也可促进T、B淋巴细胞、巨噬细胞和NK细胞活化增殖,从而参与狂犬病毒激发的细胞免疫和体液免疫[21]。
也许是 IFN-γ和IL-2的作用,CTN181-3株在暴露狂犬病毒后表现出显著的保护效果。金黄地鼠暴露后用CTN181-3 于0 d免疫1次,保护率就能达到50%,这相当于灭活苗免疫3次的保护率;若在第3 d再加强免疫1次,保护率可上升到100%,与灭活疫苗和免疫球蛋白联合使用的效果相同。该结果与汤重发等[22]的研究结果一致,即以CTN181-3株免疫1次的保护率能到77%,免疫2次可达100%。
近年来,关于狂犬病毒减毒株的安全性和有效性的动物实验报道较多,认为这种高减毒活疫苗有望发展成为人用的暴露后免疫疫苗,这或许将是狂犬病疫苗发展的新方向。
利益冲突:无
引用本文格式:石磊泰,邹剑,李玉华,等. 减毒狂犬病病毒CTN181-3株免疫学特性研究[J].中国人兽共患病学报,2022,38(7):602-606. DOI:10.3969/j.issn.1002-2694.2022.00.088

