牛种布鲁氏菌A19-△VirB12标记疫苗双重实时荧光定量PCR方法的建立
马晓菁,叶 锋,2,刘丽娅,谷文喜,钟 旗,易新萍
布鲁氏菌病(简称“布病”)是由布鲁氏菌引起的人兽共患传染病,该病主要造成家畜生殖系统损害。人可通过密切接触患病动物及动物制品从而感染布病[1]。近十年来,我国布病流行形势较为严峻,畜间和人间布病感染率维持在较高水平,同时人间布病感染趋势也由主要的职业接触感染向非职业的食源性感染转变[2]。因此,牛场布病净化,是预防和控制布病的重要部分。
布病是动物源性疾病,通过控制家畜布病从而降低人间布病是一种低成本、高效益的防控措施[3]。疫苗免疫是我国家畜布病防控的重要策略,布病流行区主要采取以疫苗接种为主、检疫-扑杀为辅的防控策略。在布鲁氏菌疫苗的使用中,牛种布鲁氏菌A19疫苗最为有效且使用较为广泛,主要用于牛的免疫[4]。A19疫苗株外膜的脂多糖(LPS)含有O-侧链,可以持续刺激机体产生特异性抗体,从而使机体产生一定保护力。但疫苗免疫产生抗体和野毒感染产生抗体都是特异性抗体,无法通过血清学检测区分。易新萍等[6-7]应用同源重组的方法敲除布鲁氏菌IV型分泌系统中VirB12基因,获得牛布鲁氏菌A19缺失VirB12基因的突变株,即具有分子诊断标记的A19-△VirB12标记疫苗株。该标记疫苗株免疫保护力与亲本株A19无显著差异,但毒力弱于亲本株A19,已于2021年正式上市推广[8]。本研究以布鲁氏菌Ⅳ型分泌系统VirB8基因设计引物鉴别布鲁氏菌属,并以牛布鲁氏菌A19-△VirB12标记疫苗缺失的VirB12基因序列作为诊断标记,建立了区分牛布鲁氏菌A19-△VirB12标记疫苗株与自然感染株的双重实时荧光PCR方法,为今后快速、准确鉴别诊断分子标记疫苗免疫牛与野毒感染牛提供了快速、可靠的诊断方法。
1 材料与方法
1.1 菌种 实验中涉及的基因组DNA包括:牛种布鲁氏菌A19-△VirB12标记疫苗株、牛种布鲁氏菌A19疫苗株、羊种布鲁氏菌M5疫苗株、猪种布鲁氏菌S2疫苗株、大肠杆菌、沙门氏菌,均由新疆畜牧科学院兽医研究所保存。
1.2 仪器与试剂 实时荧光定量PCR仪(Applide Biosystems QuantStudio 5),普通PCR扩增仪(BIO-RAD T100TM Thermal Cycler)。荧光定量PCR试剂TaqProbe 2×qPCR Mix(宝生物工程(大连)有限公司);普通PCR Mix(北京庄盟国际生物基因有限公司);克隆载体pMD18-T(TaKaRa 公司);胶回收试剂盒和质粒提取试剂盒(北京全式金生物技术有限公司);细菌基因组 DNA 提取试剂盒(TaKaRa 公司)。
1.3 荧光定量PCR引物及探针 以布鲁氏菌Ⅳ型分泌系统VirB8基因序列及VirB12基因序列,分别设计探针及引物(表1),引物及探针均委托上海生工生物技术有限公司合成。

表1 荧光定量PCR引物及探针序列Tab.1 Sequence of primers and probes of duplex fluorescence PCR
1.4 标准质粒构建 根据布鲁氏菌VirB12基因序列(GenBank ID:LT671513.1)以及VirB8基因序列(GenBank ID: CP030752.1),应用软件Primer5.0设计引物,分别扩增VirB8基因片段,上游引物VirB8-F:ATGTTTGGACGCAAACAATCTCC,VirB8-R:TGCACAA CTCCCATTTCTGGAT;以及VirB12基因片段上游引物VirB12-F:GTCAGCTTCTC GCCAACACAAG,下游引物VirB12-R:CGTCGGAACCGCTCTATAGGTC。引物由上海生工生物技术有限公司合成。PCR反应体系和条件:25 μL体系,其中PCR Mix 12.5 μL,上、下游引物(1010μmol/L)各1 μL,牛种布鲁氏菌A19疫苗株基因组DNA模板1 μL,ddH2O补足25 μL。PCR反应程序:95 ℃ 10 min;95 ℃ 30 s,58 ℃ 30 s,72 ℃ 1 min,35个循环;72 ℃ 10 min。扩增产物切胶回收后连接pMD18-T载体后转化大肠杆菌DH5a,筛选阳性克隆后提取质粒测定浓度。
1.5 双重实时荧光定量PCR扩增 优化PCR反应体系中各引物与探针浓度,确定最佳扩增条件。荧光定量PCR扩增体系及反应条件:20 μL体系,其中TaqProbe 2×qPCR Mix 10 μL,引物VirB8-RF(10 μmol/L)及VirB8-RR(10 μmol/L)各0.6 μL,VirB12-RF(10 μmol/L)以及VirB12-RR(10 μmol/L)各0.2 μL,探针VirB8-P (10 μmol/L)和VirB12-P(10 μmol/L)各0.2 μL,待检DNA样品2 μL(50~200 ng),ddH2O补足20 μL。PCR反应程序:95 ℃预变性15 min,95 ℃ 3 s,64 ℃ 30 s,共40个循环。
1.6 双重实时荧光PCR特异性检测 分别以牛种布鲁氏菌A19-△VirB12标记疫苗株、牛种布鲁氏菌A19疫苗株、羊种布鲁氏菌M5疫苗株以及猪种布鲁氏菌S2疫苗株、大肠杆菌、沙门氏菌基因组DNA为模板,进行Realtime-PCR扩增,评价该方法特异性。
1.7 双重实时荧光PCR敏感性检测 分光光度仪测定布鲁氏菌VirB8基因和VirB12基因标准质粒质量浓度,质粒浓度分别为338.6 ng/μL及240 ng/μL,载体片段与VirB8基因扩增片段长度共为5 888 bp,载体片段与VirB12基因扩增片段长度共为3 423 bp。利用公式(1),分别计算标准质粒拷贝数。10倍系列稀释VirB12基因和VirB8基因重组质粒,分别以1010、109、108、107、106、105、104、103、102、101以及100copies/mL为模板,进行Realtime-PCR扩增,每个梯度设置 3 个复孔,绘制标准曲线,评价该方法的敏感性。
拷贝数(copies/L)=[6.02×1023×质粒质量浓度(ng/mL)×10-9]/[DNA长度(bp)× 660](1)
2 结 果
2.1 敏感性扩增及标准曲线的建立 布鲁氏菌VirB8基因和VirB12基因重组质粒浓度分别为1.24×1011copies/μL和3.78×1010copies/μL,将重组质粒稀释至1010~100copies/μL进行Realtime-PCR扩增,结果可见VirB8基因重组质粒灵敏度为102copies/μL(图1),绘制标准曲线斜率为-3.809 3,截距为44.284,相关系数为R2=0.996(图2),VirB12基因重组质粒灵敏度为103copies/μL(图3),绘制标准曲线斜率为-4.346 3,截距为50.025 1,相关系数R2=0.997(图4),结果表明已建立的双重实时荧光PCR方法误差较小。
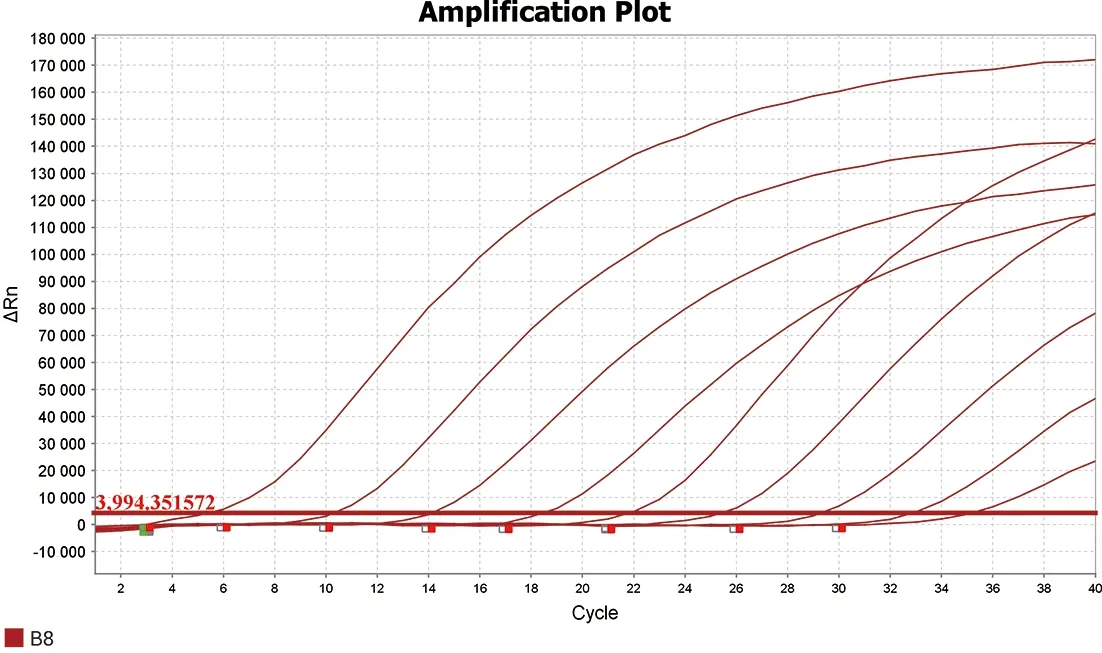
图1 不同拷贝数VirB8标准质粒扩增图Realtime-PCR扩增结果Fig.1 Real-time PCR results of VirB8 standard plasmid with different copies

图2 VirB8基因标准质粒不同拷贝数Realtime-PCR扩增标准曲线Fig.2 Realtime PCR amplification standard curve of VirB8 standard plasmid with different copies
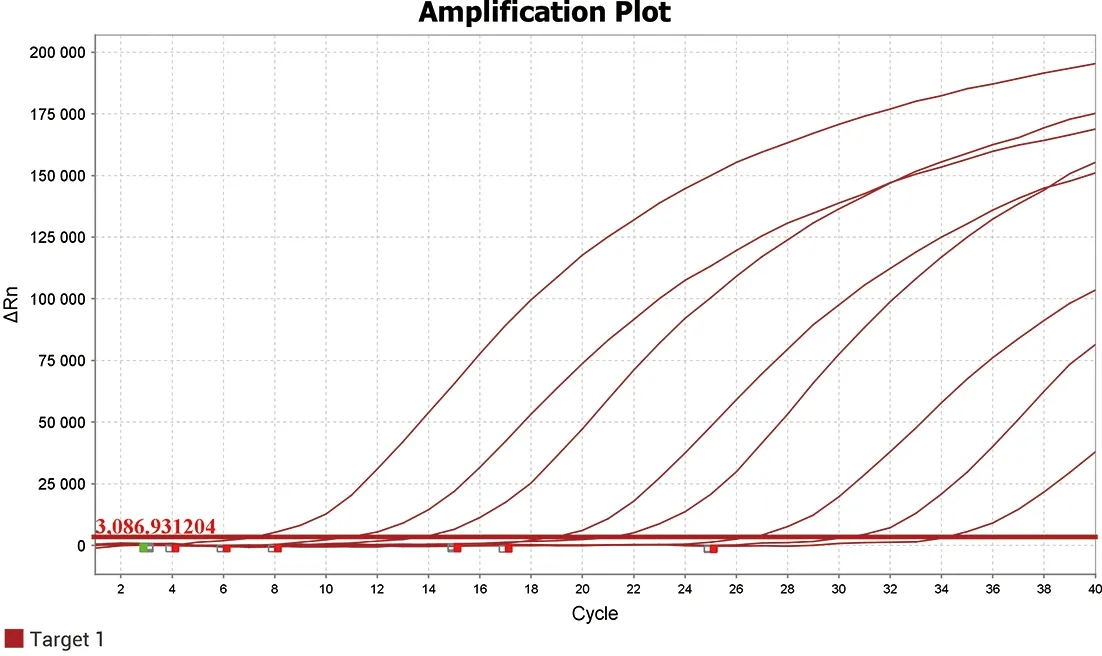
图3 VirB12基因标准质粒不同拷贝数Realtime-PCR扩增结果Fig.3 Real-time PCR results of VirB12 Standard plasmid with different copies
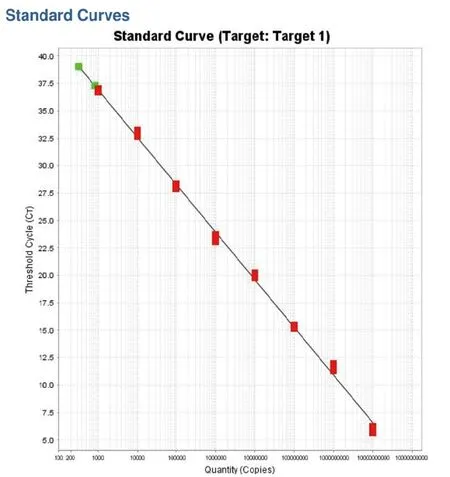
图4 VirB12基因标准质粒不同拷贝数Realtime-PCR扩增标准曲线Fig.4 Real-time PCR amplification standard curve of VirB12 standard plasmid with different copies
2.2 特异性扩增结果 以牛种布鲁氏菌A19-△VirB12标记疫苗株、牛种布鲁氏菌A19疫苗株、羊种布鲁氏菌M5疫苗株、猪种布鲁氏菌S2疫苗株、大肠杆菌和沙门氏菌基因组DNA为模板,灭菌水为空白对照,进行布鲁氏菌Realtime-PCR扩增,结果可见,牛种布鲁氏菌A19疫苗株、羊种布鲁氏菌M5疫苗株以及猪种布鲁氏菌S2疫苗株基因组DNA出现VirB8基因及VirB12基因两条扩增曲线,并获得相应Ct值(表2),牛种布鲁氏菌A19-△VirB12标记疫苗株基因组DNA仅VirB8基因扩增获得扩增曲线,Ct值为29.831,大肠杆菌、沙门氏菌基因组DNA与灭菌水均无扩增曲线,为阴性(图5),结果表明双重实时荧光PCR具有良好的特异性。

表2 双重实时荧光定量PCR扩增Ct值Tab.2 Ct values of dual real-time PCR

1-2:羊种布鲁氏菌M5疫苗株基因组DNA;3-4:牛种布鲁氏菌A19疫苗株基因组DNA;5-6:猪种布鲁氏菌S2疫苗株基因组DNA;7:牛种布鲁氏菌A19-△VirB12标记疫苗株基因组DNA8:大肠杆菌基因组DNA;9:沙门氏菌基因组DNA;10:灭菌水 图5 双重荧光定量PCR特异性扩增结果Fig.5 Specific amplification results of duplex realtime-PCR
3 讨 论
我国是畜牧业大国,近年来布鲁氏菌病流行形势仍较为严峻,不仅对畜牧业发展造成影响,同时危害公共卫生安全。疫苗免疫在家畜布病防控和根除过程中具有重要的意义,尤其在布病流行较为严重的地区[9]。2016年我国出台《布鲁氏菌病防治计划(2016-2020年)》,其中明确在全国范围内,家畜布病防治实行区域化管理,采取以免疫接种、监测净化、风险防范等为主的防治策略[10]。
目前布病防控仍以布鲁氏菌弱毒活疫苗为主[11]。我国生产的布鲁氏菌弱毒活疫苗主要有猪种布鲁氏菌S2、羊种布鲁氏菌M5/M5-90株、牛种布鲁氏菌A19株以及牛种布鲁氏菌A19-△VirB12疫苗株[8],其中牛种布鲁氏菌A19疫苗株是19世纪50年代从苏联引进的S19株。S19疫苗自19世纪30年代起便在全球范围内广泛用于奶牛布病的预防,是世界公认的奶牛布病防控的最有效疫苗[12-13]。A19疫苗株为光滑型布氏菌,免疫后能够持续刺激机体产生抗体,但由于疫苗免疫产生抗体与布氏菌野毒感染产生抗体均为特异性抗体,因此用现有的血清学诊断方法无法将疫苗免疫抗体与自然感染抗体区分,影响疫苗免疫地区布病的检疫及净化。牛种布鲁氏菌A19-△VirB12疫苗株是以我国A19疫苗为亲本株,应用同源重组技术敲除布鲁氏菌IV型分泌系统中VirB12基因而构建的突变株,该突变株具有与亲本株相同的保护力,但毒力却低于亲本株,同时获得了诊断标记[6-7]。
布氏菌VirB8蛋白是IV型分泌系统中必备组成成分,也是早期分泌蛋白[14-15]。钟旗[16]等建立了VirB8-PCR方法用于布氏菌属检测,具有良好的特异性。实时荧光PCR是通过加入特异性荧光探针,通过收集荧光信号进行核酸实时检测的技术,可准确测定样品中DNA含量,且无需进行凝胶电泳检测,既缩短了检测时间,又避免了扩增产物的污染[17]。Winchell JM等[18]建立了区分羊种、牛种以及猪种布鲁氏菌Realtime-PCR,将荧光定量PCR方法应用于布鲁氏菌检测,并具有良好的特异性及敏感性。本研究依据布鲁氏菌VirB8基因片段可用于布鲁氏菌属鉴别,及牛种布鲁氏菌A19-△VirB12疫苗株无法扩增获得VirB12基因片段的特点,以布鲁氏菌VirB8基因以及VirB12基因序列设计引物及探针建立鉴别牛种布鲁氏菌A19-△VirB12疫苗株双重实时荧光PCR方法,该方法具有良好的特异性及敏感性,对VirB8基因和VirB12基因扩增灵敏度分别为102copies/μL、103copies/μL,相关系数分别为R2=0.996,R2=0.997,结果表明该方法误差较小。该方法仅用于鉴别区分牛种布鲁氏菌A19-△VirB12标记疫苗株与布鲁氏菌野毒株,无法鉴别牛种布鲁氏菌A19疫苗株与布鲁氏菌野毒株。
综上所述,本研究建立的双重实时荧光PCR方法具有良好的特异性、敏感性,在判定检测样品为布鲁氏菌的同时鉴别区分布鲁氏菌自然感染与A19-△VirB12疫苗株免疫,为今后布病的防控提供技术支撑。
利益冲突:无
引用本文格式:马晓菁,叶锋,刘丽娅,等. 牛种布鲁氏菌A19-△VirB12标记疫苗双重实时荧光定量PCR方法的建立[J].中国人兽共患病学报,2022,38(7):638-642. DOI:10.3969/j.issn.1002-2694.2022.00.075
——一道江苏高考题的奥秘解读和拓展

