急性脑出血“动态点征”区域CT灌注参数定量评估血肿扩大
王晓晨,王思慧,赵雪宁,孙胜军*
(1.北京市神经外科研究所放射科,北京 100070;2.首都医科大学附属北京天坛医院放射科,北京 100070)
急性脑出血(acute intracerebral hemorrhage, AICH)致死率、致残率高,血肿扩大预示预后不良。CT血管造影(CT angiography, CTA)可见“点征”提示血肿内对比剂渗漏,以之预测血肿扩大的敏感度为51%~78%[1];而CT灌注(CT perfusion, CTP)“动态点征”可反映血肿内强化灶的动态变化,其预测血肿扩大价值高于CTA“点征”[2]。目前对于脑出血后血肿内对比剂渗漏速率不同可致局部灌注参数改变尚不清楚。本研究测量CTP原始图像血肿内对比剂渗漏区域相对脑血流量(relative cerebral blood flow, rCBF)和相对脑血容量(relative cerebral blood volume, rCBV),评价以“动态点征”区域CTP参数量化预测血肿扩大的价值。
1 资料与方法
1.1 研究对象 回顾性分析2014年1月—2016年1月首都医科大学附属北京天坛医院经一站式CT检查诊断的45例AICH患者,男33例、女12例,年龄27~82岁、平均(56.6±12.4)岁;发病至CT检查时间(time to scan, TTS)<6 h、平均(2.91±1.76)h,并于24 h内复查平扫CT;29例累及基底节,6例累及大脑,5例累及丘脑,3例累及小脑,2例累及脑干;平均动脉压(164.62±19.74)mmHg、血糖(7.37±2.30)mmol/L,活化部分凝血活酶时间(activated partial thromboplastin time, APTT)为(27.49±3.93)s,美国国立卫生研究院卒中量表(National Institutes of Health stroke scale, NIHSS)评分(11.26±5.36)分,国际标准化比值(international normalized ratio, INR)为(0.98±0.06)。排除动脉瘤、脑血管畸形、肿瘤或外伤所致脑出血,脑梗死伴出血转化及复查前接受手术治疗者。
1.2 仪器与方法 采用Siemens Sensation 16排CT扫描仪,采集仰卧位全脑轴位平扫CT,参数:管电压120 kVp,管电流300 mA,FOV 24 cm×24 cm,矩阵512×512,幕上层厚9 mm,幕下4.5 mm。之后行CTP,经肘前静脉以8 ml/s流率注射40 ml碘海醇对比剂(300 mgI/ml),并以相同流率注射20 ml生理盐水冲管,4 s后采集包含血肿层面的图像,Z轴覆盖包含血肿病灶最大横切面水平的2个连续层面,参数:管电压80 kVp,管电流209 mA,转速1 s/rot,连续采集40 s,层厚12 mm,层间距0,每层扫描40次,总扫描时间44 s,总辐射剂量3.51 mSV。于入院24 h内复查CT,参数同上。
1.3 图像分析 将图像上传至Neurosoft图像存储与传输系统,由2名具有5年以上工作经验的神经影像学诊断医师以3D-Slicer软件逐层勾画血肿ROI,系统自动测量血肿体积;每名医师勾画2次,计算平均值,以复查血肿体积增加6 ml以上或较首诊增加33%以上为血肿扩大。根据首诊CTP原始图像判读“动态点征”,逐层观察动脉期至静脉窦期图像,调整窗宽为185、窗位为85(即点征窗)[3],将CTP原始图像显示血肿内非血管走行区存在1个或多个1~2 mm明显强化灶、其CT值为血肿区域1.5倍且除外钙沉积(平扫CT图像中表现为高密度)者判定为“动态点征”阳性;逐层观察“动态点征”出现时相,记录其总出现时间(s)。根据是否存在“动态点征”将患者分为阳性组(n=21)和阴性组(n=24)。2名医师意见存在分歧时,经讨论达成共识。
采用Neusoft V 2.1灌注软件测量灌注参数。以大脑前动脉为输入动脉、上矢状窦为输出静脉,获取灌注参数图。分别于阳性组CTP示“点征”区域(强化区)及血肿全部区域勾画ROI;于阴性组CTP肉眼所见血肿内密度最高区域(强化区)和血肿全部区域勾画ROI;排除rCBF>100 ml/(min·100 g)区域。对各ROI的rCBF及rCBV均测量3次,取平均值(图1、2)。
1.4 统计学分析 采用SPSS 22.0统计分析软件。以频数表示计数资料,组间行χ2检验;以±s表示符合正态分布的计量资料,组间行两独立样本t检验;以中位数(上下四分位数)表示不符合正态分布的计量资料,组间行Wilcoxon秩和检验。绘制受试者工作特征(receiver operating characteristic, ROC)曲线,计算曲线下面积(area under the curve, AUC),评价强化区灌注参数评估血肿扩大的效能。以Spearman相关性分析评估阳性组血肿体积变化与“动态点征”总出现时间的相关性。P<0.05为差异有统计学意义。
2 结果
2.1 基本资料 阳性组TTS小于阴性组(P<0.05),其余组间差异均无统计学意义(P均>0.05),见表1。
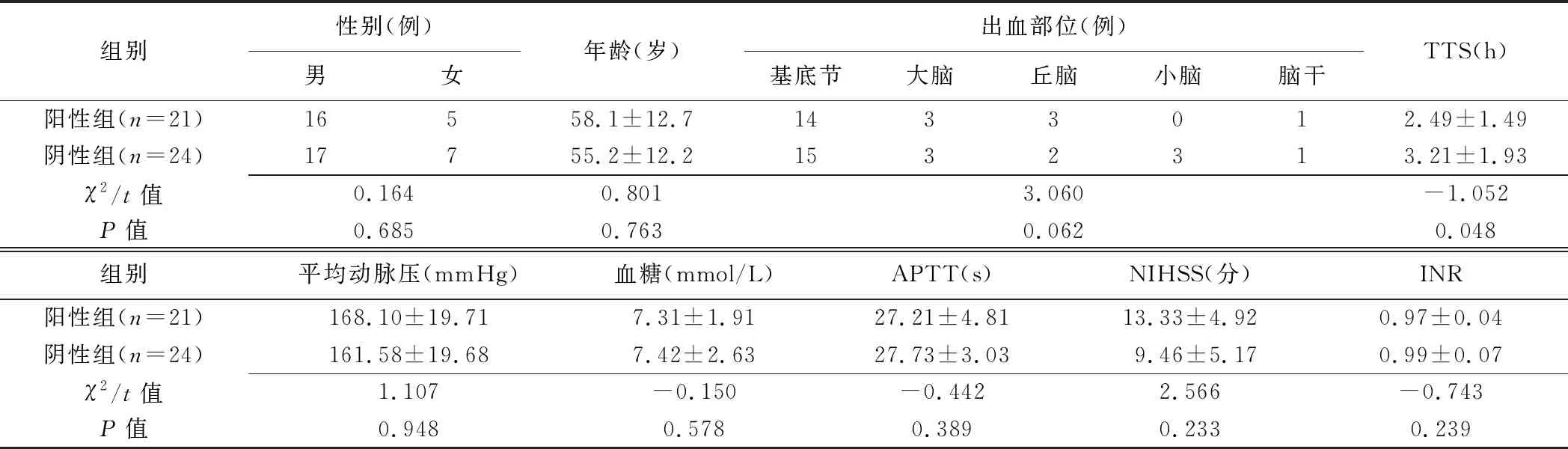
表1 CTP“动态点征”阳性与阴性AICH 患者基本资料比较
2.2 血肿体积与灌注参数 2组首诊血肿体积差异无统计学意义(P>0.05)。复查CT,阳性组血肿体积明显大于阴性组(P<0.05),阳性组17例(17/21,80.95%)、阴性组2例(2/24,8.33%)血肿扩大,差异有统计学意义(P<0.05)。见表2。

表2 CTP“动态点征”阳性与阴性AICH患者血肿体积比较(ml)
阳性组强化区rCBF、rCBV,强化区与血肿区rCBF、rCBV差值均显著高于阴性组(P均<0.05);组间血肿区灌注参数差异均无统计学意义(P均>0.05),见表3。

表3 CTP“动态点征”阳性与阴性AICH患者灌注参数比较
2.3 强化区灌注参数评估血肿扩大 45例中,19例血肿扩大,26例未扩大。以rCBF=8.90 ml/(min·100 g)和rCBV=6.55 ml/100 g为截断值,预测血肿扩大的AUC分别为0.877和0.889,敏感度分别为84.20%和89.50%,特异度分别为88.50%和84.60%,见图3。
2.4 血肿体积变化与“动态点征”总出现时间的相关性 Spearman相关性分析显示,阳性组血肿体积变化与“动态点征”总出现时间呈正相关(r=0.628,P<0.05)。
3 讨论
血肿扩大是唯一与脑出血预后高度相关且可加以干预的潜在靶点[4],积极探索其预测指标极为重要。脑出血血肿扩大机制研究中,“雪崩”模型获得广泛认可,即血肿压迫周边组织致小血管断裂,使其范围进一步扩大[5]。WADA等[6-7]提出CTA“点征”,即血肿内小血管破裂可致其扩大;但CTA“点征”仅能在注射对比剂后动脉高峰期获得,易遗漏发生于毛细血管期或静脉期对比剂渗漏[8],虽然延迟CTA或多期相CTA可提高 “点征”检出率[9],但脑出血患者依从性多较差,多期相检查难以避免伪影。利用CTP对选定层面进行连续重复扫描可缩短检查时间,能早于常规CTA发现对比剂渗漏[10]; CTP“动态点征”显示率高于CTA“点征”,以之预测血肿扩大的敏感度和特异度更高[2]。
本研究基于Patlak示踪动力学模型(即假设对比剂仅从血管内向血管外细胞外间隙流动而无回流,适用于评估血脑屏障破坏后灌注情况)量化观察rCBF、rCBV,结果显示阳性组“动态点征”区域rCBF、rCBV及强化区与血肿区rCBF、rCBV差值均显著高于阴性组血肿内密度最高区域,与WADA等[6]的结论相符合;分析原因,可能主要在于“动态点征”阳性代表血肿内小动脉破裂,出血速度快,持续时间长,导致局部灌注改变明显,血肿扩大风险较高,而阴性组可能仅有小静脉破裂或血肿内无血管破裂,出血速度慢或持续时间短,不足以引起局部灌注参数改变,故24 h内血肿保持稳定。刘艳华等[11]认为基线体积较大的血肿更易扩大。本研究首诊血肿体积组间差异无统计学意义,可能与样本量较小有关,有待继续观察。
多数情况下,出血时间越长,血肿越趋于稳定;不稳定血肿患者症状更为明显,入院时间可能更早[12-13]。本研究阳性组TTS短于阴性组,提示对发病时间较短的急性期脑出血患者应给予积极治疗,以避免血肿进一步扩大、降低病死率及改善神经功能[14]。
本研究的主要局限性:①单中心回顾性观察,样本量小;②仅针对血肿层面采集CTP,可能遗漏部分信息;③勾画ROI难以避免操作者主观因素的影响。
综上,对早期AICH行CTP有助于动态观察血肿内对比剂渗漏;量化评估“动态点征”区域灌注参数可反映活动性出血所致局部血流动力学变化及预测血肿扩大。

