微波纳米解冻对秘鲁鱿鱼保水性和蛋白结构的影响
朱文慧,郭慧芳,单春雨,步 营,李学鹏,励建荣,宦海珍
(渤海大学食品科学与工程学院 辽宁省高校重大科技平台食品贮藏加工及质量安全控制工程技术研究中心 辽宁锦州 121013)
秘鲁鱿鱼隶属柔鱼科,其肉质比其它鱿鱼鲜嫩[1],可食部分高,是一种高蛋白、低脂肪的水产品种类[2]。秘鲁鱿鱼是远洋海产经济动物,捕捞后需立即冻结。冷冻水产品加工前必须经过解冻,不恰当的解冻会给产品质量造成很大的影响,如解冻过程冰晶破坏细胞组织结构,导致溶酶体、促氧化剂的释放,加快蛋白氧化,使解冻品质大大降低。理想的解冻方式是产品解冻快速、均匀。
微波解冻(Microwave thawing,MT)是近年来报道的新型解冻方法之一,它的解冻效率高,能大大缩短解冻时间,然而其具有解冻不均匀,解冻过程中造成大量汁液流失的缺点。有研究表明,分散在溶液中的纳米粒子在暴露于交流磁场时可以将电磁能转化为热量[3],胞外Fe3O4纳米粒子磁感应加热(Magnetic induction heating,MIH)可以显著抑制再加热过程中的失透或重结晶[4]。有学者通过数值模拟研究了超顺磁性纳米粒子在低温保存样品中的微波复温过程,结果表明,纳米粒子显著提高了升温速率,对低温保存样品的复温有积极作用[5]。本课题组前期已研究证明微波纳米解冻(Microwave nanoparticles thawing,MNPT)能够减少冰晶对肌肉纤维的损伤,提高肌肉的保水性,实现快速、均匀解冻[6]。然而,微波纳米解冻对鱿鱼蛋白氧化和持水能力的影响尚未见报道。本研究建立羟自由基氧化体系,探讨MNPT 对秘鲁鱿鱼保水性、肌原纤维蛋白的影响,为其后续提高解冻品质,降低蛋白氧化提供一些理论参考。
1 材料与方法
1.1 材料与试剂
冻结的秘鲁鱿鱼由锦州市古塔区海英水产商店提供,冻藏运回实验室,快速分割成质量约160 g 左右正方体,放于-80 ℃超低温冰箱备用。
三羟甲基氨基甲烷(Tris)、2,4-二硝基苯(2,4-Dinitrophenylhydrazone,DNPH)、磷酸二氢钠、磷酸氢二钠购自国药集团化学试剂有限公司、乙二胺四乙酸 (Ethylene diaminete traacetic acid,EDTA)、盐酸、三氯乙酸(TCA)、盐酸胍(均为分析纯级)购自南京圣比奥生物科技公司;尿素、氯化钠购自福晨化学试剂有限公司;Fe3O4磁性纳米粒子 (Magnetic nanoparticles,MNPs)(粒径20~50 nm)购自成都艾科达化学试剂有限公司。
1.2 仪器与设备
Testo 106 型高精度食品温度计,德国德图集团;Bio-Rad 电泳仪,美国Bio-Rad 公司;FJ200-SH 型实验室均质机,上海标本模型厂;ORVALL Stratos 型冷冻高速离心机,美国Thermo 公司;970CRT 荧光分光光度计,上海棱光公司;UV-2550 紫外-可见光分光光度计,岛津仪器(苏州)有限公司;低场核磁共振分析仪,上海纽迈科技有限公司;NN-DF392B 微波炉,松下电器(中国)有限公司。
1.3 试验方法
1.3.1 样品处理 在前期研究的基础上,本试验选用MT 条件为微波功率500 W,MNPT 条件为微波功率500 W,MNPs 质量浓度为1 mg/mL。以冻结的秘鲁鱿鱼胴体为原料,将鱿鱼切分成6 cm×6 cm×2 cm 的长方体。
将鱿鱼取出放在不同浓度的H2O2溶液(抗坏血酸浓度为0.1 mmol/L、FeCl3浓度为0.01 mmol/L,H2O2浓度分别为1,5,10,50 mmol/L) 的羟自由基氧化体系(各处理组设为MT-1,MT-5,MT-10,MT-50)模拟肌肉氧化,MT 解冻至中心温度0 ℃。将鱿鱼取出放在不同浓度的H2O2溶液(抗坏血酸浓度为0.1 mmol/L、FeCl3浓度为0.01 mmol/L,H2O2浓度分别为0,1,5,10,50 mmol/L) 的羟自由基氧化体系 (各处理组设为MNPT-0,MNPT-1,MNPT-5,MNPT-10,MNPT-50) 模拟肌肉氧化,MNPT 解冻至中心温度为0 ℃。
1.3.2 肌原纤维蛋白的提取 根据李学鹏等[7]的方法略作修改。将解冻后的鱿鱼肉搅碎,加4 倍重量的Tris-HCl(pH 7.2,20 mmol/L),均质20 s,接着在5 000 r/min 条件下离心15 min,重复2 次。去上清液,加入4 倍沉淀质量的20 mmol/L Tris-HCl-NaCl 缓冲液 (含0.6 mol/L NaCl,pH 7.2)混匀均质,然后在5 000 r/min 条件下离心15 min,取上清液置于-20 ℃冰箱中保存备用(3 d 内用完)。
1.3.3 保水性的测定 蒸煮损失率和离心损失率参考宦海珍[1]的方法进行测定。
1.3.4 低场核磁共振 鱿鱼样品解冻后,切成10 mm×10 mm×20 mm 的长方体,放入核磁管,采用Carr-Purcell-Meiboom-Gill(CPMG)脉冲序列,在32 ℃下进行横向弛豫时间T2的测定。设定参数:SFI=22 MHz,P90=16.5 μs,SW=200 KHz,TR=2 000 ms,NS=8,τ=100 μs,回波个数=4 000。
1.3.5 羰基含量的测定 根据Oliver 等[8]的方法略作修改。取1 mL 1.0 mg/mL 肌原纤维蛋白溶液,加入1 mL 10 mmol/L DNPH 溶液(含2 mol/L HCl)。在室温下避光静置1 h (每15 min 振荡一次)。加入4 mL、20%的TCA,10 000 r/min 条件下离心15 min,弃去上清液。取1 mL 乙酸乙酯和乙醇(V乙酸乙酯∶V乙醇=1∶1)冲洗沉淀3 次,加入3 mL 6 mol/L 盐酸胍溶液,37 ℃水浴25 min 使沉淀溶解,然后在10 000 r/min 离心5 min,弃掉沉淀,测定上层清液在波长370 nm 处的吸光度。分子吸光系数22 000 L/(molocm),计算每mg 蛋白中羰基含量。
1.3.6 巯基含量的测定 采用DTNB 法[9]测定并稍作修改,用0.6 mol/L 的NaCl 溶液将肌原纤维蛋白配成1.0 mg/mL 的溶液,取0.5 mL 稀释后的蛋白溶液加入4.5 mL Tris-甘氨酸缓冲溶液(8 mol/L 尿素,1% Tris,92 mmol/L 甘氨酸,4 mmol/L EDTA,pH 8.0),均质后加入0.5 mL 10 mmol/L DTNB,25 ℃反应30 min,于波长412 nm 处测定吸光值。其中13 600 L/(molocm)为巯基摩尔消光系数,稀释倍数是11。
1.3.7 二聚酪氨酸的测定 参考Davies 等[10]的方法稍作修改,用20 mmol/L 的磷酸盐缓冲液(0.6 mol/L KCl,pH 6.0) 将肌原纤维蛋白配成1.0 mg/mL 的溶液。采用双缩脲法测定蛋白浓度。利用荧光分光光度计测定二聚酪氨酸含量,狭缝宽度(激发光2.5 nm,发射光5 nm),发射波长420 nm,激发波长325 nm。二聚酪氨酸含量用相对荧光值(A.U.)表示。
1.3.8 内源荧光的测定 参考Liu 等[11]的方法稍作改动,用50 mmol/L 的磷酸盐缓冲液(pH 7.0)将肌原纤维蛋白配成0.1 mg/mL 的溶液。采用荧光分光光度计测定光谱。激发波长295 nm,狭缝宽度(激发光2.5 nm,发射光5 nm),扫描范围320~460 nm。
1.3.9 紫外光谱的测定 将得到的蛋白溶液用20 mmol/L Tris-HCl-NaCl 缓冲液 (含0.6 mol/L NaCl,pH 7.2)稀释至0.4 mg/mL,缓冲溶液作为空白,测定在220~360 nm 的紫外吸收光谱。
1.3.10 浊度的测定 将肌原纤维蛋白稀释到1 mg/mL,25 ℃水浴20 min,在波长340 nm 处测其吸光度,每个样品做3 次平行试验。
1.3.11 硫代巴比妥酸反应物(TBARS)的测定参考Benjakul 等[12]的方法并略微改动,称取解冻好的鱿鱼10.00 g,依次加入蒸馏水25 mL、5%TCA 溶液25 mL,均质后搅拌混匀过滤。取过滤后的溶液5 mL,加入相同体积0.02 mol/L 的TBA 溶液,80 ℃水浴40 min,快速冷却至室温,在波长532 nm 处测定其吸光度,TBARS 值用丙二醛(MDA)表示,单位为mg MDA/kg。
1.3.12 数据分析 采用SPSS 19.0 统计软件进行ANOVA 分析,P<0.05 代表差异显著,P<0.01 代表差异极显著。采用Origin 进行作图,试验均最少重复3 次。
2 结果与分析
2.1 自由基氧化对秘鲁鱿鱼保水性的影响
蒸煮损失率和离心损失率可以反应样品的保水性情况,图1为自由基氧化对蒸煮损失率和离心损失率的影响。由图可知,MT 和MNPT 各处理组的蒸煮损失率和离心损失率均随着H2O2浓度的升高而升高,不同氧化浓度之间差异显著(P<0.05),且MNPT 各处理组的蒸煮损失率和离心损失率均低于同等H2O2浓度的MT 各处理组,进一步证实了MNPT 优于MT,同时说明MNPT 可以减缓秘鲁鱿鱼的水分损失。在微波加热过程中,MNPS 会转变为顺磁性状态,加大热量在组织的传导[13],使秘鲁鱿鱼解冻相对均匀,减少了水分的流失,提高了解冻品质;另外,微波加热使纳米粒子变暖,抑制了冰晶的再生,降低解冻过程对组织的损伤[14]。
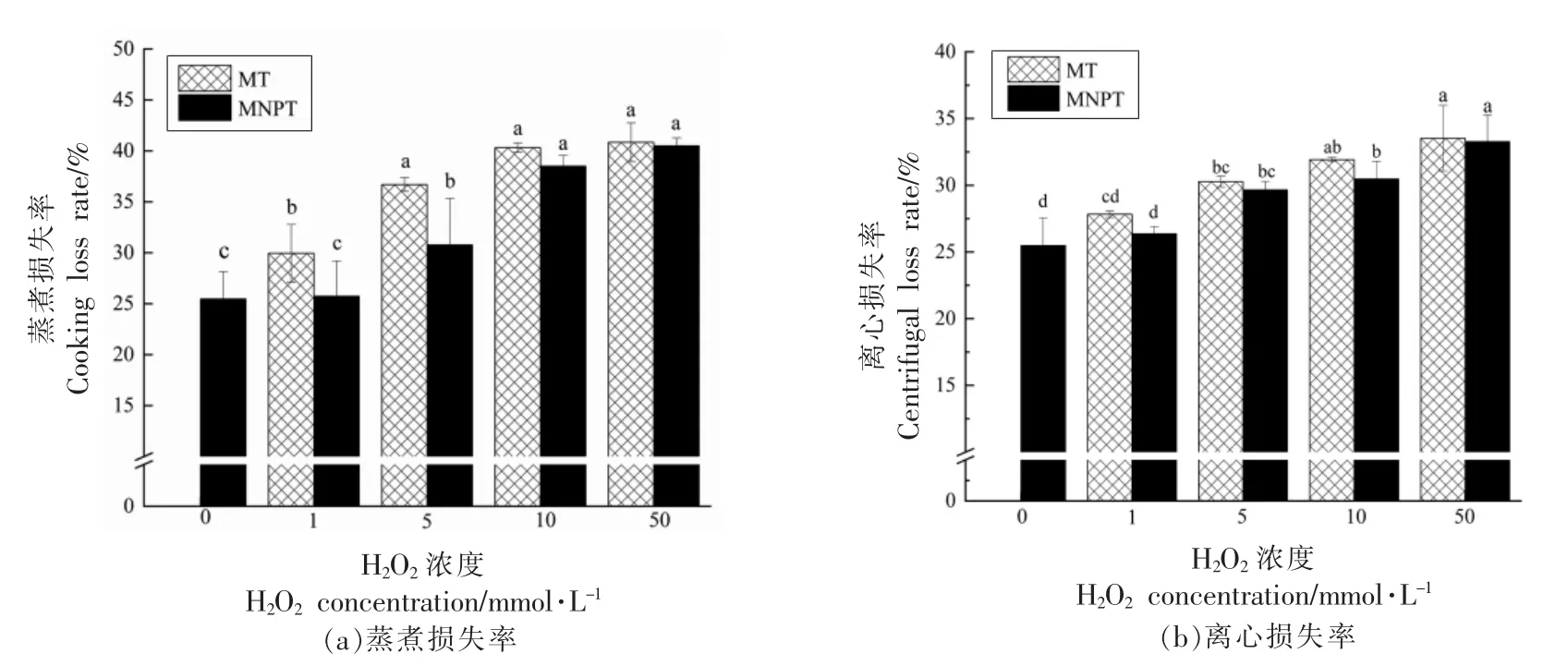
图1 自由基氧化对秘鲁鱿鱼蒸煮损失和离心损失的影响Fig.1 Effect of free radical oxidation on cooking loss and centrifugal loss of jumbo squid
2.2 自由基氧化对秘鲁鱿鱼水分分布与组成的影响
秘鲁鱿鱼T2弛豫时间如图2所示,随着H2O2浓度的升高自由水越来越高,说明随着氧化的进行,体内其它水分转化为自由水,使蛋白质结构发生改变,影响了蛋白质与水的结合。

图2 秘鲁鱿鱼水分T2 弛豫时间图谱Fig.2 Transverse relaxation time T2 of water in jumbo squid
图3是各组分水分所占有的百分含量。由图可知,MT 和MNPT 各处理组的P21均随着H2O2浓度的增加呈下降趋势,P23呈上升趋势,P22呈平稳趋势。相同H2O2浓度下,MNPT 各处理组比MT 组自由水含量低、结合水含量高,说明MNPT 解冻过程中减缓了结合水向自由水转化,MNPS 使解冻均匀抑制了鱿鱼自由水的生成。另外,有研究表明纳米解冻可以提高蛋白质的结构稳定,增强水和蛋白质分子之间的相互作用[15],提高肌肉的保水性。

图3 秘鲁鱿鱼水分分布及组成Fig.3 Water distribution and composition of jumbo squid
2.3 自由基氧化对秘鲁鱿鱼肌原纤维蛋白羰基的影响
羟基通过进攻氨基酸的侧链或直接作用于肽链,使肽链断裂形成羰基[16]。羰基含量的升高使肌原纤维蛋白发生聚集、交联,也会引起肽链结构的改变。由图4可知,MT 和MNPT 各处理组的羰基含量均随着H2O2浓度的增加而增加,不同氧化浓度之间差异显著(P<0.05),且MNPT 各处理组结果均低于同等H2O2浓度的MT 各处理组。当H2O2浓度为50 mmol/L 时,MT 和MNPT 组羰基含量分别为8.56 nmol/mg MP 和7.95 nmol/mg MP,降低了7.13%,表明了MNPS 可以在解冻过程中缓解鱿鱼蛋白氧化,当暴露在交变磁场中时,分散在溶液中的MNPS 可以将电磁能量转化为热量[3],颗粒均匀地嵌入使冰晶融化更加均匀,降低对蛋白结构的破坏,实现均匀解冻。在器官保存的冻融循环中,MNPs 的加入保持了均匀的升温,增加了组织的存活力[5]。

图4 自由基氧化对鱿鱼肌原纤维蛋白羰基含量的影响Fig.4 Effect of free radical oxidation on carbonyl content in myofibrillar protein of jumbo squid
2.4 自由基氧化对秘鲁鱿鱼肌原纤维蛋白巯基的影响
肌原纤维蛋白包括肌球蛋白和肌动蛋白,巯基是肌原纤维蛋白非常重要的基团,当蛋白质被氧化时巯基转变为二硫键,导致总巯基含量下降,因此总巯基含量是表征蛋白氧化的一个重要指标。由图5可知,MT 和MNPT 各处理组的巯基含量均随着H2O2浓度的增加而降低,不同氧化浓度之间差异显著(P<0.05),且MNPT 各处理组结果均高于同等H2O2浓度的MT 各处理组。当H2O2浓度为50 mmol/L 时,MT 和MNPT 组巯基含量分别为53.36 nmol/mg 和64.36 nmol/mg,MNPS 显著抑制了巯基的减少,提高了蛋白的稳定性。

图5 自由基氧化对秘鲁鱿鱼肌原纤维蛋白巯基含量的影响Fig.5 Effect of free radical oxidation on sulfhydryl content in myofibrillar protein of jumbo squid
2.5 自由基氧化对秘鲁鱿鱼肌原纤维蛋白二聚酪氨酸的影响
酪氨酸是蛋白质中的一种重要的氨基酸,受到自由基的攻击极容易被氧化,通过共价作用等产生酪氨酸残基、酪氨酰自由基,进一步形成二聚酪氨酸[17]。由图6可知,MT 和MNPT 各处理组的二聚酪氨酸含量均随着H2O2浓度的增加而增加,不同氧化浓度之间差异显著(P<0.05),且MNPT各处理组结果均低于同等H2O2浓度的MT 各处理组。当H2O2浓度达到50 mmol/L,MT 组二聚酪氨酸含量是对照组(MNPT-0)的1.75 倍,MNPT 组是对照组的1.38 倍,MNPT 显著减缓了二聚酪氨酸的生成,稳定了蛋白质的结构,减缓了秘鲁鱿鱼肌原纤维蛋白的氧化。

图6 自由基氧化对秘鲁鱿鱼肌原纤维蛋白二聚酪氨酸含量的影响Fig.6 Effect of free radical oxidation on the content of dityrosine in myofibrillar protein of jumbo squid
2.6 自由基氧化对秘鲁鱿鱼肌原纤维蛋白中内源荧光含量的影响
蛋白质中的一些芳香族氨基酸,对氧化较敏感,如色氨酸容易被自由基攻击,进而转变为犬尿氨酸,使荧光强度下降[18]。秘鲁鱿鱼内源荧光变化如图7所示,空白MNPT-0 组内源荧光含量最高,此时肌肉组织受到自由基攻击最弱,所以荧光强度最高。随着H2O2浓度的升高产生更多的·OH,内源荧光呈下降的趋势,色氨酸逐渐暴露在外部,肌原纤维蛋白氧化使得色氨酸残基从亲水性环境逐渐变为疏水性环境[19],蛋白氧化越来越严重。H2O2浓度低时内源荧光含量高,说明·OH 促进了秘鲁鱿鱼肌原纤维蛋白的氧化。MNPT 各处理组的内源荧光均高于同等H2O2浓度的MT 各处理组,说明MNPT 有一定减缓蛋白氧化的作用。

图7 自由基氧化对秘鲁鱿鱼肌原纤维蛋白内源荧光含量的影响Fig.7 Effect of free radical oxidation on endogenous fluorescence content in myofibrillar protein of jumbo squid
2.7 自由基氧化对秘鲁鱿鱼肌原纤维蛋白紫外吸收光谱的影响
紫外吸收光谱可以反应芳香族氨基酸的侧链变化并揭示明蛋白质的构象变化[20]。由图8可知,随着H2O2浓度的增加,·OH 自由基数量增大,使得芳香氨基酸色氨酸、酪氨酸、苯丙氨酸等生色基团被氧化,从而导致紫外光谱下降,吸光值整体呈下降的趋势。MNPT 各处理组的紫外吸收均高于同等H2O2浓度的MT 各处理组,说明MNPS 可以在解冻过程稳定蛋白结构,减缓蛋白氧化。

图8 自由基氧化对秘鲁鱿鱼肌原纤维蛋白中紫外吸收光谱的影响Fig.8 Effect of free radical oxidation on ultraviolet absorption in myofibrillar protein of jumbo squid
2.8 自由基氧化对秘鲁鱿鱼肌原纤维蛋白浊度的影响
浊度用来反映蛋白质的大小和多少,当肌原纤维蛋白聚集后粒径变大,吸光度变大,浊度增加[21]。由图9可知,MT 和MNPT 各处理组的浊度均随着H2O2浓度的增加而增加,不同氧化浓度之间差异显著(P<0.05),说明H2O2形成的羟自由基体系促进了蛋白氧化、聚集。MNPT 各处理组结果均低于同等H2O2浓度的MT 各处理组,浊度越低,粒径越小,意味着蛋白有着更大的表面积,蛋白质与水的相互作用也越高,说明MNPT 可以均匀解冻有效抑制肌原纤维蛋白的氧化,与上述保水性结果一致,因此MNPT 能更好的维持蛋白结构,利于产品质量的保持。

图9 自由基氧化对秘鲁鱿鱼肌原纤维蛋白浊度的影响Fig.9 Effect of free radical oxidation on turbidity in myofibrillar protein of jumbo squid
2.9 自由基氧化对秘鲁鱿鱼肌原纤维蛋白脂肪氧化的影响
硫代巴比妥酸(TBARS)值为脂质二级氧化产物丙二醛的含量,TBARS 值的高、低用来表示鱿鱼脂肪的氧化情况。如图10所示,MT 和MNPT 各处理组的TBARS 值均随着H2O2浓度的增加而增加,不同氧化浓度之间差异显著(P<0.05),说明H2O2形成的羟自由基体系促进了脂肪氧化。MNPT各处理组结果均低于同等H2O2浓度的MT 各处理组,说明MNPT 可抑制秘鲁鱿鱼脂肪氧化。蛋白氧化和脂肪氧化存在一定的依存关系,蛋白氧化进行的同时,脂肪氧化也在发生,可能是脂质氧化产生的丙二醛与肌球蛋白发生反应生成羰基[22],具体的机理还要进一步研究。

图10 自由基氧化对秘鲁鱿鱼肌原纤维蛋白TBARS 值的影响Fig.10 Effect of free radical oxidation on TBARS value in myofibrillar protein of jumbo squid
3 结论
通过构建羟自由基氧化体系,发现MNPT 可以有效维持秘鲁鱿鱼的保水性,维持蛋白结构降低蛋白和脂肪氧化,减缓蛋白的聚集,提高解冻肌肉品质,实现了快速、均匀解冻,是一种有效的解冻方式。

