葡萄糖和丁酸钠对CHO-rHSA工程细胞株中rHSA产量的影响
牛宇辉 李向茸 吴贝 李洪珊 李殿玉 陈磊 魏锁成冯若飞
(1.西北民族大学生物医学研究中心 生物工程与技术国家民委重点实验室,兰州 730030;2.西北民族大学生命科学与工程学院,兰州 730030)
人血清白蛋白(human serum albumin,HSA)是一种在人体内带负电荷的由585个氨基酸组成的单链非糖基化的可溶性蛋白单体,分子量为66.5 kD[1],为人血浆中含量最多、分子较小、溶解度大、功能较多的一种蛋白质。HSA的三级结构由Domain-I、Domain-II和Domain-III三个结构域所构成,每个结构域均由2个含有4-6个α-螺旋的亚结构域组成,6个亚结构域聚合形成一个不中心对称的心型分子结构[2-3]。HSA在人体内的主要作用是维持血浆胶体渗透压及总蛋白水平,人血白蛋白制剂当前广泛应用于临床医学和生物制药等领域,其中临床上主要用于治疗休克、水肿和作为血浆容量扩充剂等;生物制剂领域常常被用作疫苗保护剂和无血清培养基添加剂等[4-6]。目前我国商品化的HSA主要是从人血浆或胎盘血中通过低温乙醇法或柱层析法进行提取制备的。其不足之处主要有两点:(1)血浆来源有限,市场供应紧张;(2)可能增加血源性传染疾病的扩散,如艾滋病、肝炎[7-8]。与之相比,采用基因工程生产的重组人血清白蛋白(recombinant human serum albumin,rHSA)其优点主要有生物活性与天然的HSA相同,还兼具可大规模生产,来源不易受病原体污染等多种优点[9-11],因此,rHSA市场蕴含着巨大的发展潜力。
葡萄糖作为哺乳动物细胞培养基中的重要的碳源物质,在CHO细胞培养过程中通过添加葡萄糖可以显著提高活细胞密度和外源蛋白表达量[12]。但葡萄糖会通过糖酵解代谢产生乳酸,乳酸又会通过影响pH进而影响细胞生长,故常见的CHO细胞无血清培养基中的葡萄糖浓度一般控制在5.0-7.0 g/L左右。丁酸盐作为一种小分子短链脂肪酸可以提高细胞中多种外源蛋白的表达量,如人促红细胞生成素[13]、嵌合抗体等[14],依据其脂肪酸特性还可诱导肠道抗菌肽的产生[15]。有研究表明,丁酸钠可通过延缓细胞周期来提高外源蛋白表达量,但同时也抑制细胞生长[16-17]。本实验以表达重组人血清白蛋白的CHO-rHSA工程细胞株为研究对象,考察培养过程中葡萄糖及丁酸钠对rHSA产量的影响,并优选出利于rHSA表达的最佳葡萄糖及丁酸钠组合方案,为药用辅料级及兽用生物制品中重组人血清白蛋白的工业生产奠定基础。
1 材料与方法
1.1 材料
本试验所用表达重组人血清白蛋白的全悬浮单克隆CHO工程细胞株CHO-rHSA由西北民族大学生物医学研究中心提供。SFM4CHO培养基购自Cytiva(原Hyclone公司);HRP标记的抗人血清白蛋白抗体(ab24438)及Human Albumin ELISA Ki(tab108788)购自Abcam公司;无水葡萄糖购自国药集团化学试剂有限公司;丁酸钠(NaBu)购自上海麦克林生化科技有限公司。
1.2 方法
1.2.1 葡萄糖对CHO-rHSA细胞生长及rHSA表达量的影响 复苏1支CHO工程细胞株CHO-rHSA,迅速离心后弃去上清,将细胞加入至SFM4CHO培养基中,随后置于37℃、5% CO2摇床中培养,转速为120 r/min。待细胞状态稳定后,以0.5×106cells/mL的密度接种至125 mL摇瓶中,培养体积为50 mL,培养条件同上。之后从第4天开始每天测定其活细胞密度、细胞活力及培养基中的葡萄糖含量。待培养基中葡萄糖含量降低至2.0或3.0 g/L时,添加葡萄糖至终浓度为5.0或7.0 g/L,以不添加葡萄糖组作为对照,具体补糖策略见表1。直到培养第14天或细胞活力降至60%以下时收获细胞悬浮液,离心后收集上清,采用Western Blot或ELISA检测上清中rHSA的含量。

表1 不同的补糖策略Table 1 Different strategies for supplementing glucose
1.2.2 丁酸钠对CHO-rHSA细胞生长及rHSA表达量的影响 将生长状态良好的CHO-rHSA细胞以1.0×106cells/mL的密度传代,培养体积为50 mL,置37℃、5% CO2摇床中培养,转速为120 r/min。传代时SFM4CHO培养基中加入不同浓度的丁酸钠(1.0、2.0及3.0 mmol/L),以不添加丁酸钠组作为对照。从第4天开始每天测定其活细胞密度、细胞活力及培养基中的葡萄糖含量,待培养至第14天或活力降至60%以下收获细胞悬浮液,离心后收集上清,采用Western Blot及ELISA检测上清中rHSA的含量。
1.2.3 葡萄糖及丁酸钠组合使用对CHO-rHSA细胞生长及rHSA表达量的影响 为进一步验证葡萄糖和丁酸钠同时加入对rHSA表达量的影响,最大限度地提高工程细胞株CHO-rHSA生长密度及rHSA表达量。我们选择1.2.1和1.2.2单因素实验筛选出的葡萄糖添加策略同丁酸钠浓度进行两因素组合作用分析。将生长状态良好的CHO-rHSA细胞以1.0×106cells/mL的密度传代,培养体积为50 mL,置37℃、5% CO2摇床中培养,转速为120 r/min。传代时SFM4CHO培养基中分别加入两种浓度的丁酸钠,同时以筛选出两种补糖策略进行补糖,以不添加丁酸钠和葡萄糖组作为对照。从第4天开始每天测定其活细胞密度、细胞活力及培养基中的葡萄糖含量,待培养至第14天或活力降至60%以下时收获细胞悬液,离心后收集上清,采用Western Blot及ELISA检测上清中rHSA的含量。
1.2.4 不同时间段添加丁酸钠对CHO-rHSA细胞生长及rHSA表达量的影响 为了进一步考察丁酸钠加入时间对CHO-rHSA生长及rHSA表达量的影响,在细胞培养24 h、48 h和72 h分别加入1.2.3筛选出的最佳的丁酸钠浓度和葡萄糖添加策略进行组合培养。将生长状态良好的CHO-rHSA细胞以1.0×106cells/mL的密度传代,培养体积为50 mL,置37℃、5% CO2摇床中培养,转速为120 r/min。分别在24 h、48 h和72 h向培养基中加入1.2.3筛选出丁酸钠浓度以及相应补糖策略进行培养。从第4天开始每天测定其活细胞密度、细胞活力及培养基中的葡萄糖含量,待培养至第14天或活力降至60%以下时收获细胞悬液,离心后收集上清,采用Western Blot及ELISA检测上清中rHSA的含量。
1.2.5 统计学分析 采用GraphPad Prism 8.0软件作图,利用单因素分析ANOVA或t检验法计算各组数据间显著性差异。数据均以均值±标准差形式表示,P 值用星号表示,*P < 0.05,**P < 0.01,***P < 0.001。
2 结果
2.1 不同补糖策略对CHO-rHSA细胞生长及rHSA表达量的影响
单因素试验结果显示,添加葡萄糖组工程细胞株CHO-rHSA的最高活细胞密度和rHSA表达量均高于对照组,且各补糖组细胞培养时间与对照组相比明显延长(图1-A和D),表明补糖对CHO-rHSA细胞生长和rHSA表达均具有一定的促进作用。而对照组细胞中的葡萄糖浓度从第4天开始持续降低,活细胞密度和活力在培养至第8天后急剧下降(图1-A-C),这可能是由于培养基中的葡萄糖等营养物质消耗殆尽及代谢产物累积太多所致。不同补糖策略下CHO-rHSA细胞的活细胞密度与细胞活力相差不大(图1-A和B),其中补糖方案为3.0→7.0 g/L时,rHSA表达量为36.467 mg/L,与对照组(rHSA表达量为16.432 mg/L)相比平均提高了121.93%(图1-D)。综合考虑,选择补糖方案为3.0→5.0 g/L和3.0→7.0 g/L进行后续葡萄糖同丁酸钠两因素组合作用分析。
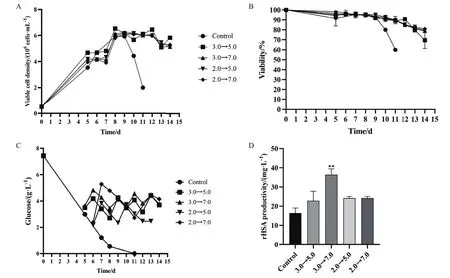
图1 不同的补糖策略对CHO-rHSA细胞生长及rHSA产量的影响Fig.1 Effects of different glucose supplementation strategies on the growth of CHO-rHSA cells and the yield of rHSA
2.2 不同浓度丁酸钠对CHO-rHSA细胞生长及rHSA表达量的影响
结合已有研究,本文选择了1.0 mmol/L、2.0 mmol/L和3.0 mmol/L NaBu浓度来进行初筛,以选择一个适宜的浓度来最大限度地提高rHSA的产量。结果显示,加入不同浓度NaBu后工程细胞株CHO-rHSA的活细胞密度和细胞活力均低于对照组,且随着NaBu浓度的增加,最大活细胞密度逐渐下降,说明高浓度的NaBu对CHO-rHSA细胞生长具有一定的抑制作用(图2-A-C)。但3种浓度的NaBu均能显著提高rHSA的表达(图2-D-F),但因考虑到NaBu浓度为3.0 mmol/L时活细胞密度的下降尤为显著,综合考虑后选择NaBu浓度为1.0 mmol/L和2.0 mmol/L进行接下来的两因素组合试验。

图2 不同浓度丁酸钠对CHO-rHSA细胞生长及rHSA产量的影响Fig.2 Effects of different concentrations of sodium butyrate on the growth of CHO-rHSA cells and the yield of rHSA
2.3 葡萄糖及丁酸钠组合培养对CHO-rHSA细胞生长及rHSA表达量的影响
利用2.1和2.2单因素试验筛选出的补糖方案(3.0→5.0 g/L和3.0→7.0 g/L)和NaBu浓度(1.0 mmol/L NaBu和2.0 mmol/L NaBu)进行两因素组合分析,以验证不同浓度的葡萄糖和丁酸钠组合培养对CHO-rHSA细胞生长及rHSA表达的影响,确定最佳的培养方案,为后期补料及生物反应器培养优化夯实基础。两因素组合作用结果显示,丁酸钠和葡萄糖组合使用可使CHO-rHSA工程细胞株培养时间从7 d左右延长到14 d左右(图3-A-C),并且显著地提高rHSA表达(图3-D-F)。说明不同的葡萄糖和丁酸钠组合方案均能明显延长CHO-rHSA细胞培养周期及提高rHSA表达量。综合考虑活细胞密度和rHSA表达水平,选择3.0→7.0 g/L的补糖方案与1.0 mmol/L NaBu浓度进行后续培养,但由于该组合培养中的最高活细胞密度仅达8.154×106cells/mL,远远低于对照组的最高活细胞密度10.783×106cells/mL(图3-A),推测可能是由于添加丁酸钠的时间不同所引起的,故接下来进行了不同时间段添加丁酸钠及补糖实验。

图3 葡萄糖及丁酸钠组合培养对CHO-rHSA细胞生长及rHSA产量的影响Fig.3 Effects of combined culture of glucose and sodium butyrate on the growth of CHO-rHSA cells and the yield of rHSA
2.4 不同时间段添加丁酸钠对CHO-rHSA细胞生长及rHSA表达量的影响
为了进一步考察丁酸钠加入时间对CHO-rHSA细胞生长及rHSA表达量的影响,在细胞培养24 h、48 h和72 h分别加入1.0 mmol/L丁酸钠,同时选择上述优化得到的葡萄糖添加策略3.0→7.0 g/L进行组合培养。结果发现第24小时加入丁酸钠细胞生长状态最佳(图4-A-C),最大活细胞密度与同期对照组相差无几,可达10.213×106cells/mL,rHSA表达量为74.616 mg/L(图4-F),比对照组平均提高了172.26%;但第48小时加入丁酸钠CHO-rHSA细胞的最大活细胞密度仅为8.025×106cells/mL(图4-A),但rHSA表达量是目前本工程细胞株能达到的最高表达量,为85.642 mg/L(图4-D),比同期对照组平均提高了212.49%,比单独添加葡萄糖平均提高了134.85%,比单独添加丁酸钠平均提高了88.35%。以上结果表明,丁酸钠添加时间对提高rHSA表达量也显得尤为重要。综上,确定待细胞培养48 h 时添加1.0 mmol/L NaBu和补糖方案为3.0→7.0 g/L是利于CHO-rHSA工程细胞生长和rHSA表达的最佳条件,这为后期进一步优化及生物反应器培养提供数据支持。

图4 不同时间段添加丁酸钠对CHO-rHSA细胞生长及rHSA产量的影响Fig.4 Effect of adding time of sodium butyrate on the growth of CHO-rHSA cells and the yield of rHSA
3 讨论
目前我国临床使用的HSA 来源十分有限,HSA作为临床医学及生物制药领域重要的药物和原辅料,需求量逐年上升[7,18]。因此利用基因工程方法大规模生产rHSA即可解燃眉之急。由于研发成本过高,国内大多数研究只限于实验室水平,试制产品纯度不高,华北制药集团采用酵母表达人血清白蛋白取得了一定的进展,并开发了高盐阳离子捕获为特征的纯化工艺,但酵母表达重组白蛋白在天然修饰方面始终劣于哺乳动物细胞表达[19-20]。而CHO细胞相对于酵母和大肠杆菌而言是很好的表达细胞系,其表达产物在分子结构、理化性质和生物学功能等方面与天然蛋白更接近,重组乙肝疫苗、注射用重组人促红细胞生成素等产品均利用CHO细胞表达平台[21]。因此,用无血清悬浮的CHO细胞表达系统生产HSA相对于酵母菌和大肠杆菌等而言是更好的表达细胞系统,能够准确的进行转录后修饰,天然修饰方面更具优势,同时还具有培养基化学组分明确、无血清成分、易于工业化放大等优点,并且自身分泌的内源性蛋白较少,更加有利于外源蛋白的分离纯化,从而使CHO表达的rHSA更具市场潜力。
本文研究了在CHO-rHSA细胞培养过程中添加丁酸钠及葡萄糖对rHSA产量的影响。单因素试验结果表明,葡萄糖可明显促进细胞生长,细胞培养第3天开始,每48 h添加终浓度为7 g/L的葡萄糖,可使rHSA产量显著增加;同时发现细胞培养第48小时时加入终浓度为1.0 mmol/L的丁酸钠对rHSA的表达量提高最为明显。已有文献表明,丁酸钠对细胞生长有一定的抑制作用,会诱导细胞凋亡。但同时它也可促进与DNA结合的组蛋白的乙酰化功能从而具有显著提高重组蛋白表达的能力[22-24]。本试验通过添加葡萄糖来弥补丁酸钠对细胞生长的毒副作用,葡萄糖又对细胞生长具有明显的促进作用,最终提高重组蛋白产量。因此,探究丁酸钠与葡萄糖之间平衡的点显得尤为重要,同时丁酸钠及葡萄糖在本试验中对细胞作用的具体机制及作用比重仍有待研究。本研究采用葡萄糖和丁酸钠联合应用可把CHO-rHSA工程细胞株培养时间从7 d左右延长到14 d左右。葡萄糖的加入明显减弱了丁酸钠对CHO-rHSA细胞生长的抑制作用,葡萄糖和丁酸钠组合使用可更高效表达外源蛋白,与对照组相比表达量平均提高了212.49%。当然接下来的生物反应器还有一系列培养条件如pH、溶氧以及搅拌转速等参数需要进一步优化,因此对于工艺条件的不断优化是我们下一步探索的方向。
4 结论
本研究通过考察不同补糖策略、不同浓度丁酸钠、葡萄糖及丁酸钠组合培养与丁酸钠的添加时间对CHO-rHSA细胞生长及rHSA产量的影响,确定待细胞培养48 h 时添加1.0 mmol/L NaBu和补糖方案为3.0→7.0 g/L是利于CHO-rHSA细胞生长及rHSA表达的最优条件,为接下来的补料培养及生物反应器培养奠定基础。

