长江中下游地区粳稻稻瘟病基因型与苗瘟抗性分析
周坤能 张彩娟, 夏加发 王元垒 云 鹏 马廷臣 吴德祥 李泽福,*
(1 安徽省农业科学院水稻研究所/安徽省水稻遗传育种重点实验室,安徽 合肥 230031;2 安徽农业大学农学院,安徽 合肥 230036)
稻瘟病是水稻主要病害之一,每年发生严重,导致水稻减产,甚至绝收[1-2]。目前能够有效防治稻瘟病的方法有两种:化学防治和抗病品种选育[3-4]。在种植稻瘟病抗性较好的品种基础上,结合化学防治方法,可以有效降低稻瘟病危害;选择稻瘟病抗性好的水稻品种可以减少化学药剂的使用,减少农药污染,与水稻产业的绿色高质量发展相辅相成。因此,选育抗稻瘟病水稻品种具有重要意义,发掘和利用稻瘟病抗性基因和资源更是相关研究的前提[5-7]。
目前已经在水稻中鉴定出100多个稻瘟病抗性基因位点,其中35个基因被克隆[8]。这些基因之间的抗病性存在较大差异,且部分基因在水稻资源中出现频率低,育种利用效率低[9-11];一些广谱持久抗稻瘟病及适宜特定生态区的基因已被广泛用于育种实践[12-14]。不同种植区域水稻中蕴含的稻瘟病抗性基因不同,其中Pikh、Pi9和Pish对广东稻瘟病菌表现广谱抗性[15];Pita、Pib、Pi54和Pikm对江苏稻瘟病菌表现广谱抗性[16];Pib、Pi54和Pikm对山东和黄淮区稻瘟病菌表现广谱抗性[17]。通过分子标记辅助聚合抗性基因对水稻稻瘟病抗性育种具有重要指导意义。前人研究发现,通过分子聚合Pi9和Pi49位点能够提高水稻两系不育系创5S的稻瘟病抗性[18];通过分子标记分别将Pi1、Pi2、Pi33、Pigm等基因转入空育131等粳稻品种中,能够显著提高受体材料的稻瘟病抗性[19-20];将广谱抗稻瘟病基因Pi9导入水稻不育系丰源A中,其抗性频率增加2.5倍以上[21]。近期研究表明,Pita、Pib、Pi5和Pi9基因对辽宁和天津地区稻瘟病抗性能力较强[22]。长三角地区粳稻携带Pita、Pi5、Pi2和Pikm基因的水稻种质抗病性增加[23]。王小秋等[24]通过对江苏育成粳稻品种的稻瘟病抗性基因和穗颈瘟抗性之间的关系进行研究,表明Pia、Pi5和Pita对穗颈瘟的抗性有显著贡献,Pigm及基因组合“Pia+Pita”在江苏粳稻育种中有重要利用价值。
稻瘟病生理小种容易发生变异,不同区域的稻瘟病菌优势种群和优势生理小种差异显著[25-26]。安徽省水稻生产应用的多数品种稻瘟病抗性不强,稻瘟病育种研究进展较为缓慢。对近5年安徽育成品种进行稻瘟病抗性统计,发现达到抗病水平的品种比例较低(平均为5.5%)。前人通过人工接种和自然诱发鉴定分析苗瘟、叶瘟和穗颈瘟之间的关系发现,上述三者之间存在显著正相关,因此,可以根据苗瘟抗性鉴定结果推测穗颈瘟的抗性[27-28]。同时稻瘟病鉴定研究发现,粳稻稻瘟病抗性复杂多变,不同区域间差异较大[22-24],稻瘟病抗性与基因之间的关系不够明确,依靠单个或多个抗性基因提高品种抗性的目的性不强。鉴于此,本研究利用12个稻瘟病抗性基因分子标记对153份长江中下游地区审定的品种或参加中间试验的粳稻材料进行基因型分析,旨在明确稻瘟病抗性基因分布;并结合稻瘟病苗期人工接种鉴定,分析抗性基因与苗瘟之间的关系,评估单个基因或多基因组合的抗性,以期指导安徽粳稻品种的稻瘟病抗性育种。
1 材料与方法
1.1 试验材料
用于稻瘟病抗性鉴定的粳稻材料153份,包括安徽、江苏、浙江、山东、湖北、上海近年育成的61个粳稻品种(品系)和92份安徽省近几年参试品种(附表1),以原丰早和丽江新团黑谷(LTH)为苗瘟鉴定的感病对照。12个稻瘟病基因分子检测的阴性和阳性对照分别为Pita(LTH和武育粳27)、Pib(LTH和武育粳24)、Pikm(日本晴和扬粳4227)、Pi54(南粳9108和宁粳8号)、Pid2(LTH和地谷)、Pid3(LTH和地谷)、Pi5(LTH和镇稻88)、Pi25(LTH和地谷)、Pik(LTH和润稻118)、Pia(LTH和镇稻14)、Pb1(日本晴和镇稻18)和Pizt(南粳9108和武运粳21)。供试材料于安徽省农业科学院水稻研究所种质资源库保存。
1.2 稻瘟病抗性基因功能标记
本研究对Pita、Pib、Pikm、Pi54、Pid2、Pid3、Pi5、Pi25、Pik、Pia、Pb1和Pizt共12个稻瘟病抗性基因进行分子鉴定,所用引物参照文献[5,16,24]。引物由通用生物系统(安徽)有限公司合成。稻瘟病抗性基因Pita、Pib和Pikm分别由两对分子标记共同鉴定,Pi54、Pi5和Pia根据分子标记的多态性进行基因鉴定,Pi25、Pid2和Pid3基因扩增后分别利用NdeI、MIuI和BamHI内切酶进行酶切反应后鉴定抗性基因,Pik、Pb1和Pizt根据扩增条带的有无进行基因鉴定。
1.3 PCR检测及酶切反应
DNA提取采用十六烷基三甲基溴化铵(cetyltrimethyl ammonium bromide,CTAB)法:将样品装入96孔板,磨样机研磨成粉,加入200 μL 2×CTAB溶液[1 mol·L-1Tris-HCl (pH值8.0) 100 mL,0.5 mol·L-1EDTA (pH值8.0) 40 mL,NaCl 81.9 g,CTAB 20 g,加ddH2O定容至1 000 mL,高温灭菌],混匀,65℃水浴30 min,加入100 μL氯仿摇晃5 min后,1 500 r·min-1离心10 min,吸取100 μL上清至PCR板中,加入70 μL异丙醇,混匀,-20℃放置1 h,3 000 r·min-1离心15 min,去上清,沉淀用75%乙醇洗涤,通风晾干后,加入50 μL ddH2O溶解,4℃保存备用。
Pia、Pb1和Pizt基因的鉴定由聚丙烯酰胺凝胶电泳检测,其他基因由琼脂糖凝胶电泳检测。PCR反应体系为10 μL:10×PCR Buffer 1.0 μL,25 mmol·L-1MgCl20.6 μL,1 mmol·L-1dNTPs 0.3 μL,前后引物各0.5 μL,Taq酶0.1 μL,DNA模板20~50 ng,补ddH2O至10 μL。PCR反应程序:95℃预变性4 min,95℃变性30 s,退火30 s(退火温度视引物而定),72℃延伸 1 min,35个循环;72℃延伸 5 min,4℃保存备用。酶切反应体系:PCR扩增DNA产物≤0.5 μg,内切酶0.5 μL,10×buffer 1 μL,补ddH2O至10 μL;酶切反应程序:将酶切反应体系放置于PCR仪中37℃酶切30 min。
1.4 稻瘟病人工接种鉴定
人工接种所用的稻瘟病菌由安徽省农业科学院植物保护与农产品质量安全研究所提供,为安徽省稻瘟病优势小种ZB13、ZB15、ZA1和安徽省金寨县、休宁县、潜山县等重发地区稻瘟病菌混合菌株。稻瘟病优势小种培养:取马铃薯200 g,去皮切成2 cm左右小块,加入适量ddH2O煮20 min,过滤至1 000 mL容量瓶,在滤液中加入20 g蔗糖,18 g琼脂,边加边搅拌溶解,加ddH2O定容至1 000 mL,过滤后用100 mL锥形瓶分装,封口后121℃条件下5 min高温灭菌。将安徽省优势稻瘟病生理小种接入上述培养基中,28℃条件下黑暗培养3 d,挑菌落于灭菌大麦中培养8~10 d,待菌丝长出后,用ddH2O洗脱菌落,显微镜观察菌落浓度,10×10倍镜下每视野20~50个分生孢子为宜。
接种鉴定:将待接种的水稻材料浸种催芽,播于秧盘,3次重复;幼苗生长至3~4叶期,于傍晚开始接种,利用喷雾器装置对幼苗进行喷雾接种,使菌液呈水珠状落于幼苗叶片上,遮光保湿24 h后,每1 h喷水2 min保湿。7~10 d后按照《NY/T 2646-2014水稻品种试验稻瘟病抗性鉴定与评价技术规程》[29]观察记载稻瘟病发病情况,3次重复以感病最严重为鉴定结果。
1.5 数据分析
稻瘟病抗性等级、抗感品种分布等数据利用Excel 2010软件进行整理和作图。材料抗性与稻瘟病抗性基因之间的关联分析利用SPSS 12.0完成。将稻瘟病抗性分成2个等级,5级以下(包括5级)为抗,定义为1;5级以上为不抗,定义为2,对抗性等级进行单基因逻辑回归分析,根据P值确定基因对抗性的贡献是否在P<0.05水平显著。
2 结果与分析
2.1 稻瘟病抗性基因分子检测
利用12个稻瘟病抗性基因分子标记对部分供试材料、阴性和阳性对照进行扩增,以鉴定供试材料中稻瘟病基因型。结果显示,12个稻瘟病基因的分子标记能够有效区分是否携带对应的稻瘟病抗性基因。Pita、Pib和Pikm基因分别利用2个功能标记同时检测鉴定其基因型;Pi54、Pia和Pi5基因根据片段的大小鉴定基因型;Pid2、Pid3和Pi25基因扩增后利用相应的内切酶进行酶切鉴定;Pb1、Pik和Pizt基因则根据是否扩增出目的片段鉴定。携带和未携带抗性基因如图1所示。

注:M代表DNA标记;(+)代表抗病品种;(-)代表感病品种。Note: M indicates DNA marker. (+) and (-) represent disease-resistant and susceptible varieties,respectively.图1 稻瘟病抗性基因分子检测Fig.1 Molecular detection of rice blast resistance genes
2.2 供试材料中稻瘟病抗性基因分布
利用上述12个稻瘟病功能标记对153份粳稻品种进行基因型分析,结果发现其中11个抗性基因在供试材料中都有不同程度的分布,但未发现Pi25抗性基因的存在(图2)。Pib基因在供试材料中占比最高,达到77.12%,其次为Pita、Pi54和Pb1,分别达到41.83%、36.60%和36.60%,Pikm、Pik、Pia、Pid3、Pi5、Pid2和Pizt基因出现频率在11.76%~24.18%之间。

图2 稻瘟病抗性基因在供试材料中的分布频率Fig.2 Distribution frequency of resistance genes in tested materials
2.3 稻瘟病苗瘟接种鉴定
利用安徽省不同生态区的稻瘟病优势生理小种混合菌株对153份供试材料和阴性对照(原丰早和丽江新团黑谷)进行苗期人工接种鉴定。鉴定结果发现,材料稻瘟病抗感性状差异显著,能够明确区分稻瘟病抗性等级(图3-A~C)。对照品种丽江新团黑谷苗瘟等级为9级,原丰早为8级,说明鉴定结果准确可靠(图3-D、E)。根据稻瘟病苗瘟病斑大小和发病面积对供试材料进行记录整理(图3-F)。

注:A~C:抗病材料和感病材料的表现;D、E:丽江新团黑谷和原丰早苗瘟接种表型;F:苗瘟病级划分,1~9为苗瘟病级。Note: A~C: Phenotype of disease-resistant materials and susceptible materials. D,E: Phenotype of seedling blast of LTH and Yuanfengzao. F: Classification of seedling blast,1~9 indicates seedling blast grade.图3 苗瘟人工接种鉴定表型Fig.3 Phenotype of seedling blast by artificial inoculation
2.4 供试材料苗瘟抗性分析和抗性资源筛选
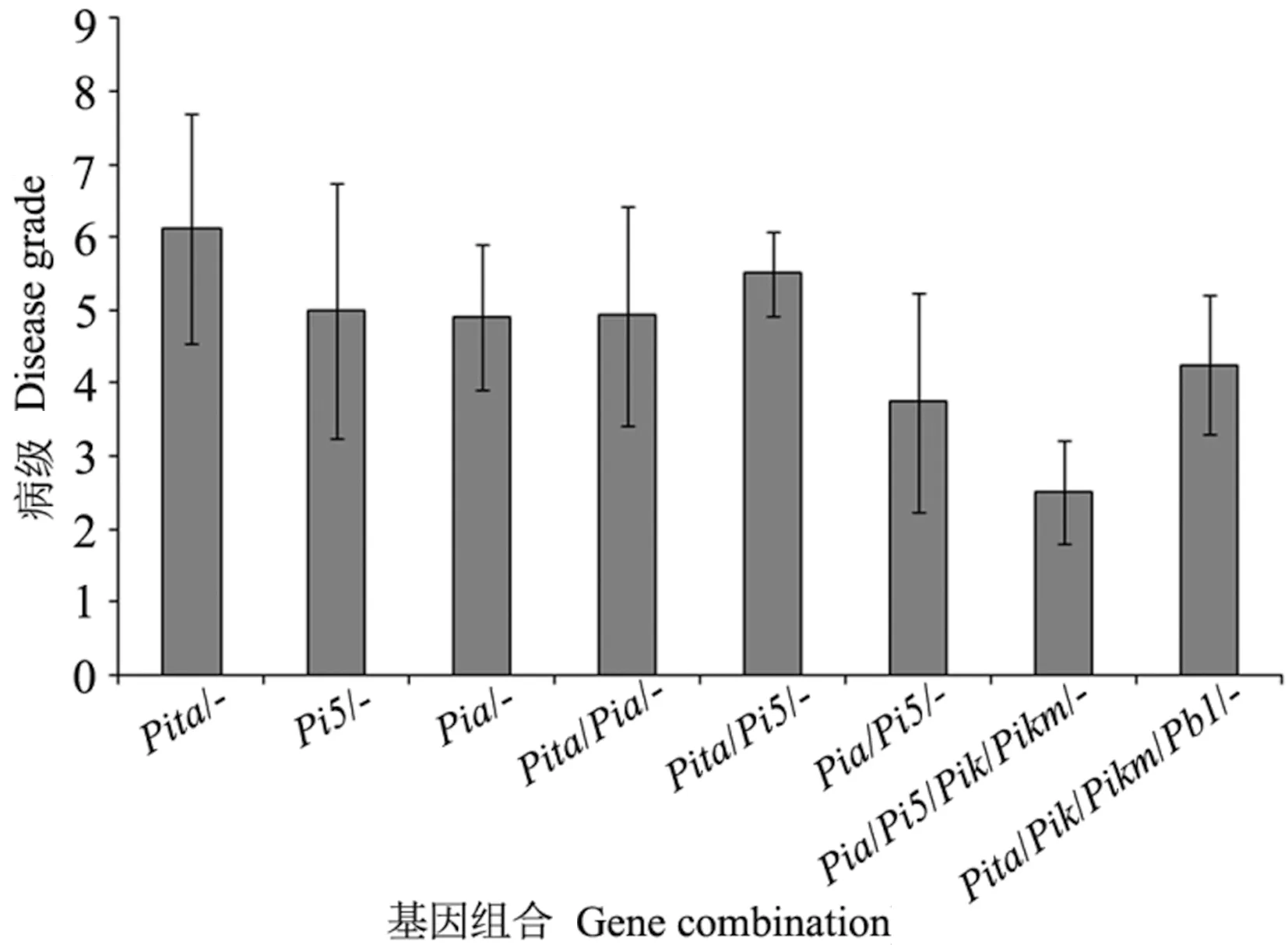
根据安徽省稻瘟病苗瘟分级标准对供试材料进行抗性分析,结果显示153份材料中,抗病(0 图4 153份粳稻材料苗瘟抗性分析Fig.4 Resistance analysis of seedling blast in 153 japonica rice materials 稻瘟病抗性基因分析结果发现,153份供试材料中有5份材料不含有检测的任何抗性基因,少数材料含有7~8个基因,具有2~5个抗性基因的品种最多(图5-A)。进一步通过关联分析鉴定携带的抗病基因数目与苗瘟抗性之间的相关性,结果表明随着基因数目增加,苗瘟抗性略有提高,但未达到显著水平(P=0.16)(图5-B),说明稻瘟病抗性与含有的抗性基因数目无显著相关性。 图5 粳稻材料中稻瘟病抗性基因数分布(A)和品种携带抗病基因数与病级间的关系分析(B)Fig.5 Distribution of gene number carried by tested varieties (A) and correlation analysis of the resistance gene number and disease grade (B) 图6 稻瘟病单个基因平均抗性(A)及其回归分析(B)Fig.6 Average resistance of single gene to rice blast (A) and its logistic regression analysis (B) 抗病性分析表明含有Pi5基因的品种平均抗性最好,病级为4.86,其次为Pia,病级为4.90,然后依次为Pizt(4.94)、Pikm(5.05)、Pik(5.14)等(图6-A)。单基因回归分析结果表明,检测的稻瘟病抗性基因均能够不同程度地增加稻瘟病抗性,但达到显著水平的只有Pi5(P=0.01)和Pia(P=0.04)(图6-B)。 为探索提高水稻稻瘟病抗性的基因或基因组合,本研究分析了含有单个基因或多个基因的品种稻瘟病抗病性,结果如图7所示。Pita/-基因组合平均病级为6.12,Pi5/-基因组合平均病级为5.00,Pia/-基因组合平均病级为4.91;在Pi5/-基因组合中加入Pita基因后病级为5.50,在Pia/-基因组合中加入Pita基因后病级为4.92,表明Pita不能增加Pi5/-和Pia/-基因组合的抗病性;Pia与Pi5组成的基因组合Pia/Pi5/-病级为3.75,稻瘟病抗性增加;同时发现,2个品种中含有Pia/Pi5/Pik/Pikm/-基因组合,其病级为2.50,明显优于Pia/Pi5/-基因组合,说明Pik和Pikm基因可能增加Pia/Pi5/-基因组合的抗病性。此外,还发现4个品种中含有Pita/Pik/Pikm/Pb1/-基因组合亦表现出较好的抗病性,平均病级为4.25。 注:- 表示不带有相应的抗病基因。Note: - means the absence of the specific resistance gene.图7 不同稻瘟病基因组合的抗性分析Fig.7 Resistance analysis of different rice blast gene combinations 稻瘟病生理小种复杂多变,解析稻瘟病抗性基因与稻瘟病之间的关系对指导水稻抗性育种以及品种推广具有重要意义[24,30]。本研究通过对153份粳稻品种(品系)进行稻瘟病苗期人工接种鉴定,发现中抗以上(≤4级)材料比例较低,为24.84%;中感材料(4 通过对153份粳稻材料的12个稻瘟病基因型分析发现,不含抗性基因的材料有5份,同时含有7和8个抗性基因的材料各1份,90%以上的材料含有2~6个抗性基因。关联分析发现携带的抗病基因数与苗瘟抗性之间无显著相关性。不含抗性基因的5份材料中只有1份为8级感病,另外4份材料为4~6级中感;含有7和8个抗性基因的材料苗瘟等级分别为6和7级,不能达到中抗以上水平,这与关联分析结果一致。通过对单个基因与苗瘟之间的抗性进行分析,发现Pid3、Pik、Pi5、Pikm、Pia和Pizt基因能够提高苗瘟抗性,但达到显著水平的只有Pi5和Pia,说明依靠单个抗性基因很难解决粳稻苗瘟的抗病问题。此外,本研究发现含有相同抗性基因的材料苗瘟抗性存在差异,如品种镇糯20含有Pita、Pib和Pi54基因,苗瘟抗性为6级,含有相同基因的糯稻品系苗瘟为9级;秀水121含有Pita、Pib、Pik和Pikm基因,苗瘟抗性为2级,同样含有相同基因的水稻品系苗瘟为5级。推测这可能与材料的背景有关,或有其他稻瘟病基因参与调控。 稻瘟病生理小种变异快,水稻品种的抗性在种植几年后即丧失,新的广谱抗性基因不能被充分利用。王军等[16]通过分析江苏省粳稻品种抗稻瘟病基因型与穗颈瘟抗性关系,发现Pita、Pib、Pi54和Pikm对江苏稻瘟病菌表现广谱抗性;然而,王小秋等[24]研究结果表明,Pita和Pib在江苏粳稻品种中的比例均超过50%,但在稻瘟病抗性5级以下品种中的比例不足30%。同时有研究发现,“Pita+Pi5”以及“Pita+Pia”基因组合能够显著增加江苏粳稻材料的稻瘟病抗性[24]。这与本研究结果有所不同,本研究发现Pita不能显著增加Pi5/-和Pia/-基因组合的抗病性(图7),这可能由于安徽和江苏地区稻瘟病生理小种有所差异。本研究发现,含有“Pia+Pi5”基因组合的品种苗瘟抗性明显较好;在“Pia+Pi5”基因组合的基础上加入Pik和Pikm基因,苗瘟抗性更好。此外,含有“Pita+Pik+Pikm+Pb1”基因的材料也具有较好的苗瘟抗性。这些研究表明,“Pia+Pi5”、“Pia+Pi5+Pik+Pikm”和“Pita+Pik+Pikm+Pb1”基因组合对安徽稻瘟病生理小种抗性较好。通过检测,未在供试材料中发现广谱抗稻瘟病基因Pigm,将该基因导入粳稻品种中可能对提高抗病性有重要作用[24,31]。以上研究结果为安徽粳稻品种稻瘟病抗性改良提供参考依据,并为下一步研究稻瘟病基因型与穗颈瘟抗性关系奠定了理论基础。 本研究通过分析153份粳稻材料中的稻瘟病基因型,及其与安徽稻瘟病优势混合生理小种的关系,发现Pi5和Pia基因对苗瘟抗性贡献较显著,“Pi5+Pia”基因组合抗性高于Pi5和Pia单个基因,在“Pi5+Pia”基因组合基础上,加入Pik和Pikm基因,抗性再次增加,此外,“Pita+Pik+Pikm+Pb1”基因组合对安徽稻瘟病生理小种亦有较好的抗性。 附表1 供试材料清单Table S1 Materials list 附表1(续) 附表1(续)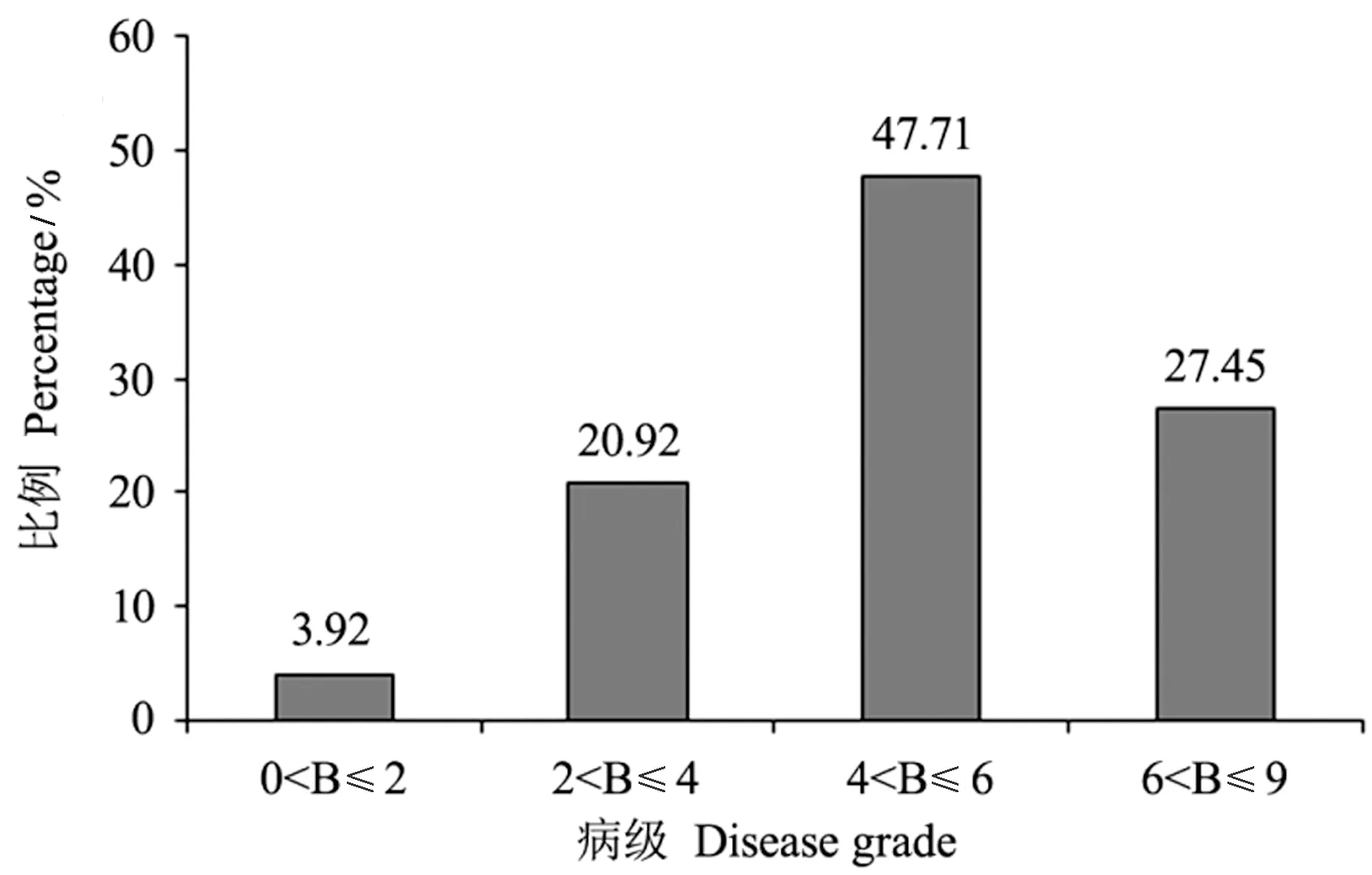
2.5 稻瘟病抗性基因与苗瘟之间的关系


2.6 优异稻瘟病抗性基因组合
3 讨论
4 结论