一株抗真菌海洋放线菌的筛选、分离和多相分类鉴定
范三微 吴祖芳 翁佩芳
(1 宁波大学食品与药学学院,浙江 宁波 315211;2 浙江药科职业大学制药工程学院,浙江 宁波 315100)
放线菌具有很高的药用价值[1]。在已知的10 000多种抗菌活性天然产物中,约70%来源于放线菌的代谢产物。其中链霉菌(Streptomycetes)是放线菌纲放线菌目的好氧革兰氏阳性菌,60%以上的已知抗生素从其中分离获得,如链霉素、氯霉素等[2]。然而自20世纪80年代以后,从陆生链霉菌中发现的新抗生素不足10种[3]。海洋是地球上最大的生态系统,近二十年以来,海洋新天然产物的发现数量呈逐年上升趋势,来源包括海洋微生物、藻类、软体动物、鱼类及大型海洋动物等,链霉菌仍然是新化合物的主要来源,占海洋细菌代谢物总数的50%以上[4-6],因此从海洋链霉菌中分离新抗生素一直是研究的热点。浙江省位于我国东海海域,在过去的十五年中,国内学者从浙江海域的海水、海泥、藻类等样品中分离出大量具有抗菌活性的微生物[7-11],但研究内容局限于抗菌微生物初筛、化合物的初步分离[11]及基于16S rRNA基因的高通量初步鉴定[11]。潮间带是典型的近岸海洋生态系统[12],具有物种多样性,是放线菌的独特来源,其中链霉菌为优势种群仍有待深入研究[13]。宁波近海拥有大面积潮间带,这与链霉菌为海洋微生物优势类群的实际相矛盾,表明相关研究方法仍有待改进。鉴于此,本研究以开发利用宁波近海潮间带药用微生物资源为出发点,从慈溪海塘采集海泥样品,筛选培养抗真菌海洋放线菌,对目标菌进行分离和鉴定,以期发现微生物新物种,为进一步研究其代谢产物奠定基础。
1 材料与方法
1.1 试验材料
1.1.1 试验样品 2015年7月25日,在位于宁波近海潮间带的慈溪海塘采样点(121°24′28′′E 30°37′08′′N),用无菌袋采集表层1~10 cm海泥样品,共7份,保存于冰盒中。同时采集当地天然海水20 L,带回浙江药科职业大学科研分中心立即进行处理,即静置海水使大量泥沙自然沉降,后用滤纸过滤除去细小悬浮颗粒。下文中出现的海水均为经过上述处理的海水。
1.1.2 指示菌 抗菌试验所用指示菌:白色念珠菌(Candidaalbicans,ATCC90028)、黑曲霉(Aspergillusniger,CMCC98003),均为浙江药科职业大学科研分中心保藏。
1.1.3 试验试剂 氯化钠、氢氧化钠、盐酸、氯化钙、磷酸氢二钾、七水合硫酸镁、七水合硫酸亚铁、重铬酸钾、硝酸钾、可溶性淀粉、醋酸、醋酸钠、乙二胺四乙酸、三羟甲基氨基甲烷,国药集团上海化学试剂有限公司;苯丙氨酸、甘氨酸、色氨酸,上海阿拉丁生化科技股份有限公司;蛋白胨、酵母浸出粉、改良高氏一号培养基、酵母提取物蛋白胨培养基( yeast extract peptone dextrose agar,YPDA),杭州百思生物技术有限公司;D0063基因组DNA小量抽提试剂盒,上海碧云天生物技术有限公司;DNA marker、2×Taq Master Mix(Dye),北京全式金生物技术有限公司。
1.1.4 试验仪器 BCD-515 MLHSSEDS9型冰箱,青岛海尔集团;SANYO MLS-3750型高压灭菌锅,日本三洋;K640型PCR仪,力新仪器(上海)有限公司;SPX-160生化培养箱,宁波江南仪器厂;SW-CJ-1F型超净工作台,江苏苏净集团有限公司;ZQLY-180E型恒温摇床,上海知楚仪器有限公司;Allegra 64R型高速冷冻离心机,美国贝克曼库尔特有限公司;PowerPac型水平电泳仪、凝胶成像仪,美国Bio-Rad公司。
1.2 试验方法
1.2.1 培养基配制
1.2.1.1 筛选培养基 磷酸氢二钾0.5 g·L-1、七水合硫酸镁0.5 g·L-1、七水合硫酸亚铁0.5 g·L-1、重铬酸钾0.1 g·L-1用海水溶解,配制好以后再分别添加丙氨酸(A)、苯丙氨酸(P)、色氨酸(T),配制不同筛选培养基,编号分别为AM、PM和TM。各筛选培养基中氨基酸浓度均为1 g·L-1,琼脂浓度为20 g·L-1,pH值7.4,分装,121℃灭菌20 min,倒平板,贮存备用。改良高氏一号固体培养基按说明书用海水替代蒸馏水配制,灭菌,贮存备用。
1.2.1.2 传代培养基 称取10 g市售干海带,洗净、剪碎,与1 000 mL海水一起加热,煮沸30 min,用4层纱布过滤除渣,收集清液,放冷备用。可溶性淀粉 5 g·L-1、 酵母浸出粉4 g·L-1、硝酸钾1 g·L-1、氯化钙0.02 g·L-1、七水合硫酸镁0.1 g·L-1、琼脂粉20 g·L-1, 用海带汁溶解,后用海水定容至1 000 mL,121℃条件下灭菌20 min,倒斜面,贮存备用。
1.2.1.3 液体发酵培养基 葡萄糖10 g·L-1,酵母浸出粉5 g·L-1,蛋白胨5 g·L-1,海水1 000 mL,每瓶25 mL分装至150 mL锥形瓶中,121℃条件下灭菌20 min,贮存备用。
1.2.1.4 指示菌培养基 按YPDA培养基说明书配制、灭菌,用于抗菌活性检测。
1.2.1.5 耐受培养基 磷酸氢二钾1 g·L-1,七水合硫酸镁0.2 g·L-1,七水合硫酸亚铁0.1 g·L-1,氯化钙0.01 g·L-1,蛋白胨10 g·L-1,酵母浸出粉5 g·L-1, 1 000 mL蒸馏水溶解。在耐受培养基母液的基础上,配制pH值为7.4,NaCl浓度分别为1%、2%、3%、4%、5%、6%的盐耐受培养基;配制氯化钠浓度为2%,pH值分别为5.0、6.0、7.0、8.0、9.0、10.0的pH耐受培养基;配制NaCl浓度为2%,pH值为7.4的温度耐受培养基。上述培养基分装至150 mL锥形瓶中,每瓶25 mL,121℃条件下灭菌20 min,贮存备用。
1.2.2 放线菌筛选培养 称取5 g不同编号的海泥样品,分别加入装有50 mL灭菌海水的锥形瓶,100 r·min-1条件下振荡混匀30 min,静置沉降15 min。备3支无菌试管,用灭菌海水,梯度稀释样品悬液,得到10×、100×、1 000×稀释悬液,每次移取200 μL稀释悬液分别涂布AM、TM、PM平板,重复3次,25℃条件下培养至单菌落出现,挑取单菌落,转接到改良高氏一号培养基上纯化培养7 d,挑取单菌落接种传代培养基,28℃培养4~7 d,将菌种斜面保存于4℃冰箱。
1.2.3 发酵培养 无菌条件下用接种环从菌种斜面上挑取一环孢子接种液体发酵培养基,于30℃、160 r·min-1条件下振荡培养2 d,设3次重复。
1.2.4 抗菌试验 将发酵液分装于2 mL无菌离心管中,6 000 r·min-1离心20 min,取上清液,用0.2 μm直径无菌滤膜过滤尽量除去发酵液中悬浮细胞。参照管碟法[14],取白色念珠菌斜面,用无菌水洗下菌苔,分别与50℃的YPDA培养基混匀,控制菌浓度为1×106CFU·mL-1,在无菌条件下倒平板;取黑曲霉斜面,用无菌水洗下孢子,以孢子悬液涂布YPDA平板。以发酵培养基为空白对照,检测发酵液的抗菌活性,检测量为200 μL,观察各指示菌平板是否产生抑菌圈,设3次重复。
1.2.5 分子鉴定 按照基因组DNA小量抽提试剂盒操作说明,以电钻高速研磨改良细胞破碎步骤,提取2P-4基因组DNA,保存于-20℃冰箱。细菌16S rRNA通用PCR引物[15]:27F(5′-A G A G T T T G A T C C T G G C T C AG-3′),1492R(5′-G G T T A C C T T G T T A C G A C TT-3′);细菌DNA旋转酶基因通用PCR引物[15]:gyrB-F(5′-G T G G C C G A T T C C G G C A A C C C C A A CG-3′),gyrB-R(5′-T C A G A T G T C G A G G A A G C G G A C G T CC-3′),由杭州华大基因公司合成。以2P-4基因组DNA为模板,PCR扩增16S rRNA、gyrB基因,PCR反应体系为50 μL:2×Taq Master Mix(Dye) 25 μL,正反向引物各2 μL,DNA模板2 μL,ddH2O 19 μL。PCR反应程序:94℃预变性5 min,94℃变性30 s,60℃退火1 min,72℃延伸 1 min,35个循环;72℃终延伸5 min。1%琼脂糖凝胶电泳分离PCR产物,凝胶成像观察条带。PCR产物送上海桑尼生物技术有限公司测序。在GeneBank上用BLAST比对基因序列相似度,下载相似度大于98%的模式菌株16S rRNA基因序列,及相似度大于85%的模式菌株gyrB基因序列,用MEGA X软件分别构建系统发育树[16-17]。
1.2.6 形态学观察和生理生化鉴定 形态和生理生化鉴定委托中国工业微生物菌种保藏中心完成。参照《伯杰细菌鉴定手册》[17]的方法进行形态学观察及生理生化特性鉴定,用微生物生化鉴定试剂盒进行氧化酶、明胶液化、过氧化氢酶、类黑色素、硫化氢和硝酸盐还原试验。采用Biolog微生物自动分析系统按细菌鉴定操作规程,用微平板培养法进行碳源自动分析鉴定[18]。
1.2.7 耐受试验 盐浓度、pH耐受试验的培养温度为30℃,温度耐受试验如表3设置培养温度,按1.2.3的方法接种,160 r·min-1条件下振荡培养4 d,每天观察、记录生长情况,每组耐受试验设3次重复处理。
1.2.8 细胞化学组成鉴定 取菌种斜面,接种液体发酵培养基,30℃ 160 r·min-1条件下振荡培养2 d, 3 000 r·min-1离心,收集菌体,送中国工业微生物菌种保藏中心鉴定糖组分、细胞壁氨基酸组分、极性脂质、甲基萘醌及细胞膜脂肪酸组成。参考Hasegawa等[19]的方法用薄层层析(thin layer chromatography,TLC)法分析氨基酸、糖组分组成;参考魏安琪等[20]的方法提取细胞总脂肪酸,用MIDI Sherlock微生物自动鉴定系统联合气相色谱(gas chromatography,GC)法鉴定脂肪酸组成,进行全细胞脂肪酸谱分析和微生物种属鉴定;参考Minnikin等[21]的方法提取醌类和极性脂质,用高效液相色谱(high-performance liquid chromatography,HPLC)法鉴定甲基萘醌[22],用双向TLC法鉴定极性脂质组成[23]。
2 结果与分析
2.1 抗性筛选结果
本研究从7份海泥样品中共分离到25个菌株,其中AM培养基筛选到10个菌株,PM培养基筛选到15个菌株,TM培养基未筛选到菌株,仅发现1株菌对真菌表现抗性(图1),该菌编号为2P-4,表明其来自2号海泥样品,由PM培养基筛选培养得到的4号分离物。发酵液抗白色念珠菌的抑菌圈直径为19.35±0.73 mm,抗黑曲霉的抑菌直径为17.83±0.24 mm,表明发酵液中含有生物活性物质,对白色念珠菌的生长及黑曲霉孢子的萌发具有抑制作用。
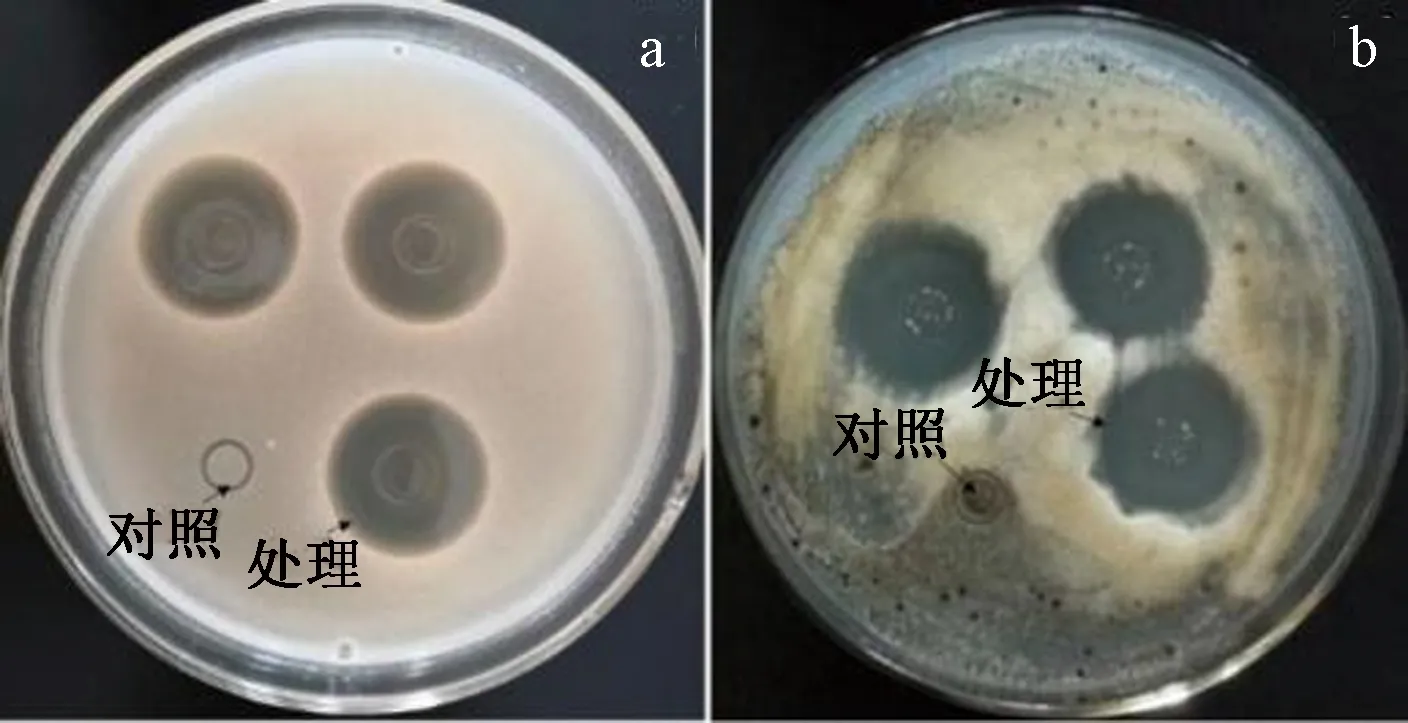
注:a:白色念珠菌平板;b:黑曲霉平板。Note: a:Plate for Candida albicans. b: Plate for Aspergillus niger.图1 发酵液抗真菌试验结果Fig.1 Results of anti-fungal experiments offermentation broths
2.2 菌株的分子鉴定
由图2可知,试验所用PCR引物特异性扩增gyrB、16S rRNA基因序列,PCR产物gyrB大小约为1 000 bp、 16S大小约为1 500 bp,与预期的gyrB、16S rRNA基因长度相符。
对PCR产物测序,将基因序列提交到GeneBank,16S rRNA基因登录号:MF785112,gyrB基因登录号:ON184034,用BLAST功能分别比对16S rRNA、gyrB基因序列与模式链霉菌的相似度。结果表明,2P-4的16S rRNA基因序列与毒三链霉菌模式菌株StreptomycestoxytriciniNBRC 13194T和浑圆链霉菌模式菌株Streptomycesglobosus LMG 19896T的相似度最高,均为99.56%;gyrB基因序列与StreptomycestoxytriciniNRRL B-5426T相似度最高,为99.04%。下载相似度大于98%的16S rRNA基因序列和相似度大于85%的gyrB基因序列,用MEGA X软件[24]分别进行序列比对、优化,用邻位连接法进行1 000次的相似度重复计算,构建系统发育树(图3、4),发育树节点只显示自展值(bootstrap value)大于50%的数值,上标“T”表示为模式菌株。图3显示,2P-4的16S rRNA基因在进化树上形成独立分枝,自展值为70%,与模式菌株StreptomycestoxytriciniNBRC 12823T和StreptomycesglobosusLMC 19896T的进化距离相等。图4显示,2P-4的gyrB基因与模式菌株StreptomycestoxytriciniNRRL B-5426T在节点处两者分开,2P-4形成独立分枝,自展值为100%。16S rRNA基因在进化上具有保守性,可作为微生物种水平鉴定的依据之一[25],gyrB基因编码DNA促旋酶β亚基,该基因为细菌的保守单拷贝基因,对于菌种水平鉴别细菌是快速而有效的方法,2P-4的16S rRNA和gyrB基因进化树都显示形成独立分枝,表明2P-4与已知链霉菌的进化距离较远[26],可能是链霉菌属的一个新种。
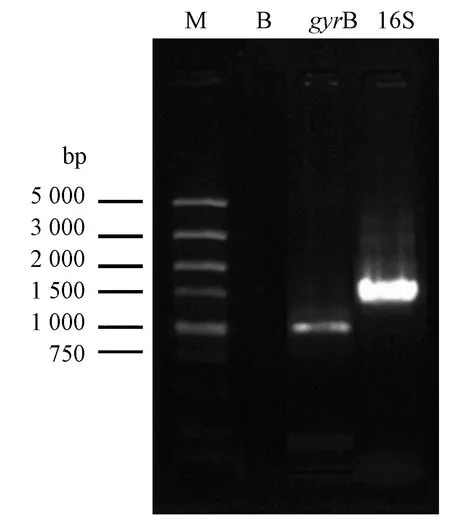
注:M:DNA maker; B:空白对照;gyrB:PCR扩增gyrB基因产物;16S:PCR扩增16S rRNA基因产物。Note: M:DNA marker. B:Blank control. gyrB:PCR products for gene gyrB. 16S:PCR products for gene 16S rRNA.图2 16S rRNA、gyrB基因PCR产物琼脂糖凝胶电泳图Fig.2 Agarose gel electrophoresis photographer of PCR product from 16S rRNA and gyrB
2.3 形态特征
2P-4分别接种在链霉菌分类标准培养基ISP2-ISP6上,28℃条件下培养10 d,菌落培养特征列于表1。2P-4在ISP2、ISP3、ISP4培养基上产生绒粉状气生菌丝,在ISP5、ISP6培养基上不产生气生菌丝;2P-4在

图3 2P-4 16S rRNA基因序列系统发育树Fig.3 Phylogenetic tree based on 16S rRNA gene sequence
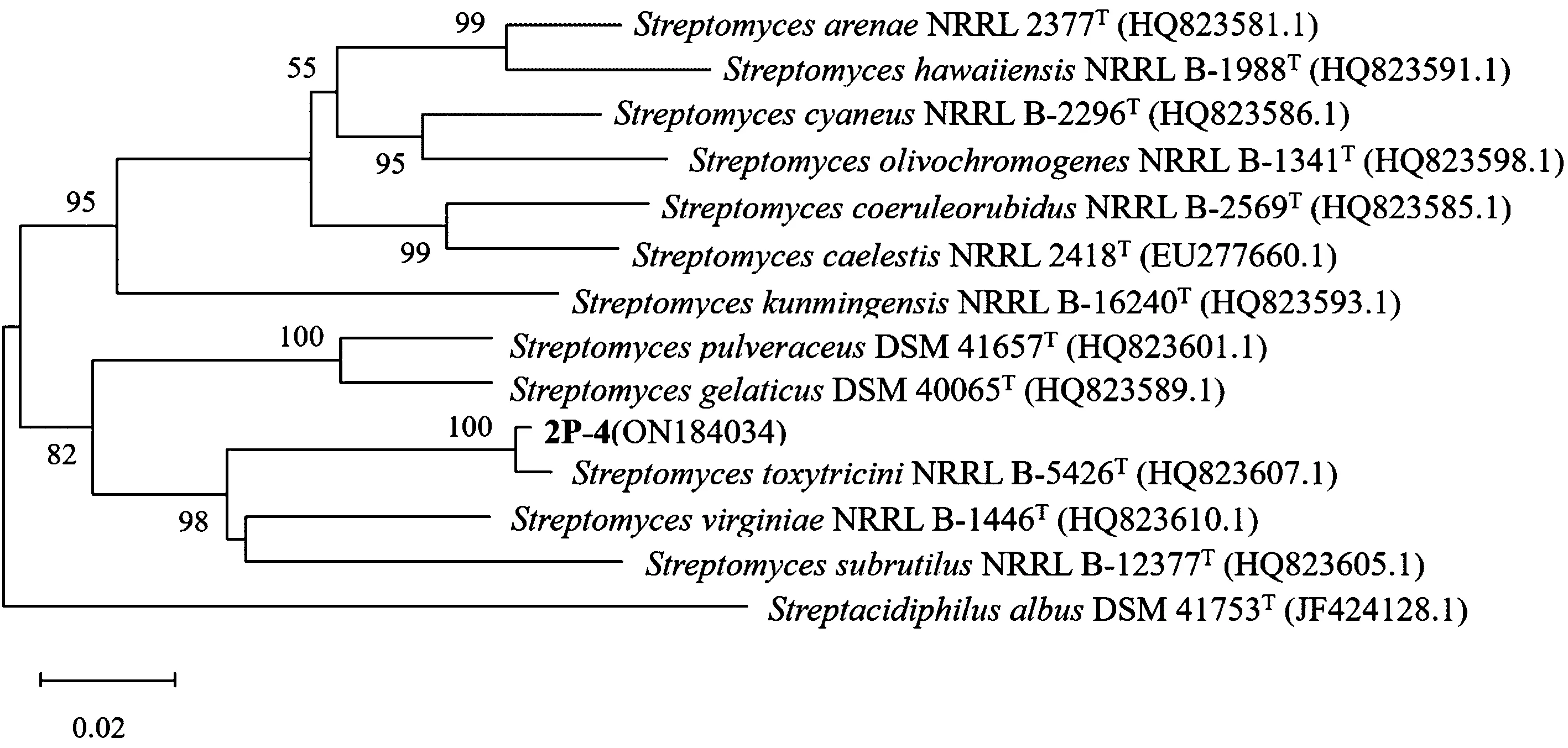
图4 2P-4 gyrB基因序列系统发育树Fig.4 Phylogenetic tree based on gyrB gene sequence

表1 2P-4在ISP培养基上的培养特征Table 1 Culture characteristics of 2P-4 on ISP media
ISP2-ISP6培养基上形成的基内菌丝颜色可呈浅橙色、浅黄色、灰黄色及米色,均不产生可溶性色素。
将2P-4孢子接种在ISP4培养基上,28℃条件下培养4 d,用显微镜观察菌丝体。图5-a显示孢子丝呈螺旋状,图5-b显示孢子呈柱状,表面带疣状装饰。
2.4 生理生化特征
表2中共有22种碳源,2P-4只能利用其中6种:D-葡萄糖、D-海藻糖、D-麦芽糖、D-蔗糖、N-乙酰-葡萄糖苷和甘油。2P-4能水解淀粉、纤维素、海藻酸和酪蛋白,不能使明胶液化,可分解含硫氨基酸产生硫化氢,不产生类黑色素,不还原硝酸盐,细胞表面不含细胞色素氧化酶。

注:a:光学显微照片;b:扫描电镜照片。Note: a: The optical microscope photograph. b: The scanning electron micrograph.图5 2P-4孢子丝、孢子形态特征Fig.5 Morphological characteristics of spore chains and spores of 2P-4

表2 2P-4生理生化特征Table 2 Physiological and biochemical characteristics of 2P-4
2.5 温度、酸碱度、NaCl浓度耐受性
由表3可知,培养液起始pH值为7.4、温度为28℃条件最适合2P-4生长;当NaCl浓度在1%~4%范围内,2P-4的生长比较旺盛,当NaCl浓度为5%时2P-4表现为生长微弱,当NaCl浓度为6%时2P-4不生长;2P-4在培养基pH值小于5.0或大于9.0条件下不生长。耐受性试验结果说明,2P-4对较高浓度的酸、碱及盐的耐受性差。
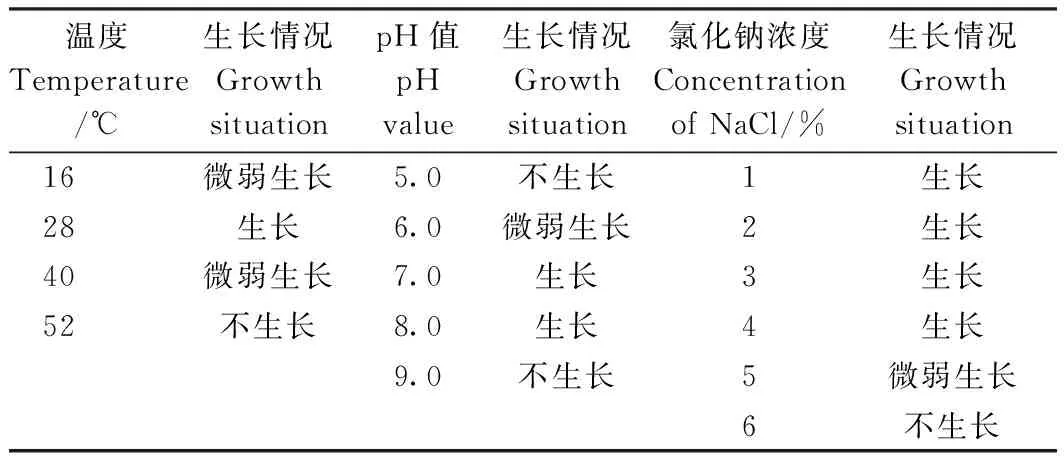
表3 2P-4对温度、酸碱度、氯化钠浓度的耐受特性Table 3 Tolerance characteristics of 2P-4 to temperature,pH value and sodium chloride concentration
2.6 细胞化学组成
细胞化学组成鉴定结果表明,2P-4的全细胞水解物含有核糖和LL-二氨基庚二酸(LL-diaminopimelic acid,LL-DPA),细胞膜极性脂质含有磷脂酰乙醇胺、心磷脂及7种不确定的极性脂质(包括磷脂、氨基磷脂和脂质)。2P-4细胞膜甲基萘醌(methyl naphthoquinone,MK)的主要形式是MK-9(H6),占总量的71.37%,其次是MK-9(H8)和MK-9(H4),各占总量的13.92%、10.69%,还含有4.03%的MK-9。2P-4全细胞脂肪酸鉴定结果如表4所示,占全细胞脂肪酸总量大于2%的饱和脂肪酸,分别是16∶0、14∶0 iso、15∶0 iso、16∶0 iso、17∶0 iso 、15∶0 anteiso和17∶0 anteiso,不饱和脂肪酸分别是 16∶1 cis 9和17∶1 anteiso C;占全细胞脂肪酸总量小于2%的脂肪酸是14∶0、 17∶0、18∶0、11∶0 anteiso、17∶1 cis 9、18∶1 cis 9和16∶1 iso H;2P-4还含有少量的羟基脂肪酸、17∶0 cyclo及可能含有16∶0 9 methyl。

表4 2P-4全细胞脂肪酸组成Table 4 Whole cell fatty acids composition of 2P-4
3 讨论
本研究用筛选放线菌的方法,自海泥样品中筛选获得了抗真菌菌株2P-4。对该菌株进行传代培养,表明其在实验室条件下可正常生长,并产生大量孢子,其发酵液对白色念珠菌和黑曲霉具有抑制生长的作用。链霉菌属的分类特征主要是细胞壁含有LL-DAP或甘氨酸,全细胞水解物中无特征性糖,或含有不易检测出的半乳糖[17],细胞膜含有磷脂酰乙醇胺和甲基萘醌MK-9(H6)、MK-9(H8)、MK-9(H4)[27],细胞膜总脂肪酸中主要含有大量直链饱和脂肪酸和末端分支饱和脂肪酸,不饱和脂肪酸含量低于5%[28]。2P-4的全细胞化学组成的鉴定结果表明,该菌不含特征性糖,而含有核糖、LL-DPA,符合链霉菌的鉴定标准,其极性脂质、甲基萘醌及脂肪酸的主要组分与链霉菌极为相似,并且2P-4的16S rRNA、gyrB基因序列与毒三链霉菌模式菌株的进化关系最为密切,因此可以确定2P-4为链霉菌属成员。《伯杰细菌鉴定手册》[17]描述毒三链霉菌的特征是具有抗细菌、抗真菌活性,孢子链为典型的初旋,孢子颜色属于红色系,表面光滑,不能利用蔗糖,产类黑色素。2P-4具有与毒三链霉菌不同的特征,2P-4的孢子链呈螺旋型、孢子壁带疣、可利用蔗糖,不产类黑色素。Tang等[29]鉴定发现,StreptomycestoxytriciniNBRC 13194T能利用L-阿拉伯糖、D-果糖、D-半乳糖、D-葡萄糖、L-鼠李糖、纤维二糖、麦芽糖和蔗糖,与上述结果相比,2P-4不能利用纤维二糖和鼠李糖,说明2P-4在碳源利用和能量代谢上与其近缘种StreptomycestoxytriciniNBRC 13194T的差别较大,并且2P-4的16S rRNA和gyrB基因在系统发育树上均形成独立分枝,从而支持2P-4与毒三链霉菌分属于不同的种。因此,结合形态、生理生化、细胞化学组成和分子进化鉴定结果,初步鉴定2P-4为链霉菌属的一个新种。
本研究用苯丙氨酸培养基(PM)筛选培养得到2P-4,生理生化特征显示该菌株具有海藻酸裂解酶活性。通过对2P-4的16S rRNA、gyrB基因序列的BLAST比对结果进行进一步分析,发现在16S rRNA基因序列相似度大于97%,及gyrB基因序列相似度大于85%的模式链霉菌株中不含有致病链霉菌。表明菌株2P-4易培养,且具有较高的生物安全性。
海藻酸是构成褐藻细胞壁的主要多糖,其降解产生的寡糖能促进植物生长,增强抗病性及抗逆性等作用[30]。海藻酶裂解酶广泛用于海藻酸寡糖的生产,在已发现并表征的海藻酸裂解酶中,大部分来自海洋细菌,如弧菌、假单胞菌、芽孢杆菌等[31],而来源于海洋链霉菌的相关酶学研究鲜有报道。2P-4具有海藻酸裂酶活性,其酶的结构、性质、底物特异性及酶催化产物可能具有独特性,值得深入探究。利用链霉菌活体制剂防治植物真菌病害在农业领域具有重要应用,如防治稻瘟病菌、镰刀菌等[32]。2P-4具有抗真菌活性,海藻酸裂解酶活性及良好的生物安全性,其活体和代谢产物有望应用于抗真菌生防制剂的研制,在农业领域具有良好的应用前景。
在陆地链霉菌资源枯竭的背景下,海洋链霉菌因独特的生物合成能力而备受关注[33]。为了保护我国微生物资源,将链霉菌2P-4送中国普通微生物中心专利保藏,登记入册编号:CGMCC No.17860。
4 结论
本研究从宁波慈溪海塘海泥样品中分离得到1株具有抗真菌活性的可培养放线菌2P-4,该菌的生长对海水具有依赖性,并且具有降解海藻酸的活性,表明该菌确为一株海洋放线菌。对2P-4进行分子进化、形态、生理生化和细胞化学组成分析,初步鉴定2P-4为链霉菌属的一个新种。本研究发现的海洋链霉菌2P-4具有抗真菌活性,其代谢产物可能成为新型抗真菌药物的来源。2P-4的抗真菌活性代谢产物及其生物合成机制还有待进一步研究。

