蜈蚣败毒饮对银屑病模型鼠外周血中Treg细胞表达影响的相关性研究
张晴 杨素清 安月鹏
银屑病是一种受多基因背景调控决定且由T淋巴细胞(thymus,T)介导的免疫性皮肤疾病[1],随着银屑病机制研究的不断深入,其相关T细胞机制的探索已从既往的辅助性T细胞1(helper T cell 1,Th1)/辅助性T细胞2(helper T cell 2,Th2)失衡逐渐转向辅助性T细胞17(helper T cell 17,Th17)/调节性T细胞(regulatory T cell,Treg)失衡[2],同时对于滤泡性辅助性T细胞(follicular helper T cell,Tfh)[3]及记忆性T细胞[4]等的研究亦不断延伸。其中研究发现,Treg细胞与银屑病的发生、发展密切相关,并受到Th17细胞的反馈调节作用,且银屑病中以Th17细胞占优势地位,Treg细胞占弱势地位[5]。本次研究拟通过对Treg细胞表面血细胞簇分化抗原4(cluster differentiation 4,CD4+)、血细胞簇分化抗原25(cluster differentiation 25,CD25+)、叉头框蛋白3(forkhead box p 3,Foxp3+)作为标记物[6],探索银屑病模型鼠外周血中Treg细胞的表达情况,并检测主要分泌因子白细胞介素10(interleukin-10,IL-10)、转化生长因子β(transforming growth factor-β,TGF-β)的水平,同时对其与模型鼠皮损指数之间的相关性进行分析,从而发现中药复方制剂蜈蚣败毒饮的作用靶点,结合课题组前期对于Th17细胞的研究成果[7],有助于挖掘Th17/Treg细胞平衡在银屑病治疗中的动态作用,为基于中医“毒”“瘀”理论的临床辨治提供佐证和依据。
1 材料与方法
1.1 实验动物
SD大鼠(雌雄各半,清洁级,4~6周,体质量为120~160 g,郑州大学医学院实验动物中心,动物合格证号:SCXK20190001),实验室通风情况良好,温度保持在20~25℃之间,相对湿度保持在40%~60%之间。
1.2 实验药品
甲氨蝶呤片(上海上药信宜药厂有限公司,批号:190510,批准文号:国药准字H31020644,规格2.5 mg×16片);咪喹莫特乳膏62.5 mg(四川明欣药业有限责任公司,批号:200611,批准文号:国药准字H20030128,规格12.5 mg∶0.25 g);生理盐水(哈尔滨三联药业,批号:20101722,批准文号:国药准字H23023525,规格100 mL∶0.9g);蜈蚣败毒饮(蜈蚣3 g、紫草30 g、土茯苓30 g、鬼箭羽30 g、乌梢蛇20 g、甘草10 g、药物来自于黑龙江中医药大学附属第一医院门诊草药局)。
1.3 实验仪器与试剂
低温离心机(赛默飞世尔科技公司,型号:ST8/8R);电子天平(梅特勒-托利多公司,型号:ME104E);呼吸麻醉机(上海玉研科学仪器公司,型号:Y1001410002);流式细胞仪(美国碧迪医疗器械有限公司,型号:FACSCalibur);Flowjo10软件(优宁维公司,型号:V10);血细胞簇分化抗原4(上海睿铂赛生物科技有限公司,批号:B245875);血细胞簇分化抗原25(上海睿铂赛生物科技有限公司,批号:B228817);叉头框蛋白3(上海睿铂赛生物科技有限公司,批号:B204163);大鼠白细胞介素10酶联免疫分析试剂盒(上海酶联生物科技有限公司,批号:ML002813);大鼠转化生长因子β酶联免疫分析试剂盒(上海酶联生物科技有限公司,批号:ML002856);红细胞裂解液(美伦公司,批号:MA0207);磷酸盐平衡生理盐水(美伦公司,批号:MA0016);4%多聚甲醛(上海易汇生物科技有限公司,批号:BL539A);聚氧乙烯单叔辛基苯基醚(上海桥星贸易有限公司,批号:1139ML100);无菌去离子水(美伦公司,批号:MA0028);肝素钠(湖北鑫润德化工有限公司,批号:9041-08-1)。
1.4 药液制备
中药复方制剂蜈蚣败毒饮以常规的煎煮方法煎煮两次,将两次煎煮好的药液混匀,通过大鼠与成年人的体表面积等效剂量换算,形成最终浓度分别为0.554 g/mL、1.107 g/mL、2.214 g/mL的蜈蚣败毒饮低剂量组、中剂量组、高剂量组的浓缩液,通过换算可知,其浓度分别相当于70 kg成年人常规用量的0.5倍、1倍、2倍。西药甲氨蝶呤片经大鼠与成年人的体表面积等效剂量换算,甲氨蝶呤片最终配置成浓度为0.023 mg/mL的甲氨蝶呤混悬液,其浓度相当于70 kg成年人常规用量的1倍。生理盐水无需特殊制备。
1.5 分组、造模及给药
将30只SD大鼠随机分为6组,每组5只,分别为空白组、模型组、甲氨蝶呤西药对照组(西药组)、蜈蚣败毒饮中药低剂量组(低剂量组)、蜈蚣败毒饮中药中剂量组(中剂量组)、蜈蚣败毒饮中药高剂量组(高剂量组)。除空白组外,其余各组大鼠均用动物电推剪将其背部约2~3 cm区域的毛剔除备皮,每日局部涂抹5%的咪喹莫特乳膏62.5 mg,每日1次,连续8天。
各组大鼠分别在造模完成后进行上述药液灌胃,频次和剂量均为2 mL/(200g·d),分成每日早晚两次灌胃。其中蜈蚣败毒饮各剂量组以相应浓度的蜈蚣败毒饮浓缩液灌胃8天,空白组和模型组以生理盐水灌胃8天,西药组在灌胃时,前4天以甲氨蝶呤混悬液灌胃,后4天以生理盐水灌胃(注:如此方法符合甲氨蝶呤药物在临床中的服用方法[8])。
1.6 皮损观察
在国际公认的人类银屑病皮损面积和严重指数评分(psoriasis area and severity index,PASI)[9]的基础上,结合大鼠与人类相比较独特的尾部结构及大鼠与人体各部位体表面积分布的不同,对PASI评分法进行改良,形成评价银屑病模型的鼠银屑病皮损面积和严重指数评分(mice psoriasis area and severity index,MPASI)评分法,MPASI评分法将鼠分为头部、上肢、躯干、下肢、尾部共5个部分,每个部分分别占总体表面积的20%、10%、50%、10%、10%,再通过类似于PASI的计算方法,以此来评价银屑病鼠模型的皮损面积和严重指数。因此,课题组通过MPASI评分法对银屑病鼠造模完成后即灌胃前的皮损指数,及灌胃后的皮损指数进行分别观察评价,并计算出在灌胃8天内,除空白组外其余各银屑病鼠的皮损指数变化量(△MPASI)。△MPASI=MPASI灌胃前-MPASI灌胃后。
1.7 含药血清制备
在灌胃给药及皮损指数观察结束后,采用呼吸麻醉机对各大鼠进行麻醉,而后将其固定在手术台上,在无菌的环境中对大鼠进行腹主动脉取血8 mL,血液置于肝素钠的真空采血管当中,经混匀、离心后制备成含药的外周血单个核细胞(peripheral blood mononuclear cell,PBMC),部分血清于2小时之内进行流式细胞学的检测,余血清保存备用。
1.8 血清指标检测
流式细胞法检测Treg的表达时,各大鼠取新鲜的抗凝血后,以400~500 g离心5分钟,离心后弃上清液;将10×红细胞裂解液以离子水稀释至1×的工作液,再加入6~10倍细胞体积的1×红细胞裂解液,轻轻吹打混匀,裂解1~2分钟;以400~500 g离心5分钟,4℃离心后弃上清液;洗涤:加入磷酸盐平衡生理盐水(phosphate buffered saline,PBS)缓冲液,重悬沉淀,以400~500 g离心2~3分钟,离心后弃上清液,重复1次,共洗涤2次;加入100 μL的PBS缓冲液,按照说明书用量加入CD4+和CD25+抗体各5 μL,4℃避光孵育30分钟;加入100 μL的4%多聚甲醛,重悬沉淀,经室温固定10分钟,再以400~500 g离心2~3分钟,离心后弃上清液;洗涤2次:加入100 μL的PBS缓冲液,重悬沉淀,以400~500 g离心2~3分钟,离心后弃上清液;加入0.1%的聚氧乙烯单叔辛基苯基醚,重悬沉淀,破膜5分钟,以400~500g离心2~3分钟,离心后弃上清液;按照说明书加入5 μL的Foxp3+抗体,以4℃避光染色30分钟;向染色后的离心管中加入300 μL的PBS缓冲,混匀后进行上机检测;以CD4+CD25+Foxp3+T细胞表示Treg细胞数目,以CD4+CD25+Foxp3+T细胞占CD4+T细胞的百分比表示Treg细胞所占的比值,采用Flowjo10软件进行分析,从而对Treg的细胞表达情况进行评估。酶联免疫吸附法(enzyme linked immunosorbent assay,ELISA)检测IL-10、TGF-β的含量时,将大鼠的全血样本进行离心,设置标准品孔和样本孔,加入不同浓度的标准品50 μL,除空白组外加酶处理,分别进行温育、洗涤、显色,最后终止反应,以空白孔凋零,450 nm波长依序测定各个孔的吸光度,以吸光度为纵坐标,标准品的浓度为横坐标,描绘标准曲线,从而计算出各因子的浓度。
1.9 统计学方法
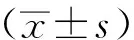
2 结果
2.1 银屑病鼠MPASI比较
灌胃后蜈蚣败毒饮各剂量组及西药组的皮损指数均有不同程度的下降(P<0.05),尤以西药组和高剂量组的下降程度最为显著(P<0.05),且二者的作用相似,具体见表1。

表1 银屑病鼠灌胃前后皮损指数比较分)
2.2 银屑病鼠外周血Treg细胞表达比较
不同组别银屑病鼠外周血中Treg的细胞数均有不同程度的下降(P<0.05),以模型组及低、中剂量组最为显著,灌胃后西药组和高剂量组外周血中Treg的细胞数相对较高,具体见表2及图1。

注:A 空白组;B 模型组;C 西药组;D 低剂量组;E 中剂量组;F 高剂量组;

表2 各组银屑病鼠外周血Treg细胞表达比较
2.3 银屑病鼠Treg细胞分泌因子IL-10、TGF-β比较
银屑病模型组大鼠的IL-10、TGF-β含量明显下降(P<0.05),灌胃后西药组和高剂量组可显著上调二者的水平(P<0.05),且低剂量组对TGF-β亦具有显著的上调作用(P<0.05),具体见表3。

表3 Treg细胞分泌因子IL-10、TGF-β含量比较
2.4 Treg细胞及分泌因子与△MPASI的相关性比较
通过对除空白组外的所有25只大鼠进行整体评估,分析Treg细胞相关通路指标与皮损情况的相关性,可以看出,灌胃后的大鼠Treg细胞数、IL-10含量、TGF-β含量与灌胃前后皮损指数变化量之间均存在正相关(P<0.05),具体见表4及图2~4。

表4 Treg细胞表达与△MPASI的相关性比较

图2 Treg细胞与△MPASI的回归曲线图
3 讨论
Treg细胞称为调节性T细胞,于1995年被首次发现[10],是一类能够调控自身免疫反应的T细胞亚群,其主要可以分为两大类,其一为天然形成的自然调节性T细胞,主要来源于胸腺;其二为通过诱导产生的适应性调节性T细胞,主要由外周成熟的T淋巴细胞在持续的抗原刺激诱导下所产生,二者均与人体的自身免疫性疾病密切相关[11]。Treg细胞的表面标记物目前公认的有CD4+、CD25+、Foxp3+,有学者认为血细胞簇分化抗原127(cluster differentiation 127,CD127+)也可以作为区分Treg细胞的重要标志物之一,其在Treg细胞表面不表达或弱表达[12]。Treg细胞主要经T细胞受体和白细胞介素2(interleukin-2,IL-2)因子的刺激,在信号传导及转录激活蛋白5(signal transducer and activator of transcription 5,STAT5)和Foxp3的转导作用下,通过分泌IL-10、白细胞介素35(interleukin-35,IL-35)、TGF-β等细胞因子,减少相关炎症因子的释放,抑制效应性T细胞的活化和增殖等功能,从而下调机体对于各种外来抗原或自身抗原的应答水平,发挥维持机体免疫耐受的功效[13-14]。有研究表明[15],银屑病患者外周血中的Treg细胞的数目和功能明显低于正常人,且在一定程度上受肿瘤坏死因子-α(tumor necrosis factor,TNF-α)、白细胞介素23(interleukin-23,IL-23)及趋化因子5(chemotactic cytokines receptor 5,CCR5)的调控作用,同时,Treg细胞和Th17细胞之间存在着动态平衡作用,通过血细胞簇分化抗原18(cluster differentiation 18,CD18)、整合素等的调节,使得发生偏向于Th17细胞的失衡反应,从而加重银屑病患者的皮损状态[16]。

图3 IL-10与△MPASI的回归曲线图

图4 TGF-β与△MPASI的回归曲线图
课题组前期应用中药制剂蜈蚣败毒饮在临床及围绕Th1、Th2、Th17细胞等的实验研究方面取得了较为丰富的研究成果[17-18],并且发现蜈蚣败毒饮可以干预T细胞之间的动态平衡从而干预银屑病的发生和发展。因此,本次研究将其应用于T细胞的另一分支Treg细胞的机制研究中来,蜈蚣败毒饮由蜈蚣、紫草、土茯苓、鬼箭羽、乌梢蛇、甘草等药物组成,其立方依据体现了中医学从“毒”和“瘀”辨治银屑病的理论特色。蜈蚣、乌梢蛇,一者熄风毒,化络瘀,再者可发挥虫类药以毒攻毒之效;紫草,清热毒,散瘀血;土茯苓,除湿毒,利关节;鬼箭羽,化瘀毒,通经络;甘草,解百毒,和药性。在组方配伍方面,充分体现了解毒化瘀法在银屑病辨治中的有效性。
在本次实验研究中,分别围绕银屑病鼠模型的皮损指数和外周血中Treg及其分泌因子IL-10、TGF-β的表达进行了检测,同时对指标与皮损之间相关性进行了分析。在皮损指数方面,灌胃后各药物组的皮损指数均有不同程度的下降,同时灌胃前后皮损指数的变化量亦表现出统计学差异,疗效依次为西药组≈高剂量组>中剂量组>低剂量组,呈现一定的量效依赖关系。在外周血Treg的表达方面,通过提取PBMC,以细胞标记物CD4+CD25+Foxp3+进行流式细胞检测,得出各组样本中Treg细胞的数目和所占CD4+T细胞的百分比。从结果可以看出:经咪喹莫特诱导的银屑病鼠模型血清中的Treg细胞数目均有不同程度的下降,以模型组、低剂量组、中剂量组下降程度最为显著,而西药组和高剂量组下降程度略低,说明高剂量的中药制剂可有效改善Treg细胞的低水平,在对Treg细胞主要分泌因子IL-10、TGF-β的检测中也可以发现,高剂量组和西药组可以显著缓解因银屑病所导致的因子抑制状态,增加血清中两种分泌因子的相对量。同时,通过对灌胃后Treg细胞数、IL-10、TGF-β与大鼠灌胃前后皮损指数变化量(△MPASI)进行相关性分析可知,Treg细胞数目越高,IL-10和TGF-β的表达越高,△MPASI的值越大,说明皮损缓解程度越好,反之,灌胃后的Treg细胞数目越低,IL-10和TGF-β的分泌量则越少,△MPASI的值越小,说明皮损缓解程度越差,二者呈显著的正相关。
可以看出,蜈蚣败毒饮能够调控外周血中Treg细胞,达到恢复Th17/Treg细胞平衡,缓解银屑病皮损的目的,在微观层面上揭示了中药的作用机制,结合前期对于蜈蚣败毒饮的研究,从而产生多靶点效应的干预效应[19]。后期可针对T细胞亚群间的多因子、多通路的细胞间机制进一步探索,为基于“毒”“瘀”理论辨治银屑病提供依据和佐证。

