伊马替尼及其代谢物血浆蛋白结合率测定方法的建立及应用Δ
王敦建,焦慧文,钱 依,徐江浩,徐 皓,孙鲁宁1,#a,王永庆1,#b(1.徐州医科大学药学院,江苏 徐州 1004;.南京医科大学第一附属医院临床药理研究室,南京 1009;.南京医科大学第一附属医院普外科,南京 1009)
伊马替尼是第一个被美国FDA批准用于胃肠道间质瘤(gastrointestinal stromal tumors,GIST)的酪氨酸激酶抑制剂,该药可显著延长晚期GIST患者的无复发生存期[1]。伊马替尼被吸收进入血液循环后,在血浆中以结合型与游离型药物存在,其中结合型药物在体内主要与白蛋白(albumin,ALB)、球蛋白(globulin,GLB)和α1-酸性糖蛋白(alpha-1-acid glycoprotein,AGP)结合,而只有游离型药物才是伊马替尼发挥药理作用的重要部分[2]。伊马替尼的主要代谢物为N-去甲基伊马替尼,两者具有相似的生物活性和效应,且与体内结合蛋白均具有较高的亲和力[3-4]。药物蛋白结合率的微小变化可能会对药物游离浓度产生显著影响,进而通过浓度-效应关系影响其药理作用[5]。因此,测定体内药物的蛋白结合率就显得尤为重要。
虽然国内外已有同时测定伊马替尼及其代谢物的报道,但样品处理方法较繁琐,灵敏度不高,检测范围不符合临床要求,且大多采用超滤法[6-8],该方法存在药物容易和超滤装置发生非特异性结合的缺点。目前也尚未有研究报道伊马替尼及其代谢物与不同蛋白的结合情况。为此,本研究建立了平衡透析法结合液相色谱-串联质谱(liquid chromatography-tandem mass spectrometry,LC-MS/MS)法测定伊马替尼及其代谢物(N-去甲基伊马替尼)与不同蛋白结合率的方法,并同法检测GIST患者血浆中两者的游离药物浓度,旨在为伊马替尼的安全用药提供参考。
1 材料
1.1 主要仪器
本研究所用主要仪器有1290 Infinity型高效液相色谱仪(美国Agilent公司),AB-SCIEX API 4000型串联四极杆质谱仪(美国Applied Biosystem公司),Stratos型高速冷冻离心机、Single-Use RED Plate with Inserts型快速平衡透析装置(美国Thermo Fisher Scientific公司)等。
1.2 主要药品与试剂
伊马替尼对照品(纯度98%,批号LPC0P57)、N-去甲基伊马替尼对照品(纯度98%,批号LN90O52)均购自北京百灵威科技有限公司;伊马替尼-d8(内标,纯度98.7%,批号2-AJK-132-1)购自加拿大Toronto Research Chemicals公司;ALB(纯度20%,批号S20170005)购自德国CSL Behring GmbH公司;GLB(纯度5%,批号S19993042)购自成都蓉生药业有限公司;AGP(纯度≥99%,批号SLBJ6840V)购自美国Sigma公司;磷酸盐缓冲 溶 液(phosphate buffer saline,PBS,pH 7.2,批 号20012027)购自美国Gibco公司;甲醇、乙酸、乙腈均为色谱纯,乙酸铵为分析纯,水为去离子纯化水。
1.3 血浆来源
空白血浆由南京医科大学第一附属医院血库提供。
2 方法与结果
2.1 色谱条件与质谱条件
2.1.1 色谱条件 以Agilant ZORBAX Eclipse Plus C18(2.1 mm×50 mm,1.8 μm)为色谱柱,以乙腈-10 mmol/L乙酸铵(含0.1%乙酸)溶液(77∶23,V/V)为流动相;柱温为35 ℃;流速为0.5 mL/min;进样量为1.0 μL;分析时间为2.5 min。
2.1.2 质谱条件 离子源为电喷雾离子源;监测方式为多反应监测;采集模式为正离子;离子化电压为5 500 V;离子源温度为550℃;雾化气压为45 psi;涡轮气压为55 psi;气帘气压为 35 psi;碰撞气压为 10 psi;用于定量分析的离子对分别为m/z494.4→394.2(伊马替尼)、m/z480.4→394.2(N-去甲基伊马替尼)、m/z502.4→394.2(内标)。
2.2 溶液的制备
2.2.1 伊马替尼对照品溶液及其代谢物溶液 精密称取伊马替尼对照品10.22 mg(经纯度换算为10.02 mg)、N-去甲基伊马替尼对照品5.13 mg(经纯度换算为5.03 mg),分别置于10 mL棕色量瓶中,用甲醇-水(1∶1,V/V)溶解并定容,混匀,制成质量浓度为1.00 mg/mL的伊马替尼对照品溶液和0.503 mg/L的代谢物溶液,于-40℃冰箱保存。
2.2.2 内标溶液 取伊马替尼-d8 0.50 mg,置于10 mL棕色量瓶中,用甲醇溶解并定容,制成质量浓度为50.0 μg/mL的内标储备液;取内标储备液适量,用甲醇稀释至所需质量浓度即可。
2.2.3 标准曲线样品溶液和质控样品溶液 取“2.2.1”项下伊马替尼对照品溶液及其代谢物溶液适量,用甲醇稀释后,各取2.5µL,加入空白血浆50µL,涡旋混匀,制成伊马替尼质量浓度分别为50.0、100、250、500、1 000、3 000、4 500、5 000 ng/mL,代谢物质量浓度分别为25.0、50.0、125、250、500、1 500、2 250、2 500 ng/mL的系列标准曲线血浆样品溶液,以及伊马替尼质量浓度分别为50.0、120、750、4 000 ng/mL,代谢物质量浓度分别为25.0、60.0、375、2 000 ng/mL的质控血浆样品溶液。取PBS 100µL,同法制备伊马替尼及其代谢物质量浓度分别均为2.00、5.00、10.0、20.0、40.0、120、180、200 ng/mL的系列标准曲线PBS样品溶液,以及质量浓度分别均为2.00、4.80、30.0、160 ng/mL的质控PBS样品溶液。
2.3 样本的预处理
2.3.1 血浆样本的预处理 取血浆样本50µL、甲醇2.5µL,涡旋混匀,加入100 ng/mL的内标溶液300µL,涡旋后于4℃下以16 000 r/min离心15 min,取上清液100µL,置于1.5 mL离心管中,加水900µL,涡旋混匀,取上清液进样分析。
2.3.2 PBS样本的预处理 取PBS样本100µL、甲醇2.5µL,涡旋混匀,加入10.0 ng/mL的内标溶液300µL,涡旋后于4℃下以16 000 r/min离心15 min,取上清液进样分析。
2.4 方法学考察
2.4.1 专属性考察 分别取PBS、空白血浆、伊马替尼(50.0 ng/mL)及其代谢物(25.0 ng/mL)的标准曲线血浆样品溶液、患者血浆样本适量,按“2.3”项下方法预处理,再按“2.1”项下色谱与质谱条件进样分析,记录色谱图,详见图1(PBS和空白血浆图略)。由图1可知,待测成分和内标的保留时间分别为1.48、1.26、1.43 min,各峰峰形良好,无杂峰干扰,空白血浆中的小分子内源性物质及PBS对测定无干扰,表明本方法专属性良好。
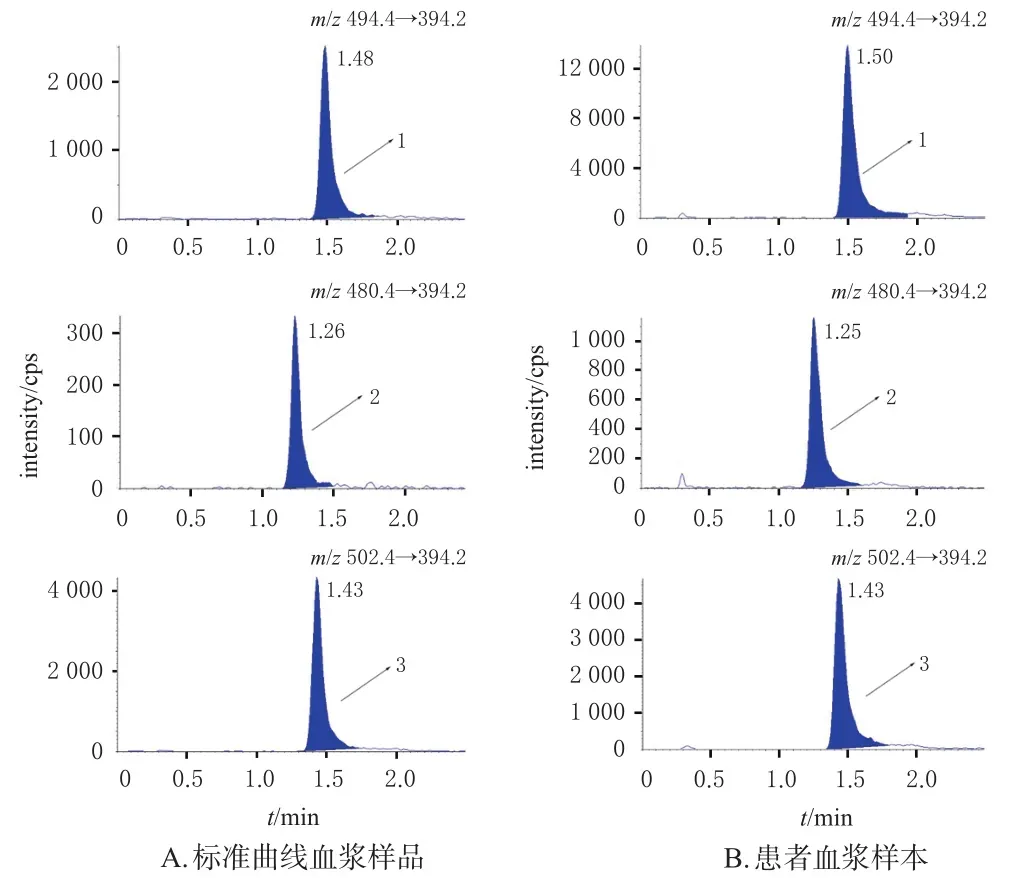
图1 伊马替尼及其代谢物、内标的典型色谱图
2.4.2 线性关系考察 取“2.2.3”项下标准曲线样品溶液,按“2.3”项下方法预处理,再按“2.1”项下色谱与质谱条件进样分析,记录峰面积。以待测成分质量浓度为横坐标(x)、待测成分与内标峰面积的比值为纵坐标(y)进行线性回归(权重系数为1/C2)。结果显示,血浆样品中伊马替尼的回归方程为y=0.002 00x+0.002 30(r=0.998 3),代谢物的回归方程为y=0.000 620x+0.000 757(r=0.997 1);PBS样品中伊马替尼的回归方程为y=0.003 67x+0.001 64(r=0.998 4),代谢物的回归方程为y=0.003 46x+0.001 77(r=0.999 0)。这表明血浆样品中伊马替尼及其代谢物的检测质量浓度线性范围分别为50.0~5 000、25.0~2 500 ng/mL,定量下限分别为50.0、25.0 ng/mL;PBS样品中线性范围均为2.00~200 ng/mL,定量下限均为2.00 ng/mL。
2.4.3 准确度和精密度试验 取“2.2.3”项下质控血浆样品溶液和质控PBS样品溶液,每浓度各5份,于同日内按“2.3”项下方法预处理,再按“2.1”项下色谱与质谱条件进样分析,考察日内精密度;连续测定3 d,考察日间精密度。以实测浓度与理论浓度进行比较,用相对误差(relative error,RE)考察准确度。结果显示,各样品的日内、日间RSD均不高于12.9%,RE为-6.3%~3.5%,符合生物样品定量分析的要求[5]。
2.4.4 提取回收率与基质效应考察 取“2.2.3”项下质控血浆样品溶液(伊马替尼120、750、4 000 ng/mL,代谢物60.0、375、2 000 ng/mL),每浓度各6份,按“2.3”项下方法预处理,再按“2.1”项下色谱与质谱条件进样分析,记录峰面积(A1)。取空白血浆适量,共6份,按“2.3”项下方法预处理后,分别加入伊马替尼对照品溶液和代谢物溶液使其质量浓度与上述质量浓度对应,再按“2.1”项下色谱与质谱条件进样分析,记录峰面积(A2)。同时按2020年版《中国药典》(四部)[5]要求,配制伊马替尼质量浓度分别120、4 000 ng/mL,代谢物质量浓度分别为60.0、2 000 ng/mL的低、高质量浓度基质效应样本溶液,每浓度各6份,按“2.3”项下方法预处理,再按“2.1”项下色谱与质谱条件进样分析,记录峰面积(A3)。按流动相比例制备与上述浓度对应的伊马替尼及其代谢物对照溶液,每浓度各6份,按“2.3”项下方法预处理,再按“2.1”项下色谱与质谱条件进样分析,记录峰面积(A4)。提取回收率=A1/A2×100%,基质因子=A3/A4×100%。结果显示,伊马替尼及其代谢物、内标的平均提取回收率分别 为 89.2%~102.0%(RSD≤12.8%)、88.8%~99.7%(RSD≤14.3%)、99.0%(RSD=8.8%),平均基质因子分别 为 98.2%~103.3%(RSD≤4.6%)、99.8%~101.1%(RSD≤6.1%)、107.0%(RSD=11.7%),符合生物样品定量分析的要求[5]。
2.4.5 稳定性试验 按“2.2.3”项下方法配制伊马替尼质量浓度分别为120、4 000 ng/mL,代谢物质量浓度分别为60.0、2 000 ng/mL的质控血浆样品溶液,每浓度各12份,各取3份分别于室温放置20 h、4℃自动进样器放置20 h、冷冻(-70℃)长期保存、-70℃反复冻融3次后,按“2.3”项下方法预处理,再按“2.1”项下色谱与质谱条件进样分析,记录峰面积。以实测浓度与理论浓度进行比较,用RE考察稳定性。结果显示,伊马替尼及其代谢物浓度的RSD均不高于8.3%(n=3),RE为-7.4%~8.5%,表明待测成分在上述各种条件下稳定性良好。
2.4.6 残留考察 取“2.2.3”项下伊马替尼及其代谢物质量浓度分别为5 000、2 500 ng/mL的标准曲线血浆样品溶液,按“2.3”项下方法预处理,配制定量上限血浆样本溶液;另取空白血浆50 μL,按“2.3”项下方法预处理,配制空白血浆样本;再按“2.1”项下色谱与质谱条件进样分析,考察残留效应,重复循环5次。结果显示,方法无残留,不影响后续样本的测定。
2.5 平衡透析实验
2.5.1 蛋白结合率检测样本的制备 取“2.2.1”项下伊马替尼对照品溶液及其代谢物溶液适量,用甲醇稀释,得伊马替尼质量浓度分别为120、4 000 ng/mL,代谢物质量浓度分别为60、2 000 ng/mL的蛋白结合率工作溶液。同时将ALB(200 g/L)用PBS稀释至45.0 g/L;将AGP(10.0 g/L)用PBS稀释至0.100 g/L;将GLB(50.0 g/L)用PBS稀释至25.0 g/L。取上述不同质量浓度的蛋白溶液50µL和不同质量浓度的蛋白结合率工作溶液2.5µL,置于1.5 mL塑料离心管中,混匀,制成3种不同蛋白结合率检测样本。
2.5.2 不同蛋白溶液结合率的测定 在一次性平衡透析板的红色和白色孔中分别加入蛋白结合率检测样本或待测血浆样本200µL、PBS 350µL,用密封带覆盖装置,以800 r/min室温涡旋2 h,分别从两孔中吸出样本,进行如下检测:取“2.5.1”项下蛋白结合率检测样本,按“2.3”项下方法处理,再按“2.1”项下色谱与质谱条件进样分析,计算样本浓度和蛋白结合率:蛋白结合率=(样本浓度-PBS浓度)/样本浓度×100%。测定3次,取平均值。使用SPSS 26.0软件,采用t检验进行统计学分析(下同)。结果显示,与低浓度伊马替尼(120 ng/mL)及其代谢物(60 ng/mL)比较,高浓度伊马替尼(4 000 ng/mL)及其代谢物(2 000 ng/mL)与AGP、GLB的血浆蛋白结合率显著提高(P<0.05),但与ALB的血浆蛋白结合率比较,差异无统计学意义(P>0.05)。结果见表1。

表1 伊马替尼及其代谢物与不同蛋白的结合率测定结果(n=3)
2.5.3 不同质量浓度伊马替尼及其代谢物与空白血浆蛋白结合率的测定 取“2.2.3”项下质控血浆样品溶液(伊马替尼低、中、高质量浓度分别为120、750、4 000 ng/mL,代谢物质量浓度分别为60、375、2 000 ng/mL),按“2.5.2”项下方法检测蛋白结合率并进行统计学分析。结果显示,中浓度伊马替尼及其代谢物的血浆蛋白结合率与低浓度比较,差异无统计学意义(P>0.05);高浓度伊马替尼及其代谢物的血浆蛋白结合率显著低于低、中浓度(P<0.01)。结果见表2。
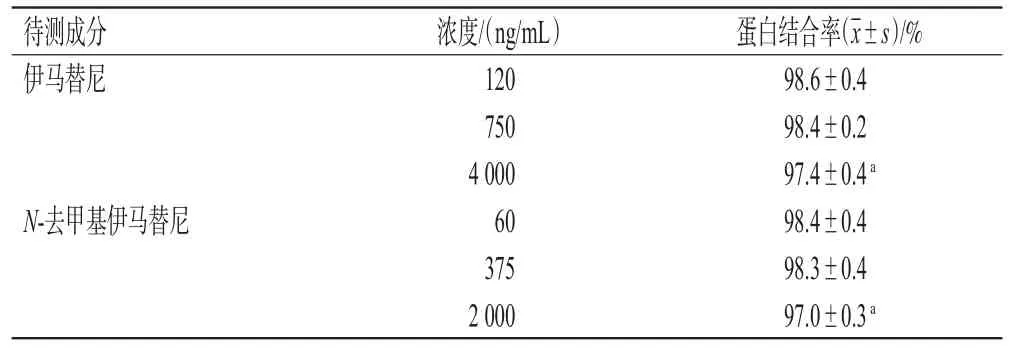
表2 不同质量浓度伊马替尼及其代谢物与空白血浆的蛋白结合率测定结果(n=3)
2.6 患者血浆中的蛋白结合率测定
2.6.1 纳入与排除标准 本研究的纳入标准为:(1)经病理组织学证实为GIST;(2)接受肿瘤完整切除术且病理证实切缘阴性;(3)之前未服用过伊马替尼;(4)GIST切除术后风险分级为中高度复发风险;(5)美国东部肿瘤协作组评分为0~2,重要脏器功能正常;(6)年龄为18~75岁;(7)所有患者均知情同意且签署了知情同意书。本研究的排除标准为:(1)活动性感染者;(2)妊娠期或哺乳期妇女;(3)严重脏器功能不全或丙氨酸转氨酶/天冬氨酸转氨酶超过正常值上限3倍者;(4)本研究开始前4周或参加本研究的同时又参加了其他临床研究者。
2.6.2 资料来源 本研究方案经南京医科大学第一附属医院医学伦理委员会审查批准,审查号为2013-SR-142。选择该院2014年12月-2017年9月收治的GIST患者64例,其中男性33例、女性31例,平均年龄(54.3±11.8)岁。所有患者均接受伊马替尼400 mg/d治疗至少4周。
2.6.3 患者血浆中蛋白结合率的测定 采集所有患者处于稳态时的谷浓度血浆样本,按“2.5.2”项下方法检测血浆蛋白结合率。结果显示,伊马替尼及其代谢物的平均血浆蛋白结合率分别为(99.0±0.3)%、(99.2±0.3)%。使用SPSS 26.0软件,经Pearson相关性分析,结果显示,伊马替尼及其代谢物的总浓度越大,其游离浓度越大(r分别为0.800 4、0.682 0,P均小于0.05),血浆蛋白结合率越低(r分别为-0.298 5、-3.332 3,P均小于0.05)。结果见图2。

图2 患者血浆中伊马替尼及其代谢物的总浓度和游离浓度
3 讨论
血浆蛋白结合率是药动学的重要参数,可以影响药物的作用时间和强度[9],已成为药学领域的研究热点之一。目前,测定体内药物游离浓度的方法主要有超滤法、超速离心法、平衡透析法[10],其中平衡透析法最常用,具有操作简便、分析成本低、药物在设备上非特异性吸附少等特点[11]。
本课题组前期考察了不同有机相(乙腈、甲醇)对色谱峰峰形和响应的影响,结果发现,两种试剂对色谱峰峰形和响应的影响相差无几,但乙腈的沉淀效果更佳,故选择乙腈为有机相。同时还考察了不同水相[10 mmol/L乙酸铵溶液、10 mmol/L乙酸铵(含0.1%乙酸)溶液]的响应情况,结果发现,虽然以10 mmol/L乙酸铵溶液为水相时,可保持水相的稳定性和保留时间的重现性,但加入0.1%乙酸后,可增强电离和质谱响应,提高检测灵敏度,故选择乙腈-10 mmol/L乙酸铵(含0.1%乙酸)溶液为流动相。本课题组前期还发现,当流速为0.5 mL/min时,待测成分可获得合适的保留时间;并且样品的制备为简单的蛋白质沉淀过程,这有效避免了复杂的萃取过程;此外,等度洗脱程序为分析提供了稳定的基线和恒定的电离效率,实现了生物样本的高通量分析。另有研究认为,同位素内标法能极大降低离子化效应,准确率更高[12],因此本研究选择伊马替尼-d8为内标。
本研究结果显示,伊马替尼及其代谢物与ALB的蛋白结合率较高,且高浓度伊马替尼及其代谢物与AGP、GLB的血浆蛋白结合率显著高于低浓度,但与ALB的蛋白结合率比较,差异无统计学意义。这提示伊马替尼及其代谢物与ALB的结合可能属于饱和结合,此时若再增加药物剂量,游离药物浓度会不成比例地增加,甚至造成患者中毒,因此在临床使用过程中应引起重视,尤其是患者在服用竞争同一蛋白位点的药物时,需严密监测体内血药浓度的变化。伊马替尼及其代谢物与患者血浆的蛋白结合率结果显示,伊马替尼及其代谢物的总浓度越大,其游离浓度越大,血浆蛋白结合率越低,这可能是由于伊马替尼及其代谢物与体内蛋白的结合接近饱和状态,随着药物浓度的增加,游离药物占给药量的比例增大。
综上所述,本研究成功建立了测定伊马替尼及其代谢物血浆蛋白结合率的方法;GIST患者伊马替尼及其代谢物的血浆蛋白结合率与药物浓度呈负相关。

