谷氨酰胺代谢与卵巢癌相关研究进展*
张自辉,洪 莉
(武汉大学人民医院妇产科,武汉 430060)
卵巢癌是妇科最常见的恶性肿瘤之一,据报道,2020年全球新增卵巢癌患者313959例,我国新发病例55342例,占17.62%,而全球卵巢癌患者死亡207252例,占女性肿瘤死亡人数的4.7%,其中我国死亡病例数为37519,占18.10%[1-2]。目前卵巢癌的标准治疗包括肿瘤细胞减灭术及铂类联合紫杉烷类药物化疗。一线治疗后多数患者会复发并产生铂耐药,最终导致预后不良。因此,研究卵巢癌的恶性进展及耐药相关机制,对于卵巢癌的治疗及改善预后具有重要意义。
氨基酸是哺乳动物合成蛋白质的最重要前体物质之一,人类八种氨基酸(Thr、Met、Phe、Trp、Val、Ile、Leu和Lys)不能自我合成,因此被认为是必需氨基酸。谷氨酰胺是许多蛋白质、核苷酸和其他生物大分子合成的重要前体,并生成烟酰胺腺嘌呤二核苷酸(NADPH)和谷胱甘肽(GSH)以维持氧化还原稳态。因此,谷氨酰胺在细胞存活和生长中具有关键作用。谷氨酰胺不是必需氨基酸,但是被认为是条件必需氨基酸,特别是在分解代谢应激条件下,如手术后、创伤或败血症等,肾脏、胃肠道和免疫系统等对谷氨酰胺的需求急剧增加。此外,谷氨酰胺与肿瘤恶性进展亦密切相关。由于肿瘤细胞快速增殖,谷氨酰胺作为肿瘤细胞能源的基本底物,以及合成核苷酸、脂质、蛋白质和GSH生物合成等重要前体,谷氨酰胺从头合成不能满足肿瘤细胞的需求,此时谷氨酰胺转变为条件性必需氨基酸,即“谷氨酰胺成瘾”。研究显示,肿瘤细胞通过谷氨酰胺转运蛋白摄取利用谷氨酰胺,满足肿瘤细胞能量和生物合成需求,从而促进肿瘤的恶性进展[3]。近年研究表明,谷氨酰胺代谢广泛参与卵巢癌的增殖[4]、侵袭转移[5]、耐药[6]及免疫逃逸[7]等环节,是卵巢癌的潜在治疗靶标。因此,本文将谷氨酰胺代谢参与卵巢癌的最新研究做一综述。
1 肿瘤谷氨酰胺代谢
代谢重编程是肿瘤的重要特征之一。既往研究认为,肿瘤细胞即使在氧充足的情况下进行糖酵解获取能量,并且产生大量的乳酸,即“Warburg效应”,被认为是肿瘤能量代谢的主要方式。但是脂肪酸和氨基酸,尤其是谷氨酰胺、丝氨酸和甘氨酸等代谢失调,也与肿瘤能量代谢密切相关[8]。2021年4月,美国范德堡大学医学中心Reinfeld等在《Nature》上发表最新研究,利用两种不同的PET示踪剂,一种用于追踪葡萄糖,另一种用于追踪谷氨酰胺,在结直肠癌、肾癌、乳腺癌等6种不同肿瘤模型中进行了验证,结果表明,髓系免疫细胞(主要是巨噬细胞)都吸收葡萄糖最多,其次是T细胞和癌细胞,相反,癌细胞吸收谷氨酰胺最多[9]。研究揭示肿瘤微环境中的不同细胞倾向于吸收不同的营养,这有助于进一步开发特异性靶向肿瘤代谢疗法。
研究表明,谷氨酰胺通过谷氨酰胺转运蛋白(SLC1、SLC6、SLC7和SLC38等4个家族)转运入细胞内[10]。线粒体谷氨酰胺酶(GLS)是催化谷氨酰胺转化为谷氨酸的关键酶,谷氨酸可通过两种方式产生α-酮戊二酸:谷氨酸脱氢酶(GDH)或转氨酶(ALT/AST)反应。通过这些途径,谷氨酰胺以α-酮戊二酸进入三羧酸循环,参与柠檬酸的合成并生成乙酰辅酶A,促进脂质代谢,草酰乙酸可转化为天冬氨酸促进核苷酸的合成。α-酮戊二酸参与三羧酸循环产生ATP为细胞提供能量。此外,三羧酸循环中的苹果酸产生丙酮酸和NADPH。谷氨酸通过胱氨酸-谷氨酸逆向转运体(System Xc-)可介导细胞外胱氨酸与细胞内谷氨酸交换,从而促进细胞内GSH的合成和维持细胞内氧化还原平衡稳定,保护细胞免受氧化应激损伤。其中System Xc-由SLC3A2和SLC7A11组成的异二聚体,可促进细胞摄入胱氨酸并排出谷氨酸,GSH是一种含有巯基的小分子活性肽,主要由谷氨酸、半胱氨酸以及甘氨酸构成,GSH含有的巯基结构可被氧化脱氢,使GSH成为机体内重要的抗氧化剂以及自由基清除剂。谷氨酰胺代谢,见图1。靶向谷氨酰胺转运及代谢途径在抗肿瘤能量代谢治疗方面具有巨大潜力。谷氨酰胺转运蛋白是谷氨酰胺进入细胞进行代谢的最重要的环节,本文总结了目前发现的谷氨酰胺转运蛋白共15种,见表1[10-11]。

表1 谷氨酰胺转运蛋白基本特征
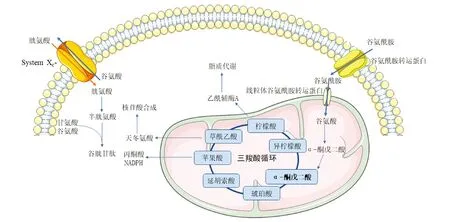
图1 谷氨酰胺代谢示意图
2 谷氨酰胺代谢与卵巢癌的临床病理相关性
谷氨酰胺代谢对于肿瘤的恶性进展至关重要。一项关于卵巢癌患者和正常人群的血清代谢组学研究发现,卵巢癌患者血清谷氨酰胺水平显著升高,ROC曲线AUC值为0.778[12]。另一项关于卵巢癌代谢组学的系统性评价发现,高水平谷氨酰胺与卵巢癌患者预后不良或复发相关[13],原因可能与癌细胞增殖和侵袭过程的代谢谱变化有关。此外,多项研究表明,谷氨酰胺代谢与卵巢癌的临床病理、预后不良以及化疗耐药等密切相关。Guo等[14]发现SLC1A5与p-mTOR在卵巢癌高表达,与FIGO分期、病理分级、CA125及Ki-67显著相关,SLC1A5和p-mTOR高表达是预测卵巢癌患者预后不良的重要因素,卵巢癌中SLC1A5和p-mTOR表达水平呈正相关(r=0.385,P<0.001)。提示SLC1A5可能通过mTOR通路促进卵巢癌的进展。另一项研究亦表明,SLC1A5阳性是卵巢癌复发的独立预测因素[15]。SLC7A5高表达与卵巢癌患者较差的预后和化疗耐药性显著相关[16]。此外,谷氨酸-氨连接酶(GLUL)在卵巢癌高表达,且与较差的无病生存期(disease-free survival,DFS)和总生存期(overall survival,OS)密切相关[17]。另一项多组学研究分析显示,GLS2过表达与结肠癌、血液系统肿瘤、卵巢癌和胸腺癌的总体存活率较差密切相关[18]。目前还没有SLC38A1和SLC1A6等与卵巢癌的相关研究。但SLC38A1在多种肿瘤高表达,且与预后不良有关[19-20]。因此,研究谷氨酰胺代谢在卵巢癌中的作用机制,靶向谷氨酰胺代谢治疗有望提高卵巢癌患者的预后,具有重要的积极意义。
3 谷氨酰胺代谢与卵巢癌恶性进展的作用机制
3.1 谷氨酰胺代谢与卵巢癌的增殖、侵袭和转移 谷氨酰胺代谢与卵巢癌的侵袭和转移密切相关。Yang等[21]利用同位素示踪剂和生物能量分析技术发现低侵袭性卵巢癌细胞(OVCAR3、IGROV1和OVCA429)不依赖谷氨酰胺,而高侵袭性卵巢癌细胞(SKOV3、SKOV3ip和Hey8)增殖和侵袭明显依赖谷氨酰胺,其机制可能与谷氨酰胺激活STAT3通路有关。此外,Prasad等[5]研究显示,谷氨酰胺可能通过上调转录因子ETS1促进MMP2、MMP9、波形蛋白(VIMENTIN)和VEGF表达,从而参与卵巢癌的侵袭和转移。另有研究显示,敲低GLUL显著抑制卵巢癌OVCAR-3和ES-2细胞的增殖,其机制可能与抑制p38 MAPK信号通路有关[17]。而miR-450a过表达抑制卵巢癌A2780和SKOV-3细胞迁移和侵袭,促进癌细胞凋亡,其机制亦与抑制谷氨酰胺代谢密切相关[22]。因此,谷氨酰胺代谢密切参与卵巢癌的恶性增殖、侵袭及转移,是卵巢癌恶性进展的重要机制之一。
3.2 谷氨酰胺与卵巢癌的耐药 细胞代谢的改变不仅促进肿瘤的恶性进展,而且还参与肿瘤的化疗耐药。耐药细胞中某些代谢基因或相关通路的表达失调,导致谷氨酰胺分解、糖酵解和脂肪酸氧化等途径的激活,耐药细胞对葡萄糖和谷氨酰胺的摄取利用增加,从而生成抗氧化剂以及线粒体的代谢重编程是肿瘤耐药的重要机制之一。研究表明,卵巢癌A2780/DDP细胞中谷氨酰胺、谷氨酸和GSH显着高于A2780细胞,谷氨酰胺饥饿则抑制A2780/DDP细胞中的GSH水平和CDDP抗性[6]。有研究显示,与敏感细胞系相比,顺铂耐药细胞系中谷氨酰胺转运蛋白ASCT2和谷氨酰胺酶(GLS)表达增加,而抑制ASCT2和GLS表达则可逆转顺铂耐药[23]。此外,System Xc-系统在A2780/DDP高表达,胱氨酸摄取率及GSH均高于A2780细胞[24]。这些研究表明高谷氨酰胺代谢对于卵巢癌化疗抗性具有重要作用。相反,使用谷氨酰胺酶抑制剂双-2-(5-苯基乙酰氨基-1,3,4-噻二唑-2-基)乙基硫醚(BPTES)靶向谷氨酰胺酶(GLS)通过抑制卵巢癌细胞谷氨酰胺代谢使紫杉醇和顺铂耐药癌细胞系对化疗重新敏感[25]。另有研究显示,谷氨酰胺酶1(GLS1)抑制剂化合物968通过诱导人卵巢癌HEY、SKOV3和IGROV-1细胞系G1期细胞周期停滞、细胞凋亡和细胞应激来抑制卵巢癌细胞的生长,同时增强紫杉醇化疗敏感性[26]。因此,靶向化疗耐药代谢重编程和代谢调控对于增强卵巢癌化疗敏感性、逆转化疗耐药具有重要意义。
3.3 谷氨酰胺与卵巢癌的免疫逃逸 肿瘤细胞代谢重编程导致的低氧、酸性、营养耗尽的肿瘤微环境(TME)是产出肿瘤免疫逃逸的一个重要因素。Ma等[27]研究表明,肿瘤细胞摄取谷氨酰胺通过促进肾癌ERK1和2(ERK1/2)磷酸化和c-Jun激活EGFR信号传导诱导PD-L1表达,从而促进肿瘤免疫逃逸。另一项研究表明,肾透明细胞癌(ccRCC)消耗谷氨酰胺导致细胞外谷氨酰胺的局部剥夺,从而通过激活缺氧诱导因子1α(hypoxia inducible factor 1α,HIF1α),并诱导肿瘤浸润巨噬细胞分泌IL-23,IL-23激活调节性T细胞增殖并促进IL-10和转化生长因子β表达,从而抑制细胞毒性淋巴细胞对肿瘤细胞的杀伤[28]。肿瘤代谢治疗策略面临的主要问题是如何特异性靶向肿瘤代谢而不影响正常细胞代谢和抑制TME中抗肿瘤免疫效应细胞的功能。2021年4月,美国范德堡大学医学中心Reinfeld等研究可能解答了这一难题[9]。另一项研究亦证实,阻断癌细胞谷氨酰胺代谢后,活化的CD8+T细胞通过上调乙酸盐代谢,从而产生高水平的乙酰辅酶A(作为双碳源),间接(作为通过增加丙酮酸羧化酶活性来激活葡萄糖回补)利用乙酸盐为OXPHOS提供能量并产生ATP,维持NADP(H)稳态[26]。因此,靶向肿瘤谷氨酰胺代谢并不会抑制抗肿瘤免疫功能。在卵巢癌相关研究中,卵巢癌谷氨酰胺代谢通过调节CD11b+Gr1+骨髓细胞的免疫抑制功能从而介导免疫逃逸[7]。GLS抑制剂968和PD-L1阻断剂的联合治疗可增强对卵巢癌的免疫反应,其机制可能与968增强CD4+和CD8+T细胞的颗粒酶B表达,从而与抗PD-L1抗体协同激活T细胞杀伤肿瘤细胞[29]。此外,BPTES衍生物CB-839促进CD4+T辅助1(Th1)细胞和CD8+细胞毒性T淋巴细胞(CTL),从而促进免疫细胞杀伤肿瘤细胞[30]。以上研究均表明,靶向谷氨酰胺代谢并不会影响TME中抗肿瘤免疫效应细胞的功能,同时联合免疫检查点阻断可显著增强免疫细胞杀伤肿瘤细胞,因此抗谷氨酰胺代谢是卵巢癌免疫治疗的一种重要辅助策略。
4 靶向谷氨酰胺代谢在抗卵巢癌方面具有重大价值和潜力
4.1 靶向谷氨酰胺转运 在肿瘤谷氨酰胺代谢重编程中,肿瘤细胞通过细胞膜谷氨酰胺转运蛋白摄取谷氨酰胺,因此,靶向谷氨酰胺转运是抗肿瘤代谢的一种途径。L-γ-谷氨酰对硝基苯胺(GPNA)是谷氨酰胺类似物。研究表明,GPNA可显著抑制多种肿瘤细胞系中谷氨酰胺转运蛋白,如SLC1A5、SLC7A5、SLC38A1、SLC38A2等,从而发挥抗肿瘤作用[31]。此外,V-9302是SLC1A5的特异性小分子抑制剂,亦可通过阻断SLC1A5、SLC38A1或SLC38A2等谷氨酰胺转运蛋白发挥抗肿瘤作用,包括头颈部鳞状细胞癌、肝癌、结直肠癌等[32]。此外,针对SLC1A5的mAb可通过阻断谷氨酰胺转运,抑制AKT和ERK磷酸化,从而对于KRAS突变的人结直肠癌细胞也具有抗肿瘤作用[33]。δ-生育三烯酚亦可通过抑制SLC1A5和SLC7A5表达,从而抑制非小细胞肺癌的生长并诱导癌细胞凋亡,其机制可能与抑制mTOR通路蛋白(p-mTOR和p-4EBP1)有关[34]。BCH是SLC7A5的竞争性抑制剂,可通过抑制mTOR通路p70S6K(T389)磷酸化显著抑制卵巢癌细胞系(SKOV3、IGROV1)集落形成能力,提示谷氨酰胺代谢可能对于卵巢癌的锚定非依赖性生长至关重要[35]。谷氨酰胺转运蛋白在卵巢癌的临床病理及预后具有重要意义,但目前靶向卵巢癌谷氨酰胺转运蛋白研究有限。
4.2 靶向谷氨酰胺代谢 研究表明,谷氨酰胺酶抑制剂CB-839可通过阻断谷氨酰胺代谢增强卵巢癌细胞对PI3K/mTOR通路抑制剂PP242的敏感性,发挥协同作用促进癌细胞凋亡,其机制可能与抑制STAT3磷酸化相关[36]。CB-839与PARP抑制剂联合对于耐药型卵巢癌具有更显著抗肿瘤作用,可显著延长荷瘤鼠生存期,这与阻断谷氨酰胺代谢、抑制GSH合成,扰乱癌细胞氧化还原稳态和核苷酸合成有关[37]。此外,谷氨酰胺酶1抑制剂化合物968亦可抑制卵巢癌细胞增殖,并增强紫杉醇化疗敏感性[26],同时与PD-L1阻断剂联用可增强免疫杀伤肿瘤细胞[29]。另外,谷氨酸脱氢酶1(GDH1)抑制剂R-162通过抑制谷氨酰胺分解,增加线粒体ROS水平等机制具有抗肺癌及乳腺癌的作用[38]。System Xc-系统抑制剂柳氮磺胺吡啶(SASP)可抑制卵巢癌细胞中Xc-系统活性,抑制GSH生成,增加ROS水平,从而抑制卵巢癌细胞生长,促进其凋亡[39]。此外,氨基氧乙酸(AOA)和表没食子儿茶素没食子酸酯(EGCG)抗神经母细胞瘤的机制与抑制GDH活性,阻断谷氨酰胺代谢有关[40]。但AOA和EGCG是否通过阻断谷氨酰胺代谢发挥抗卵巢癌的作用仍有待进一步研究。因此,通过靶向谷氨酰胺代谢或联合其他抗肿瘤疗法,是抗卵巢癌代谢治疗的一种潜在新策略。见图2。
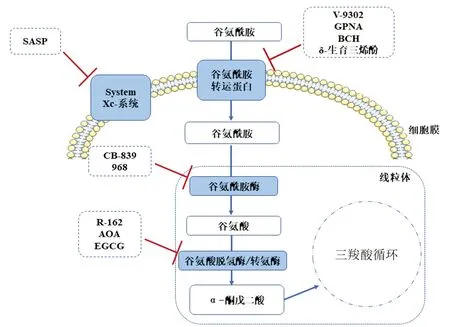
图2 靶向谷氨酰胺代谢途径示意图
5 小结与展望
综上所述,谷氨酰胺代谢广泛参与卵巢癌的增殖、侵袭和转移,并且与肿瘤免疫逃逸以及化疗耐药密切相关。谷氨酰胺代谢对于卵巢癌的恶性进展及预后不良具有重要意义,靶向谷氨酰胺代谢是抗卵巢癌的一种潜在新策略。从机制上来说,靶向谷氨酰胺代谢的相关基因或通路,可阻断卵巢癌细胞的能量代谢和抑制氧化还原稳态,并增强化疗敏感性及逆转化疗耐药,同时与免疫检查点阻断联用能更好地发挥免疫杀伤肿瘤细胞作用,从而达到更好的抗肿瘤效应。

