GDF15中和抗体研制及抗肝癌研究
周月媛,冯东林,叶俊秋,吴孟晗,彭陈瑾,王昭维,李 萌,张英起,何 磊
(空军军医大学药学系生物制药学教研室,陕西 西安 710032)
近年来,以免疫检查点抑制为主的肿瘤免疫治疗在基础研究和临床试验中不断取得突破性成果[1-2]。肿瘤免疫治疗已成为继手术、放疗、化疗之后的第四种肿瘤治疗手段,但存在药物应答率低、自身免疫反应毒性大、易产生耐药性等问题[3-4]。目前,寻找新的免疫治疗靶点是提高患者反应率的重要途径。生长分化因子15(growth differentiation factor 15,GDF15)是转化生长因子β超家族的成员之一,在正常生理调节下表达水平低,但在炎症性疾病、恶性肿瘤和妊娠等特殊状态时显著上调[5-7]。其主要功能是参与能量稳态、体质量调节等生物学过程[8-11],而在抗肿瘤免疫反应中的研究较少[12-14]。
本课题组近年聚焦于GDF15的抗肿瘤免疫作用和分子机制研究,发现其对多种免疫细胞的抑制性表型具有促进作用。若抑制GDF15的活性,可能会缓解肿瘤的发生发展。本研究通过生产制备GDF15单克隆抗体并分析其抑制肿瘤生长的功效,为以GDF15为靶点的人源化单克隆抗体研发奠定理论基础。
1 材料与方法
1.1 材料
1.1.1 细胞株 骨髓瘤细胞系SP20、人T淋巴母细胞系Jurkat均购于中国科学院细胞库(上海),并由本科室长期保存使用。人原代CD4+T细胞分离自健康人外周血单个核细胞,健康人血液来源于空军军医大学西京医院输血科,鼠CD4+T细胞由小鼠脾脏分离获得。
1.1.2 实验动物 BALB/c小鼠和C57BL/6小鼠由空军军医大学实验动物中心提供,饲养于科室专业动物房。本研究已通过空军军医大学实验动物伦理委员会批准(许可证号:IACUC-20200152)。
1.2 方法
1.2.1 杂交瘤细胞的制备 采用的抗原GDF15为商品化可溶性蛋白(9279-GD),将其与弗氏佐剂按1∶1混合,多点注射免疫BALB/c小鼠3次,每次间隔3周,最后1次注射3 d后,采用吸入CO2方式处死小鼠,取出脾脏,分离得到B淋巴细胞。提前培养SP20细胞,与B淋巴细胞混合,离心后加入500 mL/L PEG (Mr4 000),搅拌30 s,加入培养基离心后用RPMI 1640重悬培养于37 ℃细胞培养箱。采用ELISA检测杂交瘤培养体系上清液,用PBS作为对照,筛选出阳性杂交瘤细胞。通过在96孔板中的有限稀释法,筛选得到单克隆杂交瘤细胞。
1.2.2 单克隆抗体的制备和纯化 给BALB/c小鼠腹腔注射0.5 mL降植烷使小鼠腹腔巨噬细胞活化产生IL-6等细胞因子,1周后腹腔注射5×105个杂交瘤细胞,7~10 d处死小鼠,抽取腹水。采用硫酸铵盐析法(700 g/L硫酸铵)对抗体进行粗提纯,之后用亲和层析法对抗体进行细纯化,将样品上样至Protein A+G填装柱内,过柱后用10倍填装柱量的TBS过柱,以去除非特异性结合的蛋白。洗涤完毕后,用10 mL甘氨酸(50 mmol/L,pH 2.7)洗脱结合在柱子上的抗体,收集抗体。
1.2.3 ELISA筛选抗体 ELISA被用于可溶性抗原的单克隆抗体检测。实验步骤如下:①GDF15稀释至1~10 mg/L,ELISA板子每孔加入100 μL稀释好的GDF15,4 ℃过夜;②将杂交瘤上清加入包被有抗原的孔中,每孔100 μL,置37 ℃孵育1 h;③加入稀释好的酶标抗体100 μL,37 ℃孵育1 h;④每1 mL底物缓冲液加入0.4 mg邻苯二胺,置于室温或37 ℃ 15~20 min,用酶标仪检测各样品的A490 nm值。
1.2.4 实时定量PCR GDF15联合T细胞抗原受体(T cell receptor,TCR,plate-bound anti-CD3/CD28+IL-2)作为实验组,同时上述体系中分别加入浓度为1 mg/L的5株抗体(G15A01~G15A05),刺激人白血病T淋巴细胞JURKAT 5 d;对照组采用单纯TCR刺激细胞5 d。用Trizol法提取细胞总RNA,使用PCR仪对所提取的RNA进行反转录,获得cDNA。根据PrimerBank数据库,设计好目的条带上下游引物,交由北京擎科公司西安分部合成,引物序列为:β-actin-F(5′-GTCTGC CTTGGTAGTGGATAATG-3′),β-actin-R(5′-TCGAGGAC GCCCTATCATGG-3′);CTLA-4-F(5′-TTTTGTAGCCCTG CTCACTCT-3′),CTLA-4-R(5′-CTGAAGGTTGGGTCAC CTGTA-3′)。目的基因相对表达量的计算采用2-ΔΔCt法,即ΔCt=Ct目的基因-Ct同一样本的管家基因,ΔΔCt=ΔCt实验组-ΔCt对照组,通过管家基因即β-actin的Ct平均值作为校正基数来检测和计算实验结果。
1.2.5 构建小鼠原发诱导肝癌模型AKT和N-Ras基因的过表达及其相互作用能够诱导小鼠原发肝癌的发生发展,可通过给小鼠尾静脉高压注射myr-AKT1、N-RasV12质粒和sleeping beauty转座子构建小鼠原发诱导肝癌模型[15]。从Addgene(美国)购得含有目的基因的质粒,分别进行转化并摇菌提取得到足够量的质粒。准备6~8周龄雄性C57BL/6小鼠,将上一步得到的质粒溶液按myr-AKT1、N-RasV12质粒和sleeping beauty转座子,以每只小鼠分别注射10、10、0.4 μg的量,配置成2 mL质粒混合物的生理盐水溶液;使用胰岛素针头从小鼠尾部的下1/3处进行尾静脉注射,将2 mL质粒混合液在5~7 s内注入小鼠体内,棉球止血20 s,将小鼠继续饲养4周。
1.2.6 小鼠原发肝癌的治疗及模型评价 实验分为4组,包括同型对照组(isotype control, Iso;125 μg IgG)、PD-1单克隆抗体治疗组(125 μg IgG+125 μg PD-1-mAb)、G15A治疗组(125 μg IgG+125 μg G15A)以及联合用药组(125 μg PD-1-mAb+125 μg G15A)。每5 d腹腔注射给药,治疗4周后处死小鼠,肝脏灌流后取小鼠肝脏;将小鼠肝脏按照肿瘤结节数量从多到少排列进行拍照,观察肝脏成瘤情况,统计各组诱发结节的数量,并测量最大结节直径。用电子天平称量肿瘤体质量,并通过流式细胞术(flow cytometry,FCM)进行肿瘤微环境(tumor microenvironment,TME)中免疫细胞分析。

2 结果
2.1 五株杂交瘤细胞的制备和腹水效价
通过有限稀释法,最终得到能够产生GDF15单克隆抗体的5株杂交瘤细胞。杂交瘤建系标准如下:连续4次克隆化阳性率为100%;体外连续传代3个月仍具有稳定的抗体分泌能力。ELISA检测显示,PBS作为对照,5株杂交瘤细胞培养上清中均含有GDF15的特异性单克隆抗体(图1)。将抗体分别命名为G15A01、G15A02、G15A03、G15A04和G15A05。
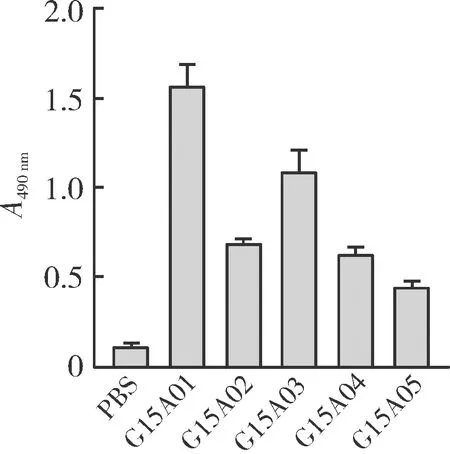
图1 五株杂交瘤细胞培养上清的ELISA检测
将5株阳性杂交瘤细胞注射BALB/c小鼠体内产生腹水后,吸取腹水并用70目筛网简单过滤去除杂质,吸取100 μL进行梯度稀释,用提前过夜包被GDF15的96孔板对5种腹水进行ELISA效价测定,实验结果显示本部分实验产生的5种腹水与抗原特性结合程度较好,腹水效价最高可达10-7。本部分实验生产的高效价腹水为接下来的纯化及筛选中和性抗体奠定了基础。
2.2 GDF15单克隆抗体的亲和层析纯化
对5种小鼠腹水进行硫酸铵盐析法粗纯化后,使用AKTA(FPLC)层析纯化系统对粗纯化后的腹水进行抗体细纯化。上机前用0.45 μm滤膜进行过滤以防止样品堵塞层析柱和管道,层析柱使用Protein A+G琼脂糖珠,上样流速为0.3 mL/min,洗脱流速 0.5 mL/min。通过亲和层析的纯化获得单一的洗脱峰(图2A),将原液和洗脱峰收集的蛋白进行SDS-PAGE,结果显示通过亲和层析的方法我们获得了纯度较高的单克隆抗体(图2B)。其他4株抗体与G15A01纯化结果相似,都得到了纯度较高的单克隆抗体,在此不做重复展示。
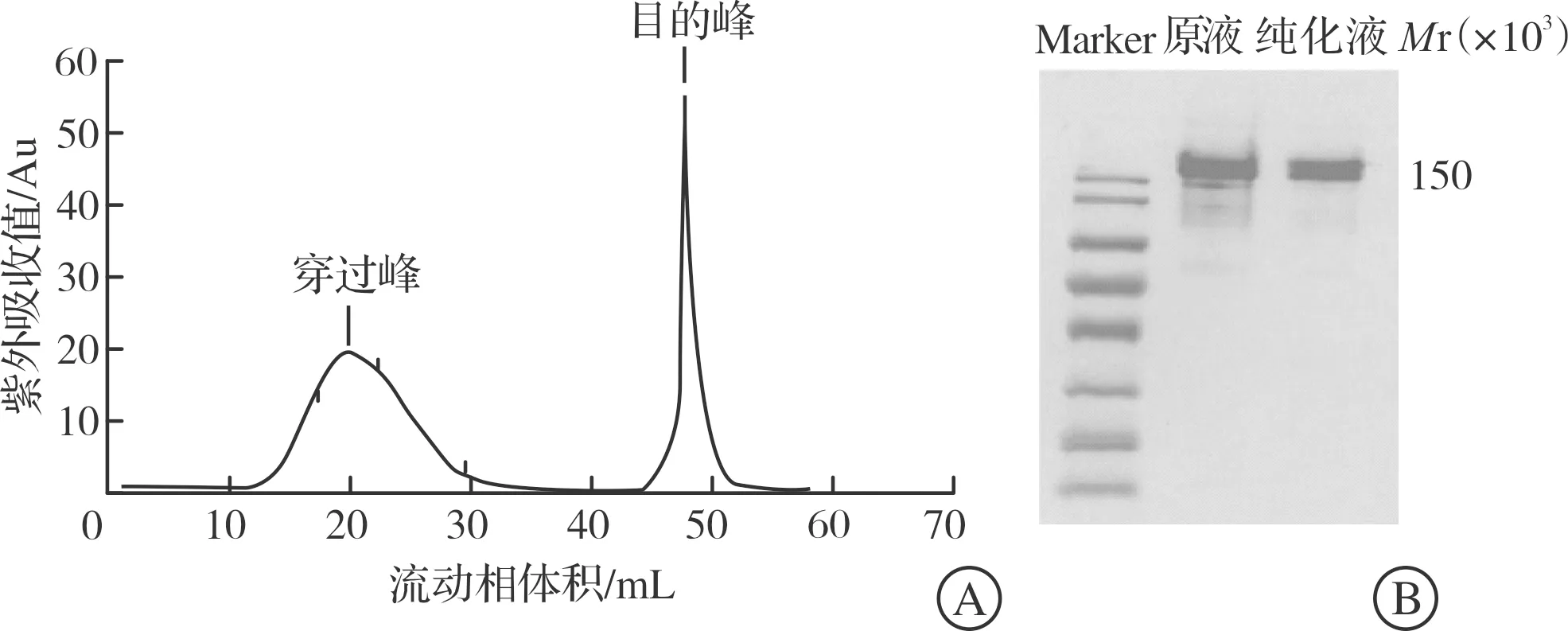
A:G15A01抗体亲和层析纯化图,第一道峰为上样未结合的样品(穿过峰),第二道峰为用pH 2.7的glycine洗脱液洗脱下结合在层析柱上的样品(目的峰);B:聚丙烯酰胺凝胶电泳图。 图2 GDF15单克隆抗体的纯化
2.3 GDF15五株单克隆抗体的效价
亲和层析纯化后,5株抗体经HPLC检测纯度均在95%以上,ELISA检测显示效价均大于10-4。抗体分型检测结果显示5株抗体中有2株IgM、3株IgG(表1)。
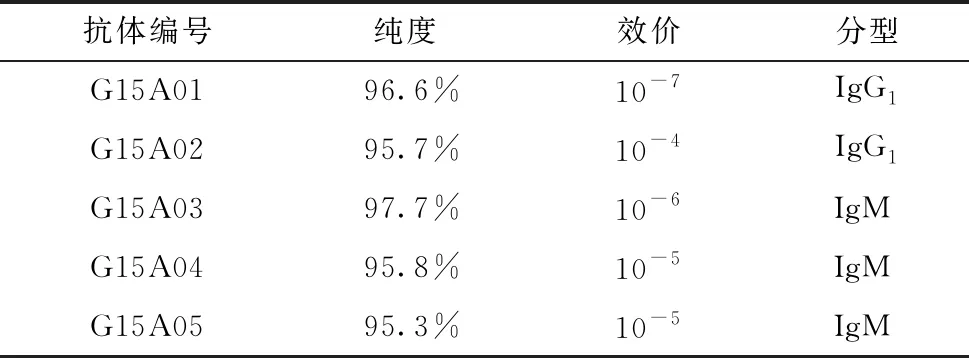
表1 GDF15五株单克隆抗体的纯度、效价和分型
2.4 GDF15中和性单克隆抗体筛选
前期,我们通过实验证明GDF15联合TCR的刺激可以诱导调节性T(regulatory T,Treg)细胞生成,Treg细胞生成的显著标志之一是CTLA-4的表达上调。因此,可以利用该体系从制备的5株单克隆抗体中筛选具有中和活性的GDF15单克隆抗体。qRT-PCR结果显示GDF15联合TCR(plate-bound anti-CD3/CD28+IL-2)刺激5 d,可显著上调naïve CD4+T细胞中CTLA-4的表达水平(P<0.01,图3A)。筛选得到的5株抗体(G15A01~G15A05)以1 mg/L浓度加入上述体系后,G15A01和G15A03单克隆抗体能够显著抑制人GDF15引起的CTLA-4表达上调(P<0.01),其他3株抗体中和作用不明显(图3B)。
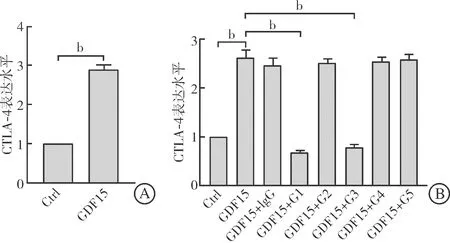
A:GDF15联合T细胞抗原受体能够显著上调Jurkat细胞CTLA-4的表达水平;B:G1和G3能够显著抑制人GDF15上调CTLA-4表达的生物学活性。Ctrl:单纯T细胞抗原受体刺激组;G1~G5:G15A01~G15A05。bP<0.01。图3 G15A01、G15A03显著抑制人GDF15引起的CTLA-4上调
2.5 G15A01、G15A03对小鼠GDF15同样具有中和作用
肿瘤免疫反应的动物实验需使用小鼠来源肿瘤细胞在同种系小鼠体内完成,为方便后续的动物实验,我们需要证明得到的抗体是否也能够中和小鼠GDF15的生物学功能。人GDF15和小鼠GDF15的同源性约为84.1%,幸运的是,G15A01和G15A03对于小鼠GDF15同样具有中和活性,具体实验结果如下:小鼠GDF15联合小鼠TCR刺激小鼠脾脏naïve CD4+T细胞也可以引发CTLA-4显著上调(P<0.01,图4A);G15A01~G15A05五株抗体以1 mg/L浓度加入上述体系后,G15A01和G15A03单克隆抗体能够显著抑制小鼠GDF15引起的CTLA-4表达上调(P<0.01),其他3株抗体中和作用不明显(图4B)。后续实验统一用G15A01完成,为简练起见,后文将G15A01统一称为G15A。
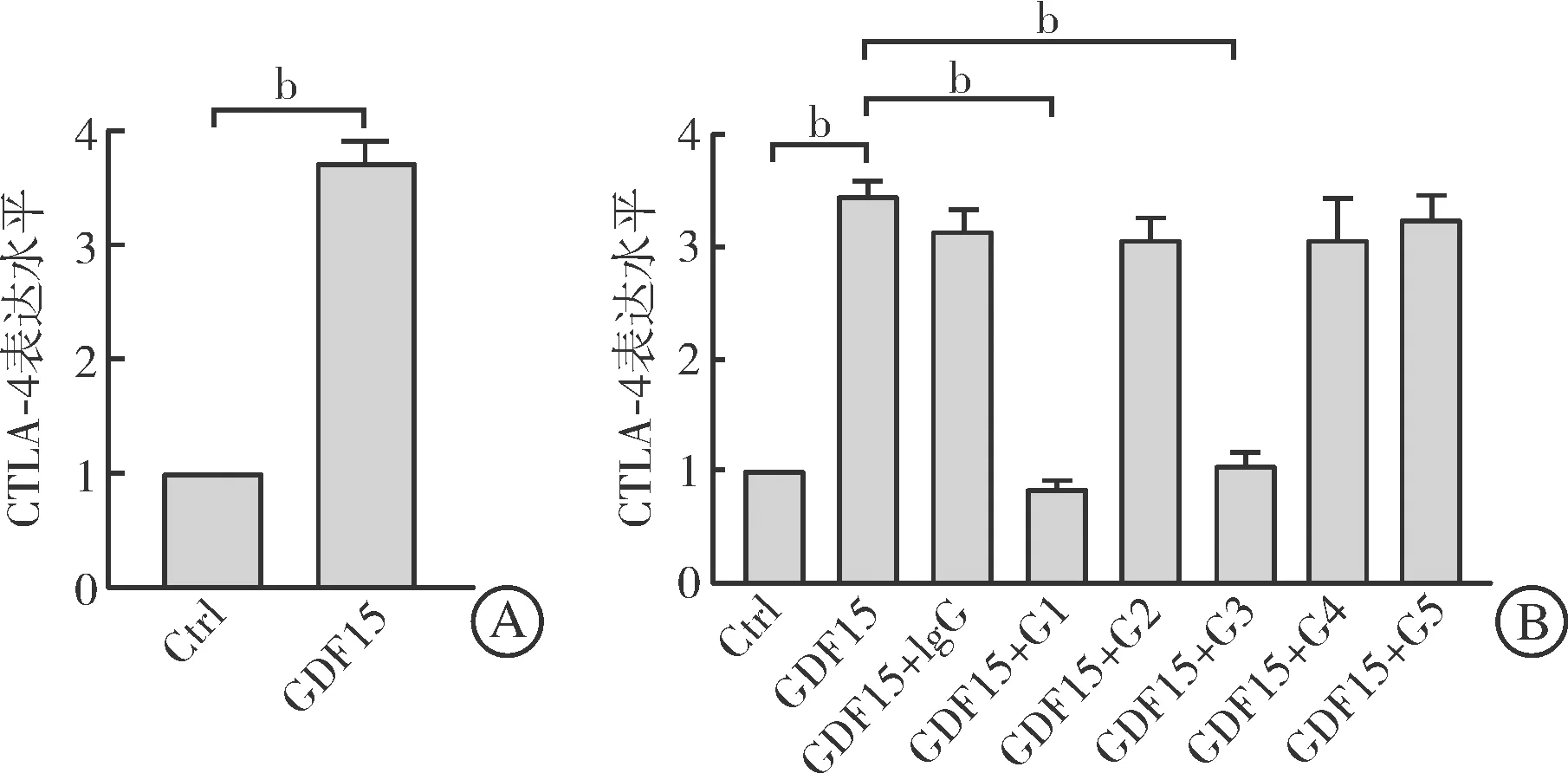
A:小鼠GDF15联合T细胞抗原受体能够显著上调小鼠naïve CD4+ T细胞CTLA- 4的表达水平;B:G1和G3能够显著抑制小鼠GDF15引起的CTLA- 4上调。Ctrl:单纯T细胞抗原受体刺激组;G1~G5: G15A01~G15A05。 bP<0.01。图4 G15A01、G15A03显著抑制小鼠GDF15引起的CTLA-4上调
2.6 G15A对小鼠体内原发诱导肝癌的治疗作用
构建小鼠原发诱导肝癌模型4 d后,每隔5 d给予G15A单克隆抗体治疗,一共给药4次。28 d时取肝脏拍照,并记录和统计肝脏结节数量以及最大结节直径。结果显示,G15A治疗明显抑制了原发肝癌的进展(图5A)。根据肝脏结节数量及肝脏最大结节直径的统计结果,G15A治疗组的肝脏结节数量和最大结节直径均显著低于等量IgG处理组(P<0.01,图5B~C)。我们对相同实验下不同批次小鼠模型进行了生存期统计,结果显示,与Iso对照组相比,G15A治疗显著延长了小鼠的生存期(P<0.01,图5D)。上述结果证实GDF15抗体显著抑制了肝癌的发展,具有明显抑制肿瘤生长的作用。
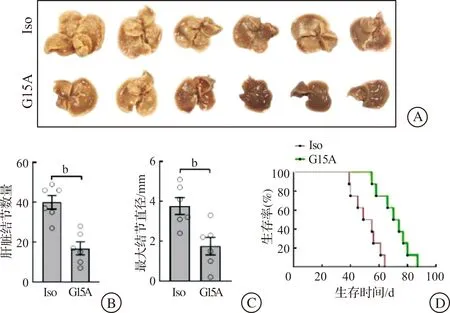
A:治疗原发肝癌28 d后小鼠肝脏照片(n=6);B:小鼠肝脏结节数量统计(n=6);C:小鼠肝脏最大结节直径统计(n=6);D:小鼠治疗后的生存期统计(n=8)。Iso:同型对照组,用125 μg IgG处理;G15A:单克隆抗体G15A治疗组,用125 μg G15A01处理。 bP<0.01。图5 G15A对小鼠原发诱导肝癌的治疗作用
FCM观察G15A治疗后小鼠肝癌TME。检测TME和脾脏中的Treg细胞,发现G15A治疗后,TME及脾脏中Treg细胞占CD4+T细胞比例均显著少于未治疗的Iso组(P<0.01,图6A)。G15A治疗后,在CD3+肿瘤浸润性淋巴细胞(tumor infiltrating lymphocyte,TIL)中,IFN-γ+T细胞显著增多(P<0.01,图6B),IL-10+T细胞显著减少(P<0.01,图6C)。对TME中CD4+和CD8+T淋巴细胞的增殖能力检测,结果显示G15A治疗后,肿瘤浸润的CD4+和CD8+T细胞Ki67的表达水平升高(P<0.01,图6D~E),提示G15A治疗增强了肿瘤中T淋巴细胞的增殖活性。上述结果提示,GDF15单克隆抗体能够通过激活抗肿瘤免疫反应,对小鼠原发诱导肝癌具有显著的治疗作用。

A:TME和脾脏中Treg细胞占CD4+ T细胞的比例;B:TME中IFN-γ+ T细胞占CD3+ TIL的比例;C:TME中IL-10+ T细胞占CD3+ TIL的比例;D:TME中CD4+ T细胞的Ki67表达水平;E:TME中CD8+ T细胞的Ki67表达水平。Iso:同型对照组,用125 μg IgG处理。n=6, aP<0.05, bP<0.01。图6 G15A治疗小鼠原发诱导肝癌TME中免疫状态的变化
2.7 G15A和PD-1单克隆抗体联合应用对小鼠原发诱导肝癌的治疗作用
构建小鼠原发诱导肝癌模型4 d后,开始给予G15A和PD-1单克隆抗体联合治疗,5 d给药1次,共给药4次。第28日取肝脏拍照,并记录和统计肝脏结节数量以及最大结节直径。结果显示,相比于Iso组、G15A和PD-1单克隆抗体单独治疗组,G15A和PD-1单克隆抗体联合治疗显示了一定的治疗效果(图7A)。PD-1单克隆抗体单独治疗效果最差,G15A治疗效果次之,二者联合应用的治疗效果最好。根据对肝脏结节数量以及最大结节直径的统计发现,虽然PD-1单克隆抗体单独治疗能够显著减少肝脏上诱发的结节数量(P<0.05),但不能减小诱发结节的大小。与G15A联用后,不仅使得诱发结节数量显著下降,诱发结节大小也显著减小,显示出更优于G15A单独治疗的疗效(P<0.05或P<0.01,图7B~C)。我们对相同实验下不同批次的4组小鼠进行了生存期统计,结果显示,G15A和PD-1单克隆抗体联合治疗显著延长了小鼠的生存期(P<0.05,图7D)。上述结果证实G15A和PD-1单克隆抗体的联合治疗显著抑制了小鼠原发肝癌的进展,并且治疗效果比G15A或PD-1单克隆抗体单独治疗效果更好。

A:第28日各处理组小鼠肝脏照片(n=5);B:各处理组小鼠肝脏结节数量统计(n=5);C:各处理组小鼠肝脏最大结节直径统计(n=5);D:各处理组小鼠生存期统计(n=8)。Iso:同型对照组,用125 μg IgG处理。 aP<0.05, bP<0.01。图7 G15A与PD-1单克隆抗体联合应用对小鼠原发诱导肝癌的治疗作用
通过FCM观察G15A和PD-1单克隆抗体联合治疗后小鼠肝癌TME的改变情况。检测TME中的Treg细胞发现,G15A和PD-1单克隆抗体联合治疗后,TME中的Treg细胞在CD4+T细胞中的比例显著低于Iso组和单独抗体治疗组(P<0.01,图8A)。与Iso组相比,PD-1单克隆抗体治疗组肿瘤Treg细胞比例无明显差异,联合用药组肿瘤Treg细胞比例比G15A单独治疗组更低(P<0.01,图8A)。对肿瘤浸润T淋巴细胞分析发现,与PD-1单克隆抗体治疗组相比,PD-1与G15A联合应用能够显著提高CD3+TIL中效应性IFN-γ+T细胞的数量(P<0.01,图8B),减少抑制性IL-10+T细胞的数量(P<0.01,图8C)。对TME中CD4+和CD8+T淋巴细胞的增殖能力检测,结果显示,经过G15A和PD-1单克隆抗体的联合治疗,肿瘤浸润的CD4+和CD8+T细胞Ki67的表达水平升高(P<0.01),表明细胞的增殖活性更强(图8D~E)。上述结果提示,G15A和PD-1单克隆抗体的联合应用对小鼠原发诱导肝癌呈现出更显著的治疗作用。
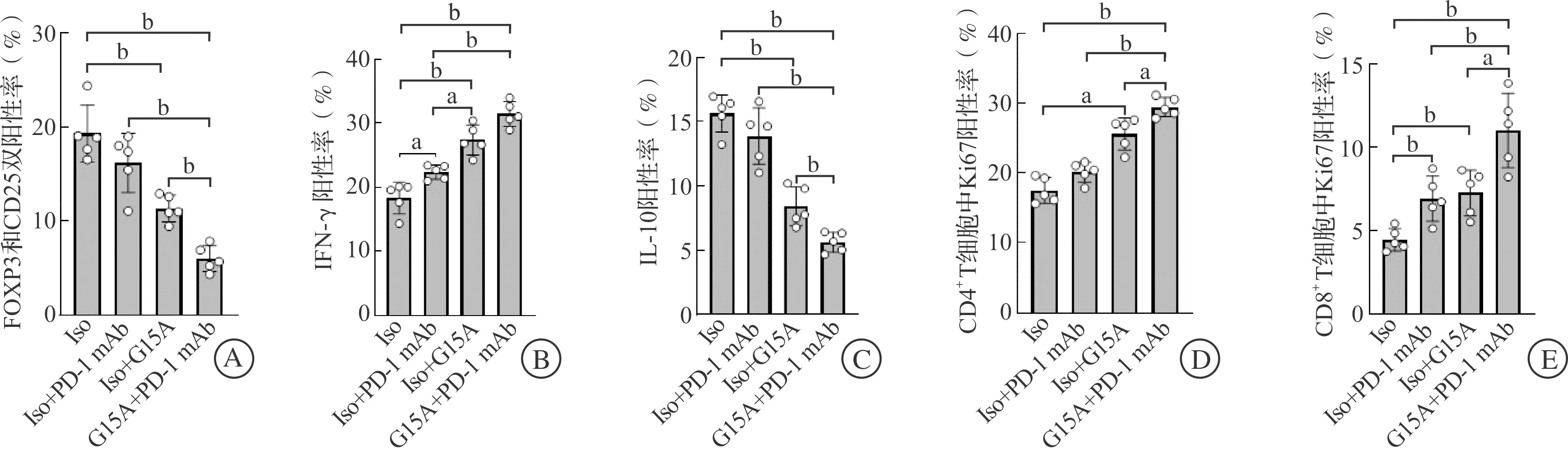
A:TME中Treg细胞占CD4+ T细胞的比例;B:TME中IFN-γ+ T细胞占CD3+ TIL的比例;C:TME中IL-10+ T细胞占CD3+ TIL的比例;D:TME中CD4+ T细胞的Ki67表达水平;E:TME中CD8+ T细胞的Ki67表达水平。Iso:同型对照组,用125 μg IgG处理。 aP<0.05, bP<0.01。图8 G15A与PD-1单克隆抗体联合应用改变小鼠原发诱导肝癌免疫微环境
3 讨论
治疗性单克隆抗体药物是针对单一抗原表位,具有药理学作用的抗体药物,其研发流程相对容易,药物毒性小、安全性高、特异性强,是目前肿瘤免疫治疗和生物制药的热点[16-17]。目前上市的单克隆抗体类药物如Nivolumab、Pembrolizumab等在临床上取得了良好的疗效[18-19]。并且有文献报道,一些新的免疫检查点如TIM-3、LAG-3单克隆抗体与PD-1单克隆抗体联合使用比PD-1单克隆抗体单独使用在效果上也会有明显的提升[20-21]。
本实验室前期许多工作证实肿瘤源性因子GDF15能够诱导多种抑制性免疫细胞产生或上调免疫细胞的抑制性表型,促进肿瘤抑制性免疫微环境的形成,从而促进肿瘤进展,是不良预后的重要因素。这些现象揭示了GDF15是一个肿瘤免疫治疗的新靶点,靶向GDF15的治疗能够促进抗肿瘤免疫反应。因为GDF15是一个分泌表达的可溶性细胞因子,因此开发其中和性单克隆抗体是最简单方便的GDF15干预方式。
靶向GDF15的免疫治疗除了可以同时抑制多种抑制性免疫细胞形成之外,还具有另外两个优点。第一,GDF15是肿瘤细胞分泌的抑制性因子,生理条件下GDF15表达水平很低,我们在Gdf15-/-小鼠中未观察到出生缺陷或成年后的生理缺陷,因此,靶向GDF15的治疗不会引发严重的副作用;第二,GDF15目前已知的生理功能是抑制食欲,控制体质量,在肿瘤患者中GDF15水平与肿瘤恶液质密切相关,所以靶向GDF15的治疗在提高抗肿瘤免疫的同时还能够抑制GDF15导致的恶液质。
本研究以肿瘤源性因子GDF15为抗原,用传统单克隆抗体生产路线生产GDF15单克隆抗体。通过课题组对GDF15十余年的研究,我们发现该分子对多种免疫细胞具有免疫抑制性,并且发现GDF15能够刺激肿瘤高表达CTLA-4,能够诱导naïve CD4+T细胞的FOXP3表达量上调,据此建立了稳定的单克隆抗体筛选体系。通过筛选体系筛选出2株能够中和抑制GDF15生物学活性的单克隆抗体,经亲和层析、SPR、抗体测序等技术对其理化性质进行分析,最终得到了纯度高、亲和力强并且对人源和鼠源GDF15均具有中和活性的单克隆抗体G15A。
我们通过G15A治疗小鼠的原发诱导肝癌,对其抑瘤效果进行了多角度验证,发现G15A治疗明显抑制了小鼠原发肝癌的进展,并显著延长了小鼠的生存期。对治疗后小鼠肝癌TME的免疫状态进行检测,我们发现与未治疗组相比,G15A治疗显著减少了肿瘤Treg细胞及IL-10抑制性T细胞的浸润,而增加了IFN-γ效应性T细胞的浸润,提高了肿瘤浸润的CD4+和CD8+T细胞的增殖能力,使肿瘤的免疫抑制状态被显著逆转。我们进一步研究了G15A与PD-1单克隆抗体联合治疗肿瘤的疗效。根据实验结果,G15A疗效比PD-1单克隆抗体疗效好,二者联用效果最好,联合用药还能使TME的免疫抑制状态得到进一步的解除。
综上所述,我们证实了GDF15作为肿瘤免疫治疗靶点的可能性,证实了G15A单克隆抗体作为肿瘤免疫治疗制剂的可能性。目前,本课题组正在进行以该抗体可变区为基础的抗体人源化工作和GDF15全人抗体的开发研究。GDF15单克隆抗体的成功开发将极大提升中国的肿瘤免疫治疗制剂的研究水平,为中国和全世界生物技术药物的发展做出贡献。

