厌氧条件下群体感应系统对铜绿假单胞菌表型的影响*
唐秀家,叶柳镅,张文淑,李金垄,王 可
(广西医科大学第一附属医院呼吸与危重症医学科,南宁 530021)
铜绿假单胞菌(P.a)是一种常见的条件致病菌,当人体组织屏障遭受破坏或免疫力低下时可引起感染等严重疾病[1]。其致病性主要归因于生物被膜形成以及细胞外毒力因子的产生,例如弹性蛋白酶、绿脓菌素、鼠李糖脂等[2],而这些均受群体感应系统(QS)所调控[3]。P.a的QS系统分为LasR-LasI、RhlR-RhlI、假单胞菌喹诺酮信号(PQS)[4]。LasRLasI 系统主要是促进毒力基因的表达[5],RhlR-RhlI系统主要是促进蛋白酶的合成以及绿脓菌素等毒素的分泌[6],而PQS 系统除了调节生物被膜形成及毒力因子的产生外,还可以通过铁螯合调控反硝化作用[7]。反硝化是指在缺氧条件下,P.a利用氮氧化物通过异源硝酸盐呼吸生长的过程[8]。因此,QS在P.a厌氧生长过程中发挥着重要作用。已有报道,P.a以厌氧生长的方式存活于肺囊性纤维化(CF)患者的肺部气道内[9]。而在CF患者肺中的黏液中,P.a根据氧浓度的不同而变换不同的生长形态以适应环境[10]。由此可见,氧环境的不同也会影响P.a的生长以及致病性。
脓胸是临床常见疾病。有研究报道,假单胞菌属是脓胸常见的致病菌之一[11]。而P.a在脓胸患者胸腔积液中的生长特征是否与CF 患者相似,目前尚无文献报道。因此,本研究主要探讨P.a在体外有氧和厌氧条件下的生长、生物被膜形成及毒力因子产生的变化,为以后开展脓胸胸膜腔内P.a的生长特征研究奠定基础;并利用两种QS 基因缺陷型菌株PAO1 lasIrhlI和PAO1 lasRrhlR研究QS系统对有氧、厌氧环境下P.a生长、生物被膜形成及毒力因子产生的调节作用。
1 材料与方法
1.1 菌株
PAO1 菌株、PAO1 lasIrhlI 和PAO1 lasRrhlR 基因缺陷型菌株,由新加坡南洋理工大学生命科学院惠赠。
1.2 主要试剂
LB琼脂粉、LB肉汤、胰蛋白大豆肉汤(TSB)均购自北京陆桥技术股份有限公司;蛋白胨购自北京鸿润宝顺科技有限公司;Tris试剂、PBS均购自北京索莱宝科技有限公司;偶氮酪蛋白、氯化钠、结晶紫均购自上海阿拉丁生化科技股份有限公司;地衣酚购自北京酷尔化学科技有限公司;浓硫酸购自成都市科隆化学品有限公司;弹性蛋白—刚果红购自上海北诺生物科技有限公司;绿脓菌素测定用培养基购自广东环凯微生物科技有限公司;无水葡萄糖购自天津市科密欧化学试剂有限公司。
1.3 P.a菌液浓度调整
将P.a复苏后,挑取单个菌落接种于培养基中,37 ℃摇床培养过夜。将菌悬液离心后去上清液,重悬3 次后使用紫外分光光度计测定600 nm 处的吸光度(OD)值为0.1,此菌液浓度约为108CFU/mL。
1.4 实验分组
实验设立PAO1 组、PAO1 lasIrhlI 组、PAO1 las-RrhlR组和对照组(无菌株)。分别在有氧和厌氧条件下比较P.a的生长、生物被膜形成和毒力因子产生能力。
1.5 生长曲线的测定
1.5.1 有氧条件下 取上述PAO1、PAO1 lasIrhlI、PAO1 lasRrhlR 菌株108CFU/mL 菌液以0.1 mol/L NaNO3的LB 肉汤培养液(LBN)作为溶剂稀释至106CFU/mL,接种于24孔板中,无菌同量LBN作为对照组,每隔2 h分别测定570 nm处的OD值(OD570)。
1.5.2 厌氧条件下 将3种菌株按照上述方法稀释至106CFU/mL,接种于24孔板中,以LBN作为对照组。将24 孔板放置于已放入厌氧反应包的厌氧反应袋中。每隔4 h测定OD570。
1.6 生物被膜形成实验
按“1.5 项”制备有氧和厌氧所需的P.a菌液,并接种到96孔板中。放入生化培养箱(厌氧组保证厌氧条件),培养24 h后,吸出菌液,用无菌PBS洗涤,自然干燥后加入0.1%结晶紫染液,室温下染色20 min,去除染色液,用PBS 洗涤后自然干燥,并加入33%冰乙酸溶液,测定OD570。
1.7 厌氧对毒力因子表达的影响
1.7.1 绿脓菌素试验(荧光法)按“1.3 项”方法调整菌液浓度至108CFU/mL。将菌液以含0.1 mol/L硝酸钠的PTSB 作为溶剂稀释至107CFU/mL,将3 种菌株接种到含0.1 mol/L 硝酸钠的PTSB 的锥形瓶中,将锥形瓶分别置于有氧和厌氧环境中,再置于振荡器上,37 ℃培养24 h。对照组设置如前所述。24 h后取出锥形瓶,混匀菌液,吸取部分菌液离心10 min,取过滤后上清液加入96 孔板中测定695 nm处的OD值(OD695)。
1.7.2 蛋白水解酶检测 取“1.7.1 项”制备的24 h菌悬液离心。取部分过滤后上清液加入含等量偶氮酪蛋白混合溶液(5 mg/mL偶氮酪蛋白,0.1 mol/L Tris-HCl缓冲液),37 ℃孵育1 h后,加入10%三氯乙酸终止反应,静置,离心,取上清液加入96 孔板中,再加入等量625 mmol/L NaOH,测定420 nm 处的OD值(OD420)。
1.7.3 弹性蛋白酶测定 取“1.7.1 项”制备的24 h菌悬液部分离心10 min。取部分过滤后上清液与适量弹性蛋白—刚果红缓冲液(5 mg/mL 弹性蛋白—刚果红,0.1 mol/L Tris-HCl,1 mmol/L CaCl2)混匀,37 ℃孵育16 h后,离心,吸取上清加入96孔板测定490 nm处的OD值(OD490)。
1.7.4 鼠李糖脂测定 取“1.7.1 项”所制备的24 h菌悬液,离心,取过滤后上清液加入等量乙酸乙酯萃取两次;取有机相并室温下自然干燥,加入去离子水溶解混匀;取溶解液、0.16%地衣酚和750 μL 60%浓硫酸混匀,水浴加热30 min,待冷却至室温后测定421 nm处的OD值(OD421)。
1.8 统计学方法
采用SPSS 23.0 统计软件处理数据。根据资料的正态性,如符合正态性采用方差分析,如不符合采用Kruskal-Wallis 秩和检验,以P<0.05为差异有统计学意义。
2 结果
2.1 QS 基因缺陷型菌株和PAO1 菌株在有氧及厌氧环境下的生长曲线
在有氧培养时,PAO1、PAO1 lasIrhlI 基因缺陷型和PAO1 lasRrhlR 基因缺陷型菌株24 h 生长总菌量相近,均在2~3 h 后开始进入对数期,在约12 h左右到达平台期。3种菌株无明显差异。在厌氧培养时,PAO1、PAO1 lasIrhlI 基因缺陷型和PAO1 lasRrhlR基因缺陷型菌株生长明显受限,生长减缓,约在3~4 h后进入对数增长期,12 h到达平台期,平台期菌量低于有氧条件,见图1。
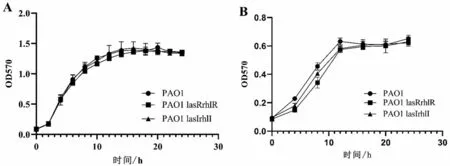
图1 3种P.a菌株在有氧、厌氧环境下的生长曲线
2.2 PAO1 和QS 基因缺陷型菌株在有氧及厌氧环境下的生物被膜形成能力
在有氧条件下,PAO1 菌株生物被膜形成量高于两种基因缺陷型菌株(P<0.05),两种基因缺陷型菌株生物被膜形成量比较,差异无统计学意义(P>0.05);在厌氧条件下,PAO1菌株生物被膜形成量低于有氧条件(P<0.05),PAO1 菌株生物被膜形成量与两种基因缺陷型菌株生物被膜形成量比较,差异无统计学意义(P>0.05);有氧、厌氧条件下,两种基因缺陷型菌株生物被膜形成比较,差异无统计学意义(P>0.05),见图2。
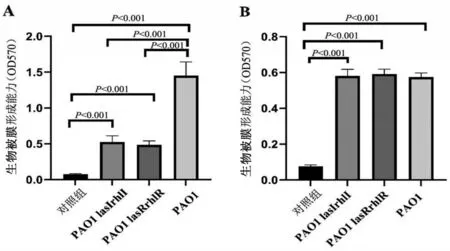
图2 3种P.a菌株在有氧和厌氧环境下的生物被膜形成
2.3 厌氧条件抑制P.a绿脓菌素的产生
在有氧条件下,两种基因缺陷型菌株仅产生少量绿脓菌素,PAO1 产生的绿脓菌素含量约为基因缺陷型菌株的4倍(P<0.05);在厌氧条件下,3种P.a菌株几乎没有产生绿脓菌素,与对照组比较差异无统计学意义(P>0.05),见图3。
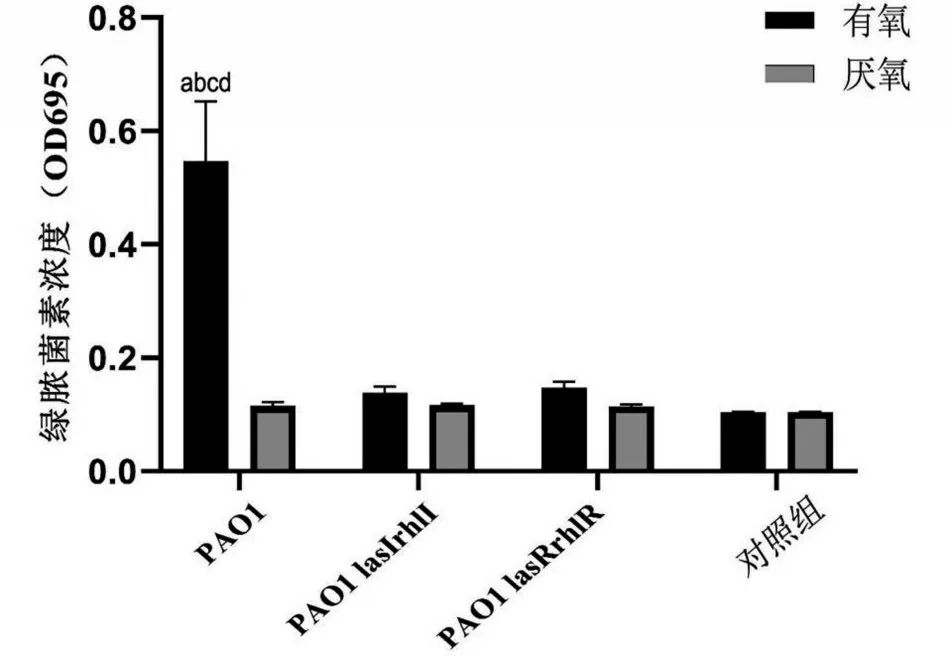
图3 3种P.a菌株在有氧和厌氧环境下的绿脓菌素形成
2.4 厌氧条件减少鼠李糖脂含量
在有氧、厌氧条件下,PAO1、PAO1 lasIrhlI 和PAO1 lasRrhlR基因缺陷型菌株均产生鼠李糖脂,鼠李糖脂含量均高于对照组(均P<0.05);在有氧、无氧条件下,PAO1 菌株产生的鼠李糖脂含量均高于两种基因缺陷型菌株(P<0.05);在厌氧条件下,PAO1 菌株鼠李糖脂含量低于有氧条件(P<0.05),见图4。

图4 3种P.a菌株在有氧和厌氧环境下的鼠李糖脂形成
2.5 厌氧抑制弹性蛋白酶活性
在有氧条件下,PAO1 弹性蛋白酶活性高于两种基因缺陷型菌株(P<0.05);厌氧条件下,PAO1弹性蛋白酶活性受到明显抑制,仅为有氧条件下的1/5左右(P<0.05);两种基因缺陷型菌株无论在有氧还是厌氧条件下弹性蛋白酶活性均较低,见图5。

图5 3种P.a菌株在有氧、厌氧环境下的弹性蛋白酶形成
2.6 厌氧条件下蛋白水解酶活性减弱
在有氧条件下,PAO1 蛋白水解酶活性高于两种基因缺陷型菌株蛋白水解酶活性(P<0.05);与有氧条件比较,厌氧条件下PAO1 蛋白水解酶活性降低(P<0.05);有氧、厌氧条件下,两种基因缺陷型菌株蛋白水解酶活性比较,差异无统计学意义(P>0.05),见图6。

图6 3种P.a菌株在有氧和厌氧环境下的蛋白水解酶形成
3 讨论
P.a是一种反硝化细菌,具有一套完整的反硝化酶[8],在厌氧条件下,可以利用N-氧化物作为末端电子受体进行厌氧生长。临床P.a感染中存在许多厌氧条件,比如慢性CF 患者的气道、痰液[9]及伤口损伤[12]等,而这些感染都是较难清除的。因此,阐明其在缺氧环境中的生长和致病性,不仅能更好地了解P.a的厌氧代谢及相应的生理特性,也有助于发现新的抗生素靶点及治疗方案。
P.a在有氧环境下可产生弹性蛋白酶、蛋白酶、鼠李糖脂、绿脓菌素等多种毒力因子,而这些毒力因子主要是由QS 控制的。研究表明,与有氧条件相比,厌氧条件下,P.a的QS 系统调节能力是减弱的,其致病力也明显下降[13-14]。为了解P.a在有氧或厌氧条件下表达毒力因子的能力,我们研究了QS双突变菌株和PAO1分别在有氧或厌氧条件下的弹性蛋白酶和蛋白酶活性以及产生绿脓菌素和鼠李糖脂能力的差异。与之前的报道[14]一致,当PAO1在厌氧条件下生长时,弹性蛋白酶活性明显受到抑制,仅为有氧条件下的20%左右,仅略高于双突变菌株在厌氧条件下的弹性蛋白酶活性。此外,与有氧条件相比,蛋白酶活性下降至20%,鼠李糖脂含量下降至1/3,绿脓菌素几乎不产生。PAO1 lasIrhlI和PAO1 lasRrhlR 基因缺陷型菌株中在有氧条件下仅检测到微弱的弹性蛋白酶和蛋白酶活性,鼠李糖脂和绿脓菌素仅有少量产生,而厌氧条件下几乎不表达毒力因子。本研究证实了无论在有氧还是厌氧环境下,QS对PAO1中的这些细胞外毒力因子均有重要的调节作用,但在厌氧环境中调节能力减弱。然而,即使PAO1、QS基因缺陷株产生毒力因子的能力极弱,但其依旧能引起临床感染[15]。
P.a的慢性感染与生物被膜形成有关。细胞与细胞之间的交流在生物被膜中的组织和分化中起着作用,而QS 系统在细菌细胞间通信中起着尤为重要的作用,这些作用因P.a的不同生活环境而表现不同[16]。本研究中,PAO1的生物被膜形成能力在厌氧条件下明显下降,仅为有氧条件下的40%左右。PAO1 lasIrhlI 和PAO1 lasRrhlR 双突变体在有氧和厌氧条件下生物被膜形成能力相近,似乎并没有受到厌氧环境的影响。在3 次重复实验中,均观察到在厌氧条件下PAO1 生物被膜形成量明显减少,且几乎与双突变菌株相同,与以往研究[17]结果相一致,但既往也有研究表明厌氧条件下PAO1 会形成更多生物被膜[18-21]。由于缺乏进一步的实验和数据,本研究无法准确解释这一现象。P.a厌氧生物被膜形成的增加,这种不同于有氧条件下的生物被膜形成,其关键是细胞的伸长[21]。Hao 等[14]研究了包括PAO1在内的7株临床分离菌株,发现尽管一些临床菌株有氧条件下生物被膜形成能力与PAO1 相近,但在厌氧条件下,这些菌株生物被膜形成能力明显减弱,意味着可能存在着另一种不同于QS 的机制也在调节生物被膜形成的过程。影响生物被膜形成的因素有很多。在厌氧条件下生物被膜的形成涉及多种调控机制,且具有菌株依赖性,不同菌株在相同条件下其所形成生物被膜的能力不一定相同[14]。这些差异可能由实验参数不同所致,不同的实验参数也会影响生物被膜的形成[16]。
综上,P.a在厌氧条件下产生毒力因子的能力减弱,而QS 系统在厌氧条件下也明显受到抑制。但本研究P.a的生物被膜形成减少,因此,针对这一现象,今后将继续探究P.a在厌氧条件下致病性机制及其在脓胸胸膜腔内的表型变化。

