矿井水对荒漠草原土壤微生物群落结构及多样性的影响
牟红霞, 刘秉儒, 李子豪, 李国旗, 麻冬梅
(1.宁夏大学生态环境学院/西北退化生态系统恢复与重建教育部重点实验室,宁夏 银川 750021;2.北方民族大学生物科学与工程学院,宁夏 银川 750021)
煤矿资源的开发极大推动了国民经济的发展,同时也带来了严重的生态环境问题[1]。例如,矿井水中含有大量重金属污染物[2],已成为矿区主要的重金属污染源之一。矿井水在环境中具有强流动性和渗透性等特征,大量外排会对周围土壤理化性质造成影响,进而对生物多样性保护和生态系统服务产生重要影响[3]。其中,土壤微生物群落对环境变化敏感,能够敏感反应环境变化和人类活动干扰的影响[4-5],是指示人类干扰和生态系统健康的重要生物学指标[6-8]。在干旱半干旱气候区,荒漠草原植物群落多样性低,降水量少且年际间波动频繁,生态系统抗干扰能力极其脆弱[9];矿井水排放会导致周边土壤盐分含量增加,理化性质发生变化,次生盐碱化和环境污染加剧[3],使原本脆弱的荒漠草原,对土壤生境恶化的修复能力急剧降低,从而影响其生态系统的稳定性与可持续发展[8]。
Newman 等[10]研究发现,采矿有可能破坏矿区内外的水文平衡,改变水文地质性质,从而直接影响到矿区的生态环境。近几年国内外一些研究表明,矿井水的排放会对土壤微生物的群落结构和多样性均产生一定影响[11-14]。李启艳等[15]研究稀土矿废弃地植被恢复过程中土壤微生物演替,表明随着植被恢复年限增加,土壤微生物群落多样性及相对丰度降低。彭玙萍等[16]研究酸性矿山微生物群落多样性,表明矿山废水中微生物以典型的矿井废水中的微生物为主,包括严格自养的酸硫杆菌属(Aci-dithiobacillus)和钩端螺旋菌属(Leptospirillum),以及可异养生长的硫化杆菌属(Sulfobacillus)、铁质菌属(Ferroplasma)和嗜酸菌属(Acidiphilium)。于晓娟[17]发现矿井水的外排是影响周边土壤性质空间异质性的主要因素,土壤环境的改变势必影响微生物群落多样性。综上所述,矿井水排放将改变微生物群落组成降低其多样性。但是,有关矿井水外排对土壤微生物群落的影响的强度和范围研究较少,矿井水对荒漠草原土壤微生物群落结构及多样性的影响过程与机理尚不明确,因此探讨矿井水外排干扰下荒漠草原土壤养分与微生物群落结构及多样性的相关机理,对维持荒漠草原生态系统的长期稳定性具有重要意义。
本研究以宁夏干旱风沙区矿井水排放地的荒漠草原为研究对象,以自然区域(MJTC)为对照样地,通过高通量测序矿井水排放样地沿岸水滨区域(MJTA)和近岸陆域(MJTB)土壤中0~10 cm、10~20 cm 和20~30 cm 的细菌和真菌群落组成,并对其多样性进行分析,结合土壤理化因子等环境因素,揭示矿井水干扰对土壤微生物群落结构组成及多样性影响的主要因素,为矿井水外排对土壤污染进行有效修复及矿井水的合理排放利用提供理论依据和科学指导。
1 材料与方法
1.1 研究区概况
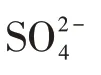
1.2 试验设计和样品采集
样地选于未经其他人为干扰靠近矿井水排放一侧,由于矿井水外排导致其周边土壤垂直距离由近及远形成含盐量梯度,进而影响其不同区域植被类型分布。因此,可以分为0~20 m 范围内水滨区域,优势植物为冰草;30~60 m 范围内近岸陆域,优势植物为冰草和沙蒿;70~100 m 范围内自然区域,优势植物为黑沙蒿;共3 种滨岸类型。每个区域设置6 个地势平坦,植被分布均匀,生长良好的15 m×10 m大样方,在每个大样方中按照五点取样法设置5 个1 m×1 m 的小样方。在每个小样方用土壤钻分别取0~10 cm、10~20 cm和20~30 cm的土样,最后将同一深度的5个小样方的土样混匀,同一深度2份,共计108份样品。一份装入经高压灭菌后带标签的冻存管,并立即放入-4 ℃的保温箱运回实验室,随后转移至-80 ℃冰箱保存,用于微生物群落测定;另一份样品装入自封袋中,带回实验室进行自然风干,并将土壤中植物碎屑和细根等杂质剔除,过筛后用于测定土壤的各项理化指标。
1.3 实验测定方法
土壤含水量通过烘干法测定,土壤pH 通过水土比2.5:1悬液用PHS-3C酸度计测定。土壤盐分用称重法测量,土壤有机碳(SOC)采用重铬酸钾氧化-外加热法测定,土壤全氮(TN)采用elementer 元素分析仪来测定,全磷(TP)采用NaOH 熔融-钼锑抗比色法,速效磷(AP)采用NaHCO3浸提-钼锑抗比色法测定[18]。
土壤微生物高通量测序:土壤DNA 采用OMEGA 土壤试剂盒提取;DNA 纯度和浓度检测:Nano-Drop2000;DNA完整性检测方法:1%琼脂糖凝胶电泳电压5V/cm,时间为20 min;PCR 扩增:采用引物为338F(5’-ACTCCTACGGGAGGCAGCAG-3’)和806R(5’-GGACTACHVGGGTWTCTAAT-3’)扩增细菌16S rRNA 基因V3-V4 区;真菌ITS 区进行扩增,引物序列用ITS1F(5’-CTTGGTCATTTAGAGGAAGTAA-3’)和ITS2R(5’-GCTGCGTTCTTCATC GATGC-3’),每个样本3个PCR重复,将3个重复的PCR产物混合;使用2%琼脂糖凝胶电泳检测产物;PCR产物纯化使用AxyPrep DNA Gel Extraction Kit,将PCR 产物用Quantus™Fluorometer 进行检测定量;按照每个样本的测序量要求,进行相应比例的混合;使用NEXTFLEX®Rapid DNA-Seq Kit 进行建库,利用Illumina 公司的Miseq PE300/NovaSeq PE250平台进行测序[19-22]。
1.4 数据分析
运用SPSS Statistics 25 进行土壤理化指标单因素方差分析。Mothur指数分析细菌和真菌Alpha多样性指数;运用Qiime生成各分类学水平丰度;通过单因素重复测量方差分析,比较3 个区域在门水平下细菌和真菌群落分布是否存在显著性差异,然后对有差异的物种进行post-hoc 检验。运用R(version 3.3.1)进行Heatmap分析,通过Spearman计算环境因子与物种之间的相关系数。运用R 语言vegan包中的NMDS分析来研究矿井水排放对土壤细菌和真菌群落组成的影响。运用R 语言vegan 包中CCA分析和作图,通过CCA分析来反映研究区细菌和真菌与环境因子间的关系。
2 结果与分析
2.1 土壤理化性质分析
由图1 可知,矿井水显著改变土壤盐分、pH、有机碳、总磷、总氮和土壤含水量(P<0.05)。土壤盐分表现为:水滨区域显著高于近岸陆域和自然区域(P<0.05,图1a),而土壤pH 表现为:水滨区域显著低于近岸陆域和自然区域(P<0.05,图1b);土壤有机碳表现为:水滨区域>自然区域>近岸陆域(P<0.05,图1c);总氮和总磷变化相似,均表现为:水滨区域和自然区域显著高于近岸陆域(P<0.05,图1d,图1e);土壤含水量表现为:水滨区域>近岸陆域>自然区域(P<0.05,图1g);而矿井水对土壤有效磷影响较小(P>0.05,图1f)。
不同土层中土壤盐分、有机碳、速效磷含量和土壤含水量有明显变化。土壤盐分仅在水滨区域差异显著,表现为0~10 cm 和20~30 cm 显著高于10~20 cm(图1a);土壤有机碳含量在近岸陆域和水滨区域表现为10~20 cm 显著高于20~30 cm,(图1c);土壤速效磷在3个区域均表现为随土层加深而显著降低(图1f);土壤含水量表现为随土层加深而显著升高(图1g);而不同土层中土壤pH值、土壤总氮、总磷变化较小(图1b,图1d,图1e)。
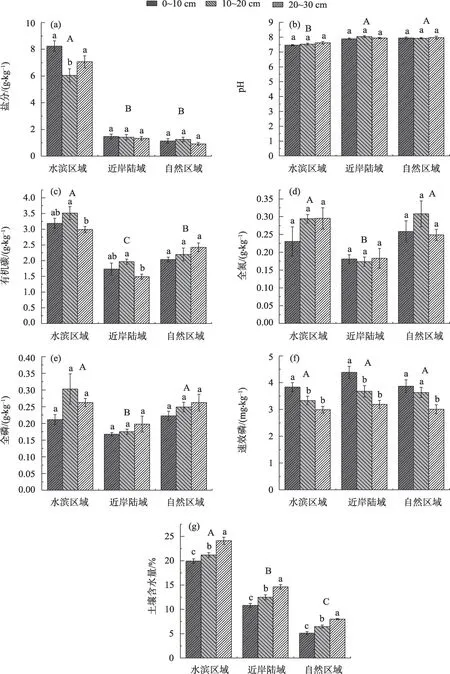
图1 不同区域不同深度土壤理化指标Fig.1 Soil physical and chemical indexes at different depths in different regions
2.2 土壤细菌和真菌群落结构组成分析
由图2可知,矿井水排放显著改变土壤细菌(P=0.001)和真菌(P=0.001)的群落组成;细菌群落相对丰度前10 的门水平在不同区域结构组成相似度较高(图3a);其中丰度前10 的门分别为:放线菌门(Actinobacteria)、变形菌门(Proteobacteria)、绿弯菌门(Chloroflexi)、酸杆菌门(Acidobacteria)、厚壁菌门(Firmicutes)、芽单胞菌门(Gemmatimonadota)、拟杆菌门(Bacteroidota)、粘球菌门(Myxococcota)、脱硫细菌门(Desulfobacterota)和Methylomirabilota。各细菌相对含量分析表明,放线菌门(33.94%)、变形菌门(19.93%)、绿弯菌门(11.93%)、酸杆菌门(7.52%)、厚壁菌门(6.84%)和芽单胞菌门(6.21%)为研究区主要细菌群落。
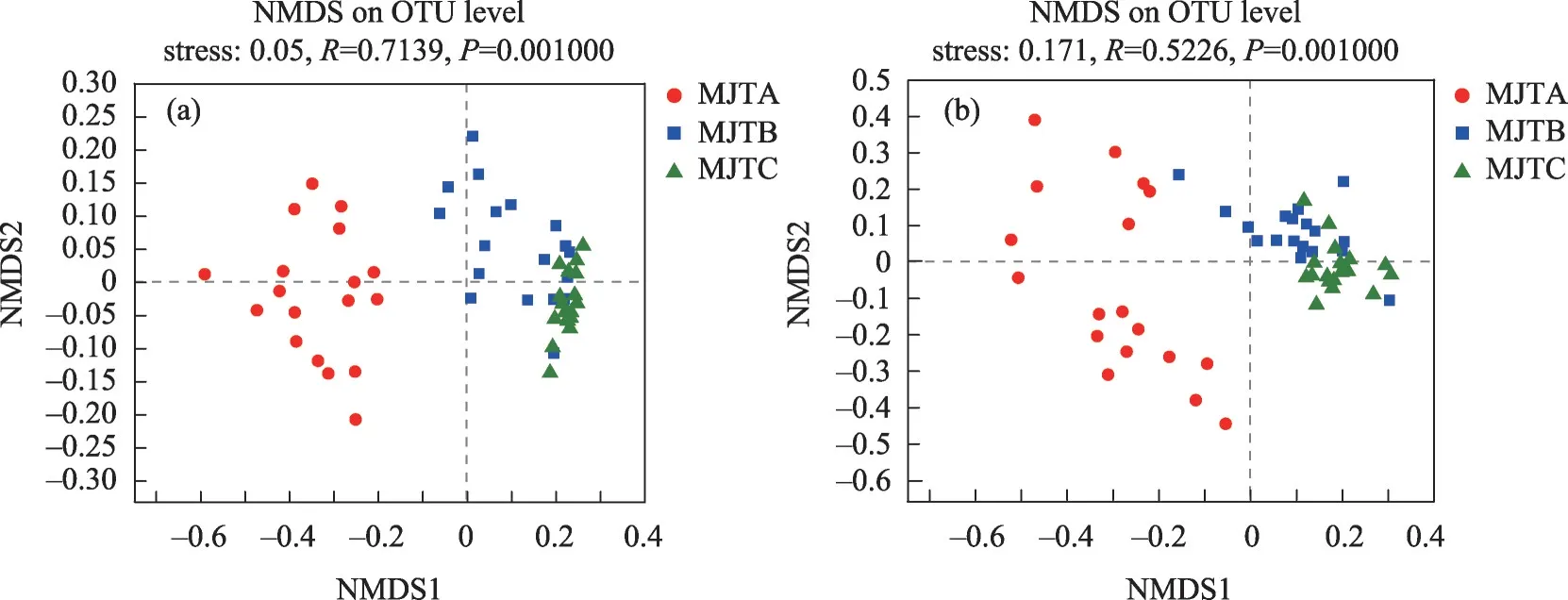
图2 土壤细菌和真菌的NMDS分析Fig.2 NMDS analysis of soil bacteria and fungi
在真菌门水平上,丰度前10的真菌门类组成基本相同(图3b),丰度较高的门分别为:子囊菌门(Ascomycota)、担子菌门(Basidiomycota)、被孢菌门(Mortierellomycota)、壶菌门(Chytridiomycota)、隐真菌门(Rozellomycota)、球囊菌门(Glomeromycota);各样本中子囊菌门丰度高达54%以上,平均占比71.29%,担子菌门平均丰度为7.08%,结合相对含量分析,研究区优势真菌类群为子囊菌门;在水滨区域0~10 cm、10~20 cm 和20~30 cm 土层中均发现了隐真菌门,为水滨区域特有菌门。

图3 土壤细菌和真菌门水平相对丰度Fig.3 Relative abundance of soil bacteria and fungi at the phylum level
门水平差异分析表明(图4),放线菌门相对丰度在水滨区域、近岸陆域和自然区域中差异均显著(P<0.01),其中在水滨区域相对丰度最低,自然区域相对丰度最高。变形菌门相对丰度在自然区域显著低于水滨区域和近岸陆域(P<0.01),在水滨区域和近岸陆域相对丰度无显著性差异;酸杆菌门相对丰度在水滨区域显著低于近岸陆域和自然区域(P<0.001),在近岸陆域和自然区域相对丰度无显著性差异;厚壁菌门相对丰度表现为:水滨区域>近岸陆域>自然区域(P<0.01);拟杆菌门相对丰度表现为:水滨区域显著高于近岸陆域和自然区域(P<0.01),在近岸陆域和自然区域相对丰度无显著性差异;脱硫细菌门相对丰度表现为:水滨区域显著高于近岸陆域和自然区域(P<0.001),在近岸陆域和自然区域相对丰度无显著性差异。

图4 不同区域细菌和真菌门水平丰度差异Fig.4 Abundance differences at the bacterial and fungal phyla levels in different regions
子囊菌门相对丰度仅在水滨区域显著低于近岸陆域(P<0.05),被孢菌门相对丰度仅在水滨区域显著低于自然区域(P<0.05),球囊菌门相对丰度仅在水滨区域显著低于自然区域(P<0.01),隐真菌门相对丰度在水滨区域与近岸陆域、水滨区域与自然区域中差异均显著(P<0.05)。
研究区细菌群落相对丰度前10的属分别为(图5a):norank_f__norank_o__norank_c__MB-A2-108、norank_f__norank_o__Gaiellales、芽单胞菌科中的一部分属水平的未定细菌(norank_f__Gemmatimonadaceae)、norank_f__norank_o__Vicinamibacterales、芽孢 杆 属(Bacillus)、norank_f__67- 14、norank_f__JG30-KF-CM45、节 杆 菌(Arthrobacter)、norank_f__norank_o__Actinomarinales、norank_f__norank_o__norank_c__KD4-96;其中,丰度前10 的属水平细菌分类中有8 个以norank 作为标记,即没有科学名称,有大量未分类细菌,给本次研究细菌的生态功能带来了一定困难。水滨区域主要优势细菌属为norank_f__norank_o__norank_c__MB- A2- 108(16.13%)、芽孢杆属(14.43%),近岸陆域主要优势细菌属为:norank_f__norank_o__norank_c__MB-A2-108(13.45%)、节杆菌属(13.43%),自然区域主要优势细菌属为:norank_f__norank_o__norank_c__MBA2-108(26.47%)、norank_f__norank_o__Gaiellales(22.34%)。
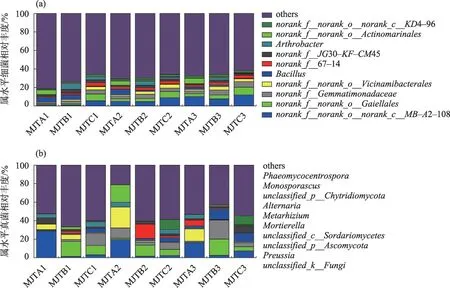
图5 土壤细菌和真菌属水平相对丰度Fig.5 Relative abundance of soil bacteria and fungi at the genus level
真菌群落相对丰度前10的属分别为(图5b):光黑壳属(Preussia)、unclassified_p__Ascomycota、unclassified_c__Sordariomycetes、被 孢 霉 属(Mortierella)、绿僵菌(Metarhizium)、链格孢属(Alternaria)、unclassified_p__Chytridiomycota、Monosporascus、Phaeo-mycocentrospora。其中,水滨区域主要优势真菌属为unclassified_c__Sordariomycetes(41.76%)、unclassified_p__Chytridiomycota(13.62%),近岸陆域主要优势真菌属为:光黑壳属(45.69%)、unclassified_p__Ascomycota(25.88%),自然区域主要优势真菌属为:光黑壳属(21.14%)、unclassified_p__Ascomycota(24.47%)。
2.3 土壤细菌和真菌多样性指数分析
由图6 可知,矿井水排放显著降低真菌和细菌的Shannon 指数、Ace 指数和Chao 指数。细菌Shannon 指数表现为:近岸陆域和自然区域显著高于水滨区域(P<0.05),细菌Ace 指数和Chao 指数变化相似,均表现为自然区域显著高于水滨区域(P<0.05)(图6a)。真菌Shannon 指数表现为:自然区域显著高于水滨区域(P<0.05),真菌Ace 指数和Chao 指数表现为:近岸陆域和自然区域显著高于水滨区域(P<0.05)(图6b)。
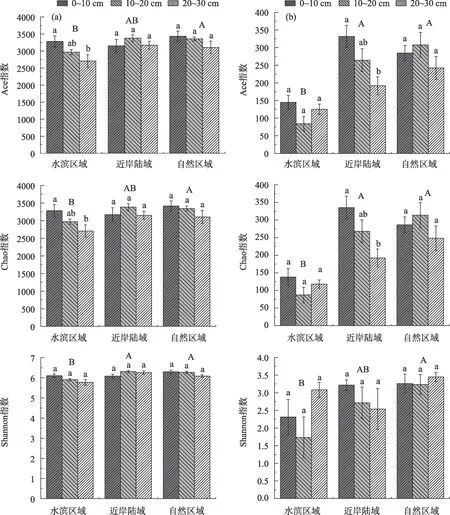
图6 不同区域不同深度土壤细菌和真菌多样性指数Fig.6 Diversity index of soil bacteria and fungi at different depths in different regions
细菌和真菌的Shannon 指数、Ace 指数和Chao指数在不同土层差异较小。细菌Ace 指数和Chao指数仅在水滨区域表现为随土层加深而显著降低(P<0.05);而真菌Ace 指数和Chao 指数仅在近岸陆域表现为随土层加深而显著降低(P<0.05)。
2.4 土壤环境因子与土壤细菌和真菌门水平相关性分析
对门水平下真菌和细菌群落组成与土壤环境因子展开Spearman相关性分析(图7),结果表明:土壤盐分与放线菌门、酸杆菌门、芽单胞菌门、粘球菌门和Methylomirabilota 呈显著负相关,与变形菌门、厚壁菌门、拟杆菌门和脱硫细菌门呈显著正相关;土壤pH 与放线菌门、酸杆菌门、芽单胞菌门、粘球菌门和Methylomirabilota 呈显著正相关,与变形菌门、厚壁菌门、拟杆菌门和脱硫细菌门呈显著负相关;土壤含水量与放线菌门、酸杆菌门、芽单胞菌门、粘球菌门和Methylomirabilota 呈显著负相关,与变形菌门、厚壁菌门、拟杆菌门和脱硫细菌门呈显著正相关;有机碳与放线菌门、酸杆菌门、粘球菌门和Methylomirabilota 呈显著负相关,与厚壁菌门、拟杆菌门和脱硫细菌门呈显著正相关;全氮和全磷与变形菌门呈显著负相关关系,速效磷与个别细菌门类呈显著正相关或负相关关系(图7a)。
土壤盐分与担子菌门、被孢菌门、球囊菌门、梳霉门、Calcarisporiellomycota 和子囊菌门均存在显著负相关关系,与隐真菌门存在显著正相关关系;土壤pH与子囊菌门、担子菌门、被孢菌门、球囊菌门、梳霉门和Calcarisporiellomycota 均存在显著正相关关系,与隐真菌门存在显著负相关关系;土壤含水量与担子菌门、被孢菌门、球囊菌门、梳霉门和Calcarisporiellomycota 均存在显著负相关关系,与隐真菌门存在显著正相关关系;有机碳与子囊菌门、被孢菌门和球囊菌门均存在显著负相关关系,与隐真菌门存在显著正相关关系;全氮、全磷和速效磷与个别真菌门类存在显著正相关关系或负相关关系(图7b)。
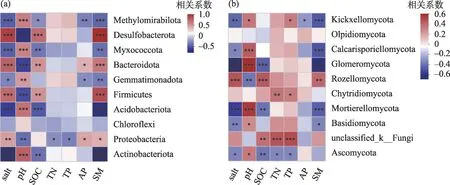
图7 土壤细菌和真菌群落门水平与环境因子相关性分析Fig.7 Correlation analysis between soil bacterial and fungus community levels and environmental factors
2.5 土壤细菌和真菌与土壤环境因子的CCA分析
Lengths of gradient 第一轴大于3.5,因此采用CCA 分析不同区域土壤细菌和真菌群落与环境因子间的关系。其中R2代表环境因子对物种的影响程度(解释量),R2越大,环境因子指标箭头越长。细菌群落中,第1 排序轴与土壤盐分、土壤含水量、土壤SOC 呈负相关,相关系数分别为:-0.999、-0.998、-0.936,第1 排序轴与pH 呈正相关,相关系数为0.997;第2 排序轴与TN、TP 呈正相关,相关系数分别为:0.89、0.86,土壤盐分、土壤含水量、土壤SOC和土壤pH的R2分别为0.87、0.70、0.68和0.58,P值均为0.001(图8a)。真菌群落中,第1排序轴与土壤盐分、土壤含水量、土壤SOC呈负相关,相关系数分别为:-0.986、-0.993、-0.997,第1排序轴与pH呈正相关,相关系数为0.992;第2排序轴与AP呈正相关,相关系数为0.957。土壤盐分、土壤含水量、土壤SOC和土壤pH的R2分别为0.94、0.81、0.65 和0.62,P值均为0.001(图8b)。即土壤盐分、土壤含水量、土壤SOC 和土壤pH 是影响研究区土壤细菌和真菌群落结构的主要影响因子。
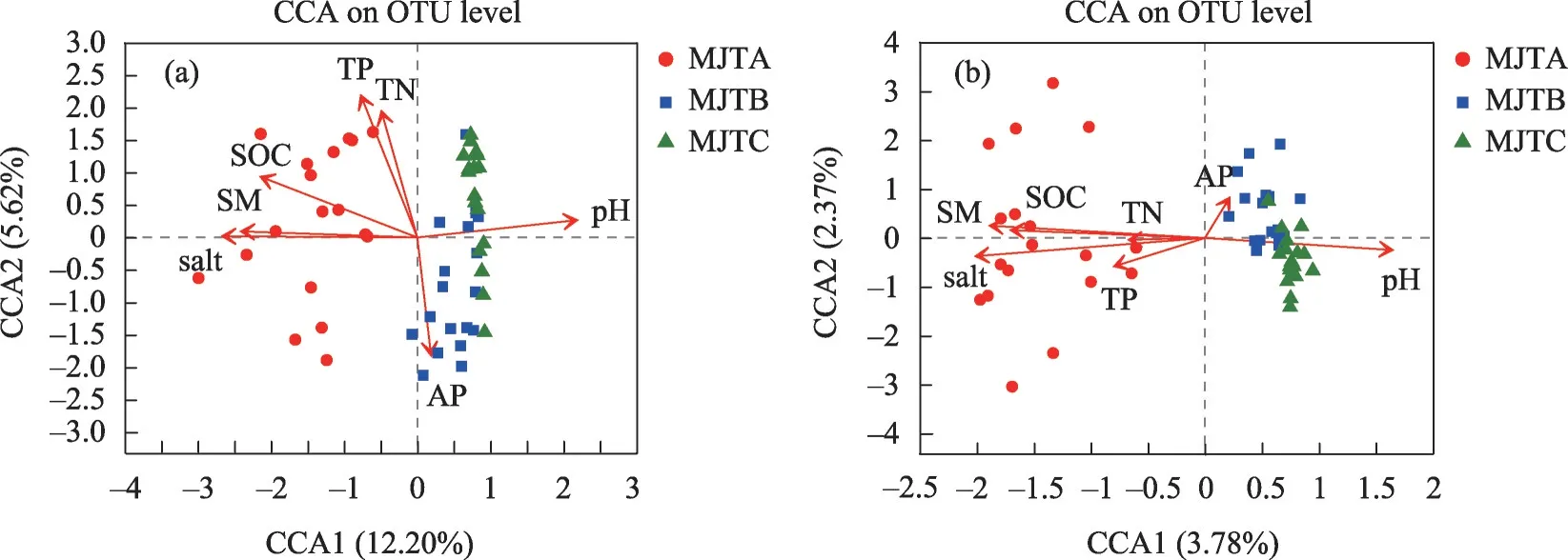
图8 土壤细菌和真菌群落-CCA分析Fig.8 Bacterial and fungal communities in soil-CCA analysis
3 讨论
矿井水对研究区土壤细菌和真菌群落门水平相对丰度差异影响显著。研究区主要细菌类群为:放线菌门、变形菌门、绿弯菌门、酸杆菌门、厚壁菌门、芽单胞菌门和拟杆菌门,这些细菌门类均为盐碱土壤的主要细菌类群[23],也是矿废水沉积物中主要的细菌群落结构[24]。国内外相关研究表明,在盐碱土壤中,变形菌门为主要优势细菌类群[25-27],而本研究区土壤细菌中放线菌门占主导地位,说明在不同盐碱环境下土壤细菌的类群结构具有相似性,但主要优势群落会有所变化。有研究表明,在次生盐碱土中其优势细菌为放线菌门,这与本研究结果一致[23],说明放线菌门在研究区干旱盐渍化的土壤环境中具有十分重要的作用。放线菌门相对丰度在水滨区域显著低于近岸陆域和自然区域,这可能与大多数放线菌生活在含水量低、土壤呈微碱性的条件有关[28]。相关研究表明,变形菌门、厚壁菌门在硫酸盐还原过程中起着重要作用[29],本研究中水滨区域变形菌门、厚壁菌门的选择性富集可能与硫酸盐降解有关。水滨区域脱硫细菌门相对丰度显著高于近岸陆域和自然区域,这同样与水滨区域距矿井水排放地距离最近,矿井水中含有大量硫酸盐有关[30-31]。拟杆菌门相对丰度在水滨区域同样显著高于近岸陆域和自然区域,已有研究证实,在中碱性矿井水中其拟杆菌门含量较高[32-33]。芽孢杆属(Bacillus)隶属于厚壁菌门,具有良好的嗜盐碱特性,可以更好地在盐渍化且干旱环境中生长与繁殖[34],因此成为了研究区强有力的生存者。优势细菌属norank_f__norank_o__norank_c__MB-A2-108、节杆菌属、Gaiella属均隶属于放线菌,Gaiella属产生的多种抗生素,使土壤中大量储存抗生素产生菌资源更有利于其在逆境环境中生长繁殖[35]。属水平优势细菌进一步证明,放线菌门和变形菌门为研究区土壤中主要优势细菌门。
研究区主要真菌门为子囊菌门和担子菌门。但子囊菌门丰度远高于担子菌门,这是因为子囊菌门的进化速度和物种多样性比担子菌门更快更丰富[36],即子囊菌门对土壤的生态适应性较强,是土壤中最丰富的真菌类群,这与多数学者的研究结果一致[37-38]。在土壤微生物中,腐生真菌对有机质起到分解作用,子囊菌和担子菌是土壤中纤维素的主要真菌分解者[39-40],这对研究区生态系统的物质循环发挥着十分重要的作用。隐真菌门为水滨区域0~30 cm 土层中特有菌门,这可能与水滨区域距矿井水排放地距离最近,土壤含水量较高具有一定关系[41]。优势真菌属中,光黑壳属、链格孢属、Monosporascus属、翅孢壳属均隶属于子囊菌,进一步表明,子囊菌门为研究区土壤中主要优势真菌门。翅孢壳属为耐盐碱菌属[42],内生真菌Alternaria能促进植物生长或提高盐耐受性能[43],对研究区耐盐碱植物有着抗逆、促生等作用。
矿井水对研究区土壤细菌和真菌丰富度与多样性影响均显著,降低了细菌和真菌丰富度与多样性,这与有的研究结果一致[44]。细菌和真菌丰富度与多样性均表现为水滨区域显著低于自然区域,这是因为土壤盐分、土壤含水量均在水滨区域显著高于近岸陆域和自然区域,本研究中,水滨区域土壤盐分的积聚虽然会促进嗜盐碱细菌的富集,但同时会抑制一些细菌的生长,真菌活性同样受到抑制甚至死亡[36],且研究区干旱少雨,蒸发量大于降水量,含水量过高会造成土壤板结,最终抑制了细菌和真菌的生长,因此水滨区域土壤细菌和真菌多样性与丰富度显著低于近岸陆域和自然区域。
Spearman 相关性分析表明,放线菌门与土壤与盐分呈极显著负相关关系,与土壤pH 呈极显著正相关关系,与土壤有机碳、含水量呈极显著负相关关系,进一步表明放线菌门生活在含水量低,微碱性土壤中,是营养贫瘠型菌门,能够适应各种不利的条件。酸杆菌门与土壤pH 呈极显著正相关关系,这一结论与多数研究结果相反[45-46],但也有研究发现,酸杆菌不同亚群相对丰度与土壤pH 有不同的显著相关关系[47],在中碱性环境中发现酸杆菌门,其主要作用是降解植物残体,本研究中酸杆菌门平均相对丰度为7.52%,在研究区土壤生态过程中发挥着十分重要的作用。有学者研究表明,当土壤盐分含量较高时,变形菌门、厚壁菌门和拟杆菌门相对丰度较高[48-49],本研究结果也支持此结论,这些细菌门能降解各种污染物、复杂有机物和聚合物,在荒漠草原土地生态恢复过程中发挥着积极作用。土壤盐分与子囊菌门、担子菌门两大优势菌门均呈显著负相关关系,说明盐分对研究区真菌具有明显的抑制作用。土壤环境因子与土壤细菌和真菌多样性分析表明,土壤盐分、土壤含水量、土壤SOC 和土壤pH 是影响研究区土壤细菌和真菌群落多样性的主要影响因子。
4 结论
(1)矿井水排放显著改变了研究区土壤细菌和真菌的群落组成,对土壤细菌和真菌群落门水平相对丰度差异影响显著。
(2)盐分抑制了水滨区域土壤细菌和真菌的生长,但同时促进了水滨区域嗜盐碱细菌的富集。
(3)细菌和真菌丰富度与多样性均表现为水滨区域显著低于自然区域,进一步说明矿井水对土壤细菌和真菌丰富度与多样性影响显著。
(4)土壤盐分、土壤含水量、土壤SOC 和土壤pH 是影响研究区土壤细菌和真菌群落多样性的主要影响因子。

