茯苓提取物对1型糖尿病小鼠血糖及肠道菌群的调节作用
刘 蕾 ,李海涛 ,郑华月 ,陈 琼
1.南阳医学高等专科学校第一附属医院儿科,南阳 473000;2.郑州儿童医院/河南省儿童医院/郑州大学附属儿童医院内分泌遗传代谢科,郑州 450053
1型糖尿病(Type 1 diabetes mellitus,T1DM)全球发病率呈逐年上升趋势,多见于儿童或青少年,且具有不可治愈性,给患者家庭及社会带来沉重的负担[1-2]。临床以胰岛素或二甲双胍等降糖药控制糖尿病患者的血糖水平,而在临床应用中发现低血糖、体质量增加、过敏反应等不良反应可影响治疗进展,探寻不良反应小的药物是临床研究重点[3-4]。中药提取物具有毒性与不良反应小、作用温和等优点,如茯苓具有利水渗湿、健脾宁心之效,其化学成分具有抗氧、降血脂、抗衰老等多种药理作用[5]。另有研究发现[6],或可通过改变肠道菌群组成来防治T1DM,而有学者在研究茯苓三萜类化合物对肠上皮完整性中发现,其可改善肠道屏障功能[7]。基于此,本研究建立T1DM小鼠模型,用茯苓提取物(poria cocos extract,PCE)等灌胃干预,探讨其降血糖、调节肠道菌群的作用机制,为临床新药研发提供依据。
1 仪器与材料
1.1 仪器
流式细胞仪(赛默飞世尔科技有限公司,Attune NxT);德国Applied Biosystems 2720热循环仪。
1.2 试药
PCE(CAS:65637-98-1)购自上海昕凯医药科技有限公司;二甲双胍(国药准字H20174087)购自郑州泰丰制药有限公司;链脲佐菌素(CAS:18883-66-4)购自Sigma-Aldrich(上海)公司;胰岛素(insulin,INS)与胰高血糖素(glucagon,GC)试剂盒均购自广州市进德生物科技有限公司;白细胞介素-10(interleukin-10,IL-10)、白细胞介素-17(interleukin-17,IL-17)ELISA试剂盒与CD4、CD25、FOXP3、IL-17A抗体均购自Abcam公司。
1.3 实验动物
昆明种小鼠60只,雄性,SPF级,6周龄,体质量17~22 g,购自上海南方模式生物科技股份有限公司,生产许可证号SCXK(沪)2017-0010,小鼠适应性喂养1周,自由采食进水,保持温度23 ℃~25 ℃,相对湿度40%~70%,12 h交替光-暗饲养。
2 实验方法
2.1 配制链脲佐菌素溶液
将链脲佐菌素在预冷0.1 mol·L-1柠檬酸钠缓冲液(pH环境4.2~4.5)中溶解,配成20 g·L-1的链脲佐菌素溶液,用滤菌器过滤除菌,避光保存,保证30 min内注射完成。
2.2 建立T1DM小鼠模型[8]
取48只小鼠造模,小鼠禁食不禁水12 h,现配链脲佐菌素溶液腹腔注射,200 mg·kg-1,每日1次,连续3 d,注射完成后,小鼠自由饮水摄食,观察造模小鼠饮水、摄食、排尿等情况。5 d后,采集小鼠尾静脉血,用血糖仪检测小鼠空腹血糖(fasting plasma glucose,FPG),FPG范围在11.1~25.0 mmol·L-1为T1DM造模成功,弃去未成模小鼠。
2.3 分组与干预方法
剩余12只小鼠作为对照组,造模成功43只小鼠随机分为模型组(11只)、PCE低剂量组(11只)、PCE高剂量组(11只)及二甲双胍组(10只)。造模成功后第2天,PCE低剂量组、高剂量组对应予以PCE 3.0、12.0 g·kg-1灌胃,二甲双胍组予以0.2 g·kg-1二甲双胍灌胃,对照组与模型组均予以5 mL·kg-1双蒸水灌胃,各组干预均为每日1次,连续灌胃28 d。
2.4 观察指标
2.4.1血糖检测仪测定小鼠FPG水平 末次干预后,禁食12 h,固定小鼠,摘除眼球法采血,用血糖仪与医用血糖试纸检测各组小鼠FPG水平。
2.4.2ELISA法检测血清INS、GC水平 采集全血进行离心处理,以3 000 r·min-1,离心5 min,-70 ℃保存,ELISA法检测,加入样品、对照品后37 ℃反应(30 min),洗板5次,加入酶标试剂,37 ℃反应(30 min),再次洗板,加入显色液,37 ℃显色10 min,加入终止液,15 min读取A值,计算小鼠血清INS、GC水平。
2.4.3HE染色观察小鼠胰腺组织形态学 采血完毕,脱颈处死小鼠,分离出胰腺组织、结肠组织等。甲醛固定胰腺组织,梯度乙醇脱水处理,二甲苯透明、包埋,切片机切片(4 μm),苏木精染色10 s,自来水冲洗3 min,体积分数为1%的盐酸酒精分化20 s,自来水冲洗15 min,伊红染色5 s;乙醇中脱水,二甲苯透明,中性树胶固片,光学显微镜观察胰腺病理学变化。
2.4.4ELISA法检测结肠组织匀浆炎性因子水平 取结肠组织,每50 mg组织加PBS溶液1 mL,剪刀剪碎,进行超声匀浆,4 ℃以3 000 r·min-1离心15 min,取上清液,-80 ℃保存,ELISA法检测,进行包被洗涤、上样孵育、加酶标二抗孵育洗涤、加底物液显色、加终止反应液终止反应、450 nm酶标仪测定吸光度值,计算结肠组织IL-10、IL-17质量浓度。
2.4.5流式细胞仪测定结肠组织Th17细胞、Treg细胞比例 取结肠组织,剪成1 mm3的组织块,置于15 mL离心管中,200目过滤网过滤,以3 000 r·min-1离心5 min,洗涤2次,加裂解液稀释,加PBS溶液,以3 000 r·min-1离心5 min,洗涤,调整细胞密度为1×106个·mL-1,将细胞放置于流式管中,以3 000 r·min-1离心5 min,洗涤,PBS重悬,加破膜固定液,室温静置1 h后取荧光抗体加入细胞悬液,避光孵育(4 ℃,30 min),以3 000 r·min-1离心5 min,反复洗涤2次,用流式细胞仪检测Th17细胞、Treg细胞比例。
2.4.6测定结肠内容物肠道菌群丰度 取小鼠结肠内容物50 mg,提取DNA,NanoDrop Lite超微量分光光度计检测质量浓度,检测结果为一级样本,满足建库要求,选择肠道菌群16 s区域V 4区(基因组),作为扩增区域,用KAPA公司Hi Fi PCR试剂盒、热循环仪扩增,Bioanalyzer 2100生物分析仪系统建库,数据用Trimmomatic V0.32分析。
2.5 统计学方法
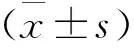
3 结果
3.1 PCE对T1DM小鼠FPG的影响
5组小鼠FPG水平比较,差异有统计学意义(P<0.05);两两比较发现,模型组、PCE低剂量组、PCE高剂量组和二甲双胍组FPG水平均高于对照组(P<0.05);PCE低剂量组、PCE高剂量组和二甲双胍组FPG水平低于模型组(P<0.05);PCE高剂量组和二甲双胍组FPG水平低于PCE低剂量组(P<0.05);PCE高剂量组和二甲双胍组2组FPG水平比较,差异无统计学意义(P>0.05)。见表1。

表1 PCE对T1DM小鼠FPG的影响
3.2 PCE对T1DM小鼠血清INS及GC的影响
5组小鼠血清GC和INS水平比较,差异有统计学意义(P<0.05);两两比较显示,模型组、PCE低剂量组、PCE高剂量组和二甲双胍组血清GC水平均高于对照组,血清INS水平低于对照组(P<0.05);PCE低剂量组、PCE高剂量组和二甲双胍组血清GC水平低于模型组,血清INS水平高于模型组(P<0.05);PCE高剂量组和二甲双胍组血清GC水平低于PCE低剂量组,血清INS水平高于PCE低剂量组(P<0.05);PCE高剂量组和二甲双胍组2组血清GC及INS水平比较,差异无统计学意义(P>0.05)。见表2。

表2 PCE对T1DM小鼠血清INS及GC的影响
3.3 PCE对T1DM小鼠胰腺组织形态学的影响
对照组小鼠胰腺组织形态规则,胰岛细胞大小均匀、排列紧密,细胞质无空泡化;模型组胰腺组织形态不完整,胰岛细胞排列疏松,细胞质内空泡明显;PCE低剂量组、PCE高剂量组和二甲双胍组胰腺组织损伤程度有不同程度减轻,胰岛细胞排列相对紧密,空泡逐渐减少,其中PCE高剂量组、二甲双胍组空泡减少更明显。见图1。

注:A.对照组;B.模型组;C.PCE低剂量组;D.PCE高剂量组;E.二甲双胍组。
3.4 PCE对T1DM小鼠结肠组织IL-10和IL-17的影响
5组小鼠结肠组织IL-10、IL-17质量浓度比较,差异有统计学意义(P<0.05);两两比较发现,模型组、PCE低剂量组、PCE高剂量组、二甲双胍组结肠组织IL-10质量浓度低于对照组,IL-17质量浓度高于对照组(P<0.05);PCE低剂量组、PCE高剂量组、二甲双胍组结肠组织IL-10质量浓度高于模型组,IL-17质量浓度低于模型组(P<0.05);PCE高剂量组、二甲双胍组FPG水平结肠组织IL-10质量浓度高于PCE低剂量组,IL-17质量浓度低于PCE低剂量组(P<0.05);PCE高剂量组、二甲双胍组2组结肠组织IL-10、IL-17质量浓度比较,差异无统计学意义(P>0.05)。见表3。

表3 PCE对T1DM小鼠结肠组织IL-10和IL-17的影响
3.5 PCE对T1DM小鼠结肠Th17细胞和Treg细胞比例的影响
5组小鼠结肠Th17细胞、Treg细胞比例比较,差异有统计学意义(P<0.05);两两比较发现,模型组、PCE低剂量组、PCE高剂量组、二甲双胍组Th17细胞比例高于对照组,Treg细胞比例低于对照组(P<0.05);PCE低剂量组、PCE高剂量组、二甲双胍组Th17细胞比例低于模型组,Treg细胞比例高于模型组(P<0.05);PCE高剂量组、二甲双胍组Th17细胞比例低于PCE低剂量组,Treg细胞比例高于PCE低剂量组(P<0.05);PCE高剂量组、二甲双胍组2组Th17细胞、Treg细胞比例比较,差异无统计学意义(P>0.05)。见表4。

表4 PCE对T1DM小鼠结肠Th17细胞和Treg细胞比例的影响
3.6 PCE对T1DM小鼠结肠内容物肠道菌群结构的影响
5组小鼠肠道菌群乳酸杆菌属、瘤胃杆菌科、拟杆菌门比例比较,差异有统计学意义(P>0.05);两两比较结果显示,模型组、PCE低剂量组、PCE高剂量组、二甲双胍组肠道菌群乳酸杆菌属、瘤胃杆菌科比例低于对照组,拟杆菌门比例高于对照组(P<0.05);PCE低剂量组、PCE高剂量组、二甲双胍组肠道菌群乳酸杆菌属、瘤胃杆菌科比例高于模型组,拟杆菌门比例低于模型组(P<0.05);PCE高剂量组、二甲双胍组肠道菌群乳酸杆菌属、瘤胃杆菌科比例高于PCE低剂量组,拟杆菌门比例低于PCE低剂量组(P<0.05);PCE高剂量组、二甲双胍组2组肠道菌群乳酸杆菌属、瘤胃杆菌科、拟杆菌门比例,差异无统计学意义(P>0.05)。见表5。

表5 PCE对T1DM小鼠结肠内容物肠道菌群结构的影响
4 讨论
目前认为T1DM是免疫代谢紊乱疾病,由于自身免疫系统紊乱、单核淋巴细胞浸润胰岛β细胞,导致β细胞凋亡、INS分泌严重不足、血糖升高,机体处于高糖水平,破坏正常生理环境,引发酮症酸中毒、急性感染等严重并发症[9]。但近年研究认为有未知因素触发T1DM,不良饮食是触发糖尿病的重要因素[10],而肠道菌群或许是触发桥梁[11],以此为突破点,或可探寻治疗新契机。
T1DM治疗需注重延缓胰腺组织损伤程度,控制血糖、INS等水平,目前使用药物虽可有效降低血糖水平,但不容忽视其副作用。
而近年中药学快速发展,临床发现多种中药有效成分可控制糖尿病病情,如青稞多糖[12]和茯苓、丹参[13]等,且来源广泛,安全性高。其中茯苓作为药食同源药材,药性补而不峻、利而不猛,其提取物包含三萜、多糖及脂肪酸类成分,目前已研究证明[14-15],茯苓具有抗糖尿病、抗氧化及抗炎等活性。本研究构建T1DM小鼠模型后予以不同干预方式,结果显示,PCE低剂量组、PCE高剂量组FPG和血清GC水平有不同程度降低,血清INS水平有所升高,提示PCE能提高INS分泌,减少GC质量浓度,相应改善机体高血糖状态;且本研究发现,PCE高剂量组小鼠上述指标改善程度优于低剂量组,并与二甲双胍组无明显差异,说明PCE具有剂量依赖性,高剂量PCE能达到与二甲双胍相当的血糖调节效果;本研究进一步通过HE染色结果证实PCE可减轻小鼠胰腺组织损伤程度,综合上述结果分析,PCE中茯苓多糖能促进HepG2细胞葡萄糖消耗,发挥降血糖效果,且三萜类化合物茯苓酸可诱导胰岛素样生长因子1信号转导,延缓小鼠细胞衰老,激发胰岛细胞分泌胰岛素,发挥降血糖效用。
通过文献调研发现,肠道菌群与T1DM关系密切,肠道菌群可代谢饮食难以消化的物质,代谢产物方可被机体吸收,若肠道菌群结构失衡,可影响肠道稳态[16-18];而肠道组织相对于其他器官,具有高密度免疫细胞,而T1DM机体中Treg细胞可调节炎症反应,延缓T1DM进展,主要依赖IL-10抗炎,Th17细胞及其分泌的IL-17促炎[19-20],调节免疫炎症与肠道微生物平衡,二者可共同构建肠道屏障,控制T1DM疾病进展。本研究统计与分析免疫炎症与肠道菌群指标发现,建模后Treg细胞比例、结肠组织IL-10与肠道菌群乳酸杆菌属、瘤胃杆菌科比例降低,Th17细胞比例、结肠组织IL-17与拟杆菌门比例升高,小鼠肠道菌群结构失衡,免疫炎症紊乱,而相应干预后,PCE低剂量组、PCE高剂量组及二甲双胍组上述指标均有所改善,且相较于PCE低剂量组,PCE高剂量组小鼠肠道菌群结构恢复及免疫炎症调节水平较佳,可达到与二甲双胍相似的效果,表明高剂量PCE治疗T1DM小鼠,能通过调节肠道菌群结构增加有益菌数量,修复肠道稳态平衡,利于肠道免疫细胞功能恢复,以增强免疫调节,抑制肠道炎症发展,从而缓解病情进展。
综上,PCE可减轻T1DM小鼠胰腺组织损伤、诱导INS释放和降低血糖水平,可能与PCE调节肠道菌群结构和改善免疫炎症状态有关,以此来控制病情进展,降低血糖水平,为临床药物研制提供实验依据。

