呼伦湖浮游植物群落季节动态及其与环境因子的关系*
钱玺亦,李金彪,敖 文,庞 博,包萨茹,王 琪,刘 波,王增龙**
(1:南通大学地理科学学院,南通 226001) (2:内蒙古自治区呼伦贝尔市北方寒冷干旱地区内陆湖泊研究院,呼伦贝尔 021000) (3:国家环境保护呼伦湖湿地生态环境科学观测研究站,呼伦贝尔 021000)
湖泊是重要的地表水资源之一,是地球表层系统各个圈层相互作用的联结点[1]. 富营养化是指水体中大量氮、磷等营养物质富集,使得藻类等水生生物异常增殖,最终导致湖泊水质恶化,抑制和破坏水生态系统和自净能力的现象. 富营养化在一定程度上增加了水体中有机质的含量,甚至造成蓝藻水华[2]. 呼伦湖又称达赉湖,位于呼伦贝尔草原西部,是我国北方第一大湖泊,也是我国第五大湖泊[3],是“一湖两海”政策综合治理专项工作的主要实施地点和推动地区,在调节气候、涵养水源、防止荒漠化以及维系呼伦贝尔草原生态平衡,乃至我国北方生态安全等方面发挥着不可替代的作用[4]. 近年来,由于受到气候变化和人类活动的影响,呼伦湖流域生态环境不断恶化[5]. 通过对呼伦湖进行实地调查后发现,呼伦湖呈现出不同程度的富营养化情况.
浮游植物作为水生生态系统的初级生产者,其群落组成和分布对水环境变化具有一定的指示作用,同时又受水环境变化的影响[6-7]. 影响浮游植物群落结构变化的因子众多,包括非生物因素(如pH、光照、水温、营养元素等)和生物因素(如食植动物和浮游动物的捕食等)[8]. 例如,光照通过影响光合作用、温度通过影响酶的活性进而影响浮游植物的生长与繁殖[9],Redfield[10]曾发现当水体中氮(N)∶磷(P)小于或超过某一特定数值时,N、P都有可能成为影响浮游植物生长的限制因素. 由于浮游植物对水环境变化具有指示作用,因此其群落变化能够准确地反映水质特征及其变化趋势[11]. 已有研究发现,湖泊等淡水生态系统在衰退和修复过程中存在着不同的演变路径[12],水体中的浮游植物与各环境因子之间有着密切的相关关系,研究浮游植物对富营养化程度响应情况具有重要的理论与实践意义[13].
目前,对浮游植物群落结构的研究大多集中于我国南方湖泊,而我国北方地区纬度高、寒冷干燥、季节温差大、全年降水量少,有关此类环境条件下的北方干旱区内陆湖泊浮游植物群落季节变化的研究还较为缺乏. 呼伦湖最早在1980s进行过系统的渔业资源调查[14],但对于浮游植物研究开展时间较晚且研究相对较少. 自2010年实施“引河济湖”工程后,呼伦湖水体循环结构改变,多年以来周边居民生活污水、工业废水、畜牧业污染结构和管控机制也发生较大的变化[15]. 呼伦湖目前处于修复期,通过对浮游植物进行监测研究可以实时跟踪呼伦湖水质变化动态,也可作为实时监测该地区蓝藻水华情况和富营养化程度的一种手段. 根据以往的调查研究,王俊等[16-17]研究了呼伦湖浮游植物群落组成结构,探讨了呼伦湖水质和生物资源量的变化趋势:盐碱化程度相对较高,富营养化比较严重,生物资源量总体有所下降;李星醇等[18-20]探讨了呼伦湖单个季节及冰封期浮游植物群落结构与环境因子的关系,证实了呼伦湖浮游植物与溶解氧(DO)、pH等部分环境因子之间存在着密切的相关关系,但目前有关呼伦湖全年浮游植物群落结构和水环境因子之间响应的研究明显缺乏,同时研究手段和方法也有较大的进步空间. 本文采用湖泊生态调查方法,研究呼伦湖浮游植物的种类、细胞密度、生物量以及水质理化指标的季节变化特征,旨在摸清呼伦湖水域浮游植物群落结构的季节变化及其优势种特征,并运用冗余分析(redundancy analysis,RDA)探究影响呼伦湖浮游植物群落变化的主要环境因子,从而进一步探讨蓝藻水华的机制,以期为呼伦湖富营养化防治提供科学支持,为呼伦湖的生态环境保护和治理工作提供新的数据支撑,进而为我国北方寒冷干旱区内陆湖泊生态学研究积累基础资料.
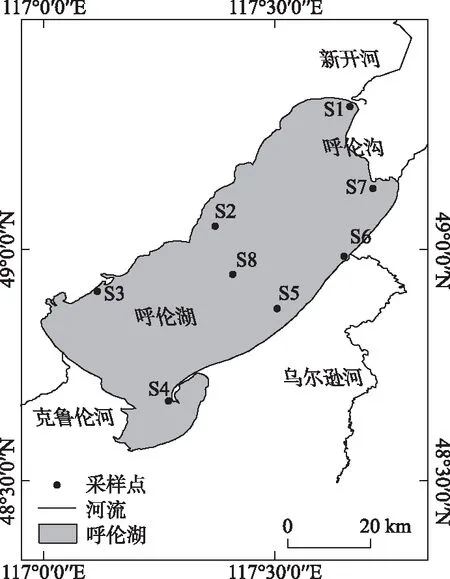
图1 呼伦湖采样点设置Fig.1 Sampling sites in Lake Hulun
1 材料与方法
1.1 研究区域与样点设置
呼伦湖(48°33′~49°20′N,116°58′~117°48′E),位于内蒙古呼伦贝尔市新巴尔虎左旗、新巴尔虎右旗和满洲里市之间,属于呼伦贝尔高平原的一部分. 湖泊面积约为2339 km2. 呼伦湖流域属于中温带半干旱草原气候,春季干旱风大,夏季温凉短促,秋季降温急剧霜冻早,冬季寒冷漫长[21-22]. 本研究在呼伦湖共布设了8个采样点(图1),涵盖了新开河入湖口(S1)、五一队(S2)、拴马桩(S3)、乌嘟噜(S4)、扎布哈朗图乌拉(S5)、乌尔逊河入湖口(S6)、海拉尔河入湖口(S7)和湖心(S8).
1.2 样品采集和分析
依据候温划分法,分别于5、6月(春季)、7、8月(夏季)、9、10月(秋季)和3月(冬季)对呼伦湖浮游植物和水样进行采集.
浮游植物样品采集:在各采样点处分别采集1个定性样品和1个定量样品. 定性样品用网孔直径为0.064 mm的25#浮游生物网在距水面0.5 m处按“∞”字形拖取3~5 min,采集的样品盛于采样瓶中并用5%甲醛固定. 定量样品根据水深不同分层采样,具体如下:当水深≦5 m时,取表层水样;当5 m<水深≦10 m时,分上、下2层采集水样;当水深>10 m时,在离水底0.5 m处分上、中、下3层采集水样. 采集后的1 L水样用Lugol’s碘液固定后带回实验室静置48 h,吸去上清液浓缩至30 mL,在Motic BA400光学显微镜下进行鉴定并计数. 浮游植物种类鉴定主要参照《水生生物学》[23]、《中国淡水藻类:系统、分类及生态》[24]和《淡水微型生物与底栖动物图谱》[25].
水温用温度计测定,pH、溶解氧(DO)用便携式的多参数测量仪(Multi 3630 IDS,德国WTW公司)测定,总磷(TP)、总氮(TN)、叶绿素a(Chl.a)、高锰酸盐指数(CODMn)、氟化物等理化指标参照《水和废水监测分析方法》[26]进行测定.
1.3 数据分析
1.3.1 数据处理方法 浮游植物在显微镜下按视野法计数,数量特别少时全片计数. 每个样品均计数2次取平均值,若计数结果与平均值之差大于15%,则取第3片进行计数并取3次计数的平均值. 每升水样中浮游植物的数量按照如下公式计算[23],并根据浮游植物的体积相关公式[23]换算为生物量(mg/L,湿度).
(1)
式中,N:1 L水样中浮游植物的个体数(cells);C:计数框的面积(mm2);Fs:每个视野的面积(mm2);Fn:视野数;V:每升水样浓缩后的体积(mL);U:计数框的体积(mL);P:每个计数框统计到的浮游植物个体数(cells).
1.3.2 优势度(Y)Y计算公式为:
(2)
式中,Y为优势度,N和ni分别为样品中所有物种个体总数和第i种个体数,fi是第i种的出现频率. 当Y>0.02 时,视为浮游植物优势种. 当fi>65%时,视为浮游植物常见种.
1.3.3 水质评价方法 Shannon-Wiener多样性指数(H′):
(3)
式中,S为种类数;Pi为第i种个体数与样品总个体数比值. Shannon-Wiener多样性指数0~1为严重污染,1~2为α-中污染,2~3为β-中污染,>3为轻污染或清洁[27].
Pielou均匀度J:
(4)
式中,S为种类总数. 其中J值越大,表示物种分布越均匀;J值0~0.3为重污染,0.3~0.5为中污染,0.5~0.8为轻污染或无污染[27].
综合营养状态指数是评价湖泊营养化的指标,根据综合营养状态指数计算值,对营养状态评价采用0~100的一系列连续数字进行分级,其中TLI(∑)<30为贫营养,30≤TLI(∑)≤50为中营养,50
TLI(Chl.a)=10(2.5+1.086 lnChl.a)
(5)
TLI(TP)=10(9.436+1.624 lnTP)
(6)
TLI(TN)=10(5.453+1.694 lnTN)
(7)
TLI(CODMn)=10(0.109+2.66 lnCODMn)
(8)
(9)
式中,TLI(∑)为综合营养状态指数;Wj为第j种参数的营养状态指数的相关权重;TLIj为第j种参数的营养状态指数;n为评价参数的个数. Chl.a单位为μg/L,其余指标单位均为mg/L. 以Chl.a作为基准参数,第j种参数归一化的相关权重计算公式如下:
(10)
式中,rij表示第j种参数与基准参数Chl.a的相关系数,本研究选取的环境参数为Chl.a、TP、TN和CODMn,相关系数参照表1.
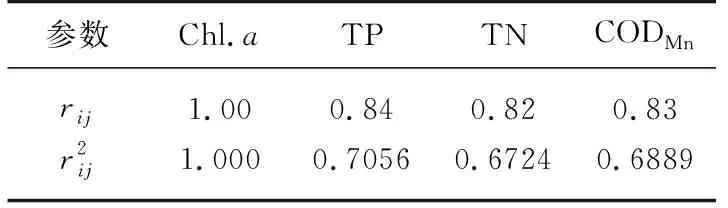
表1 中国湖泊(水库)部分参数与Chl.a的相关关系[29]
1.3.4 数据分析 对浮游植物环境因子数据进行正态分布和方差齐性检验,运用SPSS 19.0通过单因素方差分析比较不同季节环境因子的差异显著性. 采用浮游植物细胞密度数据,运用Canoco(V4.5)软件先进行除趋势对应分析(detrended correspondence analysis,DCA)(数据采用lg(x+1)方法进行量纲化处理). 计算结果发现SD值<2,经过蒙特卡洛置换检验后,再采用冗余分析(RDA)进一步探究浮游植物群落分布与环境因子的相关性.
2 结果与分析
2.1 呼伦湖水环境因子的季节变化
呼伦湖各季节水温变化差异显著(表2),从高到低依次为夏季、春季、秋季和冬季,夏季的水温约为春季的1.41倍、秋季的2.61倍、冬季的35.01倍;水体pH值在7.40~10.41之间,各个季节间差异不显著;DO浓度变化范围为4.42~29.30 mg/L,冬季DO显著高于春夏秋季,且在春夏秋季之间差异不显著;CODMn范围为1.50~16.80 mg/L,夏秋冬季水体中CODMn浓度显著高于春季,且夏秋冬季之间差异不显著;TP浓度范围为0.05~2.02 mg/L,春季水体中TP浓度最高,各个季节间差异不显著;TN浓度范围为0.24~3.05 mg/L,春季水体中TN浓度显著高于秋季,夏冬季之间无显著差异;氟化物浓度在0.13~3.39 mg/L之间,冬季水体中的浓度最高、秋季最低,各个季节间差异不显著;Chl.a季节变化范围为2.00~82.00 μg/L,夏季水体中的Chl.a显著高于春秋冬季,春秋冬季间差异不显著.
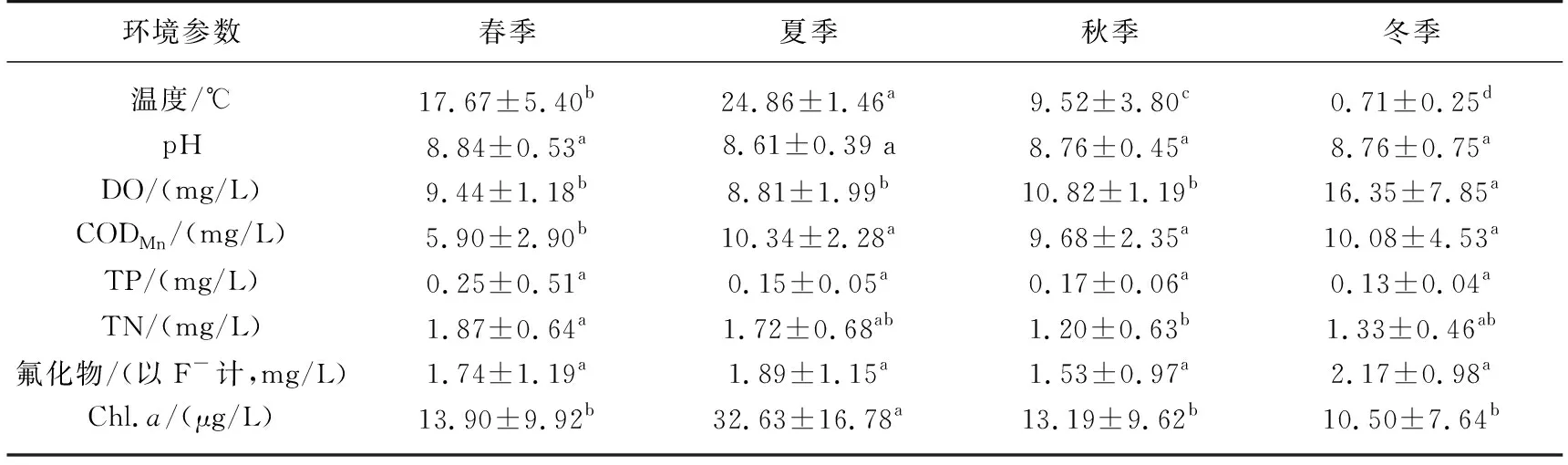
表2 呼伦湖水环境参数的季节变化(平均值±标准差)*
2.2 浮游植物群落季节变化特征
2.2.1 浮游植物的群落组成 综合四季调查的结果,共鉴定出浮游植物7门120种. 种类数最多的是绿藻门58种(48.3%),其次是硅藻门33种(27.5%)、蓝藻门15种(12.5%)、金藻门7种(5.8%),其它门类种类数较少:裸藻门4种(3.3%)、隐藻门2种(1.7%)、甲藻门1种(0.8%).
呼伦湖水体中浮游植物种类表现为夏季最多,冬季最少(图2a). 冬季浮游植物种类以硅藻门(8种)和绿藻门(7种)为主. 春季绿藻门和蓝藻门种类显著增加. 夏季以绿藻门(15种)和蓝藻门(6种)种类为主,硅藻门种类较少. 秋季呼伦湖浮游植物种类组成没有明显变化.
2.2.2 浮游植物的细胞密度和生物量 呼伦湖水体中浮游植物年平均细胞密度为226.62×104cells/L,春季(123.52×104cells/L)和冬季(16.41×104cells/L)浮游植物细胞密度比夏季(280.80×104cells/L)和秋季(380.63×104cells/L)低. 春季绿藻门细胞密度最高(64.7%)、蓝藻门次之(25.8%),夏秋季蓝藻门细胞密度最高(夏季:67.6%、秋季:84.9%)、绿藻门次之(夏季:28.4%、秋季:12.6%),冬季绿藻门细胞密度最高(66.8%)、硅藻门次之(19.7%),各季节隐藻门、裸藻门和甲藻门的细胞密度都相对较低(图2b). 从空间上来看(图3),呼伦湖四周点位浮游植物细胞密度较高,中部细胞密度较低.
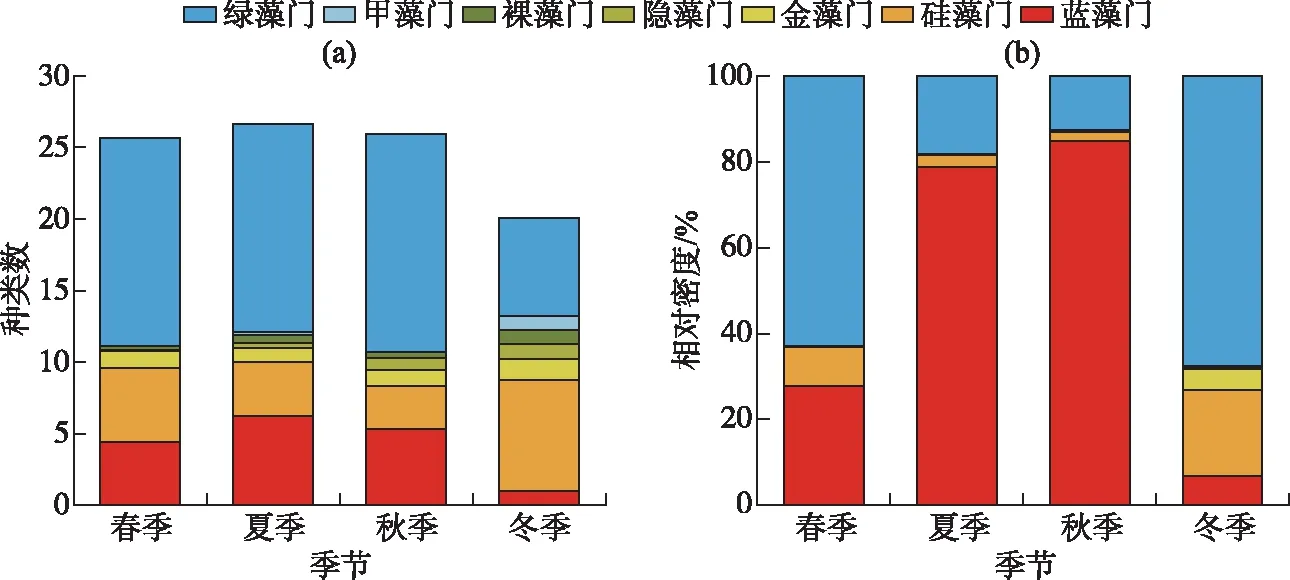
图2 呼伦湖浮游植物不同季节各门类种类数(a)和相对密度(b)Fig.2 Species(a) and relative density(b) of each phylum of phytoplankton in different seasons in Lake Hulun
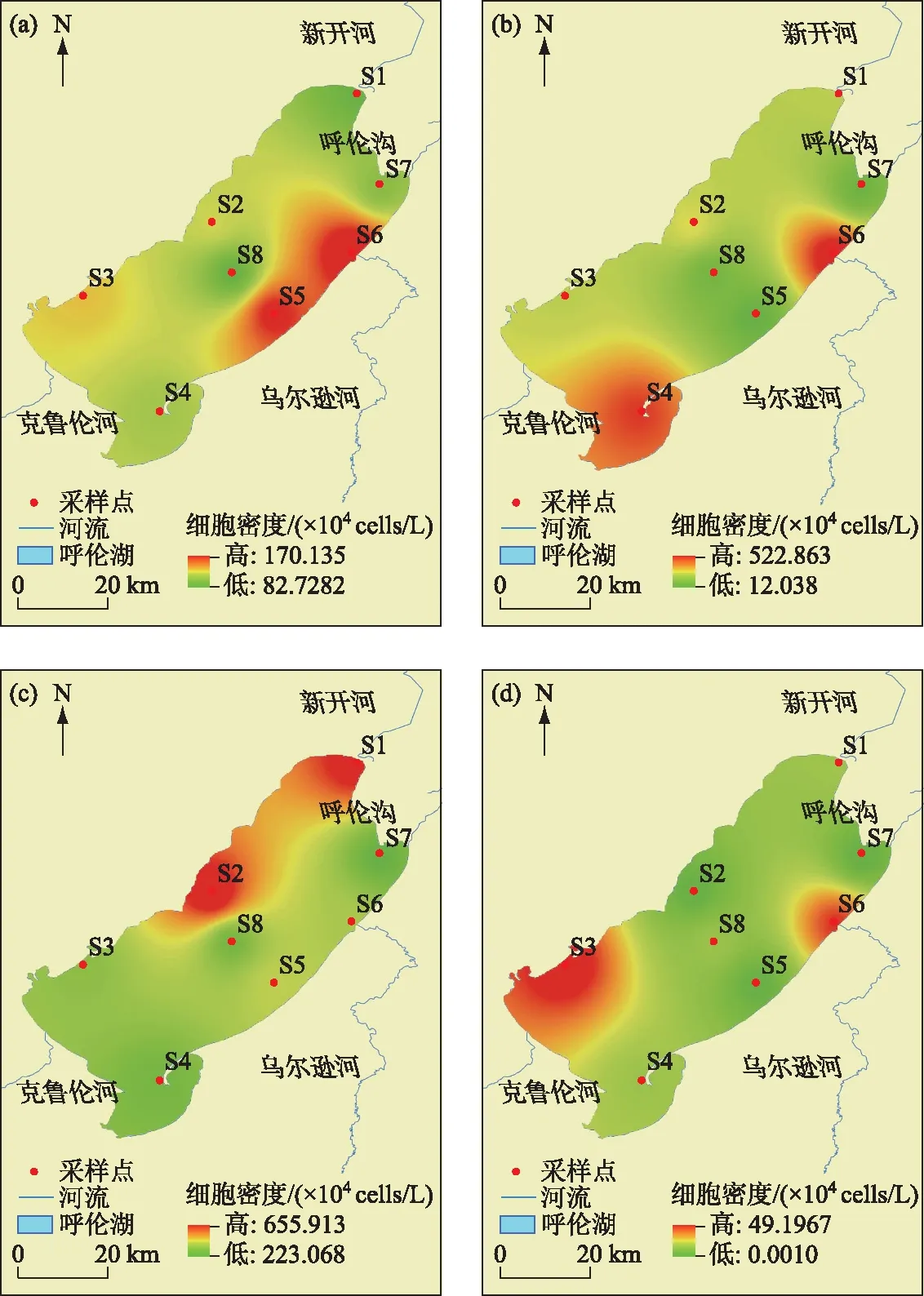
图3 呼伦湖浮游植物细胞密度的时空变化:(a)春季、(b)夏季、(c)秋季、(d)冬季Fig.3 Temporal and spatial variation of phytoplankton abundance in Lake Hulun:(a)Spring, (b) Summer, (c) Autumn, (d) Winter
浮游植物生物量在夏季最大(0.38 mg/L),其次是秋季(0.26 mg/L)和春季(0.24 mg/L),冬季(0.13 mg/L)最小. 春冬季绿藻门生物量最大(春季:68.0%,冬季:60.6%)、硅藻门次之(春季:25.9%,冬季:26.1%),而夏秋季绿藻门生物量最大(夏季:59.1%,秋季:59.7%)、蓝藻门次之(夏季:27.4%,秋季:19.5%),各季节隐藻门和裸藻门的生物量均较小(图4). 从整体上来看,浮游植物生物量呈现出绿藻门和硅藻门交替占主要优势地位的演替过程. 从空间上来看(图5),呼伦湖东南部浮游植物生物量较大,北部生物量较小,且东南部生物量有随气温升高呈逐渐增大的趋势.
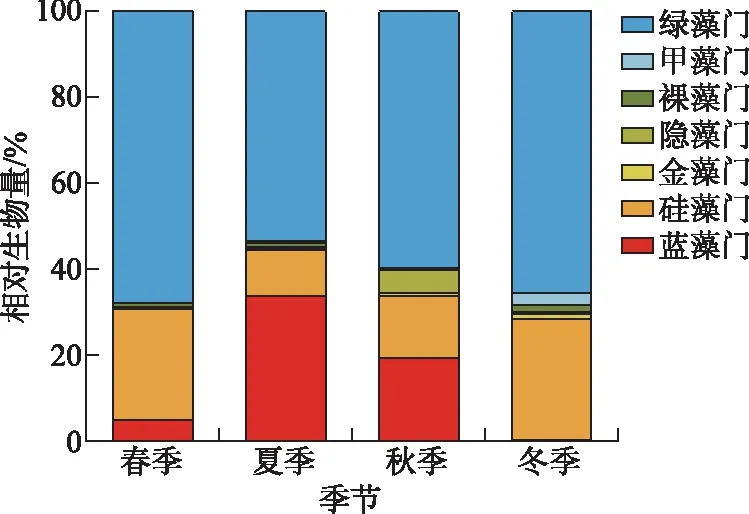
图4 呼伦湖浮游植物不同季节各门类相对生物量Fig.4 Relative biomass of phytoplankton of each phylum in different seasons in Lake Hulun
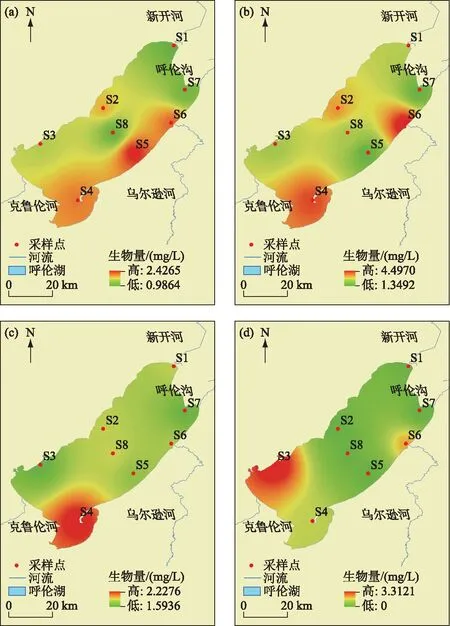
图5 呼伦湖浮游植物生物量的时空变化:(a)春季、(b)夏季、(c)秋季、(d)冬季Fig.5 Temporal and spatial variation of phytoplankton biomass in Lake Hulun: (a) Spring, (b) Summer, (c) Autumn and (d) Winter
2.2.3 浮游植物优势种 呼伦湖浮游植物优势种共有4门12种(表3),其中绿藻门4种,蓝藻门和硅藻门均为3种,金藻门2种. 在水温较低的春季,优势种以硅藻门、金藻门和绿藻门为主. 随着水温升高,到了夏季,优势种以硅藻、蓝藻门为主. 之后随着水温的逐渐降低,优势种又以蓝藻门、硅藻门和金藻门为主. 在这些优势种中,梅尼小环藻在调查的所有月份均有出现,其在春夏冬季优势度均较高,为主要优势种. 卷曲长孢藻在夏季出现,且优势度较高. 细小平裂藻在8月开始出现,在秋季开始成为主要优势种.
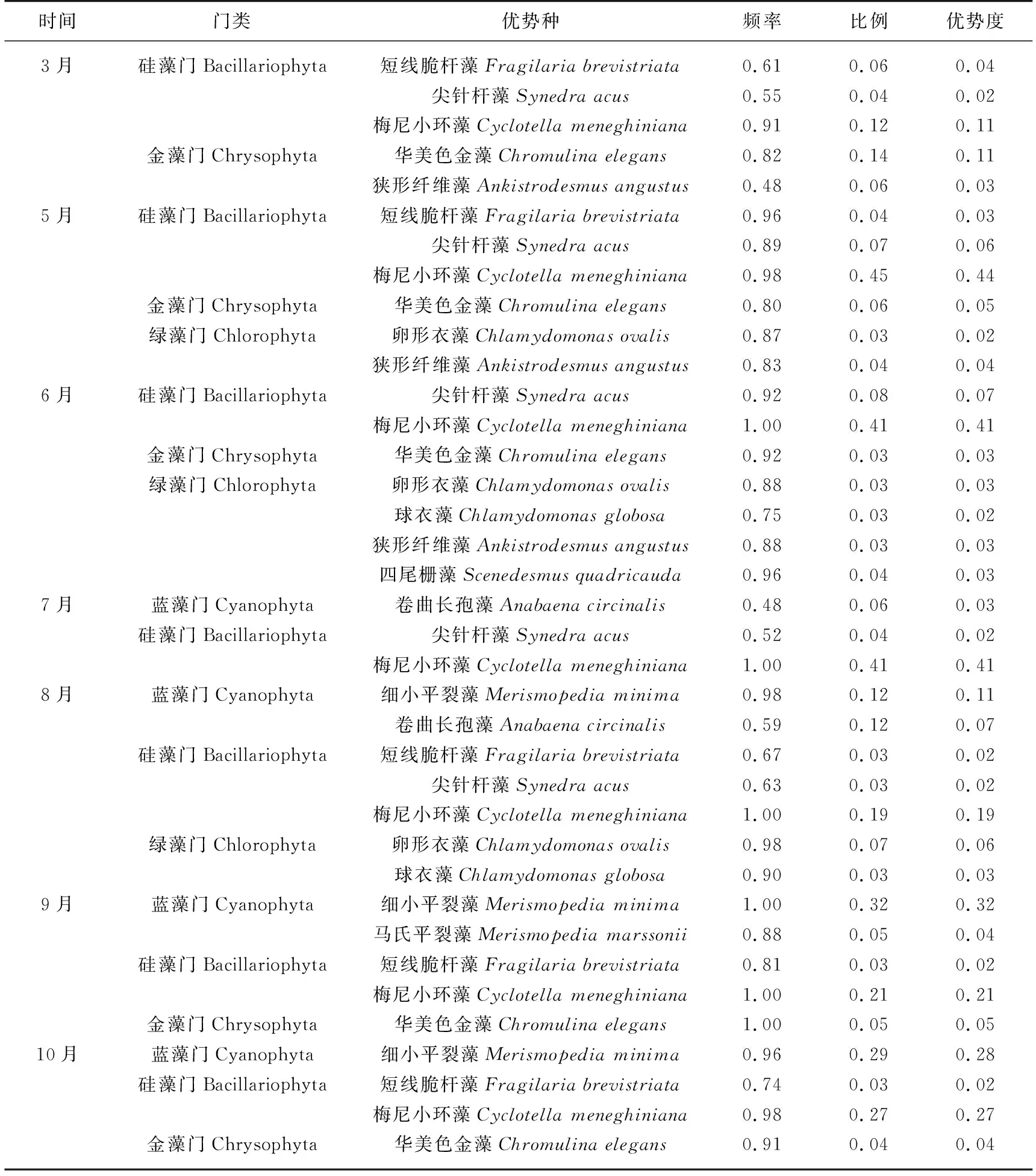
表3 呼伦湖2019年浮游植物各调查月份的优势种
2.2.4 浮游植物多样性指数 如表4所示,Shannon-Wiener多样性指数在0.96~4.48之间,表明总体上呼伦湖水质处于中污染状态. 浮游植物多样性在夏季最高,春季略低于夏季,冬季最低. 均匀度指数J在0.13~0.60之间,其变化趋势与Shannon-Wiener多样性指数相似.
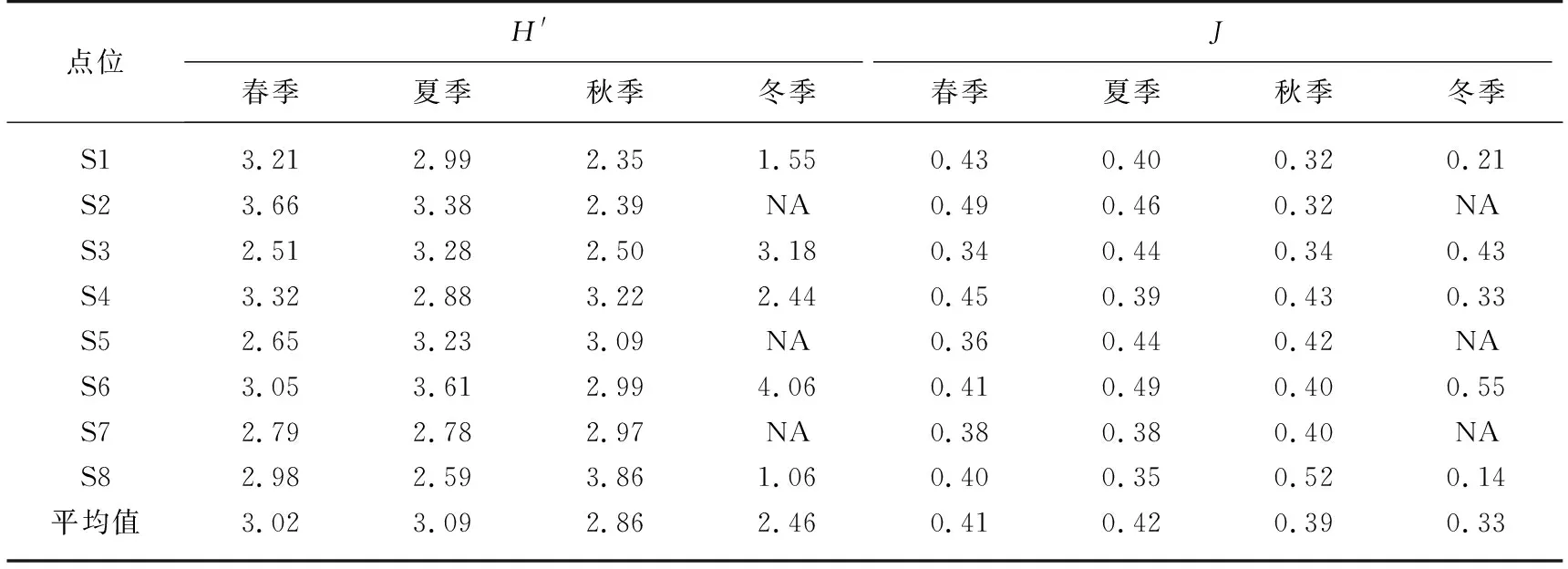
表4 呼伦湖浮游植物多样性的季节变化*
3 讨论
3.1 呼伦湖浮游植物群落组成
整体来看,呼伦湖浮游植物群落结构以绿藻-硅藻-蓝藻为主,这3门藻类数占全部种类数的88.3%,共同决定水体中物种丰富程度. 在群落组成上,浮游植物生物量和细胞密度夏季相对较高,冬季最低. 呼伦湖水域浮游动物种类主要为轮虫类、原生动物、枝角类和桡足类;其中,有些轮虫直接以藻类为食[30],原生动物、枝角类和桡足类也会对浮游植物生长起较强的限制性作用[31]. 由相同时期的对浮游动物调查结果来看[32],夏季浮游动物的生物量最大,但由于蓝绿藻的体积较大,难以被滤食性的浮游动物食用,另外蓝藻门的微囊藻可通过分泌毒素对浮游动物的摄食进行抵抗[33],因此,夏季蓝绿藻的生物量在所有门类里最大,且显著高于其他门类的生物量. 作为寒旱区湖泊,呼伦湖冰层厚、冰封期长,湖水冻融过程中污染物在冰和水两种介质中不断重新分配,具有流动性强的特点,冰封期时水温低于藻类的最适生长温度,浮游植物在冰盖下与外界环境形成隔离,湖水与大气之间的物质能量交换也被阻隔[20],因此冬季浮游植物的生物量和细胞密度低.
优势种在群落中起主导作用,对群落结构和群落环境的形成有明显的控制作用. 从优势种的物种组成来看,呼伦湖浮游植物优势种以绿藻门、硅藻门和蓝藻门为主. 呼伦湖优势种梅尼小环藻在调查的所有月份均有出现,而小环藻属于寡污和β-中污染水体的指示物种[34],侧面表明呼伦湖水域处于中污染状态,这与Shannon-Wiener多样性指数与Pielous均匀度指数所指示的结果一致. 卷曲长孢藻是水体富营养化的指示种之一[35],其在夏季出现,且优势度较高,这表明呼伦湖夏季的水质状况较差,富营养化程度较为严重. 金藻门的华美色金藻在冬季优势度高,这是由于金藻喜低温,在秋冬季节占优势.
通常情况下,水体的浮游植物Shannon-Wiener多样性指数越高,则代表其群落结构越复杂,稳定性越好,水质越好[28];反之,多样性指数越小,则代表水体中浮游植物群落结构越简单,受到的污染越严重,水质越差[28]. 呼伦湖浮游植物的多样性指数和均匀度指数随季节变化较为明显,年平均值分别为2.94和0.36,说明总体上呼伦湖水体处于中营养状态. 所有采样点TLI(∑)平均值为61.43,也可判断出呼伦湖水体处于中度富营养化状态.
3.2 呼伦湖浮游植物群落结构与环境因子的关系
环境因子影响着浮游植物的生长和分布,本研究综合呼伦湖各季节浮游植物细胞密度和水环境因子的RDA分析结果(图6)显示,WT、Chl.a、pH和营养盐浓度是影响呼伦湖浮游植物群落分布的主要环境因子,但是同一水体不同时期的影响因子不大相同.
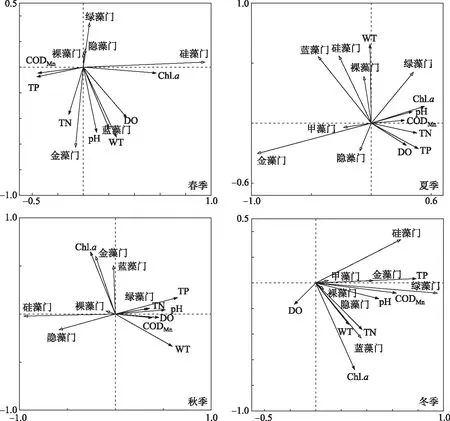
图6 不同季节呼伦湖浮游植物与环境因子关系的RDA排序图Fig.6 Redundancy analysis of the relationship between phytoplankton and environmental factorsin the Lake Hulun in different seasons
WT是影响浮游植物生长的重要指标,其通过调控藻类的同化过程、细胞内酶的活性和代谢速率直接或间接地影响浮游植物的群落结构[36-37],是影响浮游植物季节演替的一个重要因素. 一般来说,蓝藻门和裸藻门适宜在温度较高的水域中生长,硅藻门耐弱光能力强且喜低温[38],而绿藻门适宜生活在水温中等的水域中[39]. 呼伦湖各月份温差显著(P<0.05),浮游植物种类的季节变化符合这一规律,在温度较低的春季和秋季,浮游植物种类以耐低温的绿藻门和硅藻门为主,温度较高的夏季则主要以蓝藻门为主. RDA分析图显示,WT在春夏秋季均为主要影响因子,呼伦湖浮游植物细胞密度变化主要取决于温度梯度的驱动作用. 通常认为当水温大于20℃时,蓝藻达到最快的增长速度,且当水温升高时,蓝藻表现出比其他群落更具有优势[40]. 呼伦湖夏季平均水温高于20℃,调查结果也表明呼伦湖夏季蓝藻门细胞密度与WT呈显著相关(r=0.826,P<0.05),优势种卷曲长孢藻和细小平裂藻在夏季出现并逐渐占据优势地位. 这是由于较高的水温会使地表水粘度下降,加速了较大固定物种的下沉,再加上它们调节浮力的能力,导致蓝藻在群落中占据主导地位[41]. RDA结果显示呼伦湖冬季WT对浮游植物的影响力相比于春夏秋季较小. 有研究表明冬季由于水温低于藻类的最适生长温度,因而水温对藻类生存的影响就不再明显[42].
水体营养盐浓度变化也会影响浮游植物生物群落. P是水生生物物质合成和能量传输的必要元素,其浓度变化会影响水生生物的代谢及群落的动态格局[43],N是浮游植物生长代谢所必需的大量元素之一[44]. 呼伦湖渔场渔业养殖发达,鱼虾养殖会将大量的营养盐和悬浮物质排入呼伦湖内[45],水生动物的排泄物和饲料均会增加湖中的N、P浓度[46]. 同时,湖泊周边地势平坦、草场辽阔,干草入湖量大,微生物分解后使得水体的N、P浓度升高. 另外,由于农田退水携带大量N、P等营养物质[47]进入呼伦湖,高浓度的TP、TN及其他营养物质为湖泊中藻类的繁殖提供了有利的条件[45]. 绿藻门在高磷水体中更具优势,本研究中呼伦湖TP浓度在春季最高,绿藻门细胞密度在春季达到最高值. RDA排序分析得出呼伦湖绿藻门细胞密度在夏秋冬季都与TP浓度呈正相关关系,在温度较低的冬季呼伦湖所有门种的细胞密度均与TP浓度呈正相关关系,可见TP浓度也是影响浮游植物细胞密度的一个重要影响因子. 总体上来看,呼伦湖硅藻门细胞密度与TN浓度呈正相关,与贺玉晓等[48]的研究结论一致,且本文研究发现硅藻中短线脆杆藻、尖针杆藻和梅尼小环藻的细胞密度随着TN浓度的升高而增加,这主要是由于硅藻门适宜高氮环境,其生长需要较多的氮素[49-50]. 呼伦湖春夏季TN浓度较高,硅藻门的种类数也相应较多这一现象也证实了这一点. 蓝藻门喜高磷低氮的生长环境[51],秋季呼伦湖水体N/P比为0.14,为四季中最高,蓝藻门细胞密度达到最高. 蓝藻门因其自身的固氮作用,能在水体中氮浓度较低时仍大量生长[52],本研究中隶属于蓝藻门的优势种细小平裂藻的细胞密度随着TN浓度的下降显现出逐渐增大的趋势,且优势度也逐渐增大. 但也有一些浮游植物群落本身不固定氮,只能依靠外部输入的氮来维持其产生[40],呼伦湖的高氮环境有助于其生长繁殖.
pH是水体理化性质的直接反映,浮游植物的生长繁殖对其所处环境的pH有不同的要求[53]. 浮游植物在碱性水体中具有较高的初级生产力,更有利于进行光合作用[54],通常认为水体pH>8.0时,对蓝藻生长具有促进作用[55]. 呼伦湖水体pH常年大于8.0,这正是蓝藻的细胞密度和生物量均较高的主要原因. pH也与一些硅藻门种类的生态分布密切相关[56],本研究发现呼伦湖硅藻门的细胞密度与pH呈显著相关(P<0.05),呼伦湖这种碱性水体为优势种群隶属于硅藻门的梅尼小环藻、短线脆杆藻、尖针杆藻提供了适宜的栖息环境. Chl.a浓度的变化可以反映出水中浮游植物生物量的变化[57],且与其他环境因子的联系较为密切. 郭子扬等[58]研究发现呼伦湖无论是冰封期还是非冰封期TN、TP均与Chl.a有较高的相关性,pH在非冰封期是受Chl.a影响的被动环境因子,本研究调查显示Chl.a在四季均为主要影响因子.
4 结论
1)呼伦湖共有浮游植物7门72属120种,以绿藻门、硅藻门和蓝藻门为主. 优势种主要为硅藻门的梅尼小环藻、蓝藻门的卷曲长孢藻和细小平裂藻.
2)呼伦湖水体中浮游植物生物量和细胞密度呈现出绿藻门和硅藻门交替占主要优势地位的演替过程. 蓝藻门在春夏秋季细胞密度均较高,夏季生物量较高. 从空间上来看,呼伦湖四周点位浮游植物细胞密度较高,中部细胞密度较低;东南部生物量较大,北部生物量较小.
3)Shannon-Wiener多样性指数、均匀度指数J和综合营养状态指数均说明呼伦湖水体处于中营养状态.
4)呼伦湖各季节浮游植物细胞密度和水环境因子的RDA分析结果显示,WT、Chl.a、pH和营养盐浓度是影响呼伦湖浮游植物群落分布的重要环境因子. 在后续研究中,需要加强对呼伦湖营养盐水平变化的关注,可以通过对浮游植物连续多年监测了解呼伦湖富营养化程度,侧面检验呼伦湖综合治理的成果.

