小鼠上下气道一致的变应性气道炎症动物模型的建立
张勇,张婷,王志颐,吴明海,季俊峰,陈仁杰, 陈伟
(1.南京医科大学第四附属医院 耳鼻咽喉头颈外科,江苏 南京 210031; 2.解放军东部战区总医院 耳鼻咽喉头颈外科,江苏 南京 210002; 3.南京医科大学第二附属医院 耳鼻咽喉头颈外科,江苏 南京 210003)
变应性鼻炎(allergic rhinitis,AR)和变应性哮喘(allergic asthma,AS)都是临床常见病,两种疾病分属耳鼻咽喉科和呼吸科,两者发病机制及病理生理具有极大相似性,且两种疾病中任何一种的控制对另一种疾病均有正性作用,因此现在很多基础研究及临床治疗均将两者视作一个整体,也就有了变应性气管炎症(allergic airway inflammation,AAI)的概念[1]。理想的AAI模型是制备动物的单一模型能够产生我们需要的所有反应。目前国内外建立AAI动物模型的种类繁多,方法各异,剂量悬殊,给研究者带来不必要的麻烦。小鼠的基因组背景纯净,品系丰富,生物学试剂及抗体完备且性价比高,药物干预试验因小鼠重量轻可减少药物用量从而节省经费,且可复制出经典的AR、AS模型的气管慢性炎症、气管高反应性、黏液分泌增多等表现[2]。小鼠具有体积小,操作及取材较困难,造模需要多次致敏和激发等缺点,但目前仍为AR、AS研究最为常用的动物模型[3],为此我们以小鼠为实验动物建立AAI模型。
1 材料和方法
1.1 实验动物和致敏试剂
6~8周龄SPF级雌性Balb/c小鼠16只,体重16.4~23.3 g,购自南京医科大学实验动物中心,并由其代为饲养。在环境室温(22±2)℃饲养,同时避免变应原存在,早晚12 h间断照明。实验前,动物在标准环境下饲养1周。实验过程中,动物自由进水、饮食。卵白蛋白(ovalbumin,OVA,美国 Sigma公司,V级)及氢氧化铝凝胶[Al(OH)3,美国Sigma公司,13 mg/mL]。
1.2 仪器和材料
超声雾化吸入器(德国PARI BOY N公司产品)、离心机(德国eppendorf centrifuge 5417R)、秒表、显微镜(日本奥林巴斯公司)、数码相机、酶标仪(美国BIO-RAD 680型)。
1.3 变应性气管炎症动物模型制备
将16只小鼠随机分为模型组(A组)和空白对照组(B组),每组各8只。在参考国内外造模方法及前期预实验基础上,我们摸索出造模方法如下:A组将40 μg OVA+200 mg Al(OH)3+200 μL PBS溶液,分别于第1、3、5、7、9、11、13天早晨08:00腹腔注射,共7次,其后观察1周,从第20天起以10 μL OVA(1 mg/mL)滴鼻激发,每周3次,连续3周,最后1次滴鼻激发后24 h以2%OVA 5 mL雾化吸入激发,连续5 d。对照组以0.9%生理盐水代替OVA。整个造模周期为42 d(图1),建模期间小鼠置于标准环境下饲养,每天观察动物的饮食、精神状况及鼻、肺部症状和体征。
1.4 模型的检测和确认
1.4.1 症状学观察 末次激发后,用数码相机记录10 min,分析其症状并叠加法计分,总分大于5分即为造模成功。AR症状积分主要观察小鼠鼻痒、喷嚏、流涕3个方面(表1)[4]。AS积分:出现明显呼吸急促、咳嗽、腹肌收缩、口唇发绀等说明肺部哮喘症状出现。根据轻重缓急分为4级[5]:1级为无反应;2级为呼吸困难;3级为咳嗽;4级为休克死亡。

图1 小鼠AAI模型制作流程图

表1 小鼠鼻部症状评分表
1.4.2 体液检查 各组动物均在最后1次激发后24 h,腹腔注射过量1%水合氯醛麻醉。将小鼠取头低脚高位30度,切开气管,插入静脉留置针套管并向头端抵至鼻咽部(图2),取1 mL 4 ℃ PBS液行鼻腔灌洗,反复3次,在鼻部下方收集灌洗液。鼻灌洗液收集毕,左心室取血约0.7 mL并静置于0 ℃环境(图3)。取血毕,将小鼠放平,结扎右肺行病理检查,取1 mL PBS液经气管向左肺灌洗,灌洗液每次置留3 min,反复3次(图4)。将血液、鼻、肺灌洗液在4 ℃恒温离心机2 000 rpm的条件下离心10 min,取上清液置于-70 ℃环境中待检。
1.4.3 OVA特异性IgE的检测 采用小鼠OVA specific IgE ELISA 试剂盒(Catalog No.E-EL-M0869c,Elabscience)测定,其检测OVA sIgE的灵敏度为0.94 ng/mL,检测浓度下限为1.56 ng/mL,上限为100 ng /mL。实验严格按照产品说明书操作程序进行。
1.4.4 组织病理学检查 将小鼠鼻及鼻窦组织整体及右肺取下用4%中性甲醛固定24 h,鼻组织置于中性EDTA脱钙约35~45 d,然后用梯度乙醇脱水、二甲苯透明、石蜡包埋。3 μm连续切片(轴平面),行苏木素-伊红(hematoxylin-eosin,HE)及阿辛兰-过碘酸-希夫(alcian blue-periodic acid-Schiff,AB-PAS)染色。每只实验小鼠光学显微镜下观察(每张切片随机观察5个视野,取平均值)行组织病理学分析,记录单位视野下嗜酸性粒细胞(eosinphil,EOS)数目及1 000 μm长黏膜的杯状细胞数。另外,根据在光镜下观察到的病理征象,记录黏膜纤毛缺失程度,将上皮细胞状态分4级:0级为纤毛上皮无损伤,纤毛完整;1级为纤毛缺失,无上皮细胞剥脱;2级为上皮细胞剥脱但未至基底膜;3级为上皮细胞全部剥脱,基底膜暴露。
1.5 统计学分析

2 结果
2.1 一般情况及肉眼观察
本实验过程中小鼠基本能够耐受本实验方案所给予的OVA剂量。第1次激发后,部分小鼠即出现抓鼻、流涕、喷嚏等症状,随着激发次数的增加,出现呼吸急促、全身瘙痒等症状,激发停止后,症状逐渐缓解。整个实验过程未出现死亡现象。采集标本时鼻、肺组织标本肉眼观察两组间无差异。
2.2 症状学观察
鼻、肺部症状按照评分标准,A组8只小鼠在激发后10 min内鼻部症状积分全部都满足AR标准,均值为(7.88±0.84)分,与对照组(1.01±0.76)分比较,差异具有统计学意义(t=17.27,P<0.01)。肺部症状方面:A组8只全部出现明显呼吸急促、咳嗽、腹肌收缩症状,有2只出现口唇发绀,症状更为明显,与对照组比较有统计学差异(P<0.01)。见表2。

表2 两组小鼠在OVA末次激发后的肺部症状表现 (只)

图2 鼻灌洗液采集示意图 图3 左心室取血示意图 图4 左肺灌洗示意图
2.3 体液检查
A组鼻、肺灌洗液及血清中OVA sIgE的浓度分别为(55.24±7.12) ng/mL、(36.73±4.88)ng/mL、(81.19±5.27)ng/mL,B组分别为(4.61±1.97)ng/mL、(1.73±0.77)ng/mL、(4.14±2.17)ng/mL,两组比较差异具有统计学意义(P<0.01)。见表3。

表3 两组小鼠体液OVA sIgE浓度比较
2.4 组织病理学检查
A组鼻和肺上皮层黏膜纤毛损伤(1级和2级)百分比明显高于B组(表4、5,P<0.01)。但鼻、肺部损伤三级所占比例两组间并没有显著性差异(P>0.05)。
鼻、肺黏膜EOS浸润程度及1 000 μm长杯状细胞计数详见表6,A组鼻、肺EOS及杯状细胞计数均较B组有显著差异(P<0.01)。鼻部整体冠状切面见图5,可见到靠近鼻底部的犁鼻器、鼻中隔软骨、嗅裂、上下鼻甲(小鼠只有上下鼻甲,而不存在中鼻甲及最上鼻甲[6])。A组可见鼻腔,黏膜部分破裂、纤毛结构紊乱,黏膜下组织间质水肿,小血管扩张,血管内及黏膜下组织间隙大量EOS浸润,且大多集中在鼻中隔的下1/2、鼻腔侧壁及鼻底部;嗅区及鼻底部犁鼻器见大量复层鳞状上皮附着,但均未见EOS浸润;黏膜下基底层未见明显增厚。A组肺组织部分实变,黏膜纤毛部分中断、破坏,可见血管旁及较大气道黏膜下EOS浸润,且较鼻部略严重(P<0.05)。B组鼻、肺黏膜纤毛完整,未见炎细胞浸润,黏膜下层仅偶见少量EOS及其他炎症细胞。A组鼻、肺黏膜均见杯状细胞扩大、大量增生,而B组未见相似改变。见图6~9。A组鼻、肺EOS数目呈显著正相关(r=0.775,P<0.01),见图10;A组鼻、肺黏膜杯状细胞数也呈正相关(r=0.723,P<0.05),见图11。B组鼻、肺部EOS及杯状细胞均无明显相关性(P>0.05)。
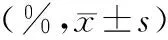
表4 两组小鼠鼻黏膜上皮细胞损伤情况比较
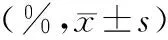
表5 两组小鼠肺黏膜上皮细胞损伤情况比较

表6 两组小鼠鼻、肺嗜酸性粒细胞及杯状细胞计数比较 (个,

图5 小鼠鼻冠状切面图 5a:HE ×40; 5b:PAS×40 图6 鼻腔黏膜病理改变 (HE ×400) 6a:A组; 6b:B组 图7 肺黏膜病理改变 (HE ×400) 7a:A组; 7b:B组 图8 鼻腔黏膜病理改变 (PAS ×400) 8a:A组; 8b:B组 图9 肺黏膜病理改变 (PAS ×400) 9a:A组; 9b:B组

图10 A组鼻肺部EOS呈正相关 (r=0.775,P<0.01)

图11 A组鼻肺部杯状细胞呈正相关 (r=0.723,P<0.05)
3 讨论
AR、AS造模途径多种多样,AR模型经典的有变应原腹腔注射基础致敏,滴鼻激发出鼻部症状[7];AS经典的造模方法为变应原腹腔注射或皮下注射作基础致敏,雾化吸入激发出相应的症状[8]。本文综合两种造模方法,并结合AAI的概念,选择腹腔注射基础致敏,滴鼻、雾化吸入激发的造模方法。
国内外很多文献报道:设想从变应原及致敏方法两个角度均模仿人类临床上可能的发病机制:如Nabe等[9]利用人类常见的变应原日本花粉作为基础致敏及激发物质,通过单纯经鼻给药建立AR模型,但该模型的制作时间长达33周。另外花粉种类繁多,不便于研究者之间的交流;而单纯滴鼻致敏、激发可以引起肺内轻微的EOS浸润和气道高反应性,不过这一进程的演变比腹腔注射致敏的方法要慢很多[10]。此外,经鼻给药绝大部分变应原仍停留于上气道,如花粉等大分子物质仅0.001%到达下气道,雾化吸入OVA仅12.2%分布于鼻外其他器官[11],如肺部5.6%,胃2.8%,滴鼻分布于下气道的则更少,因此本文选择OVA作腹腔注射作基础致敏较为合适,滴鼻、雾化吸入续贯激发,保证鼻、肺均能获得变应原的激发,从本实验的结果分析看,该模型可以制造出临床所需的症状,同时免疫学、病理分析均证实了上下气道的改变。现分别从症状、免疫及病理学3个角度对该模型行进一步论述。
理想的AAI模型需要具备4个条件:速发相、迟发相、AHR及炎细胞浸润[8]。速发相在激发后立即发生,并持续到2 h左右,3~10 h是迟发相,迟发相与AHR是伴随关系。本实验模型组激发前症状跟对照组肉眼观察无明显区别,而激发后很快出现典型的症状,如喷嚏、抓鼻、流涕、呼吸急促、咳嗽等,而对照组激发后无明显改变,说明基础致敏已经引起了气道的慢性炎症,激发后能够快速出现典型症状说明该实验方案能够实现小鼠从气道高反应性、气道梗阻到症状期的转变。
AAI级联反应最常见的起始步骤是变应原通过sIgE分子与肥大细胞、嗜碱性粒细胞相连,刺激其释放相关介质如组胺、白三烯和血小板激活因子(PAF)等[12]。速发相的症状主要取决于靶器官的结构如鼻部鼻痒、流涕及鼻塞,肺部的支气管收缩及喘鸣。迟发相通过聚集在气道黏膜表面的EOS、巨噬细胞释放炎症前细胞因子,包括Th2型细胞因子GM-CSF、TNF-α、IL-4、IL-5和IL-13等,引起组织局部B细胞释放IgE,其中IL-5等因子又是强烈的EOS趋化因子,对EOS的增殖、分化、迁移、激活及生存有重要的作用,而IL-4、IL-13可使呼吸道无分泌能力的上皮细胞转变为具有黏液分泌功能的杯状细胞[13],这样便形成了炎症的级联反应和恶性循环,目前实验阶段已有抗IL-5单克隆抗体(TRFK5),其抑制黏膜EOS浸润的能力高达86%[14]。本实验鼻、肺、血中OVA sIgE的浓度均较对照组明显升高。AR与AS患者的症状通常与循环血液中IgE的水平呈正相关[15],且血液中总IgE水平的升高对于非变应性个体同样是一个危险因素[16]。本造模方法能够产生OVA sIgE,且鼻、肺灌洗液及血清中的浓度均较对照组明显升高,说明该模型便于进一步研究,可用OVA sIgE作为炎症指标,监测炎症状态,观测干预的效果。
黏膜上皮破坏已经被证实是AHR的主要原因[17]。EOS趋化至IgE介导的黏膜炎症部位并活化是变应性炎症的显著特点,其浸润程度与炎症的严重程度呈正相关[8]。本实验显示该模型鼻、肺部EOS浸润同样严重,说明该造模方法能够引起上、下气道的病理改变,其中鼻部改变更明显一些,这进一步强化了鼻在AAI中的重要性。另外,上下气道黏膜EOS浸润程度具有显著相关性,究其原因可能存在如下联系:①全身因素[18]:变应原激发后促使肥大细胞及嗜碱性粒细胞脱颗粒释放炎症介质,直接作用于鼻、肺黏膜引起相应症状(速发相);促使EOS裂解或脱颗粒引起气道慢性炎症(迟发相);②组织结构因素:上下气道在黏膜结构、形态、分布、组织间的连接、黏膜下淋巴结构等方面具有很大的相似性;③解剖因素:上气道是接受变应原刺激的第一部位,变应原能沿气管及气管树分布;④神经因素[19]:上下气道的神经联系,如鼻-肺反射,通过释放相关神经肽影响下气道。黏液增多是AAI的另一重要特点。气道的黏液主要来自黏膜上皮层内的杯状细胞和黏膜下的黏液腺体,在维持呼吸道的正常生理功能方面发挥重要作用。黏膜上皮杯状细胞,多分布于鼻甲,肺部则主要分布于较大支气管。杯状细胞增生或化生可以看作是长期的气道炎症反应所致的黏膜形态学的改变,也可以看作是组织重塑的一个显著变化[20]。Glück 等[21]报道AR患者鼻黏膜刮片中,花粉季杯状细胞明显增加。同样哮喘患者支气管上皮细胞行定量研究发现,哮喘组杯状细胞的数量是正常组的2.5倍,其所含的黏液量是正常组的3倍。本实验显示鼻、肺黏膜上皮杯状细胞的数量约为对照组的6~10倍,证实该模型可引起鼻、肺黏膜上皮杯状细胞明显的增生、肥大或化生。
该造模方法无论从症状学观察、免疫学检测,还是病理学检查的角度,均符合AAI模型的要求,尽管这些实验性协议并不能在人体模仿,但是能够同时产生上、下气道局部及全身炎症和免疫反应,为进一步研究AAI奠定了坚实的基础。进一步完善该模型,通过改变吸入变应原的种类、致敏或激发时间、小气道阻力检测等方面,使其更接近人类AAI疾病,是我们今后努力的方向。

