蠲痹颗粒醇提物调控MAPK信号转导抑制T细胞活化效应机制的研究*
邹楠婷,吴 招,顾茜兰,应 赛,杨海浩,祁 燕,李小丝,彭江云,万春平
(云南中医药大学,云南 昆明 650500)
蠲痹颗粒是由云南省当代扶阳学派杰出代表、著名中医学家吴生元教授研制的抗类风湿关节炎的经验药方[1],1995年获院内制剂批件(滇ZJGF/1995-25),2008年获再注册批件(滇药制字〈Z〉20082554A),2012年8月获国家发明专利(专利号:201010185717.X)。处方由附片、川芎、桂枝、五加皮等药味配伍而成,具有温阳通络、祛风除湿、散寒、消肿止痛的功效,主治风寒湿痹证。
前期临床观察和实验研究证实:蠲痹颗粒对活动期类风湿关节炎有显著临床疗效,能减轻病人的临床症状,下调C-反应蛋白(CRP)和血沉(ESR)等有关治疗指标。此外,蠲痹颗粒对大鼠佐剂性关节炎(AA)和小鼠胶原关节炎(CIA)有显著的抗炎和镇痛作用[2-4],提示蠲痹颗粒防治类风湿关节炎与其抑制T细胞介导的免疫反应密切相关。但该药的确切免疫调节机制尚未明确,因此有必要进一步研究其治疗类风湿关节炎的免疫学机制。
最新研究显示[5-7],丝裂原活化蛋白激酶(mitogen-activated protein kinase,MAPK)信号通路与RA时T淋巴细胞激活和细胞因子分泌具有密切联系,已成为RA药物治疗的重要作用靶点。该通路主要由ERK、p38和JNK激酶组成的。本研究通过建立体外细胞分化模型,探讨蠲痹颗粒醇提物(JBKL)对T、B淋巴细胞体外增殖的影响,及其调控MAPK信号转导干预T细胞活化效应机制的研究,为扶阳法治疗风寒湿痹证类风湿关节炎提供理论依据和科学基础。
1 材料与方法
1.1 材料 BALB/c小鼠,雌性,78周龄,体质量(18±1)g,购自斯贝福(北京)生物技术有限公司,合格证号:SCXK(京)2019-0010;实验动物在 SPF级动物房饲养1周后使用。环境温度湿度分别为(22±1)℃和(55±5)%,12 h昼夜循环。动物自主摄取灭菌或消毒后的饲料和水。所有实验均严格按照实验动物相关条例执行。
蠲痹颗粒浸膏醇提物制备:称取289.4 g蠲痹颗粒浸膏,用蒸馏水加热溶解完全,冷却后加入乙醇混匀,直至乙醇含量为80%,放置12 h后离心,取上清液过滤,并减压回收乙醇,得蠲痹颗粒药材浸膏,将浸膏置于真空干燥箱真空干燥约2 d,得蠲痹颗粒固体浸膏3.658 g,折合原药材:1 g醇提物相当于79.11 g蠲痹颗粒浸膏。
RPMI-1640培养基购自 GibcoBRL公司(life Technologies,Grandisland,NY,USA);胎牛血清(fetal calf serum,FBS)和 MTT均购买于 Hyclone公司(Logan,Utah,USA);刀豆蛋白 A(Con A)和细菌脂多糖(LPS)均购自美国 SIGMA 公司(St.Louis,MO,USA);IL-10、IL-6、IL-17A 和 IFN-γ细胞因子 ELISA 检测试剂盒和Anti-CD3抗体均购自BD PharMingen公司(San Diego,CA,USA);抗 phospho-ERK1/2,phosphop38购自Cell Signaling Technology;其它试剂为国产分析纯。
Megafuge l1.0R离心机(德国ThermoScientific Heraeus);二氧化碳培养箱购自美国Thermo-Fisher;Epoch连续波长酶标仪来自美国Bio-Tek公司;DM2500正置显微镜(德国莱卡仪器有限公司);伯乐小型垂直电泳套装及通用电泳仪164-5070(美国Bio-Rad)、ODYSSEYCLx激光成像系统(美国 LICOR公司)。
1.2 脾淋巴细胞和纯化CD4+T细胞制备 脱脊椎处死小鼠,摘取脾脏,研磨获取脾细胞悬液,用红细胞裂解液裂解红细胞,用PBS洗2~3次,离心滤过后加入含2%FBS的RPMI-1640混匀得到脾淋巴细胞,并将细胞调至所需浓度。采用免疫磁珠分离法(阴性选择),加入小鼠抗小鼠I-Ad/b、同山羊抗小鼠抗体IgG结合磁珠,除去与磁珠结合I-A+抗原递呈细胞和Ig+的B细胞,获得纯化的T细胞。CD4+T细胞的纯化在上述纯化条件下加入抗CD8抗体标记磁珠,除去CD8+T细胞,得到纯化CD4+T细胞。以上操作均需无菌处理。
1.3 JBKL对小鼠脾淋巴细胞增殖功能的影响 以5×105/孔的BALB/c小鼠脾淋巴细胞数接种于96孔板,药物组加入低、中、高剂量(3、10、30 μg/m L)的JBKL,再加入 5 μg/mL ConA 或 LPS(10 μg/mL)刺激T、B淋巴细胞增殖。另外,设不加刺激剂和药物的空白组,以及只加刺激剂的对照组,放入37℃,5%CO2培养箱,培养第44 h后每孔加入5 mg/mL MTT 20 μL,再孵育4 h结束后,吸除上清,每孔加入100μL DMSO,低速振荡充分溶解反应后的MTT结晶,用酶标仪在570 nm波长处检测各孔的吸光度。对于Anti-CD3 mAb诱导T细胞增殖,方法如下:5μg/m L Anti-CD3 mAb稀释溶液(碳酸盐缓冲液稀释,pH 9.6)包被96孔培养板,诱导T淋巴细胞增殖,于37℃培养箱中放置2 h后,丢弃液体,用PBS洗1次,加入脾淋巴细胞(5×105/孔)和不同浓度JBKL,之后的方法同上均用MTT法检测。
1.4 MTT检测JBKL对小鼠脾淋巴细胞细胞毒性检测往96孔板内加入4×105/孔的正常小鼠脾淋巴细胞,同时加入 JBKL(0、3、10、30 μg/m L)。37℃、5%CO2培养箱中培养44 h后,每孔加入20μL 5 mg/mL MTT,继续孵育4 h。培养结束时,弃去原液,每孔加入100 μL DMSO,充分溶解结晶,用酶标仪于570 nm处测定吸光度。
1.5 JBKL对Anti-CD3 mAb诱导T细胞细胞因子产生的影响 纯化的CD4+T淋巴细胞(4×105/孔)接种于包被着anti-CD3 mAb(5μg/mL)的24孔培养板中,同时加入不同浓度的 JBKL(0、3、10、30 μg/mL)。对照组则不含anti-CD3 mAb。37℃,5%CO2培养箱中培养,36 h后收集细胞上清液,离心(5 000 r/min,4℃,5 min),根据相应 IL-10、IL-6、IFN-γ 和 IL-17A的ELISA试剂盒说明书检测细胞培养液中各细胞因子的含量。
1.6 CD4+T细胞MAPK信号通路的相关蛋白表达水平 PBS稀释的anti-CD3 mAb(5μg/mL)加入24孔培养板,于4℃包被过夜,用PBS洗2次。加入CD4+T淋巴细胞(5×106/孔)、anti-CD28 mAb(2 μg/m L)和不同浓度的蠲痹颗粒提取物(0、3、10、30、100 μg/m L),刺激30 min,另设无刺激对照组。收集细胞于Eppendorf管中,每管分别加入等量的裂解溶液(RIPA、蛋白酶抑制剂和磷酸化蛋白酶抑制剂),4℃裂解 30 min,离心(4 ℃、10 min、12 000 r/min),吸取上清获得细胞总蛋白。总蛋白按照BCA蛋白浓度测定试剂盒说明书测定后再把浓度调成一致,取相同体积样品加入适量SDS,100℃水浴煮沸10 min变性总蛋白。将总蛋白进行垂直电泳分离、转膜、封闭、洗膜,分别加入抗体p-ERK和p-P38,4℃孵育6 h,洗膜,加入相应二抗室温避光孵育1 h,弃去二抗洗膜后于ODYSSEYCLx双色红外激光成像仪上扫膜,用ImageStudio软件采集分析蛋白条带图像。以甘油醛-3-磷酸脱氢酶(GAPDH)的显色为内参。
1.7 统计学分析 用SPSS 17.0软件对数据结果进行分析,所有数据都以均数±标准差(±s)表示,组间比较使用t检验和单因素方差分析处理,P<0.05为差异有统计学意义。
2 结果
2.1 JBKL对小鼠脾淋巴细胞活性和细胞毒性的影响 图1A结果显示,正常小鼠T淋巴细胞在丝裂原Con A诱导下显著增殖;与溶媒对照组比较,JBKL 30μg/mL药物干预后,能够显著抑制Con A诱导小鼠T淋巴细胞增殖能力。图1B结果表明,与溶媒对照组相比,JBKL 30μg/mL显著抑制Anti-CD3 mAb诱导正常小鼠脾脏T淋巴细胞活化。图1C结果表明,LPS显著刺激正常小鼠B淋巴细胞发生增殖,与溶媒对照组相比,JBKL 30μg/m L药物干预显著抑制正常小鼠B淋巴细胞的增殖活性。图1D结果表明,与溶媒对照组相比,JBKL在浓度(3~30)μg/m L对正常脾淋巴细胞活度无明显的影响,提示 JBKL在(3~30)μg/mL对正常小鼠淋巴细胞无明显细胞毒性作用。上述结果表明,JBKL体外具有显著的免疫抑制活性。
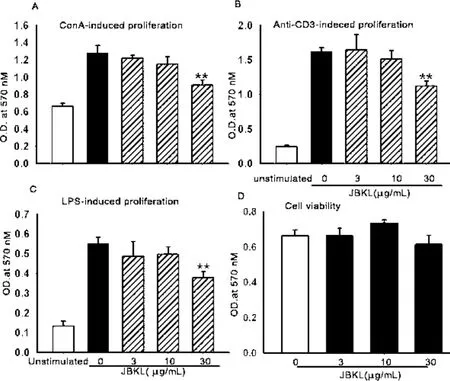
图1 不同浓度蠲痹颗粒醇提物(JBKL)对 ConA(A)、Anti-CD3 m Ab(B)和 LPS(C)诱导的正常小鼠脾淋巴细胞增殖情况影响和细胞毒性(D)(±s,n=3)
2.2 JBKL对TCR信号诱导的CD4+T淋巴细胞细胞因子产生的影响 为进一步探究JBKL对细胞因子产生的影响,本研究应用ELISA法检测JBKL对Anti-CD3 mAb诱导CD4+T淋巴细胞细胞因子产生的影响。ELISA检测结果显示,CD4+T淋巴细胞经 Anti-CD3 mAb诱导后分泌更多的 IFN-γ、IL-17A、Treg细胞因子(IL-10)和促炎细胞因子(IL-6)。给予不同浓度的JBKL作用后,产生的IFN-γ和IL-17A显著低于溶媒对照组。同时大幅增加Treg负调控细胞因子(IL-10)的分泌量,降低IL-6产生水平(表1)。
表1 蠲痹颗粒醇提物(JBKL)对Anti-CD3 m Ab诱导CD4+T细胞细胞因子的影响(±s,n=3,pg/mL)
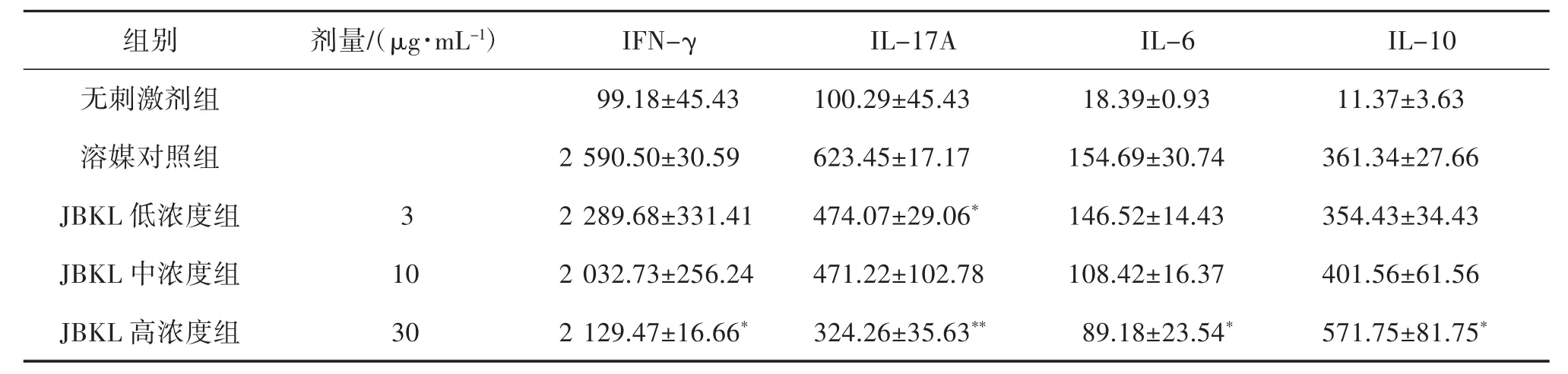
表1 蠲痹颗粒醇提物(JBKL)对Anti-CD3 m Ab诱导CD4+T细胞细胞因子的影响(±s,n=3,pg/mL)
注:与溶媒对照组比较,*P<0.05,**P<0.01。
组别剂量/(μg·mL-1)IFN-γIL-17A IL-6 IL-10无刺激剂组 99.18±45.43 100.29±45.43 18.39±0.93 11.37±3.63溶媒对照组 2 590.50±30.59 623.45±17.17 154.69±30.74 361.34±27.66 JBKL 低浓度组 3 2 289.68±331.41 474.07±29.06* 146.52±14.43 354.43±34.43 JBKL 中浓度组 10 2 032.73±256.24 471.22±102.78 108.42±16.37 401.56±61.56 JBKL 高浓度组 30 2 129.47±16.66* 324.26±35.63** 89.18±23.54* 571.75±81.75*
2.3 JBKL干预后,CD4+T淋巴细胞磷酸化p38和ERK蛋白水平变化 图2结果显示,30μg/mL和100μg/m L JBKL作用后磷酸化ERK表达量较溶媒对照组减少。而在浓度100μg/mL,JBKL显著抑制p38磷酸化表达水平,提示JBKL可能通过作用于ERK-MAPK和p38-MAPK信号通路来发挥抑制T细胞活化的作用。

图2 蠲痹颗粒醇提物(JBKL)对Anti-CD3 m Ab诱导
3 讨论
T细胞介导的免疫反应损伤是导致RA等系统性自身免疫病发病的主要原因之一[1,8]。临床上大多数RA患者的病程较长,主要以关节的免疫损伤为特征,并且在病原生物的持续感染下,病变可从小关节波及到大关节,最终引起严重的炎症损害[8]。但该病病因和发生机制目前尚未阐明。T淋巴细胞作为适应性免疫应答的主要效应细胞,其不同亚群发挥着不同的免疫效应,主要诱导分泌各类细胞因子或效应分子,从而参与调节体液免疫应答、炎症反应和自身免疫病等过程。因此,类风湿性关节炎的发生与针对自身抗原的T淋巴细胞异常活化增殖有关[9-10]。
前期研究显示,蠲痹颗粒能有效抑制DNFB引发的迟发型超敏反应(DTH)。DNFB能够刺激T细胞活化,释放大量的细胞因子和炎症介质,造成炎性损伤。基于此,我们进一步研究发现蠲痹颗粒能显著改善胶原诱导性小鼠关节炎,维持Th17/Treg细胞平衡,减少致炎因子IL-17A分泌量,促进免疫抑制因子IL-10的释放,动物模型实验证明给予蠲痹颗粒后能阻碍T细胞异常活化而发生的免疫应答,所以蠲痹颗粒治疗RA的免疫调节机制是值得探索的。因此,本实验采用ConA、Anti-CD3 mAb和LPS诱导脾脏T、B淋巴细胞增殖的体外模型,并加入JBKL;MTT结果显示,T、B细胞增殖活性在JBKL干预后减弱。且细胞毒性实验结果表明JBKL对正常脾淋巴细胞无明显细胞毒性作用,排除了JBKL抑制淋巴细胞增殖作用依赖于细胞毒性的可能,与前期体内结果一致,进而证实蠲痹颗粒具有显著免疫抑制活性,这可能是蠲痹颗粒治疗RA主要的依据之一[1,4,11]。
白细胞分化抗原3(CD3)是一类分布于细胞膜表面的蛋白质,CD3和 TCR肽链(α、β、γ)以非共价键相互连接,形成CD3-TCR复合体,在抗原刺激下使T细胞活化[12]。大量研究证实Anti-CD3 mAb可模拟抗原刺激直接作用于CD3,介导T细胞快速活化增殖,促进Th1、Th17、Treg等T细胞亚群分泌细胞因子和炎症介质释放[13]。结果表明,JBKL 30μg/mL显著降低了IFN-γ、IL-17A和IL-6的水平,显著提高了负调控因子IL-10的水平。IFN-γ除了激活巨噬细胞发挥抗肿瘤效应和促进炎症反应外,还有免疫调节作用[14]。由Th17细胞分泌的IL-17A有较强的促炎症作用,在RA的启动与进展中发挥关键作用[15-17]。另外,Th17细胞在IL-6刺激下会发生增殖和分化[18],IL-6还可以活化B淋巴细胞,发挥以抗体为主导的特异性体液免疫效应。由Treg细胞分泌的IL-10是维持免疫耐受的关键因子,以防止自生免疫性疾病发生。课题组前期在胶原诱导性关节炎模型中发现JBKL能调控Th17细胞与Treg细胞平衡,下调促炎因子IL-17A表达[3]。本研究在体外细胞因子表达角度进一步证实JBKL能调控Th17/Treg细胞平衡,这可能是蠲痹颗粒治疗类风湿关节炎的免疫学机制之一。
在RA发病时,MAPK信号通路是参与TCR信号转导的重要途径。T细胞激活信号通过多种途径转导入细胞核,其中MAPK信号通路是参与TCR信号转导的重要途径。MAPK的3种主要成分:ERK、JNK以及P38均参与T细胞激活。通过激活MAPK信号通路释放多种核转录因子,参与T细胞免疫应答过程[19]。基于此,我们进一步应用Western blot检测JBKL对MAPK信号通路中相关蛋白的影响。结果表明,JBKL给药后磷酸化ERK和p38表达降低,提示抑制MAPK信号通路,可能是蠲痹颗粒免疫抑制作用及治疗类风湿关节炎的分子机制之一。
综上所述,本实验结果证实了JBKL通过调控MAPK信号转导通路中p38和ERK蛋白磷酸化,从而抑制T细胞活化增殖和促炎因子分泌。本研究可为深入探究中药复方蠲痹颗粒治疗类风湿关节炎的作用机制提供科学基础。

