基于Th17/Treg免疫平衡观察清热化湿调枢方对溃疡性结肠炎模型小鼠的预防作用*
王欣,张涛,李敏,邱润苓,苏晓兰,魏玮
(1.中国中医科学院望京医院,北京 100102;2.中国中医科学院中医药信息研究所,北京 100700)
溃疡性结肠炎(ulcerative colitis,UC)是一种慢性、迁延性、炎症性肠病。近年来UC发病率显著增加,UC成为全球性疾病,已经受到世界各国医疗工作者的关注[1]。UC治疗缺乏特异性,病程迁延反复,治愈难度大,严重影响患者的生活质量[2]。西医指南和共识中涉及的药物取得了一定的临床疗效,但仍不能满足目前治疗的需求。中医药治疗UC从整体观念出发,针对患者不同的体质及UC病情发展不同时期制定相应的个体化干预措施,可以缓解患者的临床症状,提高其生活质量,尤其在诱导缓解、预防复发等方面具有明显的优势[3]。在临床取得良好疗效的前提下,深入探讨中医药治疗UC的效应机制显得极为迫切。目前UC发病机制可能是环境、遗传、微生物等多种因素共同作用,诱发肠道局部炎症。在诸多发病因素当中,免疫调节异常占据重要地位[4]。
魏玮教授在传承国医大师路志正先生“重脾胃、调脏腑”学术思想的基础上,立足于UC活动期“湿热蕴肠,气血不调”的核心病机,结合大量临床实践经验总结和现代科学技术,提出“清热、化湿、调枢”理论。既往临床研究发现,路志正经验方乌梅败酱方能够较好地缓解UC患者临床症状、改善生存质量,临床有效率为85.0%~91.5%[5-6]。根据乌梅败酱方化裁而成的清热化湿调枢方经过多年临床实践取得了较好的临床疗效,但其干预机制尚未阐明。故本研究采用葡聚糖硫酸钠(DSS)诱导法建立UC小鼠模型,以免疫平衡角度作为切入点阐释清热化湿调枢方治疗UC的作用机制。
1 材料与方法
1.1 实验动物8周龄C57BL/6雄性小鼠60只,体质量(20±2)g,购于北京斯贝福生物技术有限公司,实验动物生产许可证号:SCXK(京)2015-0015。小鼠饲养于中国中医科学院针灸研究所(IAM CACMS)清洁级动物房,12 h光照、12 h黑暗循环,温度(24±2)℃,相对湿度35%~45%。实验动物的所有操作均严格遵守中国中医科学院针灸研究所动物研究委员会指南,并经机构动物护理和使用委员会批准(批准号:D2021-03-16-2)。所有手术均在麻醉状态下(10%乌拉坦腹腔注射)进行,以尽量减少痛苦。
1.2 药物与试剂 清热化湿调枢方,方药组成:乌梅15 g,败酱草12 g,黄连6 g,木香9 g(后下),当归10 g,炒白芍12 g,炒枳实10 g,太子参15 g,炒白术15 g,茯苓15 g,葛根12 g,炙甘草6 g。上述药物采用中国中医科学院望京医院中药颗粒药房提供的中药免煎剂。美沙拉嗪肠溶片(批准文号:H20171358)购于Losan Pharma GmbH;葡聚糖硫酸钠(DSS,43 kDa)(批号:160110)购于美国MP Biomedicals公司;便潜血(OB)试剂(批号:B210601)购于珠海贝索生物技术有限公司;APC antimouse IL-17A(批号:506916)、Alexa Flour 488 anti-mouse/rat/huaman FOXP3(批号:320012)均购于Biolegend公司。
1.3 主要仪器ML4002/02型电子天平(梅特勒-托利多仪器有限公司);SL202N型电子天平(上海民桥精密科学仪器有限公司);JT-A20型净水开水器(上海宏溪实业有限公司);U-TvO.5xC.24H01726型电子显微镜、AHB-2-LB型万能照相机(日本奥林巴斯公司);Eq150H型脱水机、H1122Q型烤片机、RM2255型切片机(徕卡公司);Multiskan FC型酶标仪(赛默飞世尔科技);42592型96孔酶标板(康宁公司);TDZ4-WS型低速台式离心机(湖南湘仪实验室仪器开发有限公司)。
1.4 造模与分组60只小鼠适应性喂养1周后,根据小鼠体质量使用Excel中的Rand函数随机分为正常组、模型组、清热化湿调枢方高剂量组、清热化湿调枢方中剂量组、清热化湿调枢方低剂量组、美沙拉嗪肠溶片组,每组10只。除正常组外,其余各组均参照WIRTZ S等[7]的造模方法进行UC模型复制,具体操作:将DSS用蒸馏水配制成2.5%的溶液,除正常组外,其余组小鼠自由饮用,正常组小鼠自由饮用蒸馏水,连续7 d。
1.5 实验给药 在UC小鼠模型复制同时给予药物干预。给药浓度计算方法参照《中药药理研究方法学》[8]。按实验动物与人体表面积比等效剂量换算比率[9],将人每天剂量折算成小鼠等效剂量作为中剂量。高剂量为2倍中剂量,低剂量为1/2中剂量。造模第1天开始,清热化湿调枢方高、中、低剂量组小鼠每天分别灌胃给予清热化湿调枢方,0.736、0.368、0.184 g/kg;美沙拉嗪肠溶片组小鼠每天灌胃给予美沙拉嗪肠溶片溶液,0.011 g/kg;正常组和模型组小鼠灌胃给予等体积纯净水,0.5 mL/次,2次/d,连续7 d。
1.6 观察指标
1.6.1 一般情况观察 分别于干预前和干预结束后,观察小鼠的精神状态、毛发光泽度、活动情况、体质量、腹泻、便血等情况。
1.6.2 疾病活动指数(disease activity index,DAI)评分[10]以MURANO M等[11]制定的DAI评分标准为基准。观察各组小鼠体质量下降情况、粪便性状和便血情况,并计算DAI评分。DAI评分=(体质量下降分数+大便性状分数+便血分数)/3。
1.6.3 结肠组织形态学观察 干预结束后,使用10%的水合氯醛麻醉且处死小鼠,分离小鼠结肠位置,测量结肠长度。取结肠远端约1 cm处,用10%的中性甲醛将其固定,使用石蜡包埋HE染色及切片。光镜下观察切片组织学变化情况。
1.6.4 流式细胞术检测脾脏组织Treg、Th17细胞百分比 剖取完整脾脏,用手术剪剪碎,冰浴匀浆,转移至70 μm孔径的Falcon细胞筛网滤过,收集细胞悬液,再加红细胞裂解液,反应停止,离心,弃上清,重复2次,MACS缓冲液重悬,将细胞悬液通过40 μm孔径的Falcon细胞筛网,去除细胞团块,采集过滤后的细胞悬液,经流式细胞术检测。
1.7 统计学方法 运用SPSS 20.0统计软件进行分析,计量资料以“均数±标准差”(±s)表示,当满足正态分布且方差齐时,采用单因素方差分析,组间两两比较采用LSD-t检验;当不满足正态分布或方差不齐时,则采用Kruskal-Wallis H检验。以P<0.05为差异有统计学意义。
2 结 果
2.1 各组小鼠一般情况 干预前,各组小鼠活泼好动、毛色黑亮、状态均正常。干预结束后,正常组小鼠状态正常;模型组小鼠活动迟缓,精神萎靡,喜蜷缩呈弓背状;与模型组比较,美沙拉嗪肠溶片组和清热化湿调枢方高、中、低剂量组小鼠精神状态和活动度均有改善。实验过程中无小鼠死亡。
2.2 各组小鼠干预前后体质量比较 干预前,6组小鼠体质量比较,差异无统计学意义(P>0.05)。干预后,与正常组比较,模型组小鼠体质量明显降低(P<0.05);与模型组比较,美沙拉嗪肠溶片组和清热化湿调枢方高、中、低剂量组小鼠体质量均明显升高(P<0.05)。(见表1)
表1 各组小鼠干预前后体质量比较 (±s,g)
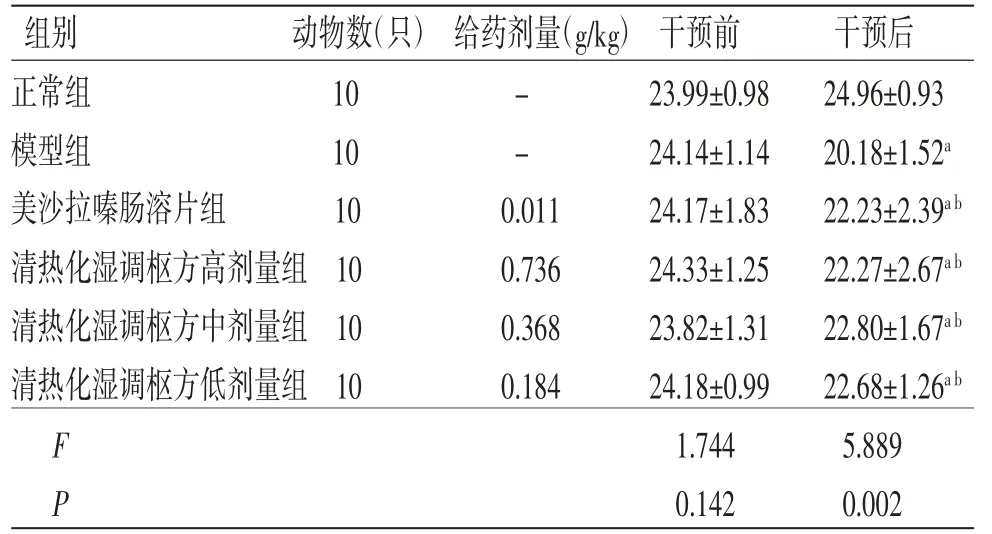
表1 各组小鼠干预前后体质量比较 (±s,g)
注:与正常组比较,aP<0.05;与模型组比较,bP<0.05
组别 动物数(只)给药剂量(g/kg)干预前 干预后正常组 10 - 23.99±0.98 24.96±0.93模型组 10 - 24.14±1.14 20.18±1.52a美沙拉嗪肠溶片组 10 0.011 24.17±1.83 22.23±2.39a b清热化湿调枢方高剂量组10 0.736 24.33±1.25 22.27±2.67a b清热化湿调枢方中剂量组10 0.368 23.82±1.31 22.80±1.67a b清热化湿调枢方低剂量组10 0.184 24.18±0.99 22.68±1.26a b F 1.744 5.889 P 0.142 0.002
2.3 各组小鼠结肠长度比较 与正常组比较,模型组小鼠结肠长度明显缩短(P<0.05);与模型组比较,美沙拉嗪肠溶片组和清热化湿调枢方高、中剂量组小鼠结肠长度均明显增加(P<0.05);清热化湿调枢方低剂量组小鼠结肠长度与模型组比较,差异无统计学意义(P>0.05)。(见表2)
表2 各组小鼠结肠长度比较 (±s,cm)

表2 各组小鼠结肠长度比较 (±s,cm)
注:与正常组比较,aP<0.05;与模型组比较,bP<0.05
组别 动物数(只)给药剂量(g/kg)结肠长度正常组 10 - 7.03±0.06模型组 10 - 4.50±0.87a美沙拉嗪肠溶片组 10 0.011 6.13±0.64b清热化湿调枢方高剂量组10 0.736 6.43±0.31b清热化湿调枢方中剂量组10 0.368 6.43±0.51b清热化湿调枢方低剂量组10 0.184 5.70±0.99 F 8.855 P 0.000
2.4 各组小鼠DAI评分比较 与正常组比较,模型组小鼠DAI评分明显升高(P<0.05);与模型组比较,美沙拉嗪肠溶片组和清热化湿调枢方高、中、低剂量组小鼠DAI评分均明显降低(P<0.05)。(见表3)
表3 各组小鼠DAI评分比较 (±s,分)
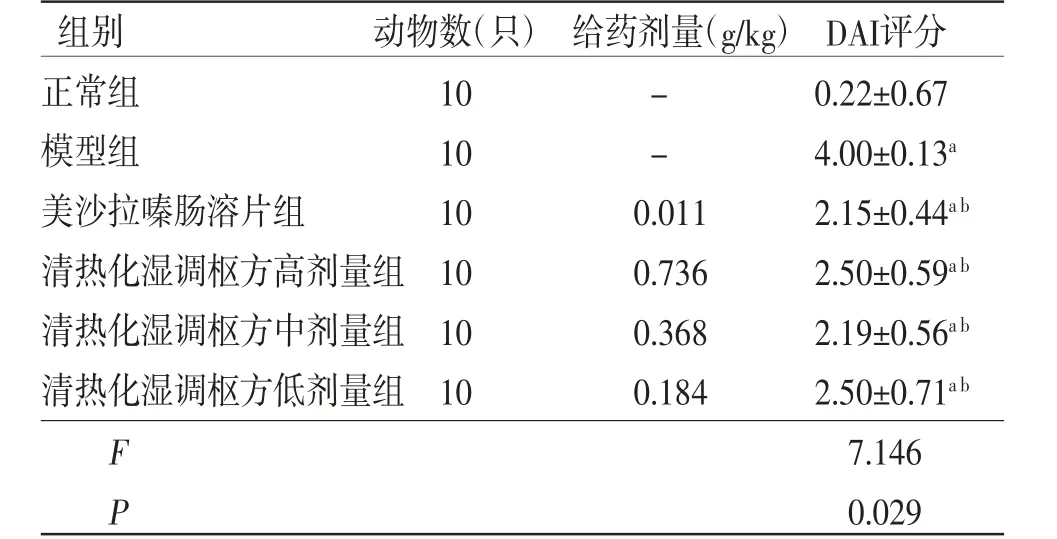
表3 各组小鼠DAI评分比较 (±s,分)
注:与正常组比较,aP<0.05;与模型组比较,bP<0.05
组别 动物数(只)给药剂量(g/kg)DAI评分正常组 10 - 0.22±0.67模型组 10 - 4.00±0.13a美沙拉嗪肠溶片组 10 0.011 2.15±0.44a b清热化湿调枢方高剂量组10 0.736 2.50±0.59a b清热化湿调枢方中剂量组10 0.368 2.19±0.56a b清热化湿调枢方低剂量组10 0.184 2.50±0.71a b F 7.146 P 0.029
2.5 各组小鼠脾脏Treg、Th17细胞百分比比较 与正常组比较,模型组小鼠脾脏中Treg细胞百分比明显减少(P<0.05),Th17细胞百分比明显增加(P<0.05);与模型组比较,清热化湿调枢方高、中、低剂量组和美沙拉嗪肠溶片组小鼠脾脏中Treg细胞百分比明显增加(P<0.05),Th17细胞百分比明显减少(P<0.05)。与正常组比较,模型组小鼠脾脏中Treg/Th17值明显降低(P<0.05);与模型组比较,清热化湿调枢方高、中、低剂量组和美沙拉嗪肠溶片组小鼠脾脏中Treg/Th17值均明显升高(P<0.05)。(见表4、图1~2)

图1 各组小鼠脾脏组织Treg细胞流式图
表4 各组小鼠Treg、Th17细胞百分比比较 (±s,%)
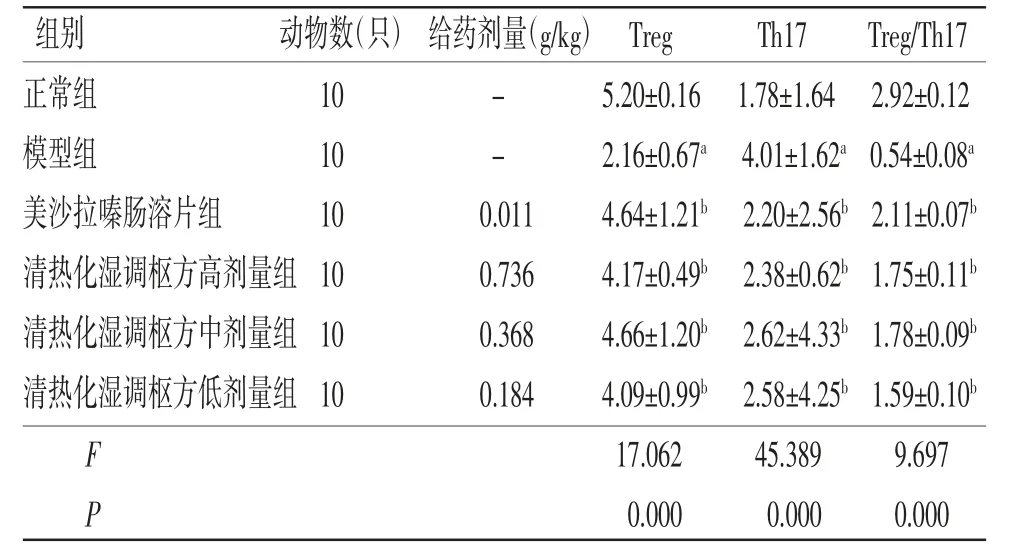
表4 各组小鼠Treg、Th17细胞百分比比较 (±s,%)
注:与正常组比较,aP<0.05;与模型组比较,bP<0.05
组别 动物数(只)给药剂量(g/kg)Treg Th17 Treg/Th17正常组 10 - 5.20±0.16 1.78±1.64 2.92±0.12模型组 10 - 2.16±0.67a 4.01±1.62a 0.54±0.08a美沙拉嗪肠溶片组 10 0.011 4.64±1.21b 2.20±2.56b 2.11±0.07b清热化湿调枢方高剂量组10 0.736 4.17±0.49b 2.38±0.62b 1.75±0.11b清热化湿调枢方中剂量组10 0.368 4.66±1.20b 2.62±4.33b 1.78±0.09b清热化湿调枢方低剂量组10 0.184 4.09±0.99b 2.58±4.25b 1.59±0.10b F 17.062 45.389 9.697 P 0.000 0.000 0.000
2.6 各组小鼠结肠组织病理学情况 正常组小鼠肠黏膜上皮完整,上皮细胞连接紧密,固有层可见完整隐窝结构,有序排列,杯状细胞分泌旺盛,黏膜下层未见明显病变;模型组小鼠肠黏膜上皮缺损,而上皮细胞连接疏松,隐窝结构破坏,排列紊乱,杯状细胞明显减少,间质层可见大量淋巴细胞及中性粒细胞等炎症细胞浸润,黏膜下层不同程度充血、水肿;清热化湿调枢方高剂量组和美沙拉嗪肠溶片组小鼠结肠组织病理形态较模型组明显改善,黏膜缺损情况均得到明显修复,上皮细胞连接较紧密,杯状细胞分泌增多,极少隐窝破坏,炎症细胞浸润程度低于模型组;清热化湿调枢方中剂量组小鼠部分结肠黏膜组织中断,缺损面积小,少量隐窝破坏,黏膜下层可见少量炎症细胞浸润、水肿;清热化湿调枢方低剂量组小鼠仍见多处结肠组织黏膜中断、隐窝破坏、间质出现充血、水肿及炎症细胞浸润。(见图3)
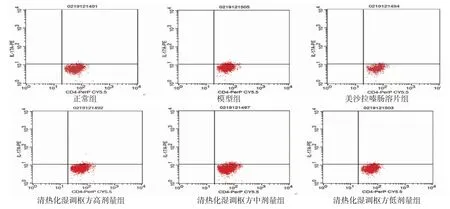
图2 各组小鼠脾脏组织Th17细胞流式图

图3 各组小鼠结肠组织病理切片图(HE,×100)
3 讨 论
中医学根据临床表现将UC归属于“肠癖”“肠风”“脏毒”等范畴[12-14]。UC中医病机可归纳为外感时邪、饮食不节(洁)、情志内伤、素体脾肾不足,基本病理因素包括气滞、湿热、血瘀、痰浊。病位在大肠,但与脾(胃)、肝、肾密切相关,而肺气失调,大肠不固亦与UC发病相关。湿热蕴肠为主要病理因素。研究[15]显示,大肠湿热证为UC最常见的证型。脾虚肝郁为主要发病基础,饮食不调为主要发病诱因。魏玮教授在传承国医大师路志正先生“持中央、运四旁,怡情志、调升降,顾润燥、纳化常”学术思想的基础上,创立清热化湿调枢方。方中君药乌梅收涩止泻;臣药败酱草、黄连清热化湿,解毒排脓;当归、白芍养血活血,柔肝止痛;葛根、枳实二味亦为臣药,调理中焦气机,一阴一阳,一升一降,葛根升清阳,枳实降浊阴;佐以木香行气止痛,恢复中焦脾升胃降之生理机能;佐药太子参、炒白术、茯苓健脾化湿;甘草为使药,取其调和之性。诸药合用,共奏清热、化湿、健脾、调枢之功。其中“调枢”可以看作是调控疾病及其病理变化过程的关键环节。全方方小药专,切中病机,轻清灵动,符合路志正临证治疗脾胃病的主要学术思想。
前期研究认为,异常激活的肠黏膜免疫是引发UC发生、发展和转归的重要因素之一[16]。而T细胞17(helper T cells 17,Th17))/调节性T细胞(regulatory T cells,Treg)在免疫调节中起到关键作用,二者在分化上相互协同,在功能上相互拮抗[17]。Th17细胞主要通过合成IL-17等炎症因子增强靶细胞通透性,导致炎症细胞募集和活化,最终促进炎症发生。大量基础研究表明,与健康对照组比较,UC患者肠黏膜中Th17细胞数量及相关因子(RORγt、IL-17、IL-22、IL-23)的表达水平明显升高,且与UC疾病活动程度呈正相关[18-19]。Treg细胞是具有免疫抑制功能的T细胞亚群,在形成外周免疫耐受、维持机体免疫平衡方面具有重要作用。Treg细胞的主要作用是表达Foxp3,通过分泌IL-10等抑炎因子,直接或间接抑制过度激活的免疫应答,从而抑制肠道炎症反应[20]。
本研究结果显示,模型组小鼠脾脏中的Treg细胞百分比明显低于正常组,Th17细胞百分比明显高于正常组,且二者的比值亦明显降低,说明模型组小鼠体内存在Treg和Th17细胞比例失衡。而美沙拉嗪肠溶片组和清热化湿调枢方高、中、低剂量组小鼠Treg/Th17值高于模型组,并接近正常组,说明清热化湿调枢方和美沙拉嗪一定程度上纠正了UC模型小鼠Treg和Th17细胞的比例失衡,并且可以明显改善病理形态,抑制隐窝破坏及炎症细胞浸润。近年来相关药理研究表明清热化湿调枢方组成药物所提取的单体及有效成分所具有的抑制UC肠黏膜炎症反应的潜在机制可能与调节Th17/Treg平衡有关。王小婷等[21]发现乌梅提取物可通过抑制小鼠小肠推进运动来延缓蓖麻油致腹泻小鼠的初次腹泻时间、减少稀便次数。LIN H H等[22]研究表明,白芍中提取的总苷可通过调节相关细胞因子的产生来缓解UC肠黏膜的损伤,并能降低UC大鼠的Th17相关细胞因子IL-17和TNF-α水平,增加Treg相关细胞因子TNF-β、IL-10的水平,抑制Th17细胞的效应表型和促进Treg反应,从而达到调节平衡的作用。白芍与当归配伍可增强机体免疫力,降低血液黏稠度,促进氧自由基清除[23]。惠毅等[24]研究证实,黄连有效成分小檗碱的治疗作用机制可能与通过抑制Notch通路从而有效修复UC小鼠受损的结肠黏膜有关。王凤云等[25]发现,败酱草总皂苷减少中性粒细胞浸润达到治疗作用的机制与降低UC大鼠结肠病变黏膜组织的丙二醛(MDA)水平及髓过氧化物酶(myeloperoxidase,MPO)活性,升高超氧化物歧化酶(Superoxide dismutase,SOD)水平相关。因此,调节免疫平衡、抑制肠黏膜炎症反应亦是清热化湿调枢方干预过程中的靶点。
综上所述,清热化湿调枢方能有效改善DSS诱导的UC小鼠一般情况并恢复结肠形态,降低组织病理学评分,其作用机制可能与调节Treg/Th17免疫失衡状态有关。但中药复方治疗UC的机制复杂,清热化湿调枢方对Treg/Th17免疫平衡相关上下游通路细胞因子和转录因子的影响仍需进一步挖掘和验证。后续研究可通过细胞和动物实验进行多组学验证,丰富清热化湿调枢方的干预机制研究,从而提供更有力的证据阐释该方对UC的免疫调节作用。

