藏党参提取物对酵母膏联合氧嗪酸钾致高尿酸血症小鼠的保护作用研究*
袁瑞瑛,普 珍,王敏竹,范成德,李 斌,卓玛东智,王聚乐
(1.西藏大学,西藏 拉萨 850012;2.武汉大学,湖北 武汉 430072;3.青岛科技大学,山东 青岛 266042)
人体嘌呤代谢失调导致尿酸过量生成,或由于尿酸排泄受到抑制,可引起血清尿酸含量急剧升高。当男性血尿酸浓度超过417 μmol/L,女性超过357 μmol/L时,则被认定为高尿酸血症(hyperuricemia,HUA)[1]。流行病学研究表明,HUA发病率逐年上升,并伴随糖尿病、高脂血症、原发性高血压及心血管疾病等慢性疾病的发生,已成为严重危害社会居民健康的代谢性疾病之一[2-4]。目前,治疗HUA的药物多为西药,如别嘌醇、丙磺舒和苯溴马隆,但长期服用副作用较大,血尿酸水平易反弹,甚至损伤肝脏、肾脏等器官[5-6]。近年来,传统药物因药效温和、多成分、多靶点、多途径作用等特点,广泛受到国内外学者的重视,已成为开发治疗HUA新药的主要来源之一[7]。
藏党参为桔梗科植物长花党参[Codonopsis thalictrifolia Wall.var.mollis(Chipp.)L.T.Shen]的全草,藏药名为罗堆多吉、鲁堆多吉。藏党参生长于我国西藏南部及中部,具有干黄水、消肿之功效,在当地常用于治疗风湿关节炎、神经痛、神经麻痹等病症[8-11]。孙杰等[12]研究发现,在体外实验中藏党参提取物及其单体成分均有抑制黄嘌呤氧化酶(XOD)的作用,并表现出良好的量效关系,表明藏党参具有降血尿酸的作用,其机制可能为抑制嘌呤核苷酸代谢。然而,目前笔者未见有关于藏党参体内抗高尿酸的研究,因此本实验通过建立酵母膏联合氧嗪酸钾诱导的高尿酸血症小鼠模型,进一步评估藏党参提取物的降尿酸作用。
1 材料与方法
1.1 实验动物4周龄SPF级雄性昆明种小鼠60只,体质量18~20 g,购于湖北省实验动物研究中心,动物生产许可证号:SCXK(鄂)2015-0018,饲养于武汉大学动物实验中心,动物使用许可证号:SYXK(鄂)2019-0013。将小鼠饲养于清洁级动物房,室温控制在(22±2)℃,相对湿度为50%~70%,12 h/12 h光照昼夜循环,所有小鼠均自由摄食与饮水。适应性喂养1周,观察小鼠身体状况良好,行为正常。所有动物实验操作均符合国家《实验动物管理条例》,并经武汉大学医学实验动物管理与使用委员会批准。
1.2 药物与试剂 藏党参采集于西藏林芝地区,经西藏大学王聚乐教授鉴定为正品。将干燥的藏党参地上部分进行粉碎,与70%乙醇按质量比1∶20混合后加热至微沸,回流提取2 h,过滤;滤渣与70%乙醇按照相同比例继续提取2 h。合并两次滤液,减压浓缩至浸膏,置于烘箱中烘干至粉末,得率为19.5%,用蒸馏水溶解,得不同浓度的藏党参提取物。
氧嗪酸钾(批号:20190427,纯度≥98%)购于合肥博美生物科技有限责任公司;别嘌醇片(批号:20190101)购于广东彼迪药业有限公司;酵母膏(批号:20190318,纯度≥98%)购于北京奥博星生物技术责任有限公司;尿酸检测试剂盒(UA)(批号:20191023)、肌酐检测试剂盒(Cr)(批号:20191023)、尿素氮检测试剂盒(UN)(批号:20191023)、黄嘌呤氧化酶检测试剂盒(XOD)(批号:20191117)、谷草转氨酶检测试剂盒(AST)(批号:20191117)、谷丙转氨酶检测试剂盒(ALT)(批号:20191117)均购于南京建成生物工程研究所;Bradford蛋白浓度测定试剂盒(批号:20210609)、RIPA裂解液(批号:20200917)均购于北京索莱宝生物科技有限公司;葡萄糖转运蛋白9兔单克隆抗体(GLUT9)(批号:GR3189763-16)购于美国Abcam公司;有机阴离子转运蛋白3小鼠单克隆抗体(OAT3)(批号:A0719)购于美国Santa Cruz公司;尿酸盐转运蛋白1兔单克隆抗体(URAT1)(批号:16i9411)、有机阴离子转运蛋白1兔单克隆抗体(OAT1)(批号:DF8582)、辣根过氧化物酶标记的山羊抗小鼠IgG二抗(批号:4358j982)、山羊抗兔IgG二抗(批号:7573s21)均购于美国Affinity公司;其余试剂均为分析纯。
1.3 主要仪器AS110R2型分析天平(波兰Radwag公司);ELX800型多功能酶标仪(美国Bio-Tek公司);Mini P-4型小型垂直电泳系统(北京凯元信瑞仪器有限公司);Tanon-4600型化学发光成像仪(上海天能科技有限公司);TDZ5-WS型冷冻离心机(湖南湘仪实验室仪器开发有限公司)。
1.4 造模与分组 将60只小鼠适应性饲养1周后,按随机数字表法随机分为空白组、模型组、藏党参提取物低剂量组、藏党参提取物中剂量组、藏党参提取物高剂量组、别嘌醇组,每组10只。除空白组外,其余小鼠每日08∶00∶00灌胃给予酵母膏(30 g/kg),15∶00∶00灌胃给药,持续14 d。末次给药后,取24 h尿液,后禁食12 h,测量小鼠体质量,腹腔注射氧嗪酸钾(300 mg/kg),间隔1 h后摘眼球取血并脱颈处死。
1.5 实验给药 依据《部颁藏药标准》中藏党参临床剂量3 g/d为低剂量组,中、高剂量以此加倍,通过人鼠剂量换算公式“小鼠剂量(g/kg)=人体用量(g)/70 kg×9.1”计算得每天藏党参提取物低剂量为76 mg/kg(相当于生药量390 mg/kg),中剂量为152 mg/kg,高剂量为304 mg/kg,别嘌醇剂量为5 mg/kg(相当于人38.46mg/kg),造模与给药同时进行,1次/d,持续14d。
1.6 观察指标
1.6.1 脏器指数、血清与尿液指标测定 将小鼠摘眼球取血,收集的血样静置30 min后,在4℃下3 500 r/min离心15 min,分离血清,试剂盒检测血清中尿酸含量,模型组大鼠血清尿酸水平明显高于空白组,差异有统计学意义(P<0.05),即为造模成功[13]。解剖小鼠,取肝脏、肾脏样本,生理盐水洗净,滤纸吸干称肝脏与肾脏质量,计算脏器指数(脏器指数=脏器质量/体质量×100%);试剂盒测定血尿酸(SUA)、血肌酐(SCr)、血尿素氮(BUN)、尿尿酸(UUA)、尿肌酐(UCr)、尿尿素氮(UUN)及血清中AST、ALT、XOD水平,并测定尿酸排泄分数(FEUA)。FEUA=[(尿尿酸×血肌酐)/(血尿酸×尿肌酐)]×100%。肝脏XOD活性测定:取小鼠肝脏,在冰水浴中制成10%肝组织匀浆(组织质量与生理盐水体积比为1∶9),离心收集上清液,按试剂盒说明书测定肝脏XOD活性。
1.6.2 尿酸转运体蛋白表达测定 取各组小鼠肾脏部位,并将其剪碎,按每100 mg组织加入1 mL裂解液(RIPA裂解液与PMSF按体积比100∶1配制),研磨成匀浆,于冰上裂解30 min,4℃下15 000 r/min离心20 min,取上清液,用BCA法进行蛋白定量,按上样量计算,加入4倍上样缓冲液,混匀,金属浴95℃加热5 min。定量后的蛋白样品上样40 μg,10% SDS-PAGE分离胶电泳分离,电泳结束后转膜,将胶上蛋白转至PVDF膜,室温下封闭于5%脱脂奶粉封闭液中2 h。孵育相关一抗(1∶1 000)2 h,再以HRP标记相应二抗(1∶5 000)孵育1 h。ECL显色后利用成像仪成像,使用软件Image J_v1.8.0分析URAT1、GLUR9、OAT1、OAT3条带灰度值。
1.7 统计学方法 采用统计软件SPSS 22.0进行数据处理,计量资料以“均数±标准差”(±s)表示,经正态性检验和方差齐性分析,多组比较采用单因素方差分析,两两比较采用LSD-t检验。以P<0.05为差异有统计学意义。
2 结 果
2.1 各组小鼠肝脏指数、肾脏指数比较 与空白组比较,模型组小鼠肝脏指数明显升高(P<0.01);与模型组比较,藏党参提取物高剂量组和别嘌醇组小鼠肝脏指数均明显降低(P<0.05),且藏党参提取物高剂量组小鼠肝脏指数与别嘌醇组比较,差异无统计学意义(P>0.05);藏党参提取物低、中剂量组小鼠肝脏指数与模型组比较,差异无统计学意义(P>0.05)。各组小鼠肾脏指数比较,差异无统计学意义(P>0.05)。(见表1)
表1 各组小鼠肝脏指数、肾脏指数比较 (±s,%)
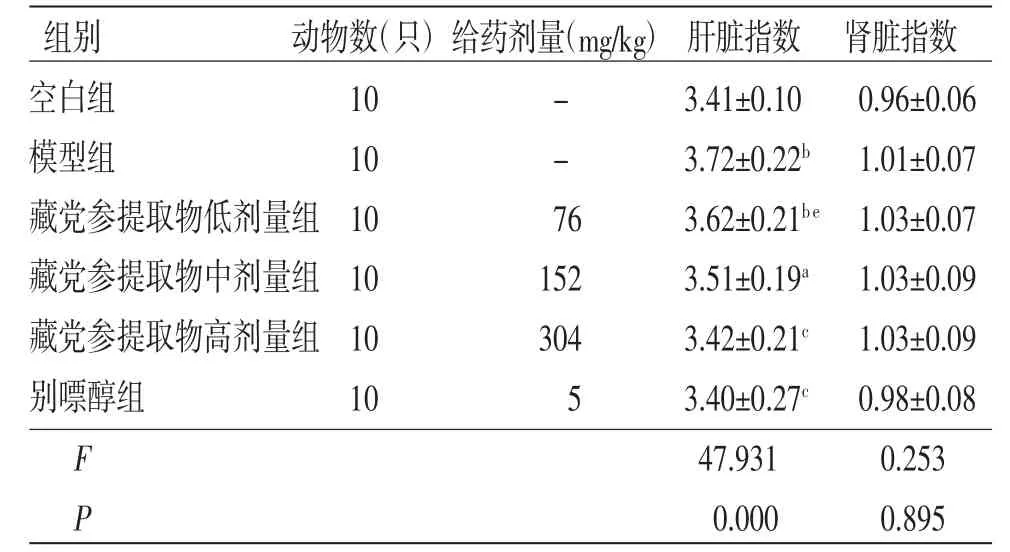
表1 各组小鼠肝脏指数、肾脏指数比较 (±s,%)
注:与空白组比较,aP<0.05,bP<0.01;与模型组比较,cP<0.05;与别嘌醇组比较,eP<0.05
组别 动物数(只)给药剂量(mg/kg)肝脏指数 肾脏指数空白组 10 - 3.41±0.10 0.96±0.06模型组 10 - 3.72±0.22b 1.01±0.07藏党参提取物低剂量组10 76 3.62±0.21be 1.03±0.07藏党参提取物中剂量组10 152 3.51±0.19a 1.03±0.09藏党参提取物高剂量组10 304 3.42±0.21c 1.03±0.09别嘌醇组 10 5 3.40±0.27c 0.98±0.08 F 47.931 0.253 P 0.000 0.895
2.2 各组小鼠血清ALT、AST水平比较 与空白组比较,模型组小鼠血清中ALT、AST水平均明显升高(P<0.01);与模型组比较,藏党参提取物高剂量组和别嘌醇组小鼠血清中ALT、AST水平均明显降低(P<0.05或P<0.01);与模型组比较,藏党参提取物中剂量组小鼠血清中AST水平明显降低(P<0.05),ALT水平与模型组比较,差异无统计学意义(P>0.05);藏党参提取物低剂量组小鼠血清中ALT、AST水平与模型组比较,差异无统计学意义(P>0.05);藏党参提取物高剂量组小鼠血清中ALT、AST水平与别嘌醇组比较,差异无统计学意义(P>0.05)。(见表2)
表2 各组小鼠血清ALT、AST水平比较 (±s,U/L)
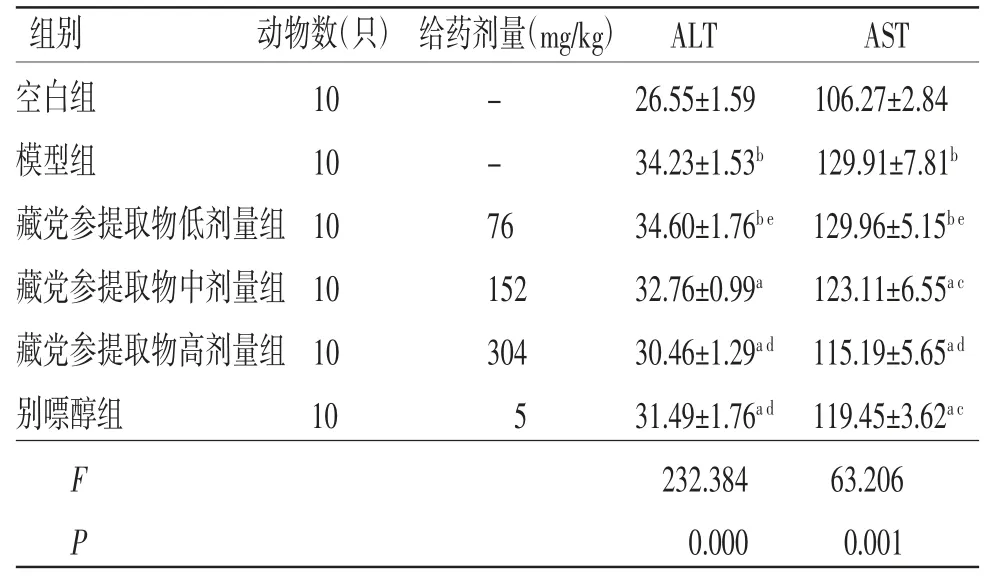
表2 各组小鼠血清ALT、AST水平比较 (±s,U/L)
注:与空白组比较,aP<0.05,bP<0.01;与模型组比较,cP<0.05,dP<0.01;与别嘌醇组比较,eP<0.05
组别 动物数(只)给药剂量(mg/kg)ALT AST空白组 10 - 26.55±1.59 106.27±2.84模型组 10 - 34.23±1.53b 129.91±7.81b藏党参提取物低剂量组10 76 34.60±1.76b e 129.96±5.15b e藏党参提取物中剂量组10 152 32.76±0.99a 123.11±6.55a c藏党参提取物高剂量组10 304 30.46±1.29a d 115.19±5.65a d别嘌醇组 10 5 31.49±1.76a d 119.45±3.62a c F 232.384 63.206 P 0.000 0.001
2.3 各组小鼠XOD活性比较 与空白组比较,模型组小鼠血清及肝脏中XOD活性均明显升高(P<0.01);与模型组比较,藏党参提取物中、高剂量组和别嘌醇组小鼠血清及肝脏中XOD活性均明显降低(P<0.01或P<0.05);藏党参提取物低剂量组小鼠血清及肝脏中XOD活性与模型组比较,差异无统计学意义(P>0.05);藏党参提取物高剂量组小鼠血清及肝脏中XOD活性与别嘌醇组比较,差异无统计学意义(P>0.05)。(见表3)
表3 各组小鼠XOD活性比较 (±s)
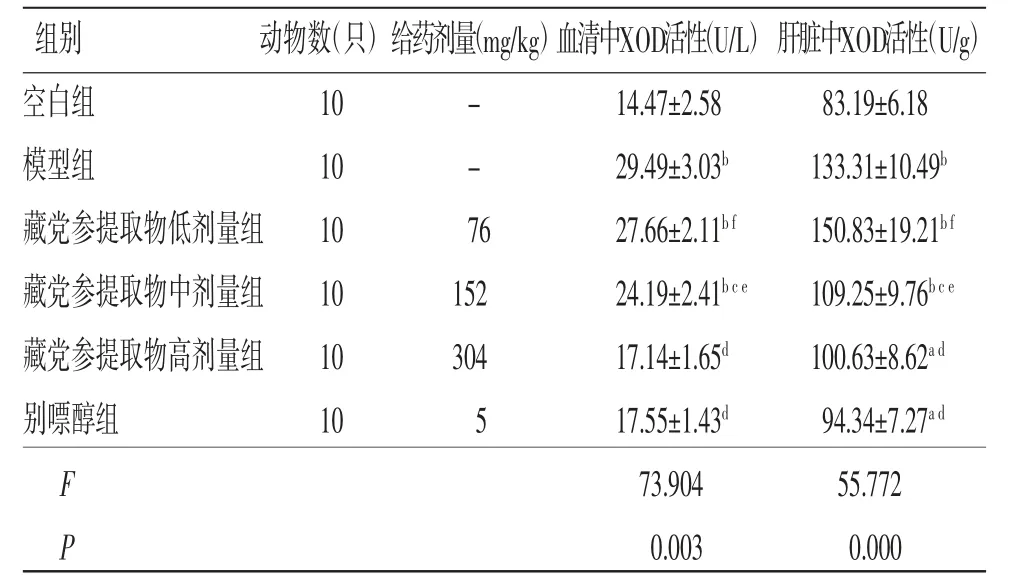
表3 各组小鼠XOD活性比较 (±s)
注:与空白组比较,aP<0.05,bP<0.01;与模型组比较,cP<0.05,dP<0.01;与别嘌醇组比较,eP<0.05,fP<0.01
组别 动物数(只)给药剂量(mg/kg)血清中XOD活性(U/L)肝脏中XOD活性(U/g)空白组 10 - 14.47±2.58 83.19±6.18模型组 10 - 29.49±3.03b 133.31±10.49b藏党参提取物低剂量组 10 76 27.66±2.11b f 150.83±19.21b f藏党参提取物中剂量组 10 152 24.19±2.41b c e 109.25±9.76b c e藏党参提取物高剂量组 10 304 17.14±1.65d 100.63±8.62a d别嘌醇组 10 5 17.55±1.43d 94.34±7.27a d F 73.904 55.772 P 0.003 0.000
2.4 各组小鼠血液和尿液中尿酸、肌酐和尿素氮水平比较 与空白组比较,模型组小鼠SUA、SCr、BUN水平均明显升高(P<0.01),UUA、UCr、UUN水平均明显降低(P<0.01);与模型组比较,别嘌醇组、藏党参提取物高剂量组小鼠SUA、SCr、BUN水平均明显降低(P<0.01),UUA、UCr、UUN水平均明显升高(P<0.01);与模型组比较,藏党参提取物中剂量组小鼠UUA、UCr、UUN水平均明显升高(P<0.05),SUA水平明显降低(P<0.05);藏党参提取物高剂量组小鼠SUA、BUN、UCr和UUN水平与空白组比较,差异有统计学意义(P<0.05);藏党参提取物低剂量组小鼠SUA、SCr、BUN、UUA、UCr、UUN水平与模型组比较,差异无统计学意义(P>0.05)。(见表4)
表4 各组小鼠血液和尿液中尿酸、肌酐和尿素氮水平比较 (±s)
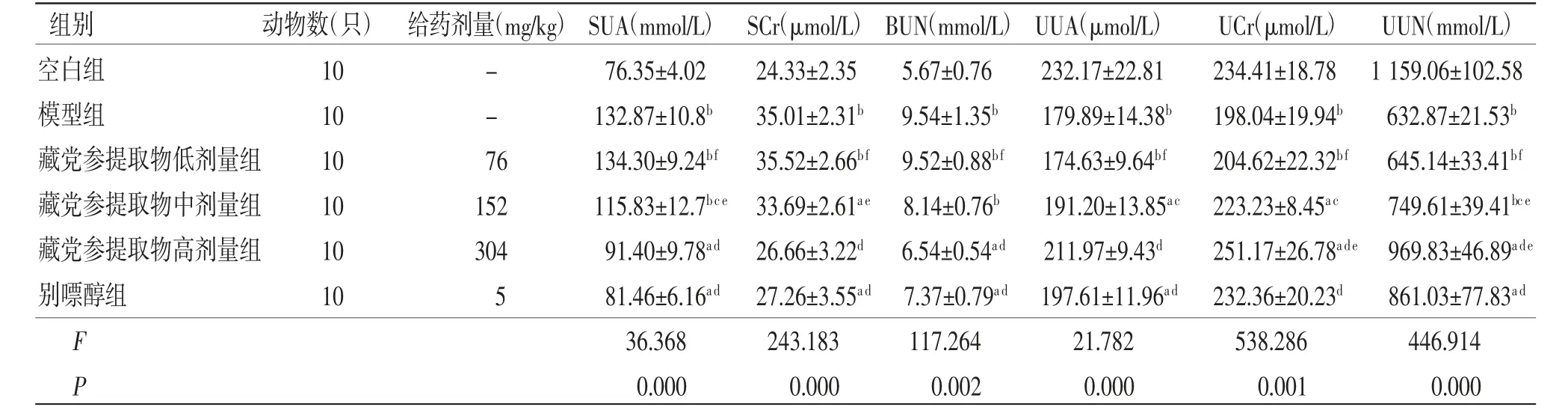
表4 各组小鼠血液和尿液中尿酸、肌酐和尿素氮水平比较 (±s)
注:与空白组比较,aP<0.05,bP<0.01;与模型组比较,cP<0.05,dP<0.01;与别嘌醇组比较,eP<0.05,fP<0.01
组别 动物数(只) 给药剂量(mg/kg)SUA(mmol/L)SCr(μmol/L)BUN(mmol/L)UUA(μmol/L) UCr(μmol/L)UUN(mmol/L)空白组 10 - 76.35±4.02 24.33±2.35 5.67±0.76 232.17±22.81 234.41±18.78 1 159.06±102.58模型组 10 - 132.87±10.8b 35.01±2.31b 9.54±1.35b 179.89±14.38b 198.04±19.94b 632.87±21.53b藏党参提取物低剂量组 10 76 134.30±9.24bf 35.52±2.66bf 9.52±0.88bf 174.63±9.64bf 204.62±22.32bf 645.14±33.41bf藏党参提取物中剂量组 10 152 115.83±12.7bce 33.69±2.61ae 8.14±0.76b 191.20±13.85ac 223.23±8.45ac 749.61±39.41bce藏党参提取物高剂量组 10 304 91.40±9.78ad 26.66±3.22d 6.54±0.54ad 211.97±9.43d 251.17±26.78ade 969.83±46.89ade别嘌醇组 10 5 81.46±6.16ad 27.26±3.55ad 7.37±0.79ad 197.61±11.96ad 232.36±20.23d 861.03±77.83ad F 36.368 243.183 117.264 21.782 538.286 446.914 P 0.000 0.000 0.002 0.000 0.001 0.000
2.5 各组小鼠FEUA比较 与空白组比较,模型组小鼠FEUA值明显降低(P<0.01);与模型组比较,别嘌醇组和藏党参提取物高、中剂量组小鼠FEUA值均明显升高(P<0.05或P<0.01);藏党参提取物低剂量组小鼠FEUA值与模型组比较,差异无统计学意义(P>0.05)。(见表5)
表5 各组小鼠FEUA比较 (±s,%)
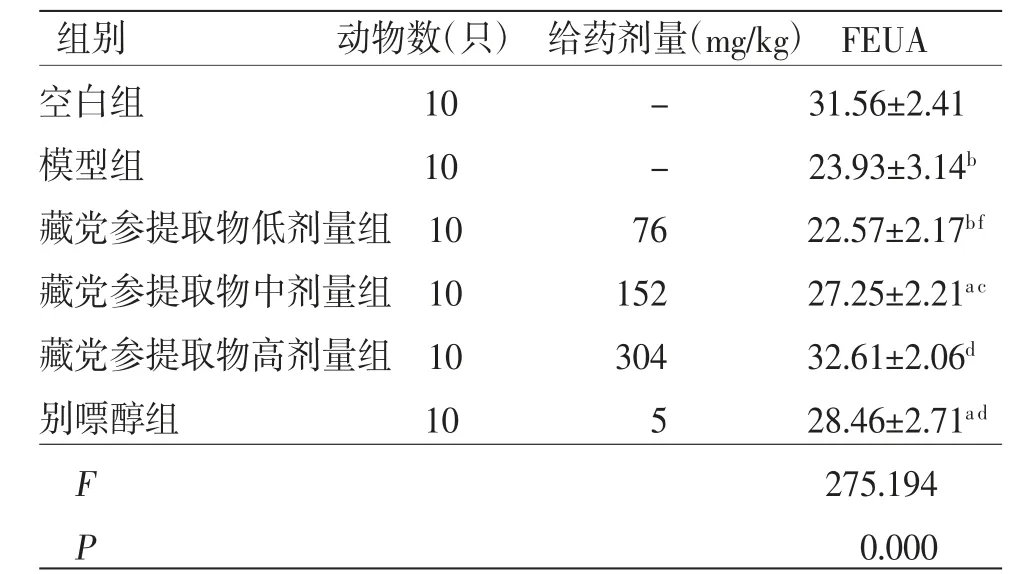
表5 各组小鼠FEUA比较 (±s,%)
注:与空白组比较,aP<0.05,bP<0.01;与模型组比较,cP<0.05,dP<0.01;与别嘌醇组比较,eP<0.05,fP<0.01
组别 动物数(只)给药剂量(mg/kg)FEUA空白组 10 - 31.56±2.41模型组 10 - 23.93±3.14b藏党参提取物低剂量组10 76 22.57±2.17bf藏党参提取物中剂量组10 152 27.25±2.21a c藏党参提取物高剂量组10 304 32.61±2.06d别嘌醇组 10 5 28.46±2.71a d F 275.194 P 0.000
2.6 各组小鼠尿酸转运体蛋白表达比较 与空白组比较,模型组小鼠肾脏尿酸转运体蛋白表达异常,其中URAT1和GLUT9蛋白表达均明显升高(P<0.01),而OAT1、OAT3蛋白表达均明显降低(P<0.01或P<0.05);与模型组比较,藏党参提取物中剂量组URAT1和GLUT9蛋白表达水平均明显降低(P<0.01或P<0.05),OAT1和OAT3蛋白表达水平均明显升高(P<0.01或P<0.05);与模型组比较,藏党参提取物高剂量组与别嘌醇组URAT1、GLUT9、OAT1和OAT蛋白表达均有明显改善(P<0.01);藏党参提取物低剂量组OAT3蛋白表达高于模型组(P<0.05),URAT1、GLUT9、OAT1蛋白表达与模型组比较,差异均无统计学意义(P>0.05)。(见图1、表6)
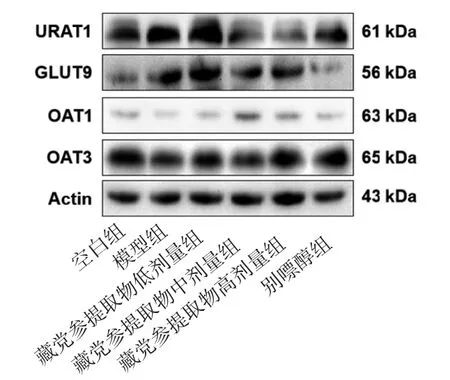
图1 各组小鼠尿酸转运体蛋白表达的Westem blotting图
表6 各组小鼠尿酸转运体蛋白相对表达量比较 (±s,%)
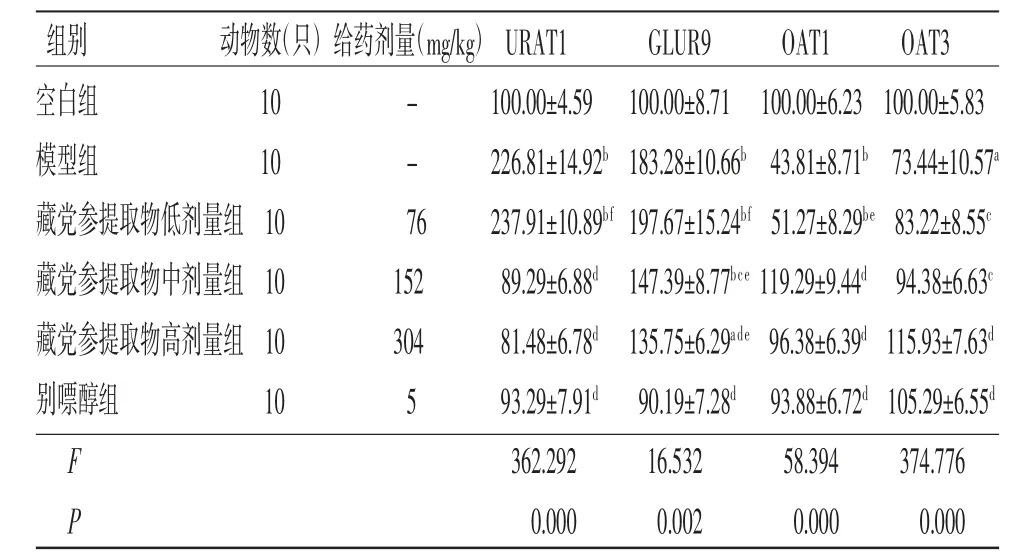
表6 各组小鼠尿酸转运体蛋白相对表达量比较 (±s,%)
注:与空白组比较,aP<0.05,bP<0.01;与模型组比较,cP<0.05,dP<0.01;与别嘌醇组比较,eP<0.05,fP<0.01
组别 动物数(只)给药剂量(mg/kg)URAT1 GLUR9 OAT1 OAT3空白组 10 - 100.00±4.59 100.00±8.71 100.00±6.23 100.00±5.83模型组 10 - 226.81±14.92b 183.28±10.66b 43.81±8.71b 73.44±10.57a藏党参提取物低剂量组10 76 237.91±10.89bf 197.67±15.24bf 51.27±8.29be 83.22±8.55c藏党参提取物中剂量组10 152 89.29±6.88d 147.39±8.77bce 119.29±9.44d 94.38±6.63c藏党参提取物高剂量组10 304 81.48±6.78d 135.75±6.29ade 96.38±6.39d 115.93±7.63d别嘌醇组 10 5 93.29±7.91d 90.19±7.28d 93.88±6.72d 105.29±6.55d F 362.292 16.532 58.394 374.776 P 0.000 0.002 0.000 0.000
3 讨 论
根据发病机制的不同,高尿酸血症可分为原发性高尿酸血症和继发性高尿酸血症,前者属于遗传性疾病,后者可由多种因素引起(如肾功能异常和药物过度刺激等)[14-15]。目前,越来越多的证据显示,饮食结构的改变大大增加了高尿酸血症的发病率,并呈现低龄化趋势[16-17]。如畜肉类、水产品和豆类等富含嘌呤类食物的高摄入,大大增加了尿酸在体内的代谢生成,从而加重肾脏的排泄负担甚至诱发肾脏损伤[18]。酵母膏作为尿酸前体物质,可增加体内尿酸生成;此方法模拟人们日常饮食中的嘌呤高摄入,而同时氧嗪酸钾作为尿酸酶抑制剂,能有效阻止尿酸的排泄,从而在体内建立高尿酸环境。因此,本实验采用酵母膏联合氧嗪酸钾诱导小鼠高尿酸血症模型。此方法操作简便,成功率高、稳定性好,已广泛适用于抗高尿酸血症的药物筛选评价及机制研究[19]。
肾脏是机体排泄的主要器官,体内约2/3的游离尿酸由肾脏排泄。而一旦肾脏功能出现异常,则会引起肌酐清除率和滤过功能下降;尿酸排泄率随之下降,易导致HUA的发生[20]。SUA水平是评估高尿酸血症最直接的指标[21]。本实验中,与空白组比较,模型组小鼠SUA水平大幅升高,UUA水平明显降低,这说明酵母膏联合氧嗪酸钾诱导小鼠高尿酸血症模型建立成功。同时,肌酐及尿素氮水平也是评价肾脏滤过功能的主要指标。模型组小鼠SCr及BUN水平明显升高,且UCr和UUN水平明显降低,这说明酵母膏与氧嗪酸钾的联合诱导致使肾脏功能异常。而实验结果表明,藏党参提取物能以剂量依赖性的方式有效恢复血液及尿液中尿酸、肌酐及尿素氮含量至正常水平。
肝脏为嘌呤核苷酸合成反应的主要器官。XOD为嘌呤代谢的限速酶,是调控尿酸必不可少的环节之一。黄嘌呤与次黄嘌呤经过XOD的二次氧化进而生成尿酸,呈现高尿酸血症的症状,其活性检测可反映尿酸的生成状况[22]。与空白组比较,模型组小鼠肝脏XOD活性明显升高,而藏党参提取物显著抑制了XOD活性,这与孙杰等[12]研究一致,即藏党参提取物成分中可能含有XOD的抑制剂,通过抑制XOD的活性而减少嘌呤的代谢及尿酸的生成,最终改善高尿酸血症。ALT与AST是评估肝脏损伤的重要指标。肝细胞受到损伤,胞质中的AST与ALT进入血液,引起血液中含量增加[23],而藏党参提取物有效降低了血清中ALT与AST水平;另外,与空白组比较,模型组小鼠肝脏指数明显升高,表明其肝脏可能由于代谢大量嘌呤产物而受到损伤,从而引起肝脏水肿,因此肝脏指数上升。结合以上实验结果表明,藏党参对酵母膏联合氧嗪酸钾引起的肝脏损伤具有一定的保护作用。
除了评价藏党参提取物降血尿酸水平和抑制XOD活性的作用,本研究还探讨了其对肾脏尿酸转运体的影响。肾脏中的多种尿酸转运体共同维持着尿酸水平的动态平衡[24-25]。URAT1作为尿酸盐转运的主要蛋白之一,其功能主要为介导尿酸与近曲小管上皮细胞内无机阴离子和有机阴离子的交换,从而将尿酸从管腔内重吸收入细胞[26]。GLUT9是葡萄糖转运蛋白家族的一员,其功能是将吸收到肾小球上皮细胞的尿酸转运到肾间质,参与近曲小管顶膜尿酸盐的再吸收[27]。OAT1和OAT3是重要的尿酸转运体[28],其表达主要分布于肾脏。如OAT1和OAT3以α-酮戊二酸作为肾脏的交换底物,将有机阴离子和药物泵入细胞,而OAT1主要介导尿酸的转运。OAT3的主要功能是通过基膜将有机阴离子转运到近曲小管上皮细胞,并排泄到尿液中[29]。URAT1、GLUT9、OAT1和OAT3等转运体在肾脏共同介导尿酸盐的转运,维持体内尿酸水平的稳定[30]。本实验结果表明,模型组小鼠URAT1和GLUT9蛋白表达明显升高,而OAT1和OAT3的蛋白表达明显降低。藏党参提取物能有效恢复上述转运体的表达水平,进而调节血液中尿酸的水平,促进尿酸排泄。
综上所述,藏党参提取物可有效改善HUA小鼠的高血尿酸水平,而潜在机制或许不仅仅是通过抑制肝脏XOD的活性,同时也可能通过恢复相关尿酸转运体表达异常而起到保护作用。因此,藏党参作为一种预防和治疗高尿酸血症的传统药物,具有进一步研究与开发的价值。然而,本研究在药物研究层面与深度上仍然有限,关于藏党参的活性成分和具体分子机制还需要进一步的研究与探讨。

