BAY 60-6583对MK-801介导小鼠脑髓鞘损伤的保护作用
王聃,李金霞,孙金萍,刘娟,马全瑞
(1.宁夏医科大学基础医学院人体解剖与组织胚胎学系,银川 750004;2.宁夏医科大学总医院,银川 750004)
精神分裂症(schizophrenia,SCZ)是一种相对常见的,受环境和遗传等多种因素影响的复杂神经精神疾病,在世界范围内发病率约为1%,其临床症状包括阳性症状(妄想、幻觉、行为异常等)、阴性症状(抑郁、焦虑、失语症等)以及认知障碍(注意力缺陷、学习记忆能力受损等)[1]。现阶段主要的治疗手段是应用抗精神病药物,其可有效缓解阳性症状和减少复发风险,但对阴性症状的临床疗效有限[2]。SCZ的复杂性之一是其发病机制尚未明确,缺乏具有临床诊断价值的病理学或生物学标记物。截至目前,相关研究表明多种多样的影响因素对疾病的发生发展起到关键作用,主要有以下假说:环境因素、遗传基因、神经递质异常学说、神经发生异常学说[3-4]。其中神经发生异常学说中髓鞘异常假说认为脱髓鞘和髓鞘再生障碍是SCZ重要的发病机制,近年来备受关注。已有研究证实SCZ患者大脑额叶及穹窿存在脱髓鞘改变[5]。尸检报道显示,SCZ患者少突胶质细胞(oligodendrocytes,OLs)数量和相关蛋白表达显著降低,发育、髓鞘化过程受损[6-7]。在动物模型的研究中,Xiu等[8]也报道SCZ模型小鼠胼胝体髓鞘丢失的现象。髓鞘异常与SCZ的发生发展密切相关,对髓鞘的保护已成为SCZ新的治疗靶点[9]。
腺苷受体A2B(adenosine receptor A2B,A2-BAR)是腺苷受体四种亚型(A1AR、A2AAR、A2BAR、A3AR)之一,在生理状态下,A2BAR与腺苷的亲和力较低,故长期以来被认为发挥作用极小[10],近年来有研究[11-13]表明,A2BAR选择性激动剂BAY 60-6583在心肌再灌注损伤、脑缺血以及咪达唑仑诱导的认知障碍中发挥积极的治疗作用,课题组前期研究[14]证明,A2BAR在低氧所诱导少突胶质前体细胞(oligodendrocyte precursor cells,OPCs)分化过程中发挥着重要作用,但是否在SCZ中发挥髓鞘保护作用尚不明确。本实验参照课题组前期研究方法[15],选择腹腔注射N-甲基-D-天冬氨酸受体(N-methyl-D-aspartate receptor,NMDAR)非竞争性抑制剂地卓西平马来酸盐(dizocilpine maleate,MK-801)制备SCZ模型,以此来探讨A2BAR选择性激动剂BAY 60-6583在SCZ模型中对髓鞘的作用。
1 材料与方法
1.1 材料
1.1.1 实验动物 选取6周龄SPF级别ICR雄性小鼠36只,体质量18~22 g,由宁夏医科大学实验动物中心提供[质量检测单位:陕西省实验动物质量监督检测中心;许可证号:SCXK(宁)2020-0001],该实验经宁夏医科大学医学伦理审查委员会批准(2018-006),所有动物自由饮水进食,鼠房环境温度为(22±1)℃,光照/黑暗周期为12 h。
1.1.2 主要试剂及材料MK-801购自Sigma-Aldrich公司,A2BAR选择性激动剂BAY 60-6583购自Tocris Bioscience公司,小鼠抗少突胶质细胞转录因子2(olineage transcription factor 2,Olig2)抗体、大鼠抗髓鞘碱性蛋白(myelin basic protein,MBP)抗体购自Abcam公司,兔抗Ki67抗体购自万类生物科技有限公司,小鼠抗Tubulin抗体购自爱博泰克生物科技有限公司,动物行为学记录分析系统购自Panlab公司,H7650型透射式电子显微镜为日本HITACHI公司产品。
1.1.3 MK-801介导SCZ模型小鼠的制备与分组 小鼠连续腹腔注射MK-801[0.6 mg·(kg·d)-1]14 d以制备SCZ模型。将36只小鼠随机分为3组,分别为对照组(Control组)、模型组(MK-801组)、模型+BAY 60-6583组(MK-801+BAY组),每组12只小鼠,对照组给予相同体积的生理盐水处理,在制备模型的7 d后隔天腹腔注射A2BAR激动剂BAY 60-6583[80 μg·(kg·d)-1]。
1.2 方法
1.2.1 旷场实验 实验在安静密闭的环境中进行,抓住小鼠尾部三分之一的位置,轻轻放入旷场实验箱的中央,同时进行摄像和计时,计时5 min,记录小鼠在中央区域和边缘区域停留的时间、总移动距离。中央区域停留时间越长、边缘区域停留时间越短、总移动距离越远,反映小鼠焦虑程度越轻,反之,则反映小鼠焦虑程度越重。计时结束后将小鼠取出。每只小鼠实验后,用70%乙醇擦拭旷场箱内壁和底面,避免前一只小鼠余留的信息(如大小便、气味)影响后一只小鼠。
1.2.2 悬尾实验 实验应在安静密闭的环境中进行,将小鼠尾尖用胶带固定,悬挂于支架上,头部距离台面15 cm,进行摄像和计时,计时5 min,记录处于该环境中小鼠静止不动时间。不动时间越长反映其抑郁状态越严重。
1.2.3 坚牢蓝(luxol fast blue,LFB)染色 小鼠麻醉后用4%多聚甲醛灌注固定;取脑后用4%多聚甲醛继续后固定12 h,流水冲12 h。将脑组织常规脱水、透明、浸蜡、包埋、切片,切片厚度为5 μm。将载有脑组织切片的载玻片脱蜡、复水下行至95%乙醇,然后切片转入LFB染色液,在37℃温箱染色过夜。次日将切片放入95%乙醇洗去多余染色液,自来水冲洗5 min后放入luxol分化液分色15 s,随后放入70%乙醇分色30 s。自来水冲洗5 min后,常规脱水、透明,中性树脂封片。光镜下观察各组切片胼胝体相近区域髓鞘着色情况。
1.2.4 透射电子显微镜 将灌注取出的脑组织放在2%戊二醛溶液4℃固定2 h,随后每2 h更换0.1 mol·L-1二钾砷酸钠缓冲液,共3次;次日4℃条件下1%锇酸溶液浸泡2 h,0.1 mol·L-1二钾砷酸钠缓冲液浸洗2次,15 min/次;梯度乙醇脱水后环氧丙烷渗透,15 min/次,共2次;1∶1渗透液(不完全包埋液∶环氧丙烷=1∶1)渗透1 h;2∶1渗透液(不完全包埋液∶环氧丙烷=2∶1)渗透1 h;不完全包埋液渗透过夜;于35℃温箱完全包埋液浸泡6 h后转移至包埋板,42℃温箱过夜后于60℃温箱干燥48 h。完成组织包埋后修块、切片定位,在各组小鼠胼胝体相近区域内随机选取视野进行拍照,观察髓鞘超微结构。
1.2.5 Western blot将新鲜的脑皮层组织称重,用全蛋白提取试剂提取出蛋白上清液,测定蛋白浓度,制作蛋白上样缓冲液,设定其浓度为7 μg·μL-1,置于-20℃冰箱中保存。配制10%SDS-PAGE凝胶,上样后用150 V电压电泳,根据条带及蛋白分子质量的大小选择合适的聚偏二氟乙烯(polyvinylidene fluoride,PVDF)膜,在低温环境下(4℃)用0.2 A恒流转膜;转膜结束后使用加入Tween-20的Tris盐缓冲液(Tris Buffered Saline with Tween-20,TBST)稀释的5%脱脂牛奶封闭非特异性抗原2 h。然后弃掉封闭液并加入一抗(大鼠抗MBP 1∶1 000),置于摇床上,在4℃冰箱过夜。第2天在室温条件下复温1 h后弃去一抗,TBST刷洗3遍;加入辣根过氧化物酶(horseradish peroxidase,HRP)标记的二抗(山羊抗大鼠IgG 1∶5 000),室温孵育1 h;TBST刷洗3遍后加入发光液A液、B液(1∶1),上机曝光。用Image J软件分别测量并计算对应的目的蛋白和内参蛋白的灰度值比值,采用正常对照组灰度值比值均一化处理各组灰度值比值,每个样本至少重复3遍。
1.2.6 免疫荧光染色 将脑组织石蜡切片放置于65℃烘箱加热1 h,用二甲苯脱蜡后,用梯度乙醇水化;磷酸盐缓冲液(phosphate buffered saline,PBS)冲洗3遍,每遍3 min;0.01 mol·L-1柠檬酸钠缓冲液高压抗原修复10 min,待恢复至室温后,PBS漂洗3遍,每遍3 min;在37℃恒温箱中用山羊血清封闭30 min后弃血清,并滴加相应一抗(小鼠抗Olig2 1∶100;兔抗Ki67 1∶100),4℃冰箱过夜孵育。第2天室温继续孵育1 h后,PBS漂洗3遍,每遍3 min;于避光环境下滴加荧光二抗混合液山羊抗兔IgG和山羊抗小鼠IgG(稀释比例均为1:300)孵育1 h;PBS漂洗3遍,每遍3 min;随后用4',6-二脒基-2-苯基吲哚(4',6-diamidino-2-phenylindole,DAPI)于避光环境下封片。荧光显微镜下,在每组样本的胼胝体相近区域选取3个20倍物镜视野观察并拍照计数。比较各组胼胝体3个20倍物镜视野内双标阳性细胞平均数的差异。
1.3 统计学方法
数据采用SPSS 26.0统计学软件进行单因素方差分析(One-way ANOVA),GraphPad Prism 8作图。数据以均数±均数标准误(x±SEM)表示,所有数据均符合正态分布及方差齐性,多组间两两比较采用Tukey检验。P≤0.05为差异有统计学意义。
2 结果
2.1 腹腔注射BAY 60-6583改善SCZ模型小鼠焦虑、抑郁样行为异常
旷场实验结果显示,MK-801组小鼠相较Control组,边缘区域停留时间延长(P<0.05),中央区域停留时间缩短(P<0.05),总移动距离变短(P<0.05);MK-801+BAY组小鼠较MK-801组旷场边缘区域停留时间缩短(P<0.05),中央区域停留时间延长(P<0.05),总移动距离延长(P<0.05),见图1。
悬尾实验结果显示,MK-801组小鼠与Control组相比,不动时间延长(P<0.05),MK-801+BAY组小鼠与MK-801组相比,不动时间缩短(P<0.05),见图1。

图1 腹腔注射BAY 60-6583后SCZ小鼠焦虑、抑郁样行为的改变
2.2 腹腔注射BAY 60-6583后SCZ模型小鼠损伤髓鞘的形态学结构明显改善
LFB属于铜-酞菁染料,在乙醇溶液中具有与髓鞘磷脂结合的染色特性,属于脂溶性染料浸染法中常用且可靠的髓鞘染色方法。LFB染色结果显示,Control组显示出致密的深蓝色丝状物,在胼胝体内延伸;与Control组相比,MK-801组髓鞘着色少而浅,胼胝体内大面积呈浅蓝色;在MK-801+BAY组中,髓鞘较MK-801组着色明显变深,浅蓝色面积明显减少,见图2。
透射电镜观察髓鞘超微结构结果显示,Control组内髓鞘板层结构致密完整,无局灶性溶解和水肿等病理变化;与Control组相比,MK-801组小鼠脑髓鞘正常纹理不清,结构紊乱变形,板层结构松散,出现局灶性溶解,呈空泡或空网状改变,甚至增生呈乳头状或球状突向轴浆;在MK-801+BAY组中,髓鞘局灶性溶解的情况明显改善,板层清晰,结构致密,形态完整,见图2。
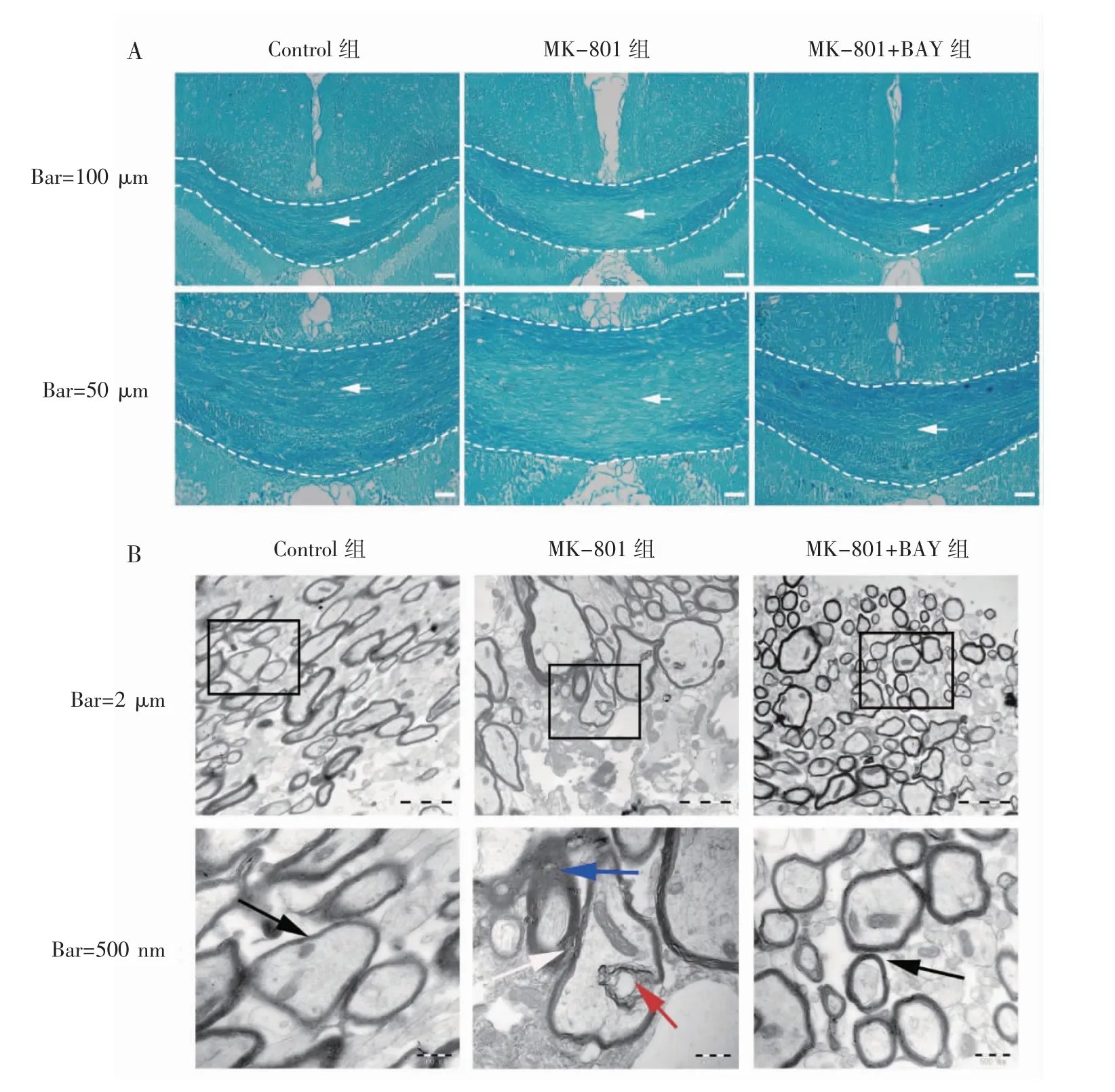
图2 腹腔注射BAY 60-6583后SCZ小鼠损伤髓鞘的形态学改变
2.3 腹腔注射BAY 60-6583可上调SCZ模型小鼠髓鞘碱性蛋白MBP的表达
Western blot结果显示,相比Control组,MK-801组小鼠MBP的相对表达量降低(P<0.05);与MK-801组相比,MK-801+BAY组MBP的相对表达量升高(P<0.05),见图3。

图3 腹腔注射BAY 60-6583对SCZ小鼠髓鞘碱性蛋白MBP表达的影响
2.4 腹腔注射BAY 60-6583可促进SCZ模型小鼠少突胶质谱系细胞的增殖
各组小鼠胼胝体区域的荧光结果显示,与Control组相比,MK-801组小鼠Ki67+/Olig2+细胞数量减少(P<0.05)。在BAY 60-6583干预后,MK-801+BAY组较MK-801组小鼠Ki67+/Olig2+细胞数量增加(P<0.05),见图4。

图4 BAY 60-6583对SCZ模型小鼠少突胶质谱系细胞增殖的影响
3 讨论
SCZ的动物模型按其诱导策略主要分为药物诱导模型、发育动物模型、转基因动物模型[16]。近年来由于谷氨酸盐失调假说引起了广泛关注,研究发现,给动物注射N-甲基-D-天冬氨酸(N-methyl-D-aspartate,NMDA)受体拮抗剂可引起SCZ样行为表现,其中代表性药物MK-801不仅可以同时模拟SCZ的阳、阴性症状,还能诱导出类似SCZ样病理学变化,如OLs损伤、髓鞘脱失等[17-18],因此MK-801已被广泛应用于SCZ动物模型的建立。在本实验中通过对MK-801诱导SCZ模型小鼠腹腔注射A2BAR激动剂BAY 60-6583,探究其对SCZ脑髓鞘损伤的保护作用。
实验过程中,观察到MK-801介导的SCZ小鼠会表现出运动过度、共济失调、刻板行为以及自发活动增加,这种行为改变可能与MK-801通过阻断NMDA受体激活抑制性纹状体γ-氨基丁酸(γ-aminobutyric acid,GABA)能投射神经元,间接激活黑质纹状体多巴胺(dopamine,DA)系统有关[19]。同时在旷场实验和悬尾实验中观察到SCZ模型小鼠表现出明显的焦虑和抑郁样行为改变,与此前研究报道相一致[20-21]。而SCZ小鼠予以BAY 60-6583治疗后其焦虑和抑郁样行为明显改善。髓鞘异常与SCZ的发生发展密切相关,前期研究发现双环己酮草酰二腙诱导小鼠脱髓鞘后可出现明显的焦虑和抑郁样行为,促进髓鞘的修复可改善其行为异常[22]。同时,抑郁动物模型中同样出现严重的脱髓鞘病变[23],促进髓鞘修复进程能明显改善抑郁和焦虑症状[24]。髓鞘是OLs包绕轴突形成的同心圆结构,不仅能为神经元轴突提供绝缘层,保证快速、高效地传递神经冲动,还能支持轴突的能量代谢[25]。本实验研究发现SCZ模型小鼠胼胝体区域LFB髓鞘着色呈浅蓝色;超微结构显示髓鞘板层结构松散,出现局灶性溶解甚至形成乳头状突向轴浆,提示SCZ小鼠脑内存在明显的髓鞘损伤改变,与先前的文献报道结果一致[8]。SCZ模型小鼠腹腔注射BAY 60-6583处理后,髓鞘LFB染色呈较致密的深蓝色丝状物,电镜下髓鞘呈现致密的板层结构,局灶性溶解的情况明显好转,损伤趋于恢复。MBP是形成致密髓鞘所必需的结构蛋白,约占髓鞘总蛋白的30%,是髓鞘的整体骨架成分,常作为髓鞘特异性标记物被广泛应用于判断髓鞘的破坏程度[26]。为了进一步验证BAY 60-6583对SCZ模型小鼠脑髓鞘的保护作用,本研究检测了MBP蛋白的表达水平,结果显示腹腔注射BAY 60-6583能显著逆转SCZ小鼠中降低的MBP蛋白表达水平,提示对髓鞘具有保护作用。综上所述,本文认为腹腔注射BAY 60-6583对SCZ模型小鼠脑髓鞘损伤具有一定的保护作用。
在中枢神经系统内,髓鞘由OPCs分化而来的成熟OLs突起包绕轴突形成。哺乳类动物脑内髓鞘始终处于一种动态调节过程[27-28],由OPCs和OLs组成的少突胶质谱系细胞数量的减少是髓鞘修复失败的主要原因。据报道,所有的少突胶质谱系细胞,无论成熟状态如何,都表达转录因子Olig2[29],Ki67是一种存在于细胞周期活性阶段的蛋白,Olig2和Ki67的双染阳性细胞可以识别出增殖的少突胶质谱系细胞[30]。实验结果显示SCZ模型小鼠脑内Ki67+/Olig2+的细胞数明显减少,而予以BAY 60-6583治疗可明显提高Ki67+/Olig2+细胞数量,说明A2BAR激动剂BAY 60-6583可促进SCZ模型小鼠脑少突胶质谱系细胞进入细胞周期活性阶段。此前有研究证明SCZ患者脑组织内少突胶质谱系细胞数量显著减少[6],少突胶质谱系细胞的增殖会缩小病变范围,是脱髓鞘疾病的治疗关键[30-31],且增强内源性髓鞘再生以恢复神经传导并防止神经变性被认为是治疗脱髓鞘类型疾病的重要策略之一[32]。
综上所述,本研究证明A2BAR激动剂BAY 60-6583可改善SCZ焦虑和抑郁样行为,并对脑髓鞘损伤具有一定的保护作用,猜测这种保护作用可能与其通过促进脑少突胶质谱系细胞进入细胞周期活性阶段相关联,在后续的实验中将继续探讨相关机制。

