PTEN抑制剂Bpv(HOpic)对大鼠缺血脑损伤的作用及机制
任近阳 姚旭进 孙江东 胡文杰 孔祥一 万芪

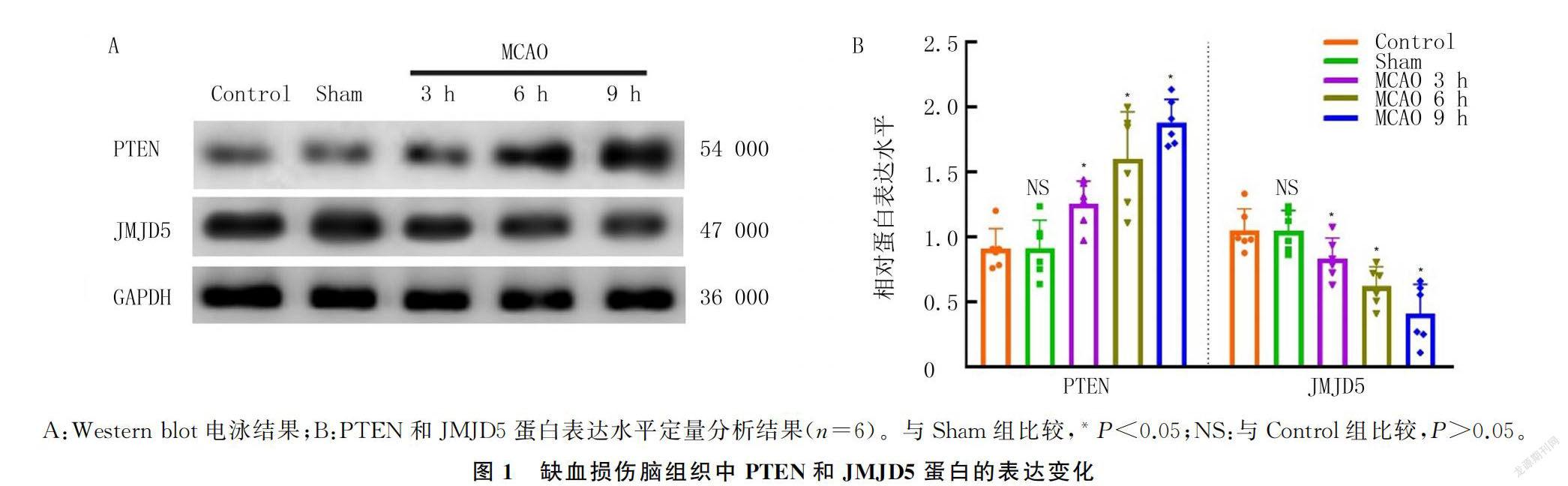
[摘要] 目的 探討第10号染色体缺失的张力蛋白同源磷酸酶基因(PTEN)-Jumonji-C结构域蛋白5(JMJD5)信号通路在缺血性脑损伤中的作用,探索潜在的神经保护治疗措施。
方法 构建大鼠大脑中动脉栓塞(MCAO)模型,Western blot检测缺血损伤脑组织中PTEN和JMJD5蛋白表达水平变化。构建PTEN过表达和干扰模型,Western blot检测脑组织中JMJD5蛋白表达的变化。构建JMJD5过表达和干扰模型,2,3,5-氯化三苯基四氮唑(TTC)染色观察脑梗死面积的变化。给予MCAO大鼠PTEN抑制剂Bpv(HOpic),Western blot检测缺血损伤脑组织中JMJD5蛋白水平的变化。通过改良神经功能缺损程度评分(mNSS)评估下调JMJD5表达对Bpv(HOpic)神经保护作用的影响。
结果 随缺血损伤时间延长,MCAO 3、6、9 h组大鼠脑组织中PTEN蛋白表达水平逐渐升高,JMJD5蛋白表达水平逐渐下降,与假手术组比较差异均有显著性(F=20.70、15.41,t=2.13~7.28,P<0.05)。过表达PTEN后脑组织中JMJD5蛋白水平明显下降,而干扰PTEN表达后JMJD5水平明显升高(F=14.10,t=3.88、2.88,P<0.05)。JMJD5表达上调使脑梗死面积减小,而JMJD5表达下调使梗死面积增加(F=10.58,t=3.92、2.38,P<0.05)。MCAO大鼠给予Bpv(HOpic)处理后损伤脑组织中JMJD5蛋白表达水平增加(t=3.32,P<0.05)。Bpv(HOpic)干预14 d可使MCAO大鼠mNSS得分明显降低,而下调JMJD5表达可阻断此作用(F=4.19,q=6.69、6.16,P<0.05)。
结论 缺血损伤脑组织中PTEN表达增加,JMJD5表达下降。PTEN抑制剂Bpv(HOpic)可能通过上调JMJD5的表达改善大鼠神经功能缺陷。Bpv(HOpic)调控PTEN-JMJD5信号通路可能是一种潜在的神经保护治疗措施。
[关键词] PTEN磷酸水解酶;含Jumonji结构域组蛋白脱甲基酶类;蛋白酶抑制药;卒中;脑缺血;神经保护;大鼠
[中图分类号] R338.2;R743.3
[文献标志码] A
[文章编号] 2096-5532(2022)05-0633-06doi:10.11712/jms.2096-5532.2022.58.114
[开放科学(资源服务)标识码(OSID)]
[网络出版] https://kns.cnki.net/kcms/detail/37.1517.R.20220622.1615.004.html;2022-06-24 11:38:48
ROLE AND MECHANISM OF ACTION OF THE PTEN INHIBITOR BPV(HOPIC) IN RATS WITH ISCHEMIC BRAIN INJURY
REN Jinyang, YAO Xujin, SUN Jiangdong, HU Wenjie, KONG Xiangyi, WAN Qi
(Institute of Neuroregeneration & Neurorehabilitation, Qingdao University, Qingdao 266071, China); [ABSTRACT] Objective To investigate the role of the phosphatase and tensin homolog deleted on chromosome 10 (PTEN)-Jumonji C-domain-containing 5 (JMJD5) signaling pathway in ischemic brain injury and potential neuroprotective treatment measures.
Methods A rat model of middle cerebral artery occlusion (MCAO) was established, and Western blot was used to measure the changes in the protein expression levels of PTEN and JMJD5 in ischemic brain tissue. A rat model of PTEN overexpression or interference was established, and Western blot was used to measure the change in the protein expression of JMJD5 in brain tissue. A rat model of JMJD5 overexpression or interference was established, and 2,3,5-triphenyltetrazolium chloride staining was used to observe the change in cerebral infarct area. MCAO rats were given the PTEN inhibitor Bpv(HOpic), and Western blot was used to measure the change in the protein expression level of JMJD5 in ischemic brain tissue. Modified Neurological Severity Score (mNSS) was used to assess the influence of JMJD5 knockdown on the neuroprotective effect of Bpv(HOpic). Results Compared with the sham-operation group, the 3-, 6-, and 9-hour MCAO groups had a gradual increase in the protein expression of PTEN and a gradual reduction in the protein expression of JMJD5 in brain tissue over the time of ischemic injury (F=20.70,15.41;t=2.13-7.28;P<0.05). There was a significant reduction in the protein expression level of JMJD5 in brain tissue after PTEN overexpression, but there was a significant increase in the protein expression level of JMJD5 after PTEN interference (F=14.10;t=3.88,2.88;P<0.05). JMJD5 upregulation reduced cerebral infarct area, whereas JMJD5 downregulation increased infarct area (F=10.58;t=3.92,2.38;P<0.05). After Bpv(HOpic) treatment in MCAO rats, there was a significant increase in the protein expres-sion level of JMJD5 in ischemic brain tissue (t=3.32,P<0.05). After 14 days of intervention with Bpv(HOpic), there was a significant reduction in mNSS score in MCAO rats, which was blocked by downregulating the expression of JMJD5 (F=4.19;q=6.69,6.16;P<0.05). Conclusion There is an increase in PTEN expression and a reduction in JMJD5 expression after ischemic brain injury. The PTEN inhibitor Bpv(HOpic) improves neurological function by upregulating the expression of JMJD5. Regulation of the PTEN-JMJD5 signaling pathway by Bpv(HOpic) may be a potential neuroprotective treatment measure.
[KEY WORDS] PTEN phosphohydrolase; Jumonji domain-containing histone demethylases; protease inhibitors; stroke; brain ischemia; neuroprotection; rats
脑卒中是严重危害人类健康的疾病之一,可导致永久性神经功能缺陷甚至死亡[1]。由于其病理机制复杂,目前仍然没有疗效明显的神经保护治疗方案[2]。第10号染色体缺失的张力蛋白同源磷酸酶基因(PTEN)具有脂质磷酸酶和蛋白酪氨酸磷酸酶活性,在多种疾病中发挥了重要的作用,包括脑卒中[3]。Jumonji-C结构域蛋白5(JMJD5)具有去甲基化酶活性并通过该活性发挥转录激活作用[4]。目前关于PTEN-JMJD5信号通路在脑卒中中发挥的作用及其机制尚不清楚。本研究旨在探讨PTEN及JMJD5在缺血脑损伤中的作用,探索潜在的神经保护治疗方法。
1 材料与方法
1.1 实验材料
1.1.1 实验动物 SPF级健康成年SD大鼠,雄性,体质量250 g,由济南朋悦实验动物繁育有限公司提供,动物合格证号SCXK(鲁)2014007,饲养于青岛大学医学部实验动物中心。适应性饲养1周后正式进行实验。本动物实验经青岛大学实验动物福利伦理委员会批准。
1.1.2 主要实验试剂 兔抗PTEN(Abcam),兔抗JMJD5(Solarbio),兔抗β-Actin(Bioss),鼠抗兔IgG HRP(Bioss),2,3,5-氯化三苯基四氮唑(TTC)染料(Solarbio),Bpv(HOpic)(HY-128693,MCE),RNA提取试剂盒(北京擎科),反转录PCR试剂盒(北京擎科),Western blot相关试剂(Solarbio),病毒转染工具(吉凯基因),PCR引物(北京擎科)。
1.2 实验方法
1.2.1 实验分组及处理 实验1观察缺血损伤脑组织中PTEN和JMJD5表达水平的变化。采用随机数字表法将SD大鼠分为对照组(Control组)、假手术组(Sham组)以及梗死3、6、9 h组(MCAO 3、6、9 h组),每组6只。梗死各组构建大脑中动脉栓塞(MCAO)模型,分别于术后3、6、9 h提取缺血半暗带区域脑组织,Western blot方法检测PTEN和JMJD5蛋白表达水平。Sham组只暴露血管不梗阻,Control组不做任何处理。
实验2观察PTEN对JMJD5蛋白表达的影响。采用随机数字表法将大鼠分为Control组、PTEN过表达组(OE-PTEN组)、过表达对照组(OE-NC组)、PTEN干扰组(Sh-PTEN组)和干扰对照组(Sh-NC组),每组6只。后4组经侧脑室转染相应病毒载体构建过表达及干扰模型,Control组给予等体积的生理盐水(NS)。
实验3观察JMJD5表达水平对脑梗死面积的影响。采用随机数字表法将SD大鼠分为Control组、Sham组、梗死组(MCAO组)、JMJD5过表达组(OE-JMJD5组)、OE-NC组、JMJD5干扰组(Sh-JMJD5组)和Sh-NC组,每组6只。病毒转染各组大鼠给予病毒转染建模,Sham组和MCAO组给予等体积的NS。病毒转染各组和MCAO组2周后行MCAO处理,Sham組只暴露血管。Control组不做任何处理。MCAO 24 h后取脑行TTC染色观察各组梗死面积。
实验4观察PTEN抑制剂Bpv(HOpic)对损伤脑组织中JMJD5表达水平的影响。采用随机数字表法将大鼠分为NS组和Bpv(HOpic)组(Bpv组),每组6只。两组均行MCAO造模。Bpv组于造模后3 h给予1 mg/kg Bpv(HOpic)腹腔注射,NS组给予等体积的NS。给药后3 h取脑检测损伤脑组织中JMJD5蛋白的表达。
实验5旨在观察下调JMJD5对Bpv(HOpic)神经保护作用的影响。采用随机数字表法将大鼠分为MCAO+NS组(A组)、Sh-NC+MCAO+NS组(B组)、Sh-NC+MCAO+Bpv组(C组)以及Si-JMJD5+MCAO+Bpv组(D组),每组10只。后3组经侧脑室注射病毒载体构建JMJD5干扰及干扰对照模型,MCAO+NS组给予等体积的NS。在病毒转染2周后行MCAO造模。Sh-NC+MCAO+Bpv组和Si-JMJD5+MCAO+Bpv组给予1 mg/kg Bpv(HOpic)腹腔注射,每天1次,连续14 d,其余2组给予等体积的NS。分别于给药1、3、7和14 d时行改良神经功能缺损程度评分(mNSS)。
1.2.2 MCAO模型制备 采用线栓法建立梗死模型[5]。大鼠经100 g/L水合氯醛麻醉,仰卧位固定于手术台上,常规消毒颈部皮肤,取颈部正中切口,暴露分离血管。结扎颈总动脉近心端和颈外动脉,将线栓插入颈内动脉,堵塞大脑中动脉开口处,扎紧动脉残端。阻塞90 min拔除线栓,缝合皮肤。应用脑血流仪(PeriCam PSI Zoom)检测术后大脑血流变化,血流降低75%以上表示梗阻成功。待大鼠清醒后观察其肢体活动,术后Longa评分1~3分者选为实验对象。
1.2.3 病毒载体构建及转染 从GenBank数据库获取PTEN基因及转录本序列。订购PTEN过表达质粒和shRNA干扰重组质粒[6]。质粒经克隆、筛选、鉴定后,将穿梭质粒和包装质粒共转染HEK 293细胞,获得重组腺相关病毒(rAAV)。病毒悬液梯度稀释后感染HEK293细胞,检测病毒滴度。重组病毒转染SHSY-5Y细胞,分别采用RT-PCR和Western blot方法检测PTEN mRNA和蛋白表达水平,对重组载体进行鉴定。病毒载体构建成功后,通过立体定向注射将病毒转染至SD大鼠侧脑室,分别构建PTEN过表达和干扰动物模型。注射位置:ML 1.5 mm、AP -0.8 mm、DV 3.5 mm,注射剂量4 μL。rAAV转染2周后分别采用RT-PCR和Western blot方法检测脑组织中PTEN mRNA和蛋白表达水平。同法构建JMJD5过表达和干扰模型[7-8]。PTEN和JMJD5引物序列见表1。
1.2.4 Western blot检测PTEN和JMJD5蛋白表达水平 收集脑组织样本,经裂解、研磨、离心后取上清,BCA法测定蛋白浓度。行SDS-PAGE凝胶电泳,蛋白上样10 μg。经电泳(80 V)、转膜(200 mA,100 min)后,用50 g/L脱脂奶粉封闭1 h,加一抗(1∶1 000)4 ℃孵育过夜,加二抗(1∶20 000)室温孵育1 h,化学发光法显影。用Image J(1.52a)软件分析条带灰度值,计算PTEN和JMJD5蛋白的相对表达量。
1.2.5 TTC染色 MCAO 24 h后,大鼠腹腔注射100 g/L水合氯醛麻醉,用生理盐水进行心脏灌注。剥离脑组织置于冠状位脑槽中,2 mm厚度切片。将脑片置于200 g/L TTC 溶液中37 ℃避光孵育30 min,每隔10 min摇晃1次[9]。染色后正常脑组织呈红色,梗死脑组织变白。用组织固定液浸泡24 h,PBS冲洗3次。按解剖结构从前向后摆放脑片,用扫描仪采集图像,用Image J软件定量检测各组梗死面积。
1.2.6 行为学检测 依据文献所述方法[10],使用mNSS对大鼠神经功能缺损情况进行评定。量表分值为0~18分,评分越高,神经系统损害就越严重。0分表示无功能缺损;1~6分为轻度损伤,7~12分为中度损伤,13~18分为重度损伤。
1.3 统计学分析
应用Graphpad Prism 9软件进行统计学分析。计量资料以±s表示,两组比较采用t检验;多组单因素比较采用单因素方差分析(ANOVA),两两比较采用LSD-t检验;各组不同时间mNSS得分的比较采用双因素方差分析,多重比较采用Tukey法。以P<0.05为差异有统计学意义。
2 结 果
2.1 缺血损伤脑组织中PTEN和JMJD5蛋白的表达变化Western blot检测结果显示,各组PTEN和JMJD5蛋白表達比较差异具有统计学意义(F=20.70、15.41,P<0.05)。与Control组比较,Sham组PTEN和JMJD5蛋白表达水平没有明显的变化(t=0.03、0.05,P>0.05)。随缺血损伤时间延长,MCAO 3、6、9 h组大鼠脑组织中PTEN蛋白表达水平逐渐增加,JMJD5蛋白表达水平逐渐下降,与Sham组比较差异均有显著意义(F=20.70、15.41,t=2.13~7.28,P<0.05)。见图1。
2.2 PTEN对JMJD5蛋白表达的影响
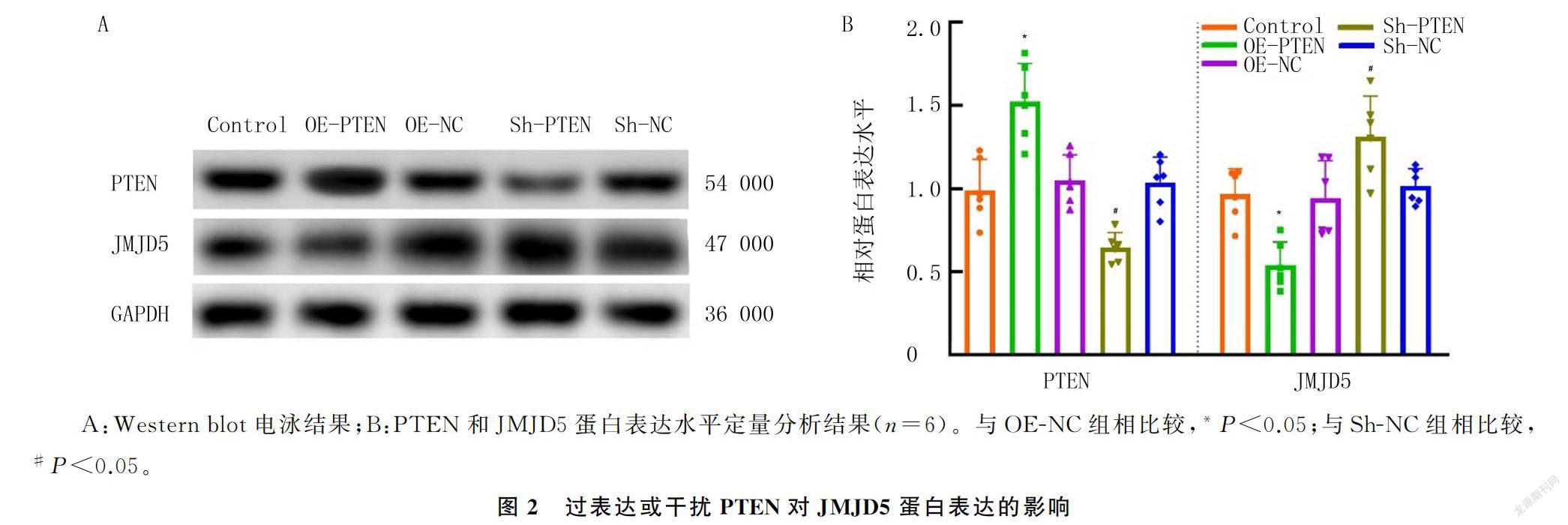
Western blot检测结果显示,各组PTEN和JMJD5蛋白表达水平比较差异具有统计学意义(F=20.65、14.10,P<0.05)。与OE-NC组比较,OE-PTEN组PTEN蛋白表达水平升高(t=4.86,P<0.05);与Sh-NC组比较,Sh-PTEN组PTEN蛋白表达水平下降(t=4.03,P<0.05)。上述结果表明PTEN过表达和干扰模型构建成功。与OE-NC组比较,OE-PTEN组JMJD5蛋白表达水平明显下降(t=3.88,P<0.05);与Sh-NC组比较,Sh-PTEN组JMJD5蛋白表达水平明显升高(t=2.88,P<0.05)。见图2。
2.3 JMJD5表达水平对梗死面积的影响
PCR检测结果显示,各组JMJD5 mRNA表达水平比较差异具有统计学意义(F=11.81,P<0.05)。与OE-NC组(0.96±0.27)比较,OE-JMJD5组(2.40±0.99)JMJD5 mRNA水平升高(t=4.71,P<0.05);与Sh-NC组(1.04±0.48)相比较,Sh-JMJD5组(0.40±0.18)JMJD5 mRNA水平降低(t=2.06,P<0.05)。表明JMJD5过表达和干扰模型构建成功。TTC染色结果显示,缺血损伤程度受到JMJD5蛋白水平影响(F=10.58,P<0.05)。与OE-NC组相比较,OE-JMJD5组梗死面积减小(t=3.92,P<0.05);与Sh-NC组比较,Sh-JMJD5组梗死面积增加(t=2.38,P<0.05)。见图3。
2.4 Bpv(HOpic)对损伤脑组织JMJD5表达影响
与NS组比较,给予Bpv(HOpic)处理后Bpv组大鼠损伤脑组织中JMJD5蛋白表达水平明显升高(t=3.32,P<0.05)。见图4。
2.5 下调JMJD5表达对Bpv(HOpic)神经保护作用的影响
Bpv(HOpic)干预14 d时,与MCAO+NS组相比较,Sh-NC+MCAO+Bpv组mNSS评分降低(F=4.19,q=6.69,P<0.05),表明神经功能缺损症状减轻;与Sh-NC+MCAO+Bpv组相比较,Sh-JMJD5+MCAO+Bpv组的mNSS评分升高(q=6.16,P<0.05),神经功能缺损症状加重。见表2。
3 讨 论
脑卒中是严重危害人类健康的疾病之一,根据病理基础可分为缺血性脑卒中和出血性脑卒中,其中缺血性脑卒中占总数的85%左右[11]。缺血发生后,神经元细胞无法维持正常的跨膜离子梯度和平衡,从而导致一系列细胞死亡过程(细胞凋亡、兴奋性毒性、氧化应激和炎症)的发生。这些病理生理过程严重损害神经元细胞、神经胶质细胞和内皮细胞,并且这些过程相互关联,相互触发,形成恶性循环,最终导致神经元细胞凋亡或坏死。目前脑卒中主要的治疗方法是血管再通及神经保护治疗[12]。由于缺乏对缺血损伤后神经元死亡的细胞及分子机制的深入了解,目前仍然没有有效的神经保护治疗手段。
PTEN基因位于人类染色体杂合体缺失的高发区10q23.3位点,其编码蛋白由403个氨基酸构成,是双特异蛋白磷酸酶家族(DSPs)的成员,同时具有脂质磷酸酶和蛋白酪氨酸磷酸酶活性,可调控细胞间的黏附作用与细胞核内周期变化。PTEN具有广泛的生物学功能,可以通过磷脂酰肌醇-3-激酶(PI3K)/AKT、FAK和MAPK信号转导通路调节细胞的生长、凋亡、迁移和转化等[13]。PTEN可以通过调控原癌基因PI3K和蛋白激酶B(PKB)阻断PI3K途径[14]。另外,在缺血性脑梗死中,PTEN通过PI3K/Akt/GSK-3β信号通路参与了细胞焦亡的调节[15]。本研究团队之前的结果显示,在脑出血模型中,PTEN抑制剂Bpv(pis)通过PTEN/E2F1/β-Catenin发挥保护作用,减轻大脑损伤[16]。本文研究结果显示,在大鼠MCAO模型中,随着缺血时间的延长,损伤脑组织中PTEN的表达逐渐增加,而JMJD5的表达逐渐下降。
JMJD5又称为KDM8,是最近确定的一种含有Jumonji结构域的组蛋白去甲基化酶,以特征性的JmjC结构域为酶活性中心,催化组蛋白的去甲基化修饰过程。
有研究通过流式细胞术分析了健康大鼠中枢神经系统中26种Jumonji基因mRNA水平的差异,发现JMJD5在所有细胞中均有表达,包括神经元(NeuN+)、星形胶质细胞(GFAP+)和小胶质细胞(CD11b+),以在小胶质细胞中的表达最高[17]。JMJD5也可以与丙酮酸激酶M2型(PKM2)直接结合,促进PKM2核转位,进而促进Hif1-α介导的反式激活,调控肿瘤细胞的代谢[18]。最近一项关于动静脉畸形(AVM)的研究表明,JMJD5与SOX2相互作用,促进了内皮-间充质转化[19]。本研究通过构建PTEN过表达及干扰模型,证明PTEN作为JMJD5的上游调控信号,可以负向调控JMJD5的表达。为证明JMJD5在缺血脑损伤中的作用,本研究构建了JMJD5干扰和过表达模型,结果表明,上调JMJD5表达可减小MCAO大鼠的梗死面积,而下调JMJD5表达则导致梗死面积增大。提示缺血损伤后增加JMJD5的水平可能是一种有效的神经保护措施。
Bpv(HOpic)是一种商业化的PTEN抑制剂,能够调控PTEN下游信号的表达[20]。一项关于神经轴突再生的研究结果表明,Bpv(HOpic)可促进大鼠原代海马和皮质神经元中HB-GAM的表达[21]。Bpv(HOpic)对异氟醚暴露脑损伤和认知缺陷也具有保護作用[22]。本研究结果表明,Bpv(HOpic)可逆转PTEN对JMJD5的抑制,促进JMDJ5的表达,改善大鼠的神经功能缺陷。而敲低JMJD5表达可以阻断Bpv(HOpic)的保护作用,说明JMJD5介导了Bpv(HOpic)的神经保护作用。但JMJD5如何通过下游信号发挥神经保护作用仍然未知,需要进一步研究。
综上所述,PTEN-JMJD5信号通路参与了缺血脑损伤过程。PTEN抑制剂Bpv(HOpic)可以通过上调JMJD5表达减小梗死面积,改善大鼠神经功能缺损,发挥神经保护作用。
[参考文献]
[1]SAUNDERS D H, SANDERSON M, HAYES S, et al. Physical fitness training for patients with stroke[J]. Stroke, 2020,51(11):e299-e300.
[2]BERNHARDT J, ZOROWITZ R D, BECKER K J, et al. Advances in stroke 2017[J]. Stroke, 2018,49(5):e174-e199.
[3]LIU B S, LI L J, ZHANG Q G, et al. Preservation of GABAA receptor function by PTEN inhibition protects against neuronal death in ischemic stroke[J]. Stroke, 2010,41(5):1018-1026.
[4]ZHANG Q, QI S K, XU M C, et al. Structure-function analysis reveals a novel mechanism for regulation of histone deme-
thylase LSD2/AOF1/KDM1b[J]. Cell Research, 2013,23(2):225-241.
[5]ZHANG Z F, CHEN J, HAN X, et al. Bisperoxovandium (pyridin-2-squaramide) targets both PTEN and ERK1/2 to confer neuroprotection[J]. British Journal of Pharmacology, 2017,174(8):641-656.
[6]WOZNIAK D J, KAJDACSY-BALLA A, MACIAS V, et al. PTEN is a protein phosphatase that targets active PTK6 and inhibits PTK6 oncogenic signaling in prostate cancer[J]. Nature Communications, 2017,8(1):1508.
[7]ZHAO Z H, SUN C T, LI F Q, et al. Overexpression of histone demethylase JMJD5 promotes metastasis and indicates a poor prognosis in breast cancer[J]. International Journal of Clinical and Experimental Pathology, 2015,8(9):10325-10334.
[8]ZHANG R, HUANG Q J, LI Y P, et al. JMJD5 is a potential oncogene for colon carcinogenesis[J]. International Journal of Clinical and Experimental Pathology, 2015,8(6):6482-6489.
[9]WEXLER E J, PETERS E E, GONZALES A, et al. An objective procedure for ischemic area evaluation of the stroke intraluminal thread model in the mouse and rat[J]. Journal of Neuroscience Methods, 2002,113(1):51-58.
[10]SAKATA H, NARASIMHAN P, NIIZUMA K, et al. Interleukin 6-preconditioned neural stem cells reduce ischaemic injury in stroke mice[J]. Brain: a Journal of Neurology, 2012,135(Pt 11):3298-3310.
[11]FEIGIN V L, FOROUZANFAR M H, KRISHNAMURTHI R, et al. Global and regional burden of stroke during 1990—2010: findings from the Global Burden of Disease Study 2010[J]. Lancet (London, England), 2014,383(9913):245-254.
[12]PRABHAKARAN S, RUFF I, BERNSTEIN R A. Acute stroke intervention: a systematic review[J]. JAMA, 2015,313(14):1451-1462.
[13]WORBY C A, DIXON J E. PTEN[J]. Annual Review of Biochemistry, 2014,83:641-669.
[14]LEE Y R, CHEN M, PANDOLFI P P. The functions and re-
gulation of the PTEN tumour suppressor: new modes and prospects[J]. Nature Reviews Molecular Cell Biology, 2018,19(9):547-562.
[15]DIAO M Y, ZHU Y, YANG J, et al. Hypothermia protects neurons against ischemia/reperfusion-induced pyroptosis via m6A-mediated activation of PTEN and the PI3K/Akt/GSK-3β signaling pathway[J]. Brain Research Bulletin, 2020,159:25-31.
[16]ZHAO D, QIN X P, CHEN S F, et al. PTEN inhibition protects against experimental intracerebral hemorrhage-induced brain injury through PTEN/E2F1/β-catenin pathway[J]. Frontiers in Molecular Neuroscience, 2019,12:281.
[17]SMITH S M, KIMYON R S, WATTERS J J. Cell-type-specific Jumonji histone demethylase gene expression in the healthy rat CNS: detection by a novel flow cytometry method[J]. ASN Neuro, 2014,6(3):193-207.
[18]WANG H J, HSIEH Y J, CHENG W C, et al. JMJD5 regulates PKM2 nuclear translocation and reprograms HIF-1α-mediated glucose metabolism[J]. PNAS, 2014,111(1):279-284.
[19]YAO J Y, WU X J, ZHANG D Q, et al. Elevated endothelial Sox2 causes lumen disruption and cerebral arteriovenous malformations[J]. The Journal of Clinical Investigation, 2019,129(8):3121-3133.
[20]CHAUHAN A, SAH D K, KUMARI N, et al. PTEN inhibitor bpV(HOpic) confers protection against ionizing radiation[J]. Scientific Reports, 2021,11(1):1720.
[21]RAUVALA H, PAVELIEV M, KUJA-PANULA J, et al. Inhibition and enhancement of neural regeneration by chondroitin sulfate proteoglycans[J]. Neural Regeneration Research, 2017,12(5):687-691.
[22]TAN L, CHEN X, WANG W, et al. Pharmacological inhibition of PTEN attenuates cognitive deficits caused by neonatal repeated exposures to isoflurane via inhibition of NR2B-mediated tau phosphorylation in rats[J]. Neuropharmacology, 2017,114:135-145.
(本文編辑 马伟平)

