白及多糖对烟曲霉菌诱导巨噬细胞炎症的调节作用
纪晓月 彭旭东 战璐 张冉冉 赵桂秋

[摘要] 目的 探討白及多糖(BSP)对烟曲霉菌诱导的小鼠巨噬细胞炎症反应的调节作用。
方法 通过CCK-8细胞毒性实验检测0、1、2、4、8、16、32、64、128 g/L的BSP溶液对巨噬细胞活力的影响;烟曲霉菌灭活菌丝感染RAW264.7细胞后给予16 g/L的BSP溶液进行处理,应用RT-PCR方法检测其炎症因子白细胞介素1β(IL-1β)、白细胞介素6(IL-6)、肿瘤坏死因子α(TNF-α)和模式识别受体LOX-1 mRNA的表达;应用ELISA和Western blot方法检测炎症因子IL-1β、IL-6、TNF-α和模式识别受体LOX-1蛋白的表达。
结果 不超过32 g/L的BSP不影响RAW264.7细胞活性(F=0.08~2.09,P>0.05)。BSP可以显著降低烟曲霉菌刺激所引起的巨噬细胞模式识别受体LOX-1和下游炎症因子IL-1β、IL-6和TNF-α的mRNA表达(F=341.20~1 112.33,P<0.001)和蛋白表达(F=74.20~641.34,P<0.001)。
结论 BSP通过下调巨噬细胞中模式识别受体LOX-1表达,抑制下游促炎因子表达,发挥对烟曲霉菌感染后的抗炎作用。
[关键词] 白及多糖;巨噬细胞;烟曲霉菌;炎症
[中图分类号] R392.5;R379.6
[文献标志码] A
[文章编号] 2096-5532(2022)05-0662-05doi:10.11712/jms.2096-5532.2022.58.131
[开放科学(资源服务)标识码(OSID)]
[网络出版] https://kns.cnki.net/kcms/detail/37.1517.R.20220713.1059.011.html;2022-07-14 08:58:07
REGULATORY EFFECT OF BLETILLA STRIATA POLYSACCHARIDES ON MACROPHAGE INFLAMMATION INDUCED BY ASPERGILLUS FUMIGATUS
JI Xiaoyue, PENG Xudong, ZHAN Lu, ZHANG Ranran, ZHAO Guiqiu
(Department of Ophthalmology, The Affiliated Hospital of Qingdao University, Qingdao 266003, China);
[ABSTRACT] Objective To investigate the regulatory effect of Bletilla striata polysaccharides (BSP) on the inflammatory response of mouse macrophages induced by Aspergillus fumigatus.Methods CCK-8 cytotoxicity assay was used to investigate the influence of BSP on macrophage viability at the concentrations of 0,1,2,4,8,16,32,64, and 128 g/L. RAW264.7 cells were infected by the inactivated hyphae of Aspergillus fumigatus and then treated with 16 g/L BSP solution; real-time PCR was used to measure the mRNA expression levels of the inflammatory cytokines interleukin-1β (IL-1β), interleukin-6 (IL-6), and tumor necrosis factor-α (TNF-α) and the pattern recognition receptor LOX-1, and ELISA and Western blot were used to measure the protein expression levels of the inflammatory factors IL-1β, IL-6, and TNF-α and the pattern recognition receptor LOX-1.Results BSP with a concentration of ≤32 g/L did not affect the viability of RAW264.7 cells (F=0.08-2.09,P>0.05). BSP significantly reduced the mRNA and protein expression levels of the macrophage pattern recognition receptor LOX-1 and the downstream inflammatory cytokines IL-1β, IL-6, and TNF-α induced by Aspergillus fumigatus stimulation (mRNA expression: F=341.20-1 112.33,P<0.001; protein expression: F=74.20-641.34,P<0.001).Conclusion BSP exerts an anti-inflammatory effect after Aspergillus fumigatus infection by downregulating the pattern recognition receptor LOX-1 in macrophages and inhibiting the expression of downstream proinflammatory factors.
[KEY WORDS] Bletilla striata polysaccharide; macrophages; Aspergillus fumigatus; inflammatory
烟曲霉菌作为一种常见的条件致病性真菌,其分生孢子直径为2~3 μm,在自然界中无处不在,可漂浮在空气中。当机体免疫力低下,抵抗真菌侵袭的能力下降,烟曲霉菌极易在体内黏附、繁殖、形成生物膜,逃避免疫清除,侵害机体;同时烟曲霉菌能够释放多种蛋白酶水解机体组织结构,扩大真菌的感染范围,引起机体严重的损伤。巨噬细胞作为机体抵抗真菌的第一道防线,分泌特定的细胞因子来激活其他免疫细胞,并对烟曲霉菌起到清除作用,但是过量的细胞因子则会造成过度的炎症反应,不仅不利于组织的修复还会损伤正常的组织细胞。白及多糖(BSP)是一种从中药白及中提取出的多糖类物质,具有抗炎、抗氧化、抗肿瘤等多种药理活性作用。既往研究发现,BSP可以通过下调JAK/STAT信号通路中的JAK2表达水平来抑制肿瘤坏死因子α(TNF-α)、白细胞介素6(IL-6)和白细胞介素1β(IL-1β)的释放,从而发挥抗炎作用。本研究旨在探讨BSP对烟曲霉菌感染后巨噬细胞产生的炎症反应的调节作用,为烟曲霉菌感染所致的炎症性疾病治疗提供一种新的思路。
1 材料与方法
1.1 实验材料
小鼠RAW264.7巨噬细胞株购自中国科学院上海细胞库。烟曲霉菌菌株(NO3.0772)来自中国北京普通微生物培养物保藏中心,根据林浩等研究方法进行烟曲霉菌灭活菌丝的制备。
1.2 RAW264.7细胞处理
RAW264.7细胞接种于6孔板或12孔板中,细胞密度约为5×10/L,37 ℃培养24 h后,加入灭活烟曲霉菌菌丝刺激1 h,再加入16 g/L 的BSP。将细胞分为空白组(N组)、单纯BSP处理组(N+BSP组)、单纯灭活菌丝处理组(AF组)及加菌加药处理组(AF+BSP组),分别给予相应的处理。在菌丝感染8 h后收集12孔板中的细胞用于实时荧光定量PCR(RT-PCR)实验;菌丝感染24 h后收集6孔板中的细胞培养液,离心后取上清液用于ELISA实验;吸出6孔板中细胞培养液后,在孔中加入蛋白裂解液(RIPA裂解液∶PMSF∶磷酸酶抑制剂=98∶1∶1),应用细胞刮刮取细胞收集至EP管中,用于Western blot实验。
1.3 BSP细胞毒性测定
将RAW264.7细胞悬浮液100 μL接种于96孔板中,加入100 μL含有胎牛血清的DMEM细胞培养液,置于37 ℃培养24 h。每孔中加入不同浓度的BSP(0、1、2、4、8、16、32、64、128 g/L),同一浓度设6个复孔,孵育48 h。再将每孔中加入10 μL的CCK-8试剂(MCE,美国),孵育2 h。使用酶标仪(PerkinElimer,美国)测定各孔450 nm波长处的吸光度值。
1.4 RT-PCR方法检测相关炎症因子mRNA表达
提取细胞总mRNA,干燥后,加入适量DEPC水(生工生物工程(上海)股份有限公司)混匀。按照Prime Script RTreagent Kit With gDNA Eraser试剂盒(TaKaRa,中国大连)逆转录步骤,建立20 μL逆转录反应体系,其中包含: SYBR 10.0 μL,上游引物、下游引物各0.5 μL,cDNA模板2.0 μL,RNase Free dHO 7.0 μL。合成cDNA,应用RT-PCR仪(Eppendorf公司,德国)进行PCR扩增反应,将β-actin作为内参照,分别检测模式识别受体LOX-1和炎癥因子IL-1β、IL-6、TNF-α的mRNA表达。引物及其序列见表1。
1.5 ELISA实验检测IL-1β、IL-6和TNF-α的蛋白表达
应用鼠IL-1β、IL-6和TNF-α酶联免疫吸附测定试剂盒(R&D Systems,SanDiego,CA,美国),采用双抗体夹心法检测RAW264.7细胞分泌的IL-1β、IL-6和TNF-α的蛋白表达水平,使用酶标仪检测样品在450 nm波长处的吸光度。
1.6 Western blot方法检测模式识别受体LOX-1的蛋白表达
根据BCA蛋白浓度测定试剂盒(Elabscience,中国武汉)的步骤检测细胞蛋白浓度并计算各样本上样量,将样品和Marker加入到胶板孔道中。连接电泳仪,至Buffer跑到胶底终止电泳。胶体通过SDS-PAGE电转液的湿转盒将蛋白转移到PVDF膜上,加入适量PBST洗涤液进行洗膜。摇洗后加入封闭液(beyotime,中国北京)室温封闭1 h,将封闭好的PVDF膜置于LOX-1(1∶1 000,abcam,英国)或GAPDH(1∶1 000,Elabscience,中国武汉)中4 ℃孵育过夜。PBST洗涤液洗膜,加入山羊抗兔二抗(1∶2 000,Elabscience,中国武汉)室温孵育1 h;PVDF膜浸润显影液(Bio-Rad,美国)进行显影并拍照。用Image J软件定量分析各组蛋白条带的灰度值。
1.7 统计学处理
应用Graph Pad 8.0软件进行统计学处理。计量资料数据以±s表示,数据间比较采用单因素方差分析及双因素析因方差分析。P<0.05表示差异有统计学意义。
2 结 果
2.1 不同浓度BSP溶液对RAW264.7细胞活力的影响
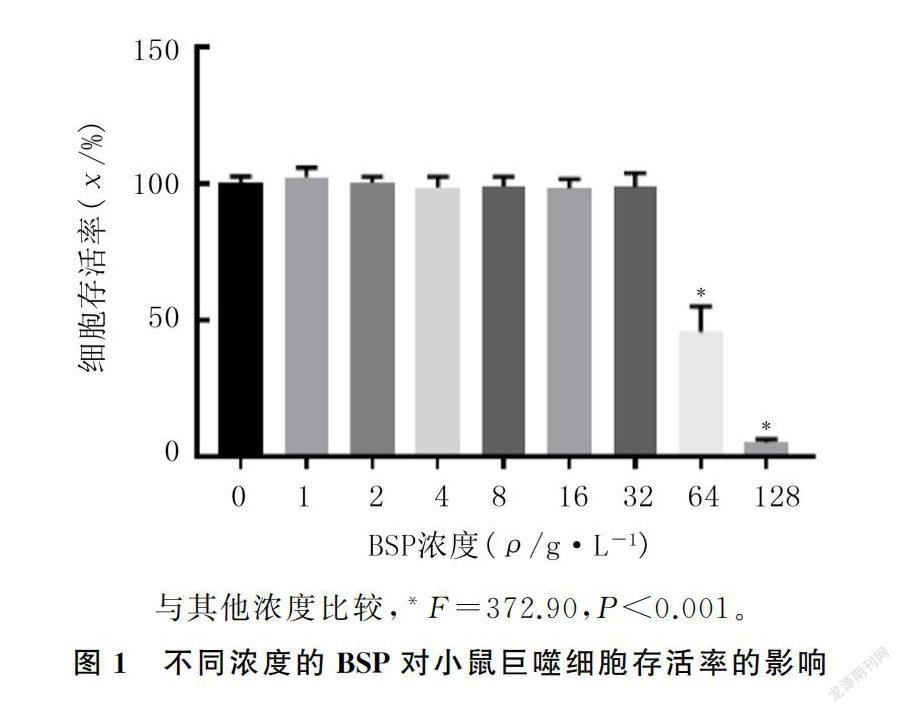
终浓度为0、1、2、4、8、16、32、64、128 g/L的BSP溶液处理RAW264.7细胞48 h后, 64 g/L和128 g/L的 BSP溶液处理组RAW264.7细胞存活率与其他浓度处理组比较差异有统计学意义(F=372.90,P<0.001)。32 g/L浓度以内的BSP溶液处理组的细胞存活率比较差异无统计学意义(P>0.05)。见图1。
2.2 BSP对烟曲霉菌诱导的小鼠巨噬细胞炎症因子mRNA表达的影响
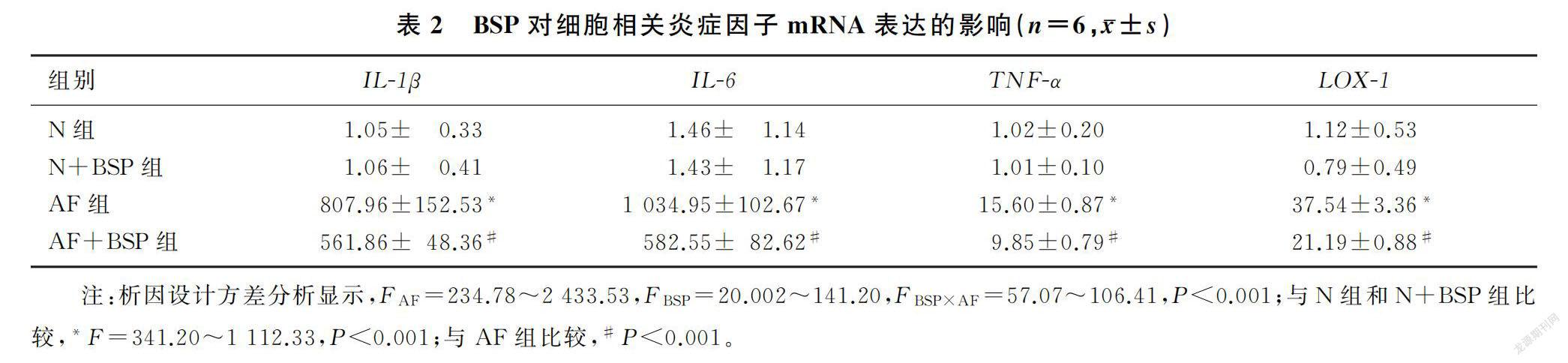
析因设计的方差分析结果显示,灭活菌丝处理产生的单独效应(F=234.78~2 433.53,P<0.001)、BSP处理产生的单独效应(F=20.002~141.20,P<0.001)、不同灭活菌丝处理组间(FAF=823.66~1 827.71,P<0.001)和不同BSP处理组间(FBSP=57.07~104.17,P<0.001)差异均具有统计学意义,两处理因素有交互作用(FBSP×AF=57.07~106.41,P<0.001)。AF组中模式识别受体LOX-1和炎症因子IL-1β、IL-6、TNF-α的mRNA表达水平较N组和N+BSP组明显升高;AF+BSP组与AF组相比,模式识别受体LOX-1和炎症因子IL-1β、IL-6、TNF-α的mRNA表达明显降低,差异均有统计学意义(F=341.20~1 112.33,P<0.001)。见表2。
2.3 BSP对烟曲霉菌诱导的小鼠巨噬细胞炎症因子蛋白表达的影响
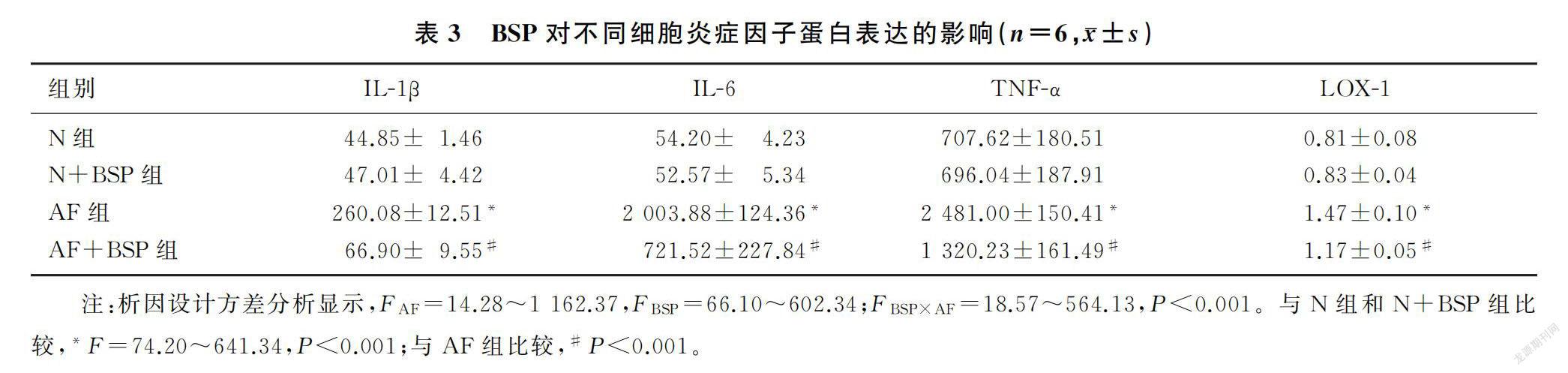
析因设计的方差分析结果显示,灭活菌丝处理产生的单独效应(F=14.28~1 162.37,P<0.001)、BSP处理产生的单独效应(F=66.10~602.34,P<0.001)、不同灭活菌丝处理组间(FAF=189.93~817.66,P<0.001)和不同BSP处理组间(FBSP=14.10~542.23,P<0.001)差异均具有统计学意义,并且两处理因素交互间也有统计学意义(FBSP×AF=18.57~564.13,P<0.001)。AF组中模式识别受体LOX-1和下游炎症因子IL-1β、IL-6、TNF-α的蛋白表达水平较N组和N+BSP组明显升高;经过BSP处理后,AF+BSP组与AF组相比,模式识别受体LOX-1和炎症因子IL-1β、IL-6、TNF-α的蛋白表达水平明显下降,差异均有统计学意义(F=74.20~641.34,P<0.001)。见表3。
3 讨 论
当烟曲霉菌侵袭机体时,机体自身免疫是抵御真菌的首要因素,并且机体的免疫防御和免疫耐受之间的动态平衡在清除真菌的过程中起着重要作用。真菌侵入机体后,真菌结构中的某些成分可以作为病原体相关分子模式被巨噬细胞吞噬并识别,使其分泌相关炎症因子,激活机体炎症级联反应,趋化其他免疫细胞共同抵抗病原菌的入侵并且消灭病原体。既往研究表明,固有免疫在煙曲霉菌感染过程中,尤其在早期进程中起决定性作用,巨噬细胞作为固有免疫的“先头部队”,其直接杀伤力仅次于中性粒细胞,并间接参与抗感染调节,在抗炎治疗中具有诊断价值。
近来研究发现,BSP作为从中药白及中提取出的一种多糖类物质,具有良好的抗炎活性,在医药领域有着广泛的应用前景。巨噬细胞作为BSP发挥抗炎作用的主要靶细胞,能够吞噬真菌孢子和菌丝,完成抗原提呈,同时作为第一线防御细胞趋化其他免疫细胞,激活免疫系统,引发免疫应答,在抵抗烟曲霉菌所致的感染性疾病中发挥着重要作用。已有研究发现,巨噬细胞通过其细胞膜表面的模式识别受体,识别某些烟曲霉菌细胞壁成分,进一步触发巨噬细胞对烟曲霉菌的吞噬、抗原提呈以及杀伤作用。LOX-1属于C型凝集素受体家族,在宿主防御中起到促炎作用。已有研究结果表明,LOX-1是在巨噬细胞抗烟曲霉菌感染中发挥重要作用的模式识别受体之一。它可以通过炎症信号传导通路促进IL-1β、IL-6和TNF-α等因子的表达,因此适当控制LOX-1的表达水平有利于抑制炎性细胞因子的表达从而起到炎症保护作用。IL-1β是一种主要由活化的单核-巨噬细胞、淋巴细胞等产生的细胞因子,通过与IL-1受体结合后发挥免疫调节、趋化中性粒细胞作用,引起炎症递质的释放,导致烟曲霉菌性角膜炎症的形成。TNF-α是一种主要由巨噬细胞和单核细胞分泌的促炎细胞因子,在机体应激反应及病理状态下最早出现并且产生增多。IL-6是全身或局部急性炎症反应的标志因子。
本文研究结果显示,32 g/L浓度内的BSP对RAW264.7细胞无毒性作用,不影响其细胞活性;烟曲霉菌感染的巨噬细胞中模式识别受体LOX-1和下游促炎因子IL-1β、IL-6和TNF-α的表达水平显著升高,这与前期研究结果一致。有研究发现,在人肾小球细胞和人角质细胞中,BSP可以通过调节炎症因子的释放来发挥抗炎作用,对炎症引起损伤的细胞具有一定的保护作用。本研究通过RT-PCR、ELISA和Western blot等检测显示,BSP能够显著降低烟曲霉菌刺激引起的巨噬细胞中模式识别受体LOX-1以及相关炎症因子如IL-1β、IL-6和TNF-α的表达水平。
综上所述,BSP能够通过抑制模式识别受体LOX-1和下游炎症因子表达,降低烟曲霉菌感染后的炎症反应,但BSP在真菌感染性疾病中的具体抗炎机制还需进一步研究。
[参考文献]
[1]LATGÉ J P. Aspergillus fumigatus and aspergillosis[J]. Clinical Microbiology Reviews,1999,12(2):310-350.
[2]DENNING D W, O’DRISCOLL B R, HOGABOAM C M, et al. The link between fungi and severe asthma: a summary of the evidence[J]. The European Respiratory Journal, 2006,27(3):615-626.
[3]SAMALOVA M, CARR P, BROMLEY M, et al. GPI anchored proteins in Aspergillus fumigatus and cell wall morphogenesis[J]. Current Topics in Microbiology and Immunology, 2020,425:167-186.
[4]JIANG N, ZHANG L, ZHAO G Q, et al. Indoleamine 2,3-dioxygenase regulates macrophage recruitment, polarization and phagocytosis in Aspergillus fumigatus keratitis[J]. Investigative Opthalmology & Visual Science, 2020,61(8):28.
[5]吴丹,李芳秋. 巨噬细胞在烟曲霉感染中的作用[J]. 医学研究生学报, 2009,22(11):1206-1210.
[6]UNDERHILL D M, OZINSKY A, HAJJAR A M, et al. The Toll-like receptor 2 is recruited to macrophage phagosomes and discriminates between pathogens[J]. Nature,1999,401(6755):811-815.
[7]OZINSKY A, UNDERHILL D M, FONTENOT J D, et al. The repertoire for pattern recognition of pathogens by the innate immune system is defined by cooperation between toll-like receptors[J]. Proceedings of the National Academy of Sciences of the United States of America, 2000,97(25):13766-13771.
[8]HE X R, WANG X X, FANG J C, et al. Bletilla striata: medicinal uses, phytochemistry and pharmacological activities[J]. Journal of Ethnopharmacology, 2017,195:20-38.
[9]JIANG S, WANG M Y, JIANG L, et al. The medicinal uses of the genus Bletilla in traditional Chinese medicine: a phytochemical and pharmacological review[J]. Journal of Ethnopharmacology, 2021,280:114263.
[10]YANG R Y, WANG D Y, LI H L, et al. Preparation and characterization of Bletilla striata polysaccharide/polylactic acid composite[J]. Molecules (Basel, Switzerland), 2019,24(11):2104.
[11]YUE L, WANG W, WANG Y, et al. Bletilla striata polysaccharide inhibits angiotensin Ⅱ-induced ROS and inflammation via NOX4 and TLR2 pathways[J]. International Journal of Biological Macromolecules, 2016,89:376-388.
[12]王剛,常明泉,杨光义,等. 白及多糖对氧化损伤的人角质形成细胞JAK/STAT信号通路的影响[J]. 医药导报, 2012,31(6):701-705.
[13] 林浩,王谦,赵桂秋. 安石榴苷对烟曲霉菌诱导小鼠巨噬细胞炎症反应影响[J]. 青岛大学学报(医学版), 2021,57(3):402-406.
[14]SALES-CAMPOS H, TONANI L, CARDOSO C R, et al. The immune interplay between the host and the pathogen in Aspergillus fumigatus lung infection[J]. BioMed Research International, 2013, 2013:693023.
[15]张笑影,刘正印,李太生. 真菌感染状态下免疫抵抗和免疫耐受的平衡机制[J]. 中华医学杂志, 2013,93(6):477-479.
[16]VAN DE VEERDONK F L, GRESNIGT M S, ROMANI L, et al. Aspergillus fumigatus morphology and dynamic host interactions[J]. Nature Reviews Microbiology, 2017,15(11): 661-674.
[17]LATGÉ J P, BEAUVAIS A, CHAMILOS G. The cell wall of the human fungal pathogen Aspergillus fumigatus: biosynthesis, organization, immune response, and virulence[J]. Annual Review of Microbiology, 2017,71:99-116.
[18]CHEN Z Y, CHENG L Z, HE Y C, et al. Extraction, characterization, utilization as wound dressing and drug delivery of Bletilla striata polysaccharide: a review[J]. International Journal of Biological Macromolecules, 2018,120(Pt B):2076-2085.
[19]JI X L, YIN M S, NIE H, et al. A review of isolation, chemical properties, and bioactivities of polysaccharides from Bletilla striata[J]. BioMed Research International, 2020, 2020:5391379.
[20]ZHAO Y, NIU J J, CHENG X C, et al. Chemical consti-tuents from Bletilla striata and their NO production suppression in RAW 264.7 macrophage cells[J]. Journal of Asian Na-tural Products Research, 2018,20(4):385-390.
[21]SERRANO-GMEZ D, DOMNGUEZ-SOTO A, ANCOCHEA J, et al. Dendritic cell-specific intercellular adhesion molecule 3-grabbing nonintegrin mediates binding and interna-lization of Aspergillus fumigatus conidia by dendritic cells and macrophages[J]. Journal of Immunology (Baltimore, Md:1950), 2004,173(9):5635-5643.
[22]LUTHER K, TOROSANTUCCI A, BRAKHAGE A A, et al. Phagocytosis of Aspergillus fumigatus conidia by murine macrophages involves recognition by the dectin-1 beta-glucan receptor and Toll-like receptor 2[J]. Cellular Microbiology, 2007,9(2):368-381.
[23]ZHANG P, LIU M C, CHENG L L, et al. Blockade of LOX-1 prevents endotoxin-induced acute lung inflammation and injury in mice[J]. Journal of Innate Immunity, 2009,1(4):358-365.
[24]ZHAO G Q, HU M, LI C, et al. Osteopontin contributes to effective neutrophil recruitment, IL-1β production and apoptosis in Aspergillus fumigatus keratitis[J]. Immunology and Cell Biology, 2018,96(4):401-412.
[25]YANG H, WANG Q, HAN L, et al. Nerolidol inhibits the LOX-1/IL-1β signaling to protect against the Aspergillus fumigatus keratitis inflammation damage to the cornea[J]. International Immunopharmacology, 2020,80:106118.
[26]GABAY C, LAMACCHIA C, PALMER G. IL-1 pathways in inflammation and human diseases[J]. Nature Reviews Rheumatology, 2010,6 (4):232-241.
[27]HUANG H L, PARK P H, MCMULLEN M R, et al. Me-chanisms for the anti-inflammatory effects of adiponectin in macrophages[J]. Journal of Gastroenterology and Hepatology, 2008,23(Suppl 1): S50-S53.
[28]XING Z, GAULDIE J, COX G, et al. IL-6 is an antiinflammatory cytokine required for controlling local or systemic acute inflammatory responses[J]. The Journal of Clinical Investigation,1998,101(2):311-320.
[29]ZHU X J, PENG X D, LIN J, et al. Lipoxin A4 activates ALX/FPR2 to attenuate inflammation in Aspergillus fumigatus keratitis[J]. International Immunopharmacology, 2021,96:107785.
(本文編辑 黄建乡)

