胆南星对四氯化碳致小鼠急性肝损伤的保护作用及机制研究 Δ
史丛晶 ,邓雅方 ,张志宏 ,李彪 ,苏慧琳 ,彭东辉 ,曾元宁 ,王秋红 (.广东药科大学中药学院/广东省中药饮片规范化炮制工程技术研究中心,广州 50006;.黑龙江中医药大学药学院/教育部北药基础与应用研究重点实验室/黑龙江中药及天然药物药效物质基础研究重点实验室,哈尔滨 50040)
肝脏在人体代谢、解毒过程中起着举足轻重的作用,是人体最主要的新陈代谢器官。外伤、病毒性感染、自身免疫病变或摄入某些外源性化学物质(如药物、毒素、酒精等)都可导致肝损伤,严重的会发展成为肝硬化甚至肝癌,危害人类健康[1]。近年,中医药在防治肝损伤方面获得了较大进展[2]。现代研究表明,中药可以通过抗氧化自由基损伤、减少炎症和凋亡相关介质的产生、改善肝功能、改善微循环、调节免疫功能等途径治疗肝损伤[3]。此外,越来越多的证据表明,酪氨酸激酶2(Janus kinase 2,JAK2)/信号传导及转录激活因子 3(signal transducer and activator of transcription3,STAT3)/核因子κB(nuclear factor kappa-B,NF-κB)信号通路介导的持续肝脏炎症可能在肝星状细胞激活和肝损伤形成过程中发挥重要作用[4]。
胆南星(Arisaema Cum Bile)为制天南星的细粉与牛、羊或猪的胆汁一起加工而成,或为生天南星细粉与牛、羊或猪的胆汁一起发酵加工而成[5]。其味苦、微辛,性凉,归肺、肝、脾经,具有清热化痰、息风定惊的功效[6]。胆南星主要含有胆汁酸类、黄酮类、核苷类、酚类、糖类等成分[7]。现代药理研究结果表明,胆南星具有清热、抗炎、镇痛、抗惊厥、抗氧化等作用[6],但其是否可通过抗炎、抗氧化的药理活性发挥对急性肝损伤的保护作用却鲜有报道。本研究以腹腔注射四氯化碳(CCl4)制备急性肝损伤小鼠模型,探究胆南星对急性肝损伤的保护作用,并基于JAK2/STAT3/NF-κB信号通路研究其可能的作用机制,为胆南星在防治化学性肝损伤方面的应用提供实验依据。
1 材料
1.1 主要仪器
本研究所用的主要仪器有SCIENTZ-48型高通量组织研磨机(宁波新芝生物科技股份有限公司),MX-S型涡旋混合仪、D1008E型八联管离心机(美国Scilogex公司),JY92-IIN型高速冷冻离心机(湖南湘仪离心机仪器有限公司),Epoch 2型酶标仪(美国BioTek公司),UVP ChemStudio/PLUS型多功能成像仪(德国Analytikjena公司),Colibri 140030型微量分光光度计(德国Berthold公司),Cycler720型PCR扩增仪(美国Thermal公司),LightCycler 96型荧光定量PCR仪(美国Roche公司),DYY-6C型电泳仪(北京六一生物科技有限公司)等。
1.2 主要药品与试剂
天南星饮片(批号2005001)购于亳州市悦林药业有限公司,由广东药科大学中药学院刘基柱教授鉴定为天南星科植物天南星Arisaema erubescens (Wall.) Schott的干燥块茎;联苯双酯滴丸(批号RF40009,规格1.5 mg/片)购于广州白云山星群药业股份有限公司;CCl4购于上海麦克林生化科技有限公司;丙氨酸转氨酶(alanine aminotransferase,ALT)、天冬氨酸转氨酶(aspartate ami‐notransferase,AST)、超氧化物歧化酶(superoxide dis‐mutase,SOD)、丙二醛(malondialdehyde,MDA)测试盒(批号分别为20210719、20210726、20210624、20210705)均购于南京建成生物工程研究所;小鼠肿瘤坏死因子α(tumor necrosis factor-α,TNF-α)、白细胞介素6(interleu‐kin-6,IL-6)酶联免疫吸附检测试剂盒(批号分别为RX202412M、RX203049M)均购于泉州睿信生物科技有限公司;苏木素-伊红(HE)染液套装购于武汉塞维尔生物科技有限公司;RNAex Pro RNA提取试剂盒、Evo-MMLV反转录预混型试剂盒、SYBR Green Pro Taq HS预混型qPCR试剂盒(批号分别为A4A0413、A4A0765、A4A0500)均购于湖南艾科瑞生物工程有限公司;兔源STAT3抗体、兔源JAK2抗体、鼠源甘油醛-3-磷酸脱氢酶(GAPDH)抗体(批号分别为4729976、1372864、4718884)均购于武汉博士德生物工程有限公司;兔源NF-κB p65抗体、辣根过氧化物酶标记的山羊抗兔IgG(H+L)二抗、辣根过氧化物酶标记的山羊抗小鼠IgG(H+L)二抗、BCA蛋白定量试剂盒(批号分别为AF0246、A0208、A0216、P0012)均购于上海碧云天生物技术有限公司;超敏ECL发光液购于大连美仑生物技术有限公司;IL-6、TNF-α、18S的PCR引物序列由生工生物工程(上海)股份有限公司合成,详见表1。

表1 PCR引物序列及扩增产物长度
1.3 动物
本研究所用动物为SPF级雄性C57BL/6小鼠,共50只,体质量15~17 g,购于广东省医学实验动物中心,动物生产合格证号为SCXK(粤)2018-0002。将小鼠饲养于相对湿度为55%~60%、温度为20~22 ℃、12 h黑暗/12 h光照循环的环境中。饲养期间小鼠自由饮水和进食,适应性喂养1周后进行实验。本实验经广东省医学实验动物中心实验动物伦理委员会审查通过,动物实验伦理审批号为C202211-1。
2 方法
2.1 实验药物的制备
(1)造模药的制备:取一定量的CCl4与橄榄油混合,用涡旋振荡仪涡旋均匀,制备0.2%CCl4-橄榄油溶液。(2)胆南星混悬液的制备:取天南星饮片,粉碎,过八号筛。将天南星粉与牛胆汁按1∶4的质量比混合发酵至黑色浸膏状,干燥后即得胆南星。将胆南星粉碎,过八号筛,加0.5%羧甲基纤维素钠溶液混合溶解,备用。(3)联苯双酯滴丸混悬液的制备:将联苯双酯滴丸粉碎,加0.5%羧甲基纤维素钠溶液混合溶解,备用。
2.2 动物分组、造模与给药
将50只小鼠按体质量随机分为5组,分别为正常组、模型组、阳性对照组(联苯双酯滴丸,150 mg/kg,为成人临床剂量的等效剂量)和胆南星低、高剂量组(0.78、2.34 g/kg,为成人临床剂量的1、3倍等效剂量),每组10只。正常组和模型组小鼠灌胃0.5%羧甲基纤维素钠溶液,其余各组小鼠灌胃相应药液,灌胃体积均为10 mL/kg,每天灌胃1次,连续灌胃7 d。末次灌胃2 h后,除正常组外的其余各组小鼠均一次性腹腔注射0.2% CCl4-橄榄油溶液(剂量为10 mL/kg)复制急性肝损伤模型,正常组小鼠腹腔注射同等体积橄榄油[8]。
2.3 动物取材
小鼠腹腔注射0.2% CCl4-橄榄油溶液后,禁食不禁水。腹腔注射17 h后,称定小鼠体质量,并摘取小鼠眼球取血,将血液以3 000 r/min离心10 min,分离血清,于-80 ℃冰箱中冻存,备用。取血后,将小鼠脱颈椎处死,取出其肝组织,仔细观察并拍照。称定肝质量,然后将一部分肝组织置于-80 ℃冰箱中冻存,另一部分肝组织置于4%多聚甲醛中固定。
2.4 指标检测
2.4.1 生化指标检测 按相应试剂盒说明书操作检测小鼠血清中肝功能指标(ALT、AST)和炎症指标(IL-6、TNF-α)水平及小鼠肝组织中氧化应激指标(MDA、SOD)水平。
2.4.2 肝脏指数计算 通过取材前小鼠体质量和取材后小鼠的肝质量计算小鼠的肝脏指数:肝脏指数(%)=肝质量(g)/体质量(g)×100%。
2.4.3 肝组织病理形态学观察 取4%多聚甲醛固定的肝组织适量,常规制备石蜡切片,进行HE染色后,在光学显微镜下观察肝组织的形态变化并对肝损伤程度进行量化评分。评分标准如下:0级(0分)——正常肝组织细胞;Ⅰ级(1分)——肝细胞轻微肿胀,散发炎症细胞浸润,个别肝细胞坏死;Ⅱ级(2分)——肝小叶不超过1/3的局灶或斑块性肝细胞坏死,聚集性炎症细胞浸润;Ⅲ级(3分)——肝小叶1/3~1/2的肝细胞坏死,大量炎症细胞浸润;Ⅳ级(4分)——肝小叶超过1/2的肝细胞坏死,广泛炎症细胞浸润[9]。
2.4.4 肝组织中IL-6、TNF-α mRNA表达的检测 每组随机取3只小鼠的肝组织作为实验样本,采用实时荧光定量PCR法进行检测。采用Trizol法提取肝组织中总RNA,按照Evo-M-MLV反转录预混型试剂盒说明书步骤将RNA反转录成cDNA。以cDNA为模板,按照SYBR Green Pro Taq HS预混型qPCR试剂盒说明书步骤进行PCR扩增。PCR扩增条件如下:95 ℃预变性10 min;95 ℃变性20 s,60 ℃退火/延伸30 s,共45个循环。PCR反应体系(共10 μL)如下:cDNA模板2 μL,上、下游引物各 0.3 μL,2×SYBR Green Pro Taq HS Premix 5 μL,无霉无菌水2.4 μL。以18S为内参,采用2-ΔΔCt方法计算目的基因mRNA的表达水平。
2.4.5 肝组织中JAK2、STAT3、NF-κB p65蛋白表达的检测 每组随机取3只小鼠的肝组织作为实验样本,采用Western blot法进行检测。采用RIPA法提取肝组织中总蛋白,按BCA 蛋白定量试剂盒说明书操作检测总蛋白浓度。将总蛋白高温变性后,上样(上样量为20 μL)8%十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(电压80~110 V,时间1.5 h),然后电转(恒流320 mA,时间3 h)至PVDF 膜上,用5%脱脂奶粉封闭2 h。以TBST洗膜3次,加入STAT3、JAK2、NF-κB p65、GAPDH一抗(稀释比例均为1∶2 000),4 ℃孵育过夜;用TBST洗膜3次,加入对应二抗(稀释比例均为1∶2 000),室温孵育1 h;用TBST洗膜3次,加入ECL显影液进行显影,拍照记录。使用Vision Works软件检测条带灰度值,以目的蛋白与内参蛋白(GAPDH)条带灰度值的比值表示目的蛋白的表达水平。
2.5 统计学方法
采用GraphPad Prism 7.0软件对数据进行统计分析。计量资料以±s表示,多组间比较采用单因素方差分析,组间两两比较采用LSD-t检验;病理分级统计数据采用Mann-Whitney U检验。检验水准α=0.05。
3 结果
3.1 小鼠血清中ALT、AST水平检测结果
与正常组比较,模型组小鼠血清中ALT、AST水平均显著升高(P<0.05);与模型组比较,各给药组小鼠血清中ALT、AST水平均显著降低(P<0.05)。结果见表2。
表2 各组小鼠血清中ALT、AST水平检测结果(±s,n=10,U/L)
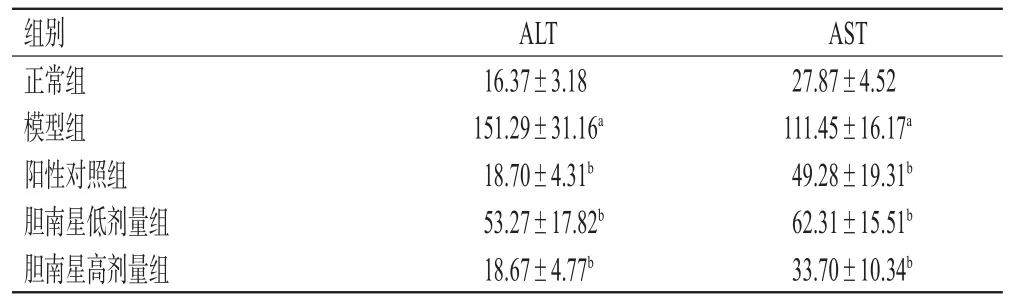
表2 各组小鼠血清中ALT、AST水平检测结果(±s,n=10,U/L)
a:与正常组比较,P<0.05;b:与模型组比较,P<0.05
组别正常组模型组阳性对照组胆南星低剂量组胆南星高剂量组AST 27.87±4.52 111.45±16.17a 49.28±19.31b 62.31±15.51b 33.70±10.34b ALT 16.37±3.18 151.29±31.16a 18.70±4.31b 53.27±17.82b 18.67±4.77b
3.2 小鼠血清中IL-6、TNF-α水平检测结果
与正常组比较,模型组小鼠血清中IL-6、TNF-α水平均显著升高(P<0.05);与模型组比较,各给药组小鼠血清中IL-6、TNF-α水平均显著降低(P<0.05)。结果见表3。
表3 各组小鼠血清中IL-6、TNF-α水平检测结果(±s,n=10,pg/mL)

表3 各组小鼠血清中IL-6、TNF-α水平检测结果(±s,n=10,pg/mL)
a:与正常组比较,P<0.05;b:与模型组比较,P<0.05
组别正常组模型组阳性对照组胆南星低剂量组胆南星高剂量组TNF-α 440.85±76.34 732.83±84.32a 473.17±127.50b 502.56±30.26b 414.68±46.70b IL-6 100.94±17.85 149.49±15.98a 121.77±22.81b 113.57±10.13b 89.10±5.81b
3.3 小鼠肝组织中MDA、SOD水平检测结果
与正常组比较,模型组小鼠肝组织中MDA水平显著升高(P<0.05),SOD水平显著降低(P<0.05);与模型组比较,各给药组小鼠肝组织中MDA水平均显著降低(P<0.05),SOD水平均显著升高(P<0.05)。结果见表4。
表4 各组小鼠肝组织中MDA、SOD水平检测结果(±s,n=10)
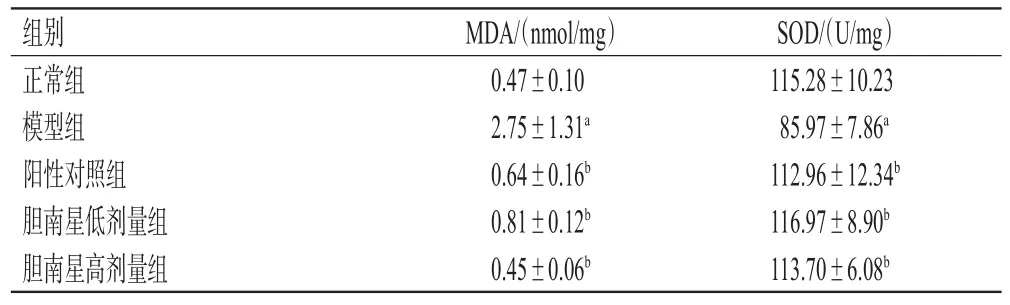
表4 各组小鼠肝组织中MDA、SOD水平检测结果(±s,n=10)
a:与正常组比较,P<0.05;b:与模型组比较,P<0.05
组别正常组模型组阳性对照组胆南星低剂量组胆南星高剂量组SOD/(U/mg)115.28±10.23 85.97±7.86a 112.96±12.34b 116.97±8.90b 113.70±6.08b MDA/(nmol/mg)0.47±0.10 2.75±1.31a 0.64±0.16b 0.81±0.12b 0.45±0.06b
3.4 小鼠体质量和肝脏指数检测结果
与正常组比较,模型组小鼠体质量显著降低(P<0.05),肝脏指数显著升高(P<0.05);与模型组比较,胆南星高剂量组小鼠体质量显著升高(P<0.05),各给药组小鼠肝脏指数均显著降低(P<0.05)。结果见表5。
表5 各组小鼠体质量和肝脏指数检测结果(±s,n=10)
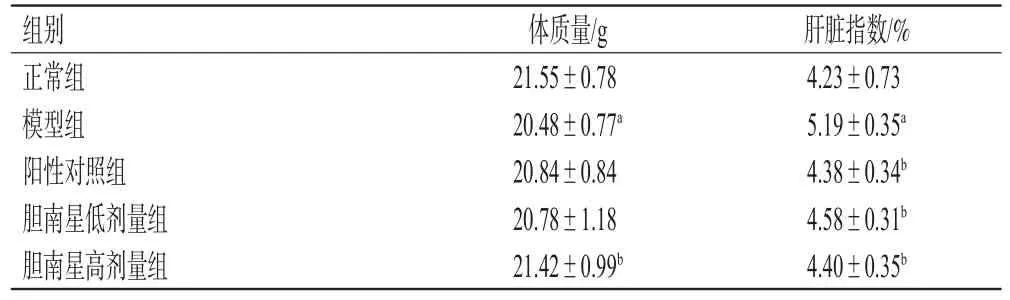
表5 各组小鼠体质量和肝脏指数检测结果(±s,n=10)
a:与正常组比较,P<0.05;b:与模型组比较,P<0.05
组别正常组模型组阳性对照组胆南星低剂量组胆南星高剂量组肝脏指数/%4.23±0.73 5.19±0.35a 4.38±0.34b 4.58±0.31b 4.40±0.35b体质量/g 21.55±0.78 20.48±0.77a 20.84±0.84 20.78±1.18 21.42±0.99b
3.5 小鼠肝组织病理形态学观察结果
病理形态观察结果显示,正常组小鼠肝组织细胞排列紧密且形态正常,肝索、肝小叶、汇管区和中央静脉周围肝细胞结构清晰完整,无炎症细胞浸润和坏死细胞。模型组小鼠肝索、肝小叶结构紊乱严重,汇管区和中央静脉周围的肝细胞肿胀、坏死严重,坏死灶相互融合形成中央静脉-中央静脉桥接坏死;在坏死灶中观察到较多的炎症细胞浸润及碎裂溶解的细胞核;胞浆嗜酸性增强。与模型组比较,各给药组小鼠肝组织的炎症细胞浸润和肝细胞坏死程度均明显降低。小鼠肝组织损伤程度评分组间比较结果如下:与正常组比较,模型组小鼠肝损伤程度评分显著升高(P<0.05);与模型组比较,各给药组小鼠肝损伤程度评分均显著降低(P<0.05)。结果见图1、表6。
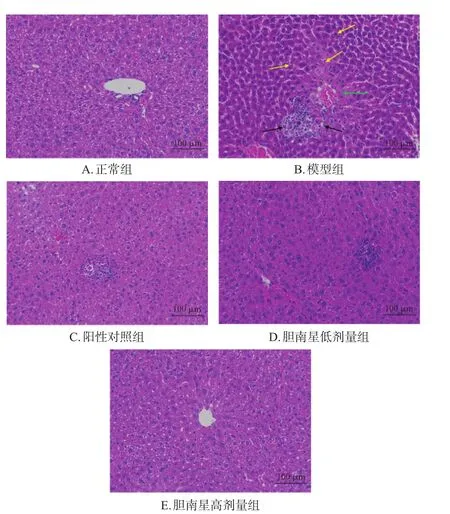
图1 各组小鼠的肝组织病理形态学观察结果

表6 各组小鼠的肝损伤程度评分结果(只,n=10)
3.6 小鼠肝组织中IL-6、TNF-α mRNA表达水平检测结果
与正常组比较,模型组小鼠肝组织中IL-6、TNF-α mRNA相对表达水平均显著升高(P<0.05);与模型组比较,各给药组小鼠肝组织中IL-6、TNF-α mRNA相对表达水平均显著降低(P<0.05)。结果见表7。
表7 各组小鼠肝组织中IL-6、TNF-α mRNA表达水平检测结果(±s,n=3)
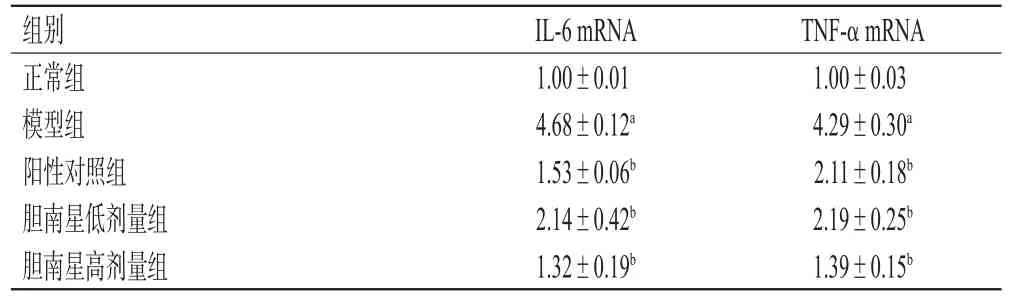
表7 各组小鼠肝组织中IL-6、TNF-α mRNA表达水平检测结果(±s,n=3)
a:与正常组比较,P<0.05;b:与模型组比较,P<0.05
组别正常组模型组阳性对照组胆南星低剂量组胆南星高剂量组TNF-α mRNA 1.00±0.03 4.29±0.30a 2.11±0.18b 2.19±0.25b 1.39±0.15b IL-6 mRNA 1.00±0.01 4.68±0.12a 1.53±0.06b 2.14±0.42b 1.32±0.19b
3.7 小鼠肝组织中JAK2、STAT3、NF-κB p65蛋白表达水平检测结果
与正常组比较,模型组小鼠肝组织中JAK2、STAT3、NF-κB p65蛋白相对表达水平均显著升高(P<0.05);与模型组比较,阳性对照组小鼠肝组织中JAK2蛋白相对表达水平及胆南星低、高剂量组小鼠肝组织中JAK2、STAT3、NF-κB p65蛋白相对表达水平均显著降低(P<0.05)。结果见图2、表8。
表8 各组小鼠肝组织中JAK2、STAT3、NF-κB p65蛋白表达水平检测结果(±s,n=3)
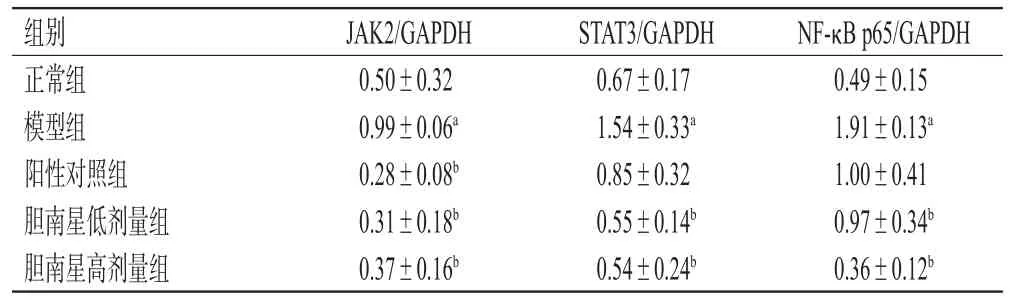
表8 各组小鼠肝组织中JAK2、STAT3、NF-κB p65蛋白表达水平检测结果(±s,n=3)
a:与正常组比较,P<0.05;b:与模型组比较,P<0.05
组别正常组模型组阳性对照组胆南星低剂量组胆南星高剂量组JAK2/GAPDH 0.50±0.32 0.99±0.06a 0.28±0.08b 0.31±0.18b 0.37±0.16b STAT3/GAPDH 0.67±0.17 1.54±0.33a 0.85±0.32 0.55±0.14b 0.54±0.24b NF-κB p65/GAPDH 0.49±0.15 1.91±0.13a 1.00±0.41 0.97±0.34b 0.36±0.12b

图2 各组小鼠肝组织中JAK2、STAT3、NF-κB p65蛋白表达的电泳图
4 讨论
研究表明,炎症反应和脂质过氧化反应与CCl4诱导的小鼠急性肝损伤密切相关[10]。CCl4进入肝细胞后会使细胞膜通透性增加,引起Ca2+内流并激活肝巨噬细胞,产生炎症反应,生成大量的促炎细胞因子(如TNF-α、IL-6等),导致肝细胞变性和坏死[11]。同时,当CCl4进入肝细胞后会使细胞膜发生脂质过氧化反应,造成SOD水平降低、MDA水平升高,导致肝脏抵抗氧化损伤的能力降低,进而引起细胞肿胀、坏死,最终造成肝损伤[12]。肝细胞膜受到破坏后,肝细胞中的ALT、AST等多种酶经肝窦间隙进入血液,血液中ALT、AST水平的升高程度代表肝细胞受损伤的程度[13]。本研究结果显示,胆南星给药组小鼠血清中ALT、AST、TNF-α、IL-6水平较模型组均显著降低;小鼠肝组织中SOD水平较模型组显著升高,MDA水平较模型组显著降低。上述结果提示,胆南星对CCl4引起的急性肝损伤具有一定的保护作用,其发挥作用的方式可能有以下2种:一是通过降低炎症细胞因子TNF-α、IL-6水平来减轻炎症浸润,进而减少炎症反应;二是通过促进细胞清除自由基来抑制脂质过氧化反应,进而降低肝细胞的损伤程度。
JAK2/STAT3信号通路是介导多种免疫反应及炎症介质传递的信号转导通路,可由炎症因子活化,进而完成信号转导过程[14]。IL-6作为JAK2/STAT3通路的上游启动因子,能够激活JAK2/STAT3通路,从而释放更多促炎细胞因子(如TNF-α等),这些异常升高的TNF-α将进一步激活巨噬细胞和NF-κB信号通路,释放更多的炎症因子,加重炎症反应[15]。本研究结果显示,胆南星可显著下调急性肝损伤模型小鼠肝组织中IL-6、TNF-α mRNA及JAK2、STAT3、NF-κB p65蛋白的表达。以上结果表明,胆南星可通过降低IL-6、TNF-α水平来抑制JAK2/STAT3/NF-κB信号通路的活化,进而减轻炎症反应,发挥其对肝损伤的保护作用。
综上所述,胆南星对CCl4诱导的小鼠急性肝损伤具有保护作用,其机制可能与抑制JAK2/STAT3/NF-κB信号通路介导的炎症反应及其抗氧化应激反应相关,但其具体的作用机制还有待深入研究。

