与新生儿呼吸窘迫综合征相关的基因变异研究进展
袁娇,强金萍,马海佳
(银川市妇幼保健院新生儿科,宁夏 银川 750001)
0 引言
新生儿呼吸窘迫综合征(r esp ir ator yd istr ess sy nd r om e,NRDS)是一种以呼吸衰竭和气体交换改变为特征的多因素疾病,主要由肺发育不成熟导致的肺表面活性物质(p ulmonary surfactant,PS)产生不足引起,是早产儿死亡的主要原因。PS是一种复杂的脂质和蛋白质的混合物,它的产生随着妊娠期的增加而增加,所以胎龄越小RDS的发病率越高[1]。近些年来,越来越多的研究揭示PS的成分,特别是表面活性物质蛋白的遗传学变异与NRDS的发生密切相关[2-5],本文就与NRDS发生有关的基因变异进行论述。
1 表面活性蛋白 A (surfactantproteinA,SP-A)
SP-A与病原体结合,通过激活或失活肺泡巨噬细胞中的炎症反应,调节微生物的吞噬作用[6]。SP-A通过结合脂质和微生物表面的碳水化合物部分,维持表面活性物质的稳态和防御呼吸道病原体的入侵[7]。SP-A是最丰富的表面活性物质蛋白,它调节磷脂的插入以及肺泡Ⅱ型细胞[8]对磷脂的摄取和分泌。既往研究发现,SP-A缺乏会影响正常的肺功能和表面活性物质代谢,并导致免疫病理缺陷[9,10],妊娠后期羊水中SP-A表达的升高是决定胎儿肺成熟度的生物标志物,而SP-A表达的缺失可能预测婴儿的RDS[11]。Perez-Gil等人发现,肺表面活性物质蛋白SP-A及SP-B是RDS发展的主要因素[12],血清SP-A水平的降低与RDS的高风险相关,并可能作为RDS监测的新的生物标志物。
人类SP-A由位于10号染色体q21-q23的SFTPA基因编码,是c型凝集素亚家族的成员,由两个转录方向相反但功能高度同源的基因SFTPA 1和SFTPA 2(SP-A 1和SP-A 2)组成,它们编码相似但不同的蛋白质。SP-A 1和SP-A 2基因处于连锁不平衡状态,这两个基因的结构由四个编码外显子(Ⅰ-Ⅳ)组成,它们的编码核苷酸差异导致蛋白胶原样结构域内的氨基酸发生变化,这些变化可以区分SP-A 1和SP-A 2基因产物以及它们相应的变体。在SP-A 1和SPA 2编码区和非编码区(103,106,107)中发现了多个单核苷酸多态性(Single nucleotid e p oly m or p hism s,SNPs)。SP-A 1和SP-A 2蛋白分子都由248个氨基酸组成:在SP-A 1的Met66、Asp 73、Ile81和Cy s85,SP-A 2(44,102,103,108)的Thr66、Asn73、Val81和Arg85的残基上存在差异。变异6A、6A 2、6A 3、6A 4、6A 5是SP-A 1外显子内5个双等位SN Ps的组合,对应氨基酸19、50、62、133和219,分别由rs1059047、rs1136450、rs1136451、rs1059057和rs4253527的组合决定。SP-A 2变体1A 0、1A 1、1A 2、1A 3和1A 5分别涉及氨基酸9、91、140和223的4个外显子
SNPs(rs1059946、rs17886395、rs1965707、rs1965708)。在大多数研究中,一种特定的SP-A 1/SP-A 2单倍型6A 2/1A 0,与RDS风险相关[13-15]。研究证实SFTPA的多态性参与了早产儿RDS的发生,SFTPA的AA和CC基因型与RDS风险独立相关[5]。Ramet发现RDS患者中SP-A 1的等位基因6A 2在RDS组过表达,6A 3为低表达;RDS患者中SP-A 2的等位基因1A 0为过表达,并且胎龄小于32周前更为明显,表明6A 2及1A 0是RDS易感性基因,RDS保护基因为6A 3[16]。国内研究发现RDS组的SP-A 2等位基因1A 0无过表达[17],SP-A 1的等位基因6A 2为蒙古族早产儿的易感基因,而6A为保护基因[18],造成结果的差异可能与种族因素不同有关,今后可针对不同种族进行进一步研究。
2 表面活性蛋白B(surfactant protein B,SP-B)
SP-B是一种低分子量的极性疏水蛋白,可以降低表面活性剂脂类的表面张力,特别是它可以吸附到气液界面并在气液界面扩散。SP-B是商业上用于治疗RDS的替代表面活性物质的关键组成部分。SP-B由人类2号染色体的SFTPB基因编码,SFTPB两个等位基因的完全功能缺失序列变异可导致严重的、弥漫性肺部疾病,通常在出生时出现。SP-B缺乏症是进行性的,通常在出生后的前三个月内致命,由于疾病的两个等位基因都需要序列变异,该疾病以常染色体隐性方式遗传[19]。于1993年首次在足月婴儿中发现[20]。临床统计发现,SP-B缺乏症的发病率为每百万分之一,而121in s2突变的频率约为1/1000[21]。SFTPB基因由12个外显子组成,迄今为止,在SFTPB基因中已经发现了40多个不同的突变,通常位于前9个外显子,主要分布于第2、4、7外显子,包括错义、无义密码子、剪接及移码突变,其中最常见在SFTPB第4外显子12密码子插入2bp,移码后出现外显子6提前产生终止密码子,导致缺乏成熟的SP-B蛋白,这种突变占等位基因突变的三分之二。目前,较多学者对SFTPB的基因突变进行研究,张亚昱利用PCR技术对患有RDS的内蒙古地区的早产儿进行SFTPB基因第4外显子测序,没有发现存在基因突变,但RDS组的T131I位点C等位基因分布频率增高[22]。也有学者对武汉汉族新生儿的T131I位点进行检测,发现等位基因C的频率无统计学意义,但C等位基因的频率与美国人及德国人存在差异,均证实基因突变的频率存在一定差异[23]。Ballard等证实外显子7突变可以降低SFTPB的翻译功能,影响SP-B蛋白的含量[24,25]。目前国内对外显子7突变研究甚少,学者对47例患有RDS的内蒙古新生儿进行第7外显子测序,发现不存在基因突变[26]。综上,不同地区与民族基因分布频率差异有统计学意义,可通过加大样本量进行分析,为RDS的基因诊断及干预提供遗传学依据。
3 表面活性蛋白C(surfactant protein C,SP-C)
SP-C是一种含有35个氨基酸的疏水蛋白,与SP-B一起以降低表面活性剂的表面张力。8号染色体短臂的SFTPC基因包含6个外显子,其编码表达含有197个氨基酸的SP-C前体,首先由一个N端前肽结构域和C端br ichos结构域(p ro-SPC)产生,随着成熟蛋白被加工,N端结构域从p ro SPC形式分裂为SP-C。成熟的蛋白有一个缩短的N端结构域、连接体和C端brichos结构域(图1)。
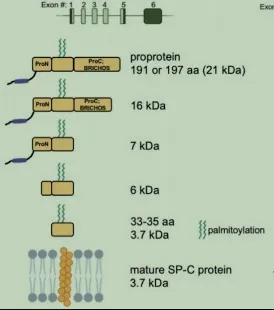
图1 顶部面板表示8号染色体上SFTPC的外显子
SFTPC基因位点跨越3500bp,其致病性变异一半为新生变异。具有致病性SFTPC变异的个体最常见的临床表现为婴儿、儿童或成人的散发性或家族性间质性肺病以及新生儿的RDS[27]。病程变化多变,一些新生儿表现为严重呼吸衰竭需要肺移植,另一些新生儿表现为长期机械通气治疗的慢性疾病,以及其他无症状的患者。在新生儿肺部疾病中发现SFTPC基因突变常见的位点位于73位上的错意突变,为异亮氨酸被苏氨酸取代(I73T)。Lahti对芬兰245例胎龄小于34周的早产患儿进行基因检测,发现外显子4、5的P.N 138T和P.N 186S位点突变与NRDS密切相关,突变后表达的异常SP-C蛋白会被体内内质网的蛋白酶体识别并吞噬和降解,导致SP-C的合成明显减少[28]。另外,国外学者对伊朗地区人群NRDS的易感性进行SFTPC基因rs1124的多态性分析,发现男性纯合AA基因型早产儿具有更高的易感性。Wambach对欧洲和非洲538例胎龄大于34周的新生儿进行SFTPC基因分析,并未出现P.N 138T和P.N 186S位点突变,而启动子中c.1647、c.-1167及c.-2385出现异常表达,使SFFPC基因转录发生异常,增加NRDS疾病风险[27]。戴仪[29]等对国内90例早产儿进行研究未发现上述位点突变,但在5'UTR的c.-368A>G、c.-1614C>A及c.-1504G>A检测存在位点突变。这些位点是否具有致病性或易感性,有待完善功能学或加大样本量进行进一步研究。
4 表面活性蛋白D(surfactant protein D,SP-D)
表面活性物质蛋白D是一种模式识别分子,属于含胶原蛋白的C型凝集素,它的组织分布和功能与SP-A蛋白部分重叠。SP-D的一个主要作用是聚集和增强微生物和死亡宿主细胞的吞噬作用。SP-D定位于肺组织和非肺组织,该蛋白与呼吸系统、消化系统、腺体、生殖道、尿路和血管上皮细胞和腺体有关。SP-D在肺中的一个主要功能是作为肺表面活性物质脂质水平的调节器[30]。人类SP-D由SFTPD编码,该基因位于10号染色体长臂22.2-23.1,共包含8个外显子,其中7个是编码的,外显子Ⅰ和外显子Ⅱ的一部分对应5'UTR,第8外显子的最后一部分对应3'UTR。在德国的一项研究中[31],非编码基因位点rs1923537对RDS具有保护作用,而Kelli等人发现r s1923537多态性可能与低胎龄早产儿RDS风险显著增加相关[32],但在国内的研究中未发现这种关联,且Met11Thr T/C和Ala160Thr G/A多态性与早产儿RDS无关[5]。另一项研究确定了SP-A 1、SP-A 2和SFTPD的几种单倍型,它们也与RDS保护作用相关,这些类型包括单倍型SP-A 2/SP-D:1A 1-Thr160(rs2243639)、1A 1-Met11(rs721917)-Thr160(rs2243639)和S P-A 1/S P-A 2/S P-D:6 A 4-1 A 2-T r 160(r s22 43639)、6A 3-1A 1-M et11(rs721917)-Thr160(rs2243639)和6A 4-1A 2-Met11(rs721917)-Thr160(rs2243639)[33]。Gow er认为SFTPD中的序列变异尚未被报道为导致人类疾病的原因[34],目前SFTPD的多态性与早产儿RDS风险之间的联系尚未完全确定,今后可进行进一步研究。
5 三磷酸腺苷结合盒转运子A3(adenosinetriphosphate-binding cassettetransporters A3,ABCA3)
肺表面活性物质储存在肺泡Ⅱ型细胞中的层状体中,对降低表面张力至关重要的脂质通过膜转运体ABCA 3家族的成员A 3导入层状体中。因此,ABCA 3的缺失导致表面活性物质缺乏磷脂酰胆碱和表面活性张力的增加[35-36]。ABCA 3缺乏症是一种常染色体隐性遗传病,由ABCA 3的致病性变异引起。ABCA 3中的双等位基因变异会导致新生儿严重RDS[37-38]。具有双等位基因ABCA 3移码或无义变异的婴儿在出生时可出现NRDS,并在未进行肺移植的出生后第一年内死亡[39]。
人类ABCA 3基因位于16号染色体q13.3,含有33个外显子,ABCA 3cDNA编码一个含有1704个氨基酸的多肽。成熟的ABCA 3蛋白在内质网中折叠,并在高尔基体中进行糖基化[40]。第二种翻译后修饰涉及到190k D蛋白的n端蛋白水解,将蛋白缩短到150k D(见图2)。迄今为止已有超过200个ABCA 3突变被报道,并且被认为该基因纯合突变是导致重症NRDS的重要因素[41-43]。p.E292V,p.R1333G,p.E690K,p.Y1515X,p.W1142X及p.L1553P是报道较多的突变位点,突变的类型为错义、无义突变,缺失、移位、插入等。错义的ABCA 3基因变异会导致细胞内ABCA 3蛋白运输的中断,对蛋白质功能产生严重影响。Mitsiakos等报道了一例位于ABCA 3基因第23外显子的错义变异,影响了肺泡表面活性物质之间的相互作用,导致致死性NRDS的发生[44]。Bozkurt发现位于第24外显子的错义变异导致了一个中性亮氨酸残基取代位于1226位的一个非极性疏水脯氨酸残基,可以影响细胞内的相互作用,亦可引发重症NRDS[43]。已确定了ABCA 3错义变异的两种机制类型包括细胞内运输中断和磷脂转运受损[45,39]。Wambach发现最常见的致病性变异p.E292V可以损害磷脂转运[46],在基因组聚合数据库中p.E292V变异存在于0.4%的个体中,国外学者发现其在NRDS患儿中的发生率为3.8%,且呈现出不同的人群和地域差异[47]。因为大多数ABCA 3变异都是罕见,这给开发变异特异性基因编辑或靶向药物方法带来了挑战。
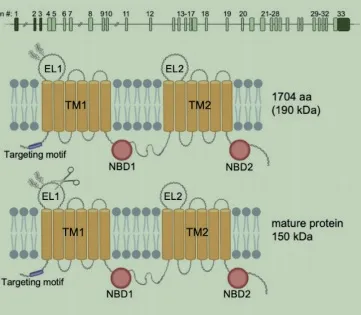
图2 上面板:代表16号染色体上ABCA3的外显子
ABCA 3基因位点多态性是NRDS的风险因素,但是是国内外存在争议的地方,研究者[48]对非洲和欧洲各200余例NRDS患儿进行基因测序,发现均存在多个位点的同义突变,而常见的同义突变不会增加该病的患病率,可能原因与胎龄和种族不同有关。Kaljalainen[49]发现第十外显子的位点rsl3332514(F353F)等位基因T频率的增加与芬兰患儿RDS的发病有关,国内学者对陕西地区60例NRDS患儿进行基因检测,未发现该位点基因突变[50]。梅花等学者对内蒙古地区蒙古族及汉族NRDS患儿进行F353F基因位点测序,发现无论是蒙古族还是汉族NRDS组患儿T等位基因频率与对照组存在统计学差异。另外发现中国儿童RDS的发病与p.P585P位点突变有关联[51]。所以,ABCA 3位点突变和多态性是否与NRDS相关需要进行不同地区多中心联合研究以明确地域、种族及民族等因素对NRDS疾病的影响,同时利用基因的功能性机制揭示该病的发生机理。
6 甲状腺转录因子1(thyroid transcriptionfactor 1 ,TTF-1)
TTF-1是一种细胞核蛋白,是甲状腺过氧化物酶和甲状腺球蛋白基因转录调控因子,研究者发现TTF-1也是肺发育中一种具有组织特异性的核转录因子。TTF-1由NKX2-1基因编码,该基因位于14号染色体q13.3,由3个外显子和2个内含子组成,其对肺、甲状腺和脑的发育至关重要。NKX2-1序列变异或缺失可导致脑一肺一甲状腺综合征(brain-lung-thyroid sy nd r ome,BLTS)[52],可表现为RDS、舞蹈症和甲状腺功能减低,为常染色体显性遗传。目前我国对BLTS病例报道较少,BLTS的肺部表现62.5%~76%为NRDS,19%~75%发展为慢性持续性肺间质病变[53,54]。正常情况下,NKX2-1表达于细支气管细胞、末梢支气管Clara细胞及肺泡Ⅱ型细胞。NKX2-1对SFTPA、SFTPB、SFTPC及SFTPD启动子的活性有着正向的调节功能,并调控着ABCA 3的表达。国内外已经报道了100多种NKX2-1基因的缺陷,其中陈杰华发现14q13.1q21.3微缺失和示NKX2-1c.1161C>A(p.Y387X)杂合变异可导致NRDS的发生[55],与Iwatani报道的患者相似[56]。所以,当新生儿出现RDS伴有神经系统及甲状腺功能异常时,应考虑NKX2-1基因突变或染色体缺失的可能。
综上,N RDS的发生与遗传因素密切相关,其中SFTPA、SFTPB、SFTPC、SFTPD、ABCA 3及NKX2-1基因突变扮演了重要的角色,但在不同的地域、种族及民族之间差异有统计学意义,今后可进行不同地区多中心联合研究,为NRDS的诊治提供新的理论依据,有效地从基因水平预防和诊疗新生儿肺部疾病,降低早产儿的病死率。

