纳米药物递送系统在前列腺癌治疗中的应用*
刘雪怡 郝 旖 宋慧佳 种 铁 高瑞霞**
(1)西安交通大学化学学院,西安 710049;2)西安交通大学药学院,西安 710061;3)西安交通大学第二附属医院,西安 710004)
1 前列腺癌
1.1 流行病学
前列腺癌(prostate cancer,PCa)是全球最常见的男性泌尿生殖系统恶性肿瘤,男性中第二大常见癌症,其中欧洲、北美和非洲某些地区的男性中发病率最高[1]。2020年全球癌症统计数据,前列腺癌是112个国家男性中最常被诊断出的癌症,48个国家男性癌症死亡的主要原因;2020年前列腺癌死亡病例375 304 例,占男性癌症死亡人数的6.8%;前列腺癌目前在男性恶性肿瘤中发病率排名第一,死亡率位列第二[2]。随着人们生活水平的提高及生活方式的改变,前列腺癌的发病率呈上升趋势,幸运的是,随着早期检测与积极治疗意识的增强以及治疗手段的不断更新,过去十年间前列腺癌的死亡率有所下降[3]。目前对于前列腺癌的病因仍知之甚少,其发病机制也十分复杂,确定的风险因素仅限于年龄增长、前列腺癌的家族史以及某些基因突变(例如,BRCA1和BRCA2)和某些特定的疾病(例如,林奇综合征)[2]。前列腺癌的病理分级多用Gleason评分系统,Gleason评分系统是目前世界范围内应用最广泛的前列腺癌的分级方法。该评分系统把前列腺癌组织分为主要分级区和次要分级区,每区按5级评分,主要分级区和次要分级区的Gleason 分级值相加得到总评分即为其分化程度,Gleason 评分为2~4 的患者预后良好,因为这代表前列腺癌的初始阶段,而6分标志着侵袭性较弱的肿瘤,7分标志着中间肿瘤,8~10分表明存在侵袭性肿瘤,该组患者的预后最差[4]。正确的诊断和分区也是治疗的关键一步。
1.2 治疗策略
前列腺癌的治疗主要有手术与非手术治疗两大类。对于还没有发生转移的前列腺癌,通常采用手术治疗。手术治疗可分为传统开放手术治疗、经尿道手术、腹腔镜手术和手术机器人辅助手术。然而,当前列腺癌有多发转移,患者不适合手术时,非手术治疗成为唯一的选择,包括免疫治疗、放疗、内分泌治疗和化疗。免疫疗法是前列腺癌治疗的一种重要方式,现在已有的用于癌症治疗的免疫制剂例如细胞毒性T 淋巴细胞相关抗原4(cytotoxic Tlymphocyte-associated antigen-4,CTLA-4)、程序性细胞死亡蛋白-1(programmed death-1,PD-1)以及程序性细胞死亡蛋白-1 配体(programmed cell death ligand 1,PD-L1)已在大量临床试验中证明有效,然而在去势抵抗性前列腺癌的治疗中,无论是单剂治疗还是联合治疗结果大多令人失望[5-6]。所以免疫疗法应用于前列腺癌还有很长的路要走。在前列腺癌的发展过程中,高水平的雄激素至关重要地促进了肿瘤的发生[7]。因此,雄激素剥夺治疗(androgen deprivation therapy,ADT)被认为是早期低危前列腺癌治疗的有效手段,常见的治疗剂有中枢雄激素产生抑制剂,如亮丙瑞林和雄激素受体拮抗剂比卡鲁胺和恩杂鲁胺等,但是大多数前列腺癌会逐渐发展为去势抵抗性(castration-resistant prostate cancer,CRPC),并显示出对雄激素剥夺治疗策略的高度抵抗性[8]。一旦前列腺癌发展为去势抵抗性前列腺癌,化学疗法便成为最常见的治疗策略,单独化学疗法或者联合ADT 的疗法对于前列腺癌仍然是比较有效的治疗方法[9]。但传统化学疗法药物会引起许多副作用(例如,心脏、肝脏、肾脏和骨髓毒性),从而严重影响前列腺癌患者的生活质量[10-11]。如何克服目前已有前列腺癌治疗方法的缺点和所带来的副作用是必须考虑的问题,而纳米药物递送系统在前列腺癌治疗中逐渐发展成为一种有前途的治疗方式。
虽然纳米药物可以利用被动靶向来促进其在所需部位的积累,大多数依赖于通过增强的渗透性和保留(enhanced permeability and retention,EPR)效应在病理部位的被动积累[12],延长血液循环时间,并控制药物释放,但通过抗体、肽、适体或小分子的“修饰”增加主动靶向识别特定器官或细胞受体可以提供额外的优势,靶向前列腺癌表面的特异性表达的物质包括前列腺特异性膜抗原(PSMA)、叶酸受体(FR)、CD44、CD24、甘露糖6-磷酸受体(M6PR)和ephrinA2受体(EphA2)等[13-15]。纳米递药系统的合理设计使它们能够克服关键的生物障碍并将治疗剂靶向运输到目标部位,从而减少对健康组织的不良影响,其中生物屏障大多与肿瘤微环境(tumor microenvironment,TME)相关,在癌细胞周围存在着血管、免疫细胞、成纤维细胞、分泌因子和细胞基质等成分,这些都有助于肿瘤的形成、进展、转移和耐药性。肿瘤微环境的特点,例如不均匀的血流、致密的细胞外基质和高间质液压力等,严重阻碍了血管运输,阻碍纳米药物有效的渗透,并阻止纳米药物的间质运输[16]。因此,调节肿瘤微环境现在已成为改善纳米药物向肿瘤递送的重要策略,针对肿瘤微环境的联合疗法可能是晚期前列腺癌治疗的有效方法。
2 用于前列腺癌治疗的纳米递送系统
纳米材料处于抗肿瘤药物研究的最前沿。纳米药物递送系统(nano drug delivery system,NDDS)是指将治疗药物与纳米载体材料复合形成的纳米药物载体复合物,可以通过载体将化疗药物、多肽、基因以及蛋白质等通过局部给药或全身循环累积在特定的病灶部位。近年来,纳米药物递送系统在肿瘤治疗中备受青睐,得到广泛研究。常见的纳米载体类型主要分为有机和无机两种。有机纳米载体如胶束、纳米凝胶和树枝状聚合物,无机纳米载体如碳纳米管、金纳米粒子、磁性纳米粒子、介孔二氧化硅纳米粒子、量子点等[17-21](图1)。纳米材料作为药物递送系统主要有以下优点。a.纳米药物载体可以通过改变大小来帮助小分子药物从肾脏或肝脏清除。b.纳米递药系统可以延长药物在体内的循环时间,通过聚合物的降解表现出快速的药物释放,此外,纳米递药系统的控释改善了化疗药物对器官造成的损伤。c.纳米递药系统的纳米级尺寸通过EPR 效应提高了肿瘤部位小分子药物的浓度。d.通过将不同的化学基团或靶向配体连接到其表面,纳米递药系统获得了特定的响应特性甚至主动靶向能力。最重要的是,纳米递药系统可以增强治疗效果并减少化疗药物的副作用。
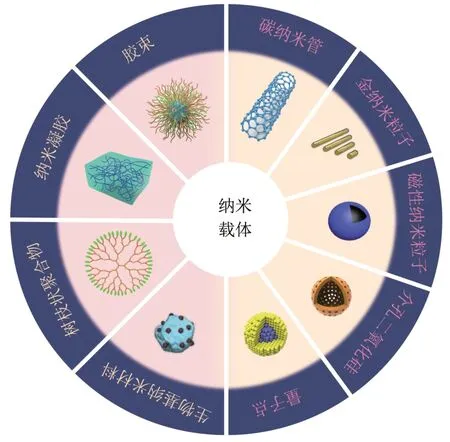
Fig.1 Schematic of organic and inorganic nanocarriers图1 有机与无机纳米载体示意图
2.1 胶束与纳米凝胶
聚合物胶束是过去十几年的热门研究课题,其作为纳米药物递送系统具有一些突出的优势,例如生物相容性好、高药物负载效率、水溶性和在生物体液中的良好稳定性等,并能够控制负载的生物活性剂在体内的分布和功能,有效地克服生物障碍。胶束是由两亲性聚合物自组装成纳米结构,尺寸在20~200 nm[22-23]。胶束内部具有疏水核,可以负载难溶于水的药物,外层亲水壳将包封的药物与外部介质隔离[24]。早期的胶束存在的问题是单纯依靠EPR 效应被动靶向进入肿瘤细胞,其特异性并不强,所以需要对外部的亲水冠用不同物质进行功能化修饰进行修饰,例如叶酸(folic acid,FA)、单克隆抗体(monoclonal antibody,mAb) 和单糖(甘露糖、葡萄糖、果糖)等,以实现纳米材料在肿瘤部位的主动靶向或pH 以及温度响应等功能[25]。
Barve 等[26]开发了一种可生物降解的、酶响应的、靶向的卡巴他赛(Cabazitaxel)聚合物胶束(图2a)。所合成胶束由两个两亲性嵌段共聚物形成。 第一段嵌段共聚物由聚乙二醇(polietilenoglicol,PEG)、酶反应肽和胆固醇组成;第二段共聚物由靶配体、PEG 和胆固醇组成。在前列腺癌肿瘤微环境中过表达的基质金属蛋白酶2(matrix metalloproteinase-2,MMP-2)存在下,酶反应肽可被切割。该胶束具有较低的临界胶束浓度(critical micelle concentration,CMC)、较高的载药量和较高的包封效率。此外,与游离卡巴他赛相比,该胶束在前列腺癌细胞中的细胞摄取显著增加,配体偶联的聚合物胶束与未修饰的胶束显示出更好的抑制前列腺癌异种移植小鼠肿瘤生长的效果。胶束是目前应用较广的抗癌药物递送纳米系统,但胶束在生物体内循环后如何保障药物能有效的递送到肿瘤内部仍具有挑战性,仍需开发新型的两亲聚合物来解决已有胶束的局限性和困境。
纳米凝胶是一种全身给药纳米载体,是一种具有三维(3D)可调多孔结构和亚微米级粒径的水凝胶,其粒径范围为20~250 nm[27]。纳米凝胶由各种天然聚合物、合成聚合物或它们的组合组成,有助于小分子、寡核苷酸甚至蛋白质的封装,这些独特的特性使纳米凝胶能够实现药物输送、诊断和成像[28]。作为一种水凝胶,纳米凝胶在不同的环境条件下保持了水凝胶的高度水化性质和收缩膨胀特性[29]。它们的3D结构能够将疏水性或亲水性药物封装在其内部网络中,从而保护这些药物在储存或循环过程中免于降解(例如由于水解或酶解导致的降解)[30]。纳米凝胶具有可调节的粒径、颗粒形状以及对pH、温度、离子强度、氧化还原条件和其他外部刺激的敏感性,这些赋予它们有效的药物控制释放特性[31]。此外,纳米凝胶可以定制为多功能和有针对性的,并且可以通过表面改性来延长其循环时间[32]。
虽然纳米凝胶优势突出,但其作为纳米递药系统应用时仍具有很大的挑战。纳米凝胶合成后残留在制剂中的表面活性剂或未反应单体可能对人体有不良影响;物理连接的纳米凝胶中的非共价键不稳定,可能导致循环过程中药物过早泄漏;同时,作为药物载体,纳米凝胶的载药能力和控释行为有待进一步提高,特别是对于某些药物的大剂量连续给药的释放。
2.2 树枝状聚合物
树枝状聚合物具有高度支化的三维结构,是线性、交联和支化结构之外的第四种类型。其具有大量的末端功能单元和内部空腔,而且具有低黏度、弱缠结或无缠结的特点。树枝状聚合物的特征在于它们的球形、内部亲水性或疏水性空腔、外部官能团以及由于其3D 结构而形成的非常低的多分散性[33]。当树枝状聚合物的“臂”被改变时,树枝状聚合物的物理和化学特性可以很容易地调整,表面基团的性质对树枝状聚合物的溶解度也有显着影响,亲水性树枝状聚合物溶解在极性溶剂中,而疏水性树枝状聚合物溶解在非极性溶剂中。树枝状聚合物独特的纳米级结构与线性聚合物相比,具有显著的结构优势,这些特性赋予它们在各种生物医学应用中的潜力,包括药物输送、基因治疗、组织工程、免疫测定和生物成像等[34]。
Lesniak 等[35]报道了前列腺特异性膜抗原(prostate specific membrane antigen,PSMA)结合聚酰胺树枝状聚合物(polyamidoamine,PAMAM)纳米载体来治疗前列腺癌(图2a)。简单的一锅法合成得到中性的树枝状纳米粒子,其粒径分布窄,直径约为5 nm。实验表明,PSMA缀合的PAMAM树枝状聚合物纳米载体和游离PSMA具有同等抑制肿瘤的效果。正电子发射断层成像(positron emission tomography,PET)证实了肿瘤部位附近PSMA的积累。
树枝状聚合物的特点赋予其与众不同的载药特性,但树枝状聚合物仍然是一个新兴的研究领域,需要填补许多知识层面的缺失,比如具有2D和3D结构的树枝状聚合物合成时监测其支化度、超支化聚合物生长时的序列控制和如何提高其材料的生物相容性。
2.3 生物基纳米材料
有机高分子纳米材料(非生物基)作为一种简单的自组装候选物,具有丰富的官能团和活性位点,可用于进一步修饰。然而,这些纳米材料是由人工合成而非天然衍生材料设计而成,可能存在药物递送效率低和体内副作用大等缺陷。因此,以绿色和有效的方式合成纳米载体成为一种备受瞩目的方法。多种生物材料如核酸(nucleic acid,NA)[36]、酚类和多酚(phenolics,PP)[37]、聚多巴胺 (polydopamine, PDA)[38],多糖(polysaccharides)[39]、蛋白质或肽(protein or peptide,POP)[40]以及细胞和亚细胞部分(cell and subcellular fraction)[41]等已被证明具有出色的抗癌效果,它们不仅可以单独作为药物或免疫制剂直接用于癌症治疗,也可以作为药物递送载体与其他材料结合以实现多种功能协同抗癌作用。
Mu 等[42]构建了携带化疗药物阿霉素(doxorubicin,DOX)和PD-L1 siRNA(PDA-DOX/siPD-L1@SCM)的干细胞膜(stem cell membrane,SCM)伪装聚多巴胺纳米颗粒,用于靶向前列腺癌骨转移。其中纳米递药载体多巴胺具有良好的亲水性、生物相容性、稳定性和生物降解性,可在有氧碱性溶液中自发聚合成聚多巴胺纳米颗粒[43]。此外,PDA 具有大量的儿茶酚和氨基官能团,可以将许多功能分子结合到其表面。体外和体内研究表明,PDA-DOX/siPD-L1@SC 在骨转移的前列腺癌协同化学免疫治疗中表现出优异的性能。
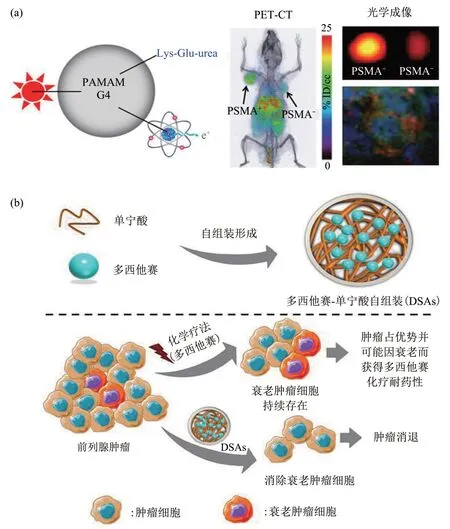
Fig.2 Schematic of organic nanodrug delivery system in the treatment of prostate cancer图2 有机纳米药物递送系统在前列腺癌治疗中应用
细胞衰老被定义为由于化疗应激引起的不可逆生长停滞状态,多西他赛(docetaxel,DTX)治疗可通过前列腺癌的衰老机制引起化疗耐药[44]。Nagesh等[45]为了消除肿瘤中衰老细胞,克服多西他赛治疗的缺点,设计了一种基于多酚类物质单宁酸(tannic acid,TA)的新型纳米自组装体(图2b),单宁酸与多西他赛通过氢键和离子键形成自组装纳米药物递送系统。基于多西紫杉醇-单宁酸自组装的纳米颗粒可将多西他赛转运至前列腺癌细胞部位,并通过抑制TGFβR1/FOXO1/p21 通路介导的前列腺癌细胞衰老和诱导前列腺癌细胞凋亡显示出对前列腺癌治疗作用。
生物基纳米材料改善了其他纳米材料可能不具备的优良生物相容性,生物安全性相对较高,但对于生物基纳米材料中常使用的蛋白质,如何在到达病灶前保证蛋白质结构稳定和蛋白质活性强是一个难题,尤其是一些常用的酶,其次生物基纳米材料存在脱靶效应可能导致全身毒性,还需要更多的研究找到解决方法和寻找答案。
2.4 碳纳米管
碳纳米管(carbon nanotube,CNT)由石墨烯片形成,分为单壁碳纳米管(singlewalled carbon nanotube,SWCNT;由单个螺旋石墨层形成)和多壁碳纳米管(multiwalled carbon nanotube,MWCNT;由多个螺旋层组成)。SWCNT的直径和长 度 分 别 为0.5~3.0 nm 和20~1 000 nm, 而MWCNT 的尺寸范围为1.5~100 nm 和1~50 μm[46]。碳纳米管的圆柱形是由共价键形成因此具有较强的抗张力能力,同时具有良好的导热性和导电性。碳纳米管作为纳米递送系统,其形状和尺寸使之可携带大量抗肿瘤药物,通过将其与维生素、糖类、蛋白质、肽以及单克隆抗体等进行修饰后还可以实现肿瘤受体靶向,增加纳米材料对靶细胞的药物递送,并减少对健康组织的药物毒性和副作用[47-49]。
Lucío 等[50]报告了一种基于“牛角形”碳纳米角的抗体纳米药物递送系统,用于治疗前列腺癌(图3a)。前药形式的顺铂和对前列腺癌细胞有选择性的单克隆抗体D2B,抗体D2B 和顺铂前药与碳纳米角的偶联物选择性靶向和杀死前列腺特异性膜抗原过度表达的前列腺癌细胞。这种制备方法可用于更多种类的药物负载,以创建用于治疗不同疾病的新靶向药物。碳纳米管在肿瘤治疗药物载体研究方面有较好的应用前景,但目前大多数研究集中在碳纳米管的化学修饰,功能化的碳纳米管药物载体的药理学效应及细胞内毒性还缺乏更深入的研究。
2.5 金纳米粒子与磁性纳米粒子
金纳米粒子(gold nanoparticles,Au NPs)在生物医学和癌症治疗应用中是很好的药物和纳米药物载体,是药物输送和癌症治疗等医学应用中的有效放射增敏剂。在生物医学和癌症治疗应用中,金纳米粒子可以在使用计算机断层扫描纳米粒子增强放射治疗中充当造影剂和剂量增强剂[51]。随着纳米材料合成和制造方法的不断改进,可以通过技术轻松精确控制金纳米粒子变量,例如尺寸、成分、形态和表面化学。此外,生物相容性表面涂层可以覆盖到金纳米粒子表面以提供其在生理条件下的稳定性,通过将功能性配体整合为涂层,使它们能够同时在分子或细胞水平上执行多种生物医学功能。
Luo 等[52]设计了用于磁共振引导放射治疗的前列腺癌靶向金纳米粒子, 通过将钆(gadolinium,Gd)复合物和PSMA 靶向配体结合到金纳米粒子表面,以提高靶向精度和疗效(图3b)。结果表明,表达PSMA 的癌细胞增强了对金纳米粒子的吸收,在体外和体内具有出色的磁共振成像对比度,Au和Gd(ⅠⅠⅠ)的组合在放射治疗后具有更好的前列腺癌抑制效果。PSMA靶向金纳米粒子的选择性肿瘤靶向可以实现精确的放射治疗、减少照射剂量和最小化健康组织的损伤。
磁性纳米粒子 (magnetic nanoparticles,MNPs)是一类可广泛应用于生物医学领域的纳米粒子,如药物输送、成像、诊断、生物传感、生物分离、靶向等[53-54]。氧化铁基磁性纳米粒子(FeridexⅠV®、Feraheme®、Endorem®、Lumiren®和Gastromark®)已被批准用于人体临床研究,因为它们具有更长的安全性和更高的血清生物利用度(长达30 h)。在磁性纳米粒子中,超顺磁性氧化铁纳米粒子 (superparamagnetic iron oxide nanoparticles,SPⅠONs)不仅获得食品和药物管理局(FDA)的批准,而且由于其固有的生物相容性和独特的磁特性,还广泛用作肠、肝和脾成像的造影剂。磁性纳米粒子还具有超小纳米尺寸、磁共振成像(magnetic resonance imaging,MRⅠ)特性、优异的生物相容性、灵活的表面化学特性,并且没有全身毒性。氧化铁基磁性纳米粒子在人体中降解产生大量存在于人体内的铁离子,进一步表明了其安全性。作为纳米递药载体,磁性纳米粒子可以与治疗剂(药物、肽、蛋白质或核酸)共同构建纳米治疗剂, 例如5- 氟尿嘧啶(5-fluorouracil,5-FU)[55]、阿霉素[56]、氟他胺(flutamide;雄激素受体的拮抗剂)、比卡鲁胺(bicalutamide;抗雄激素)和唑来膦酸盐(zoledronic acid,抗破骨细胞特性)[57]等,是一种非常有前途的前列腺癌治疗方法。
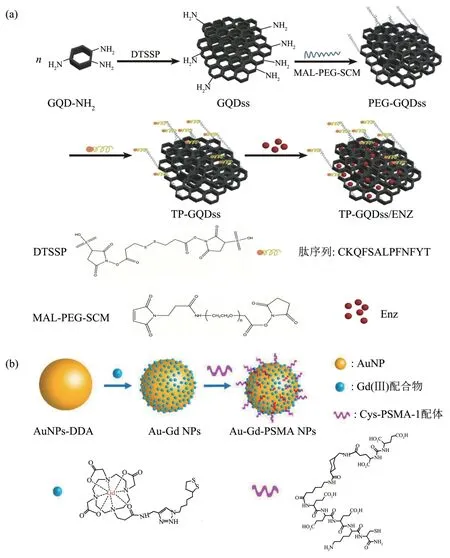
Fig.3 Schematic of organic nanodrug delivery system in the treatment of prostate cancer图3 无机纳米药物递送系统在前列腺癌治疗中应用
2.6 介孔二氧化硅
基于介孔二氧化硅纳米粒子(mesoporous silica nanoparticles,MSNs)的纳米递送系统由于其合成简单、形态均匀、孔径和体积可调、表面可定制、直径可控以及显着的生物相容性等优点,在癌症治疗中受到了广泛关注[58]。介孔二氧化硅大的表面积和孔体积提供了高载药能力,并可以吸附许多不同类型的分子[59]。利用简便的方法就可以对MSNs进行各种官能团表面改性,使其适用于各种癌症治疗方法。基于介孔二氧化硅的纳米递送系统已被FDA 认为是安全的材料,使其成为有前途的临床转化纳米平台之一[60]。
Gao 等[61]提出了一种可定制的介孔二氧化硅辅助合成策略,合成了一系列锡铬氧化镓锌共掺杂(ZnGa2O4∶Cr3+/Sn4+@MSNs (ZGOCS@MSNs))的近红外(near-infrared,NⅠR)持续发光(PersL)纳米递药系统,ZGOCS@MSNs 的平均直径约为80 nm。更有趣的是,ZGOCS与MSNs的质量比随着MSNs 孔径的增加而增加,ZGOCS@MSNs 的近红外持续发光性能随着ZGOCS 与MSNs 质量比的增加而增强,表明ZGOCS 与MSNs 在优化近红外纳米材料的持续发光性能作用,体外和体内近红外持续发光成像进一步证实了这一点。更重要的是,大孔MSNs使该材料介孔结构的孔体积足够大,可用于有效的药物加载/释放,实验也证明出高剂量的DOX 负载量(约53%)并具有出色的癌细胞杀伤效率。所合成的高性能双功能纳米递送系统展示了其在成像引导以及癌症化疗方面的巨大潜力。
在过去的十年中,介孔二氧化硅作为纳米药物递送系统展示了许多优点,尽管已经对基于介孔二氧化硅纳米药物递送系统的开发进行了广泛的研究,仍有一些关键问题需要解决,应系统地研究其生物相容性、降解性和药代动力学,尤其是在应用于临床之前,应将其血液循环特性、体内清除时间、可能的免疫毒性和组织中积累情况等基本信息研究清楚。
2.7 量子点
量子点(QD)是2~10 nm 纳米级范围内的半导体晶体,具有独特的光致发光特性以及电子特性,例如从可见光到近红外波长的可调发射和卓越的光稳定性,常见的有硅量子点、锗量子点、硫化镉量子点、硒化镉量子点、碲化镉量子点、硒化锌量子点、硫化铅量子点、硒化铅量子点、磷化铟量子点和砷化铟量子点等[62]。量子点具有强光致发光和高摩尔消光系数值,特点是对称的窄发射光谱和宽吸收光谱[63]。目前已经开发出通过与其他材料(如聚合物、蛋白质、多糖或脂质)结合来降低其毒性并增强其生物相容性的策略,不仅可以阻止它们释放到体循环外,还使其具有有效的肿瘤靶向性。
Jiang等[64]报道了一种氨基化石墨烯量子点首先通过二硫键交联成约200 nm 的石墨烯量子点衍生物,雄激素受体抑制剂恩杂鲁胺被加载到石墨烯量子点衍生物中,然后用肿瘤靶向肽和PEG 进一步功能化形成多功能恩杂鲁胺负载氧化石墨烯纳米药物系统。体外和体内研究结果表明,通过π-π电子相互作用实现了高载药效率。该纳米药物载体表现出较强的前列腺癌靶向能力,可以通过内吞作用被去势抵抗型前列腺癌细胞快速内化,抑制前列腺癌细胞的生长并减轻了恩杂鲁胺在体内的副作用。
量子点已被证明不仅能够递送抗癌药物,还可以作为纳米载体来转运基因、肽和其他非抗癌药物。然而,在它们应用于生物医学和临床之前,需要解决许多挑战,以不同方式合成的量子点的物理化学性质表现出巨大的差异,此外,量子点的大小对其毒性、表面功能化和跨越生物屏障的能力有很大影响,未来仍需要更多涉及量子点大小的系统研究。
3 纳米药物递送系统在前列腺癌治疗中的应用
前列腺癌的常规治疗易受到限制,包括副作用、疗效低和生物利用度差,化学疗法会导致前列腺癌耐药性的发展,因此开发新的、有效的、个性化的和有针对性的治疗方法是一个紧迫的问题,纳米药物递送系统由于其固有的纳米级特性可以增强常规治疗剂的治疗效果,例如纳米递送系统联合化疗、放疗、光动力治疗与过高热治疗等治疗手段可以大大提高前列腺癌患者的生存率(图4)。从这个意义上说,纳米药物递送系统具有与精准肿瘤学协同进步的潜力。
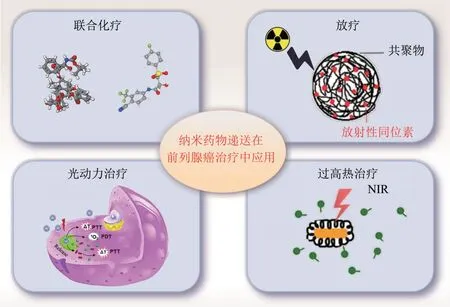
Fig.4 Schematic diagram of nano-drug delivery in the treatment of prostate cancer图4 纳米药物递送在前列腺癌治疗中的应用示意图
3.1 纳米递送系统用于联合化疗
化学治疗法是使用化学药物杀死肿瘤细胞,前期治疗效果较好,但是后期容易出现肿瘤细胞耐药性,使治疗效率显著降低,且化疗药物容易对正常组织产生毒副作用。联合化疗又称协同化疗,是指在治疗过程中同时或先后使用几种化疗药物进行治疗,在联合化疗的过程中,需要遵循的原则是使用具有独立作用机制的药物。基于纳米递药系统的联合化疗可以克服单一药物治疗出现的细胞耐药性,同时可以减少药物剂量,降低毒副作用[65]。根据美国国家综合癌症网络(National Comprehensive Cancer Network,NCCN)指南,多西他赛是前列腺癌的标准一线药物。多西他赛的作用机制是抑制快速增殖的癌细胞中微管蛋白的功能,基于多西他赛的化疗可抑制前列腺癌进展并延长患者的生存时间[66]。由于前列腺癌的雄激素依赖特性,化疗药物也常与雄激素抑制剂联合使用。目前报道前列腺癌治疗联合用药有多西他赛和卡铂[67]、多西他赛和恩杂鲁胺[68]、多西他赛联合卡铂和雌莫司汀[69]等。
Yan 等[70]设计了一种双靶向组合药物递送策略,以协同诱导前列腺癌细胞的凋亡。使用溶剂置换法配制了基于多西他赛和姜黄素前药的纳米递药系统,以表皮生长因子肽作为靶向修饰物质,通过表皮生长因子介导的内吞作用和癌症环境的酸性pH 被内化到前列腺癌细胞中,从而实现了疏水性药物多西他赛和两亲性姜黄素前药的共同递送,与其他对照组相比,该纳米递药系统表现出更好的前列腺癌细胞抑制作用。
在遵循药物联合使用原则下,通过合理的药物递送系统的设计,联合化疗纳米递药系统有望实现稳定、控释和主动靶向的功能,以提高协同抗癌作用并降低细胞毒性,同时改善前列腺癌治疗效果。
3.2 纳米递送系统用于放疗
放射疗法(radiation therapy,RT),简称放疗,是利用放射线进行肿瘤治疗的方法,常用于低危和中危并且未发生转移的前列腺癌患者[71]。但是放疗只能在局部进行,而且放射线在到达肿瘤部位之前,可能会对正常组织产生影响,出现多脏器危害。另外,由于肿瘤微环境的缺氧状态,会影响放射线的穿透过程及深度,降低治疗效率。为了克服放疗中的这些问题,研究者们设计了不同的纳米递药系统[72]:a.使用强X 射线衰减能力的高原子序数的纳米材料作为放射敏感剂来增强肿瘤部位的辐射能量累积;b.以纳米药物为基础的其他疗法联合放射治疗达到协同抗肿瘤治疗效果;c.通过各种纳米技术策略来调节肿瘤组织的微环境,以克服缺氧相关的辐射抗性并提高放射治疗的疗效。
Luo等[73]通过对金纳米粒子表面聚乙二醇化,合成了核心尺寸为2、5、19 nm的PSMA靶向放射治疗敏化剂,PSMA靶向实现了纳米粒子对肿瘤部位的选择性定位,金纳米颗粒增强了X射线在前列腺癌治疗中的敏感性,极大增强了放疗的疗效。
放疗结合化疗和手术是癌症治疗的黄金标准方案之一,而纳米递药系统既可以作为外部射线辐射的敏化剂,也可以作为内部放射治疗的核素传递系统,合理的设计纳米递药系统与放疗结合,在前列腺癌治疗的未来具有很大的发展空间。
3.3 纳米递送系统用于光动力治疗法
光动力治疗法(photodynamic therapy,PDT)是一种新的肿瘤治疗方法,在光敏剂和氧气的共同存在下,在肿瘤部位注射光敏剂,在光照条件下,光敏剂吸收光子从基态跃迁到激发态,与活性氧物质发生能量交换,产生单线态氧,诱导细胞死亡[74]。自30 多年前获得监管部门批准以来,PDT已成为众多研究的主题,并已被证明是一种有效的癌症治疗形式,但它在临床中并未得到充分利用。
Hu等[75]受细胞膜磷脂双分子结构的启发,通过从表面配位十六烷基三甲基溴化铵,一步构建具有光热/光动力协同作用的仿生细胞膜聚合物囊泡,疏水金纳米棒表面十六烷基三甲基溴化铵与吲哚菁绿和聚己内酯的配位,实现其在水溶液中的自组装。以前列腺癌PC3细胞系为例,近红外光照射下的金纳米棒囊泡可通过产生活性氧和破坏肿瘤细胞质中溶酶体膜的完整性来促进前列腺肿瘤凋亡。
越来越多的实验证据表明,无论是作为多模式治疗方法的一部分,还是作为早期癌症治疗或挽救治疗,PDT 都显示出在前列腺癌治疗中的巨大潜力。当然由于受客观条件的限制,PDT疗法还存在着一些问题。例如,因为PDT 是光响应的治疗途径,光能穿透的深浅对其疗效有比较大的影响,这就使PDT 疗法对人体深部肿瘤治疗的应用受到了一定的限制。另外,光毒也是一个一直都没有彻底解决的问题。因此,提高PDT 疗法治疗肿瘤效果和减少毒副作用的研究十分重要。
3.4 纳米递送系统用于高热疗法
与正常组织相比,由于肿瘤组织的无序、紧凑、可渗透的血管网络和不良的血液流动,其保留热的能力更好[76],高热疗法是在肿瘤组织中利用整体或局部温度升高至40~45℃或者更高的温度,暴露于高温会促进肿瘤部位血管舒张并增强血管通透性,从而增强纳米药物的外渗利用高热杀死肿瘤细胞但不损伤正常组织,实现时间和空间可控性,过高热疗法已经成功用于单独治疗或与其他治疗方法联合的肿瘤治疗方法[77]。高热疗法可以分为光热疗法[78-79]和磁热疗法[80],两者分别通过将光能转化为热能和电磁能转化为热能实现高热的产生。
常用的光热转化剂有贵金属纳米粒子金(Au)(如Au 纳米笼、Au 纳米棒、Au 纳米壳)、一些新兴的二维纳米结构(如石墨烯和黑磷)、聚多巴胺以及半导体等,其中,Au具有较好的生物相容性、较强的表面等离子体共振能力和光热转换效率,在光热治疗中被广泛应用[81-83]。Dai 等[84]制备了一种多功能类黑色素聚多巴胺纳米递药系统,外修饰小分子PSMA作为靶标,用全氟戊烷对其进行功能化修饰并负载光敏剂二氢卟吩e6,所合成纳米递药系统成功用于超声引导下的联合光动力/光热疗法治疗前列腺癌,在660 nm和808 nm照射下产生了光动力治疗和光热治疗的协同作用,由于修饰了靶向探针,在相同照射条件下,靶向组的肿瘤比非靶向组的肿瘤得到更有效的抑制。
磁热疗法是一种将电磁能转变为热能的肿瘤治疗技术,它不易损伤皮肤或肌肉,因为只有磁性纳米颗粒才能吸收磁场能量,通过外加磁场控制磁性纳米颗粒,也可以起到定点定向的靶向作用[85],防止健康组织不必要的加热。此外,磁热疗法不易受复杂因素的影响,是一种极具潜力的肿瘤治疗方法。通常纳米递药系统用Fe3O4和钆等磁性材料实现磁响应[86]。Yadavalli 等[87]制备了pH 敏感的壳聚糖纳米颗粒封装的钆掺杂镍铁氧体纳米粒子,形成了荧光和癌症靶向磁性载体系统。在250 kHz和35 mT 的交流磁场下,溶液温度可以在600 s 内从27°C 急剧增加到68°C,治疗药物姜黄素有最大86%的载药量和最高70%的药物释放,在前列腺癌治疗中表现出良好的应用前景。生物相容性磁性纳米粒子介导的磁热疗是一种创新、高效且更安全的癌症治疗热疗方法。磁性纳米粒子的结构和磁性特性以及外部磁场参数是临床必不可少的成功控制加热性能的因素。临床上,当磁热疗法与放射/化学疗法一起用作辅助疗法时,具有非常好的前列腺癌治疗效果。
4 总结与展望
为了提高前列腺癌疗法的疗效并减少副作用,纳米药物递送系统逐渐出现并应用于前列腺癌治疗,纳米递药系统在肿瘤药物递送方面发挥着巨大的作用,许多纳米递送载体材料已被用作前列腺癌治疗中药物或治剂的递送。然而仍然存在限制纳米递药系统应用的因素,实验室和临床应用的纳米递药系统仍然存在巨大差距。在未来,研究人员应考虑以下几个方面:首先,当纳米递药系统进入血液后,蛋白质电晕是在材料暴露于生物环境期间在纳米颗粒表面上形成的不可避免的外层,一些研究发现,肿瘤靶向配体的靶向能力会因蛋白冠的影响而减弱,如何避免蛋白质电晕对材料靶向的影响并延长材料在体内的循环时间,也是需要着重考虑的事情;其次,纳米递药系统的被动靶向EPR 效应目前仍存在争议,其明确的机理和递送效果在不同的肿瘤组织中存在较大的差异,虽然现在已有诸多关于纳米递药系统靶向性的研究,但如何设计优化其靶向效果是不小的挑战,应该继续研究设计具有更有效靶向和更特异性反应的先进纳米递药系统,为耐药性PCa、晚期PCa、转移性PCa 的治疗带来新的方法和希望;最后,前列腺癌与雄激素相关的特殊性使之与其他肿瘤存在差异,如何利用这种差异和区别设计更具有前列腺癌针对性的纳米材料是值得深入研究的问题。
纳米递药系统结构与治疗效果之间的定量关系为纳米递药系统的设计奠定了基础,更多的设计应该优化聚合物纳米平台的结构并提高治疗剂递送的有效性。应该彻底研究纳米药物的体内代谢,在临床试验中,纳米递药系统可以弥补传统治疗药物在药代动力学方面的不足,但更应该研究纳米递药系统对药物代谢和分布的影响,以进一步提高其临床价值。再者纳米递药系统的临床转化仍具有挑战性,纳米递药系统从实验室应用到临床的过程需要进一步研究,每一个纳米载体都需要经过无数次临床试验的验证,才能用于临床应用,对聚合物纳米载体进行更具前瞻性的研究,同时对其进行修饰以更好地适应人体,也是未来研究的重点方向。
总而言之,随着生物医学实验的进步,更多的应用于前列腺癌的纳米递药系统将从实验室转移到临床。研究人员必须在前列腺癌患者中正确评估这些纳米递药系统的辅助治疗方法是否真正有效,并建立临床相关的检测限,全面评估临床性能参数,更好的将这些纳米技术转化为临床应用。随着纳米诊断方法的许多突破性进展,癌症纳米技术在改善前列腺癌治疗方面大有可为。

