自组装无载体纳米药物的研究进展*
陈婷婷 程浩艳 李 震 金保胜 陈炜睿 黄 蕊 王文霞** 郑俊霞**
(1)广东工业大学生物医药学院,广州 510006;2)河南科技大学材料科学与工程学院,洛阳 471000)
在医学领域,利用纳米技术构建靶向纳米药物递送系统可改善传统药物溶解性和传递效率,延长药物半衰期,提高其生物利用度及降低不良反应,有望解决临床治疗中出现的耐药性问题[1]。近年来,基于纳米颗粒的靶向药物载体在生物医药领域越来越多地受到关注和青睐[2],如脂质体、蛋白质、线粒体、具有大平面尺寸和比表面积的过渡金属硫族化合物和过渡金属碳化物等二维材料。然而,新型纳米药物载体的有效性、安全性、药代动力学等成药性特征仍需深入和系统的研究。此外,纳米载体药物在未来大规模生产应用中仍存在一些“瓶颈”问题,如纳米载体载药量低、载体材料制备复杂、批次间可控性较差、生产成本高昂、具有潜在的系统毒性和免疫原性等,很大程度上限制了其临床应用[3-4]。
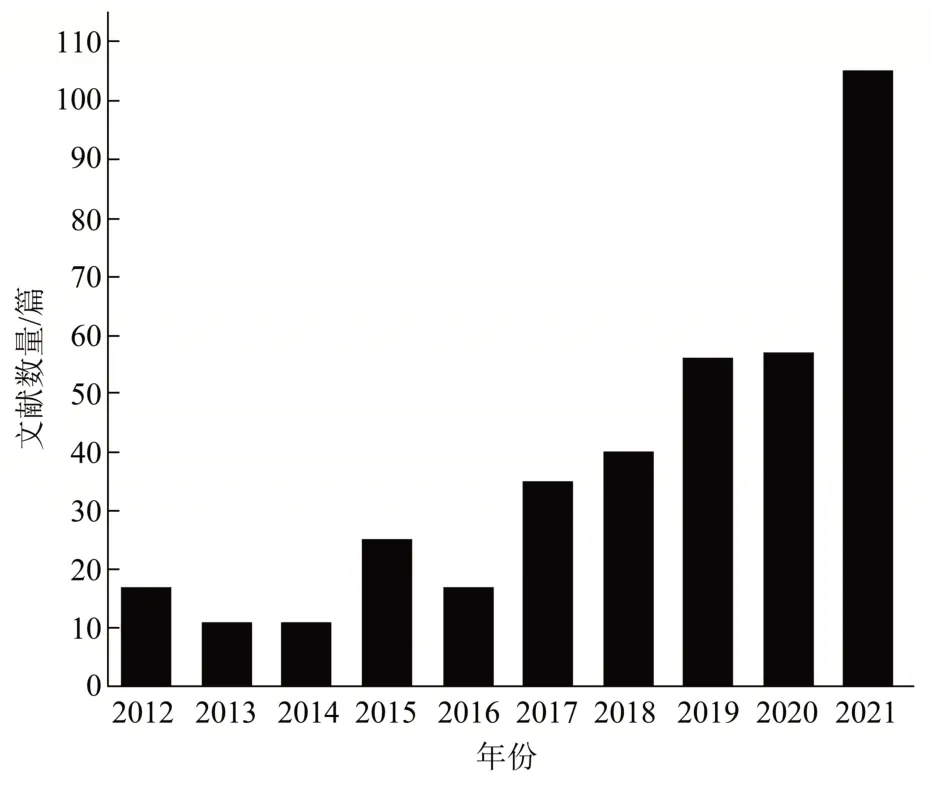
Fig.1 Number of publications regarding the self-assembled carrier-free nanodrugs reported in recent 10 years(web of science,2022.04.07)图1 近10年自组装无载体纳米药物文献报道数量(web of science,2022.04.07)
为了实现更高的疗效,无载体纳米药物的概念被提出。这种策略是基于药物分子的自组装作用形成的纳米结构,其载药量高达100%[5]。相比于传统纳米药物递送系统,自组装无载体纳米药物递送系统还具有如下独特的优势:制备方法简单灵活、药物负载能力和传递效率高、血液循环半衰期长、避免载体带来的相关毒性及免疫原等副作用[6]。近年来,无载体纳米药物广泛应用于抗肿瘤、抗菌、抗炎和抗氧化等生物医学领域[7],从近10年相关文献报道数量(图1)可以看出,无载体纳米药物越来越受到国内外学者的广泛关注,并成为当前研究的热点。因此,本文主要系统地综述无载体纳米药物的自组装机理、制备方法及其在抗肿瘤、抗菌、抗炎、抗氧化等方面的应用,重点指出目前无载体纳米药物在应用过程中存在的主要问题,并展望未来相关的主要研究方向,为无载体纳米药物在医药治疗领域的开发与应用提供重要的借鉴。
1 无载体纳米药物自组装作用力
自组装是基本结构单元(分子、纳米材料、微米物质等)自发形成有序结构的一种技术。目前,无载体纳米药物主要通过氢键、π-π 堆积、疏水作用、静电作用和范德华力等非共价键的弱作用力自组装形成。
1.1 氢键
氢键是无载体纳米药物自组装很重要的一种非共价键驱动作用力。氢键主要存在于H原子和电负性的原子(如O、F 和N)之间,是一种比较弱的作用力,强度为10~40 kJ/mol[8-9]。Le 等[9]使用瞬时纳米沉淀法通过紫杉醇(paclitaxel,PTX)、单宁酸(tannic acid,TA) 及聚乙烯吡咯烷酮(polyvinyl pyrrolidone,PVP)之间的氢键作用自组装制备出平均粒径为54 nm 的紫杉醇/单宁酸/聚乙烯基吡咯烷酮纳米药物(PTX-NP)(图2),单宁酸可以抑制肿瘤细胞中P糖蛋白的表达,降低肿瘤细胞耐药性。pH 响应型的PTX-NP 能够在胃肠道靶向释放,口服给药后相对生物利用度为25.6%,在乳腺癌异种移植小鼠模型中具有显著的肿瘤抑制效果。分子动力学模拟研究表明,PVP的羰基与TA 中的邻苯三酚或儿茶酚部分形成氢键,PTX 的羟基或氧原子与TA 形成氢键。与PVP 相比,TA与PTX之间的氢键作用力更强,但是TA与PVP之间的氢键作用对形成稳定的无载体纳米药物PTX-NP具有重要作用。
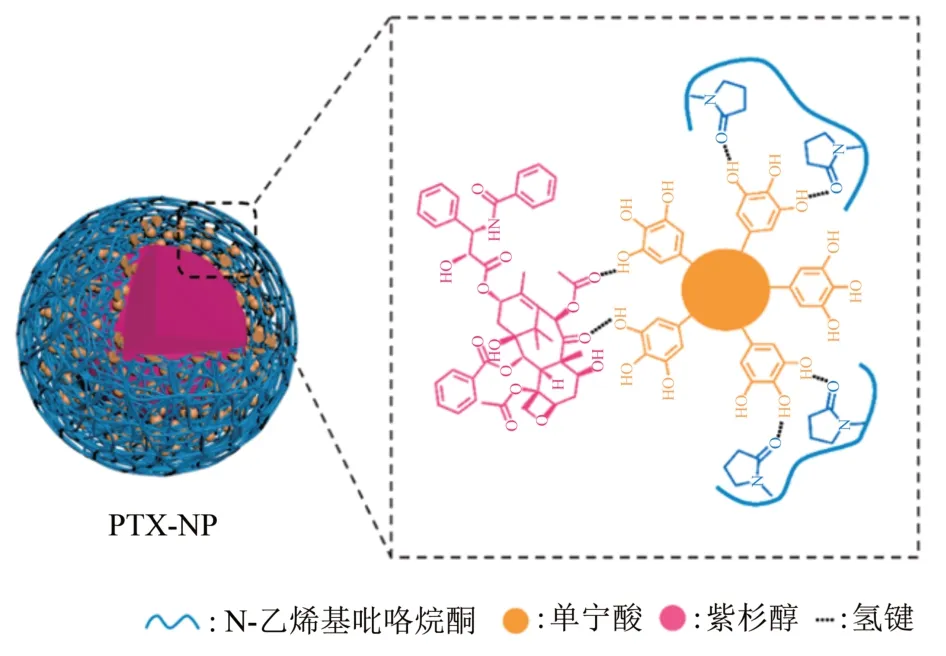
Fig.2 Self-assembly mechanism diagram of PTX-NP[9]图2 PTX-NP的自组装机理图[9]
1.2 π-π堆积
π-π 堆积是有机纳米药物自组装的重要驱动力之一。π-π 堆积是指芳香环之间有吸引力的非共价相互作用,是一种与氢键同样重要的非共价键相互作用,其强度在1~50 kJ/mol之间,可以促进含有π共轭基团的定向生长[10]。因此,芳香族化合物的芳香环可以通过边对面(T 形)、偏移堆叠或者面对面相互堆积驱动自组装形成纳米药物[11]。Zhu等[12]通过铁死亡诱导剂erastin 和光敏剂二氢卟吩e6(chlorin,Ce6)之间的π-π堆积和氢键作用力自组装成无载体纳米药物Ce6-erastin,Ce6-erastin 能被肿瘤细胞高效摄取。一方面铁死亡过程中脂质过氧化物和活性氧(ROS)的过量蓄积破坏氧化还原稳态,另一方面铁死亡过程中芬顿反应产生的分子氧可补充光动力治疗(PDT)过程中氧气的消耗,进一步提高PDT的疗效,因此,Ce6-erastin介导的诱导铁死亡联合PDT可以有效抑制肿瘤细胞活性,具有显著的抗肿瘤效果。研究表明,可以通过调控π-π 相互作用自组装制备不同形状的无载体纳米药物。Hu 等[13]将 亲 水 聚 乙 二 醇(polyethylene glycol,PEG) 和还原性响应喜树碱前药单体(CPTM)通过可逆加成断裂链转移聚合反应制备出聚前药两性分子PEG-b-PCPTM,然后通过调控PEG-b-PCPTM 自组装过程中有机溶剂的组成和加水速度,高效可控制备出具有4种不同结构的纳米药物(球形、花状复合囊泡、光滑盘状和错列堆积片层结构)。研究表明,4 种结构纳米药物具有不同的降解速率、药物释放速率和肿瘤细胞毒性。此外,不同形貌自组装纳米药物也表现出不同的生物效应。
1.3 疏水作用
疏水作用是疏水药物自组装形成纳米粒子的主要驱动力。由于疏水分子不能与水分子充分相互作用,它们倾向于在水溶液中以最小化表面积的形式聚集,从而降低总能量,提高纳米结构的稳定性[14]。近年来,许多研究学者通过疏水作用将疏水性药物和亲水性药物自组装成无载体纳米药物。Cao 等[15]通过疏水作用将疏水的酚类抗氧化剂琥珀丁醇(succinobucol,SCB)与三嵌段聚合物泊洛沙姆P188 自组装成球形纳米颗粒,该纳米粒子提高了SCB 的口服生物利用度,并显著降低乳腺癌细胞VCAM-1 的表达,抑制乳腺癌细胞的肺转移。Huang 等[16]通过疏水作用将亲水性抗癌药伊立替康(irinotecan,Ⅰr)和疏水性抗癌药苯丁酸氮芥(chlorambucil,Cb)自组装形成球形Ⅰr-Cb纳米药物,该自组装无载体纳米药物在血液中的滞留时间更长,促进细胞对药物的高效摄取,药物进入细胞后亲水性和疏水性单体药物之间的酯键水解,释放出游离的Ⅰr 和Cb,发挥优异的抗癌活性。目前由疏水作用驱动形成的自组装无载体纳米药物多为球形纳米粒子,但也有少数为其他结构。Liang等[17]将两个疏性水性的抗癌药物喜树碱分子(camptothecin,CPT)和两个亲水性的抗癌药物氟尿苷分子(floxuridine,FUDR)通过可水解的酯键偶联到季戊四醇骨架上,通过疏水作用自组装合成一种具有高度对称性的Janus结构喜树碱-氟尿苷共轭化合物(JCFC NCs)。该JCFC 共轭化合物在极性溶剂中可自组装形成具有类似脂质体双层膜结构的纳米胶囊。JCFC 纳米胶囊的载药量高达60%以上,稳定性较高且可避免药物分子的泄漏。与游离的FUDR 及CPT 相比,JCFC 纳米胶囊可高效富集到达肿瘤部位,在酸性微环境和酯酶的作用下,释放出摩尔比为1∶1的氟尿苷/喜树碱具有显著的协同抗肿瘤效果。
1.4 其他非共价作用力
除了氢键、π-π 相互作用和疏水作用,静电作用和范德华力也是驱动自组装制备无载体纳米药物的非共价作用力。静电作用发生在含有带电基团的药物之间,带电基团之间的相互作用力与电荷量成正比,与基团电荷中心距离成反比[18-19]。对于带电基团的药物,通过改变药物比例可以改变静电作用活化能,从而获得具有不同粒径的无载体纳米药物。Xiao 等[19]通过阿霉素(doxorubicin,DOX)上的—NH2+和光敏剂脱镁叶绿酸 A(pyropheophorbide a,PhA)上的—COO-之间的静电作用自组装制备了无载体纳米粒子DOX-PhA NPs,用于光/化疗联合治疗癌症。通过调控DOX和PhA 的比例,可以制备得到不同粒径的DOXPhA NPs。在弱相互作用力中,范德华力属于短程作用力,它比化学键或共价键弱得多,能量在1~4 kJ/mol 之间[20]。虽然范德华力很少被视为控制自组装的主要驱动力,但它可以用来调整纳米粒子的大小、分子晶体构象和稳定性[20]。
无载体纳米药物也可以由两种或两种以上的非共价作用自组装而成。Zhang 等[21]通过吉非替尼(gefitinib,GEF)和三肽酪丝缬肽(tyroservatide,YSV)之间的氢键和π-π堆积作用自组装制备无载体纳米药物GEF-YSV NPs,与GEF、YSV 和GEF/YSV 混合药物相比,GEF-YSV NPs 的细胞内化作用增强,可显著抑制癌细胞增殖。Zhou等[22]通过π-π堆积和氢键将喜树碱-20(S)-甘氨酸(CPT-NH2)自组装成纳米纤维,该纳米药物可以有效穿透癌细胞的细胞膜,最大限度地提高疗效。Wang 等[23]利用大黄素(rhein,Rhe)和DOX 分子之间的氢键、π-π 作用和疏水作用通过反溶剂沉淀法自组装制备RHE/DOX NPs(RD NPs)。与单独用药相比,RD NPs 对4T1 细胞表现出较高的细胞毒性,通过调控NF-κB1和MMP-9的表达从而抑制肿瘤细胞的侵袭和生长。
综上所述,无载体纳米药物主要通过氢键、π-π 堆积、疏水作用、静电作用以及范德华力等非共价作用自组装而成。分子间的非共价作用力取决于药物分子的化学结构。一般来说,具有以下结构特征的分子可能会通过自组装形成无载体纳米药物:a.大量的芳香结构(驱动π-π堆积相互作用);b.各种离子基团(驱动静电作用);c.丰富的氧原子和氮原子(驱动氢键)[3]。
2 无载体纳米药物的自组装制备方法
无载体纳米药物的自组装方法包括体内自组装法和体外自组装法。与体外自组装法相比,体内自组装法制备的无载体纳米药物具有更高的载药量,在血液中的循环时间更长,具有更优异的细胞摄取率[7]。
2.1 体外自组装法
无载体纳米药物的体外自组装法包括自上而下法、反溶剂沉淀法和模板辅助沉淀法。
2.1.1 自上而下法
无载体纳米药物的自上而下制备方法主要包括高压均质法和介质研磨法。高压均质法是指在高压条件下,利用冲击力、剪切力和空腔作用来减小药物的粒径,制备粒径分布较窄的纳米药物[7]。Fan等[24]通过高压均质法制备了平均粒径为(125.6±2.2)nm 的雷公藤红素-牛血清白蛋白纳米药物(celastrol-BSA-NPs)。celastrol-BSA-NPs 的载药量高达(13.88±0.12)%,释放时间最长可达168 h。与游离的雷公藤红素相比,celastrol-BSA-NPs在水溶液中的溶解度更高,细胞摄取率更高,通过肠道屏障的能力更强,在治疗饮食诱导的肥胖症方面表现出更好的生物利用度和体内疗效。该方法具有操作简单和可规模化生产的优点,但是存在设备成本高、均质循环次数多、均质化前药物需经过高速搅拌和分散预处理等缺点[25]。介质研磨法是将药物与研磨介质置于研磨室中,通过机器的运转带动药物颗粒之间以及药物颗粒与研磨介质、器壁间的撞击,而达到纳米级别[26]。如Tanaka等[27]通过在磨浆中加入适量的分散剂Pluronic F-68,将难溶性药物阿苯达唑和达那唑分别研磨为纳米颗粒。分散的纳米颗粒通过冻干从浆液中提取出来,得到粒径分别为185和102 nm的纳米颗粒。介质研磨法虽然操作简单、可大规模生产,但是磨床可能因为腐蚀而污染产品,延长制备周期。因此,研磨介质磨损和研磨表面可能对产品带来的污染限制了其在高纯度纳米药物制备领域的应用。研究表明,通过与其他方法结合,可以解决介质研磨法存在的缺点。Patel等[28]通过超声波辅助介质研磨法制备得到小粒径低污染的非诺贝特纳米药物,提高了药物悬浮液的稳定性。
2.1.2 反溶剂沉淀法
反溶剂沉淀法通常是将疏水性药物或者两亲化合物溶解在合适的有机溶剂中,然后与大量反溶剂(如去离子水)混合,使溶液过饱和,进而析出药物并通过非共价作用力自组装为无载体纳米药物(图3)。反溶剂沉淀法具有操作简单、环境友好、成本低廉等优点。通过改变反溶剂沉淀法关键实验参数可以调控无载体纳米药物的形貌和尺寸,使无载体纳米药物在血液中的循环时间更长,具有更优异的细胞摄取率[7]。如Chen 等[29]以10-羟基喜树碱(10-hydroxycamptothecin,HCPT)乙醇溶液和DOX水溶液为主要实验药物原料,通过调控DOX/HCPT 摩尔浓度和HCPT 乙醇溶液的注射速率,可以制备形貌和粒径可控的无载体纳米药物HCPT/DOX,当DOX/HCPT 摩尔浓度为4∶1 时,得到形貌均一、粒径为231.6 nm的球形无载体纳米药物。
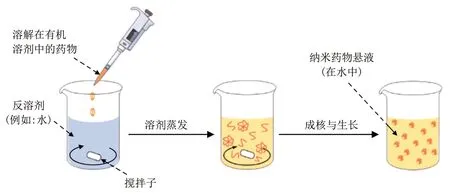
Fig.3 Schematic illustration for the synthesis of carrier-free nanodrugs by reverse solvent precipitation[6]图3 反溶剂沉淀法制备无载体纳米药物的示意图[6]
虽然反溶剂沉淀法操作简便、成本低廉,不需要昂贵的实验设备,但是,在反溶剂沉淀法自组装过程中,无载体纳米药物的形貌和尺寸非常容易受到药物浓度、溶剂类型和搅拌速率等关键实验因素的影响[6]。因此,此方法制备无载体纳米药物仍然面临很多“瓶颈”,如制备的无载体纳米药物产率较低、 重复性较差且粒径较大(100~500 nm)等[30-31]。
2.1.3 模板辅助沉淀法
模板辅助沉淀法在反溶剂沉淀法的基础上,通过使用模板来实现对无载体纳米药物颗粒尺寸的控制,可以解决反溶剂沉淀法所面临的瓶颈问题。模板辅助沉淀法可分为阳极氧化铝(AAO)模板辅助法[32]和冰模板辅助法[33],此方法首先将预处理的模板在药物溶液中浸泡,使药物溶液通过毛细管力扩散到模板的孔或缝隙,然后使溶剂挥发,药物前体进行自组装,最后去除模板得到无载体纳米药物。通过模板辅助法制备的无载体纳米药物的粒径受到药物浓度和模板孔径的影响,当实验药物的浓度较高时,模板中药物的浓度也较高,因此自组装制备的无载体纳米药物的粒径就越大[7]。然而,当实验药物浓度升高到一定的阈值时,无载体纳米药物的粒径主要受模板孔径大小的影响。如Zhang等[32]通过调控AAO 模板尺寸制备出粒径分布为10~100 nm 的无载体纳米药物替尼泊苷VM-26 PND,首次合成了粒径小于20 nm的无载体纳米药物(图4),突破了反溶剂沉淀法无法制备粒径较小的无载体纳米药物的瓶颈。此外,该方法也应用于多种实验药物自组装制备无载体纳米药物,如紫杉醇(paclitaxel,PTX)、他莫昔芬(tamoxifen,TMF)、卡莫司汀(carmustine,BCNU)、甲氨蝶呤 (methotrexate, MTX) 和 6- 巯 基 嘌 呤(6-mercaptopurine,6-MP)等[32]。
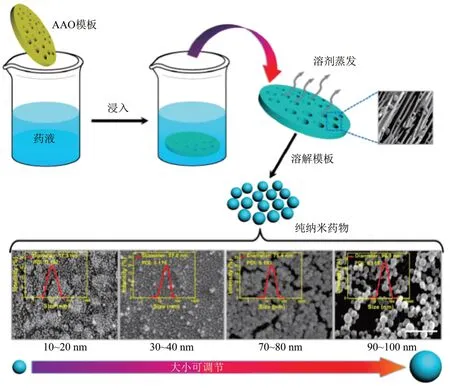
Fig.4 Schematic diagram of preparation of carrier-free nanodrugs by AAO template assisted precipitation method[32]图4 利用AAO模板辅助沉淀法制备无载体纳米药物的步骤示意图[32]
但是,AAO模板辅助法使用的AAO模板价格昂贵、前处理程序冗杂、残存的微量模板可能污染药物,且去除AAO 模板使用的强酸或强碱可能会破坏纳米药物的结构。近年来,研究表明使用冰模板辅助法制备无载体纳米药物具有独特的优势,如Zhang 等[33]开发一种低成本、环境友好的冰模板辅助法制备具有高纯度和生物相容性的无载体纳米药物姜黄素(Cur PDNs),将溶解在四氢呋喃中的姜黄素滴在冰模板上,有机溶剂挥发后,姜黄素渗透到冰晶体中,冰模板在-20℃反应24 h使实验药物自组装为纯姜黄素纳米药物。最后,通过融化、冷冻干燥或超声分散在去离子水中等方法提取纯姜黄素纳米药物。通过调控冰模板晶界形状和通道尺寸可以制备得到不同形貌和粒径的无载体纳米药物。与AAO 模板辅助法相比,冰模板辅助法成本低廉、操作简便、模板易得且制备的无载体纳米药物产率较高。
2.2 体内自组装法
体内自组装是指通过静脉注射的外源性小分子响应于特定位点发生自组装,原位形成具有特定诊断和治疗功能的高度有序纳米药物,其广泛应用于肿瘤的诊断和治疗等领域[34-35]。不同于纳米材料的被动靶向,体内自组装纳米药物具有独特的靶向方式,即小分子药物的自组装对病理位点具有选择性,可避免非靶向药物递送带来潜在副作用的风险。
根据刺激来源的不同,用于体内自组装的刺激可分为内源性刺激和外源性刺激。内源性刺激包括多种过表达的酶、pH值和氧化还原环境等[36]。与正常器官不同,肿瘤部位过表达的酶、酸性环境和氧化还原条件等可作为触发因素引发小分子药物自组装。在这些生理信号的刺激下,药物前体被切割或共轭以改变其化学结构和组装性质,从而使所得的分子进一步自组装成所需的纳米药物[37]。如图5所示,Cong 等[34]利用肿瘤微环境pH 来调控体内自组装行为,将由pH 敏感单元顺乌头酸酐(CAA)修饰的治疗肽和细胞穿膜肽通过硫醇-烯点击反应与主链β-硫代酸酯偶联,开发出了一种pH响应型多肽聚合物,CAA 可以使多肽聚合物在中性水溶液中水解为稳定的单链状态。多肽聚合物单链尺寸较小,可以渗透到肿瘤深处;而当多肽聚合物到达肿瘤中的弱酸微环境中时,CAA 将响应脱除并引起多肽聚合物自组装为纳米颗粒。此纳米颗粒可以通过内吞作用进入肿瘤细胞,同时CAA 的完全水解也使治疗肽的治疗活性恢复,从而有效杀死癌细胞。Wu 等[38]设计一种碱性磷酸酶(ALP)可激活的近红外探针ⅠR775-Phe Phe-Tyr(H2PO3)-OH(1P)。研究表明,1P在肿瘤微环境中碱性磷酸酶的作用下去磷酸化,生成疏水性的产物ⅠR775-Phe-Phe-Tyr-OH(1),其被肿瘤细胞摄取后自组装成纳米颗粒(1-NPs)。1-NPs 使光声成像信号增大6.4倍,可用于精准诊断探针相对应的癌症。
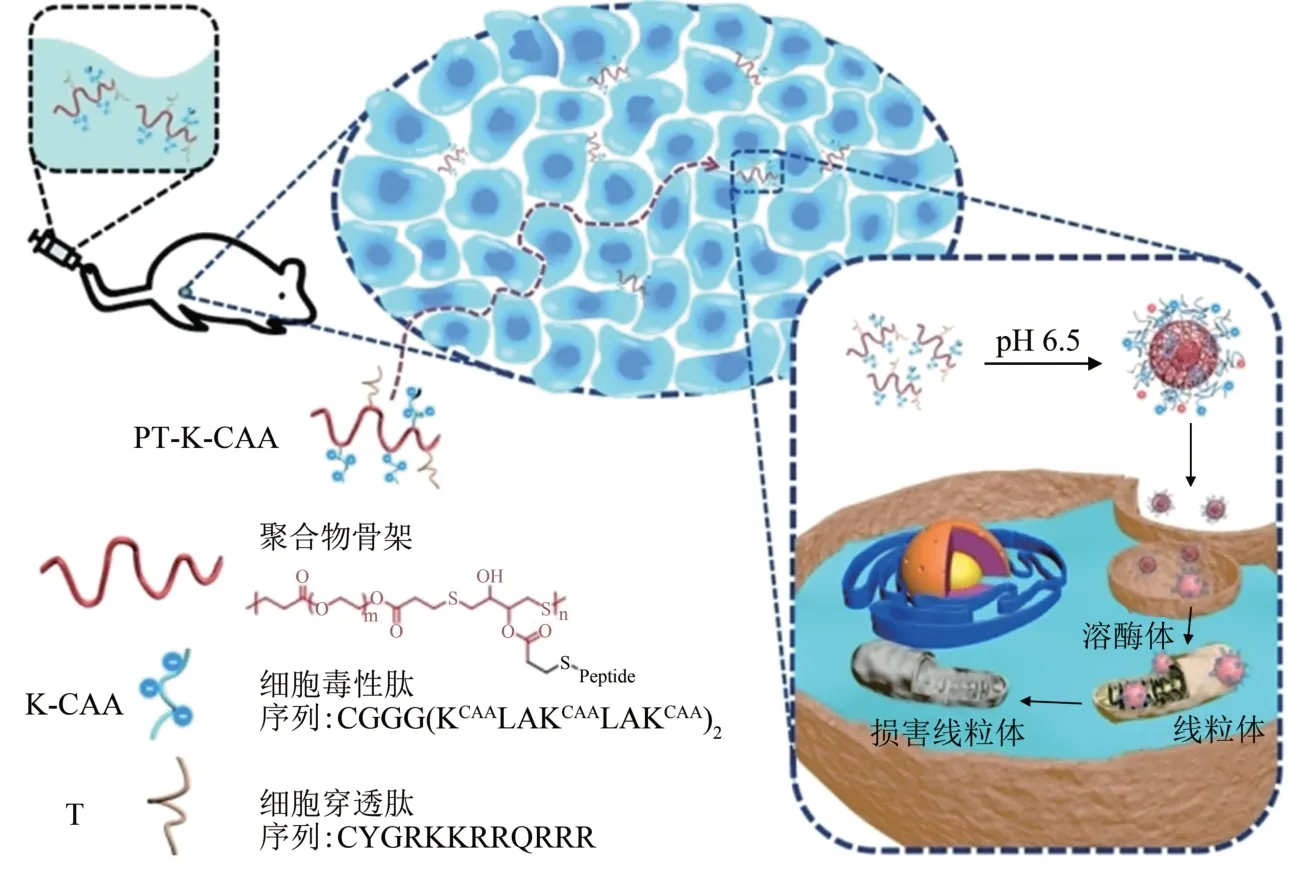
Fig.5 Schematic illustration for the self-assembly and permeation of PT-K-CAA in tumor microenvironment[34]图5 PT-K-CAA在肿瘤微环境中的自组装及渗透过程示意图[34]
外源性刺激一般指外部物理刺激,如温度和化学反应等。Liu 等[39]合成了由多聚(β-硫酯)、功能肽和近红外分子组成的聚合物偶联物(polymerpeptide conjugates,PPCs)。PPCs尺寸较小(<10 nm),易在肿瘤部位发生渗透,从而能够“深入肿瘤内部”。在近红外激光照射下,近红外分子引起的高温使热响应性PPCs 在肿瘤内自组装为球形纳米颗粒。其在肿瘤内积聚并有效进入细胞,通过破坏线粒体膜诱导细胞凋亡。不同类型的外源性刺激可以协同靶向癌细胞。Yao 等[40]利用酶触发的超分子自组装和四嗪(tetrazine,Tz) 与反式环辛烯(trans-cyclooctene,TCO)之间的生物正交断键反应合成了带有前药激活开关Tz 的酶响应组装前体短肽,与Tz 偶联的分子在宫颈癌细胞内过表达的磷酸酶作用下去磷酸化并原位自组装为纳米组装体,使前药激活开关Tz 获得肿瘤靶向性并且大量富集。阿霉素前药TCO-DOX在肿瘤内能被高效激活,注射4 h后,肿瘤内活化的DOX浓度比正常细胞或组织高10倍,显著提高了癌细胞的杀伤效果。
综上所述,介质研磨法和高压均质法可用于工业化生产纳米药物,但过程耗时、易污染产品;反溶剂沉淀法和模板辅助沉淀法是自组装制备纳米药物常用的方法,具有绿色环保、工艺简单、成本较低等优点,但是目前仅限于实验室或者理论研究;而体内自组装法制备的纳米药物具有靶向性,可在目标位置进行自组装,从而达到更高的疗效。
3 无载体纳米药物的应用
3.1 抗肿瘤作用
根据世界卫生组织公布的数据,目前癌症已成为全球第二大死因,每年有近960 万人死于癌症[41]。化学药物治疗(化疗)是临床控制肿瘤恶化的主要手段之一。然而,化疗中使用的药物存在生物相容性差、副作用大、耐药等缺点,极大地限制了其临床疗效[42]。目前研究表明,将化疗药物以非共价键封装到纳米载体(如纳米微球、脂质体以及各种类型的聚合物胶束)中可以改善难溶药物的溶解性,满足不同给药途径,但是,这些纳米系统的载药能力低,药物释放缓慢,进一步限制了其治疗效果[43]。
因此,开发一种不使用载体的高负载药物给药系统是非常有意义的。自组装无载体纳米药物是指由一种或几种活性药物自驱动形成的纳米级自投递药物[44]。由于其具有载药量高和无载体等优点,已被研究者开发用于治疗肿瘤。如Fan 等[45]利用熊果酸(ursolic acid,UA)分子间的静电和疏水作用通过反溶剂沉淀法自组装合成单一纯纳米药物(UA NPs),通过下调STAT 3的表达,影响肿瘤细胞的转录过程,诱导TNF-α 的表达来杀伤癌细胞。与游离UA 相比,UA NPs 显著改善了治疗动物外周血中CD4+ T 细胞的数量,并增强了CD4+/CD8+T细胞的浸润。除熊果酸外,阿霉素[46]、喜树碱[47]和紫杉醇[48]等抗癌药物也被发现具有自组装能力,其自组装形成的纳米药物与游离的纯药物相比,制备简单、载药量超高,且可显著提高抗癌效果。
由于肿瘤的异质性[49],单药通常不足以控制肿瘤,因此,多种化疗药物联合治疗被认为是一种更有前景的癌症治疗方式[50]。Xiao等[42]利用雷公藤红素(celastrol,CST)和DOX 分子间的静电作用和π-π堆积,通过反溶剂沉淀法将其自组装形成雷公藤红素/阿霉素纳米药物(CST/DOX NPs)(图6a)。通过使用PBS 缓冲溶液(pH=7.4 和5.0)模拟血管中的血流条件和肿瘤酸性微环境,对其进行体外药物释放研究,在pH7.4 PBS中经过48 h后仅释放出48.9%的DOX,但在pH5.0 PBS中48 h后释放出83.2%的DOX,表明CST/DOX NPs 的体外释放具有明显的pH 响应性。激光共聚焦显微镜分析表明CST/DOX NPs 通过被MCF-7 和MCF-7/ADR细胞内化而转化为游离药物CST 和DOX,从而发挥抗癌作用。与单药和CST/DOX 复合物相比,在CST/DOX NPs 处理下多细胞球形肿瘤(MCs)的平均直径从100%降低到11.8%,具有显著的抗癌效果(图6b)。此外,肿瘤微环境具有不同于其他组织的特点,如微酸性(pH=5.6)、谷胱甘肽(GSH)过度表达、乏氧程度严重以及过氧化氢水平高等[51]。因此,不少研究者通过脂键或二硫键将两种化疗药物结合形成两亲性前药,随后自组装形成纳米药物,可以在肿瘤细胞内部响应性转化为具有生物活性的原药,从而达到抗肿瘤的效果并降低药物的全身毒副作用的目的。如Hou等[52]将亲水性药物吉西他滨(gemcitabine,Gem)和疏水性药物CPT 通过二硫键链接后得到两亲性Gem-CPT前药,通过反溶剂沉淀法在水溶液中自组装形成Gem-CPT NAs。在肿瘤还原性的微环境下,Gem-CPT NAs 二硫键被裂解,释放出Gem 和CPT分子,从而发挥抗肿瘤作用。Huang 等[53]通过酯化反应将疏水性药物Cb分别与亲水性药物Gem和Ⅰr 链接起来,得到两亲性的缀合物Gem-Cb 和Ⅰr-Cb,由于具有两亲性特征,Gem-Cb 和Ⅰr-Cb 缀合物能在水中组装形成纳米粒子。此外,可以使用反溶剂沉淀法将具有不同摩尔比例的两种缀合物Gem-Cb和Ⅰr-Cb自组装制备成具有优异抗癌效果的三元纳米复合药物(图6c)。该三元纳米复合药物到达肿瘤细胞后酯键被水解,释放出3种具有不同抗癌机制和非毒性重叠的药物,从而发挥药物的协同治疗作用以提高疗效。体外细胞毒性研究表明,三元纳米复合药物N4对人肺癌细胞A549具有较高的细胞毒性(图6d,e)。
此外,通过引入靶向配体也可以提高无载体纳米药物对癌细胞的靶向性和降低全身毒性。常用的癌症治疗靶向配体有CD44、叶酸受体或整合素受体等。例如,Jiang 等[54]通过π-π 堆积、疏水和静电作用将熊果酸和DOX自组装形成UD NPs,并在表面修饰HER2适配体,提高了对乳腺癌细胞的靶向能力,从而达到更好的抗癌作用。
3.2 抗菌作用
细菌感染严重威胁着人类的健康,导致各种疾病甚至死亡[55]。抗生素是治疗临床细菌感染相关疾病的主要药物,然而,抗生素的大量使用使得耐药菌发生率急剧增加,给临床细菌感染相关疾病的治疗带来极大挑战。相关研究表明,利用纳米技术开发载药系统,可以减少抗生素的剂量和使用频率[56-58]。纳米药物载体具有体积小、比表面积大、基质可控释放、靶向给药等优点,但是,载药系统使用的无机辅助剂如二氧化硅、金属骨架等不能被人体代谢消除[59-60]。因此,合成简单、无载体、生物相容性好的自组装纳米药物在临床细菌感染治疗中具有重要意义。
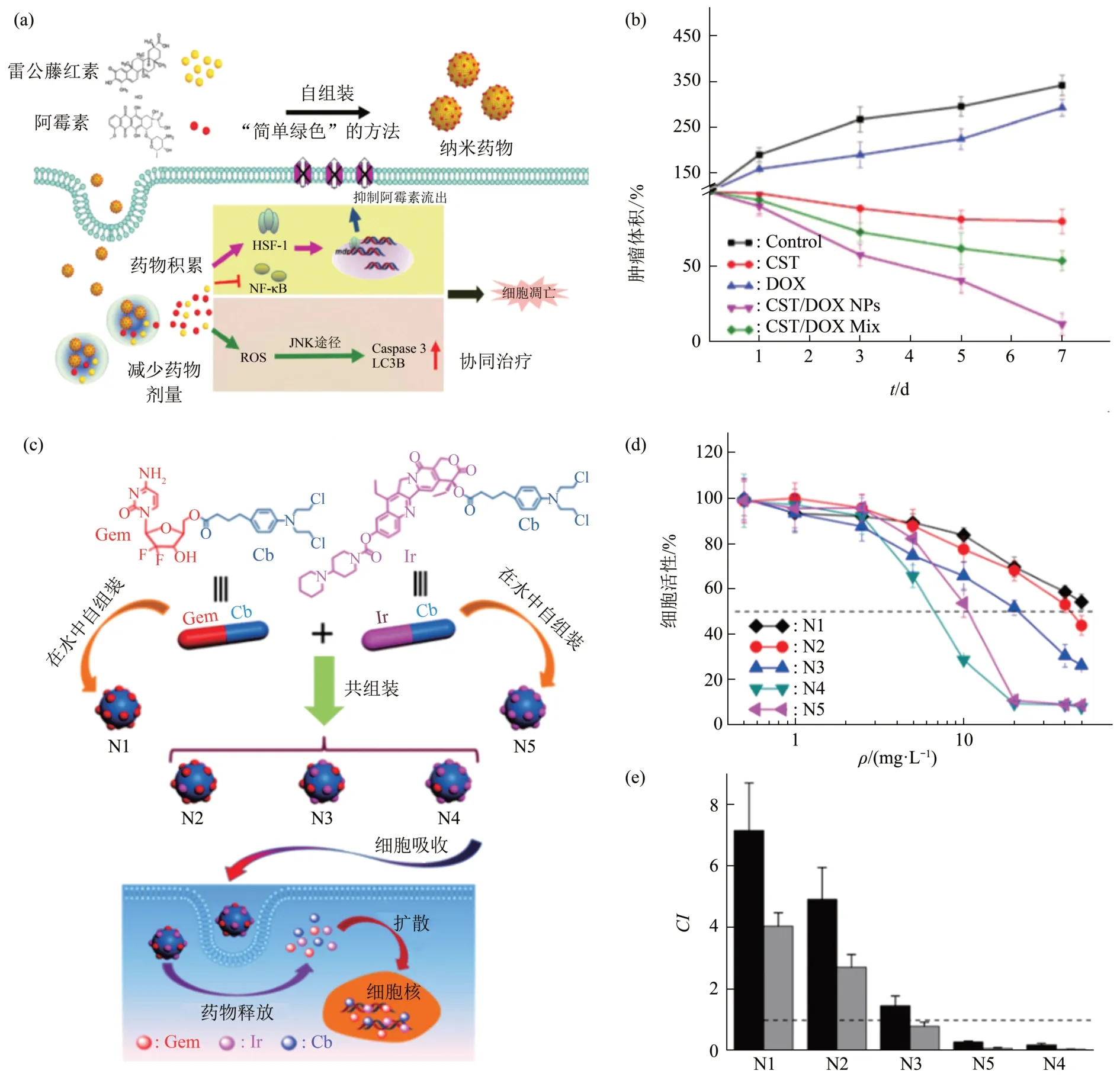
Fig.6 Self-assembled carrier-free nanodrugs for cancer therapy[42,53]图6 自组装无载体纳米药物用于癌症治疗[42,53]
雷海明等[61-63]基于中药处方的启示,研究发现小檗碱上的季铵离子和苯环可与其他药物通过非共价自组装成纳米粒子,发挥抗菌作用。比如,该课题组基于中药活性成分小檗碱(berberine,Ber)和Rhe 之间的π-π 相互作用和静电作用利用反溶剂沉淀法自组装制备Ber-Rhe NPs(图7a)。由于两种活性成分Ber和Rhe的协同抑菌作用,Ber-Rhe NPs的抗菌活性显著增强(图7b)[61]。该课题组也通过构建小檗碱和肉桂酸自组装纳米给药系统以提高对金黄色葡萄球菌的抑菌活性[62]。在自组装过程中,肉桂酸的羰基可与小檗碱的氮原子形成氢键,同时两个分子的芳香环形成π-π堆积结构。该自组装纳米粒子能自发地吸附于细菌表面,渗入细胞,攻击多耐药的金黄色葡萄球菌,从而达到较强的抑菌效果。Song 等[64]对小檗碱进行烷基化修饰后合成4种衍生物,在抗幽门螺旋杆菌上表现出比小檗碱更强的抗菌活性。随着小檗碱上修饰的烷基链长度的增加,小檗碱衍生物对幽门螺旋杆菌的最低抑菌浓度(minimum inhibitory concentration,MIC)值逐渐降低。并且,该团队将这4种烷基化小檗碱衍生 物(berberine derivatives,BDs) 和 鼠 李 糖 脂(rhamnolipid,RHL)通过静电和疏水作用自组装制备出BD/RHL NDs(图7c)[65]。与BDs相比,自组装的纳米粒子对幽门螺旋杆菌的抑制效果增加了2~8 倍。其中,C10-BD 的MIC为1.56 mg/L,而C10-BD/RHL NDs 的MIC为0.78 mg/L。此 外,C10-BD/RHL NDs可以显著抑制并破坏幽门螺旋杆菌的生物膜,降低生物膜生物量(图7d)并杀死分散在生物膜中的大部分幽门螺杆菌,减弱残留细菌对生物表面的再黏附作用,从而防止生物膜的重组。因此,自组装制备的BD/RHL NDs具备小檗碱衍生物的抗菌活性和鼠李糖脂清除生物膜的作用,在对抗生物膜及抗菌方面有巨大潜力,并为治疗幽门螺杆菌引起的相关慢性胃病提供了一种有前景的方法。
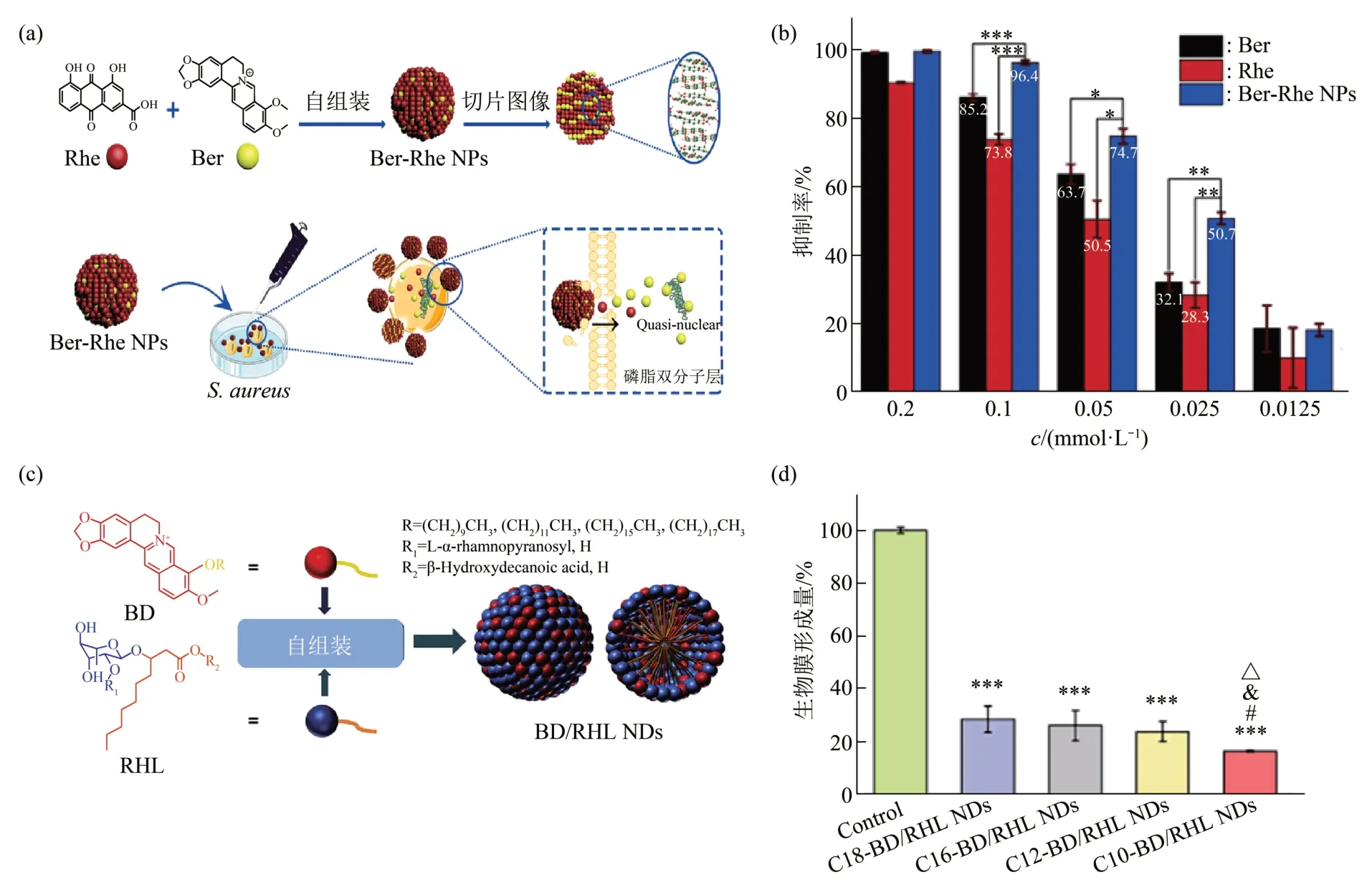
Fig.7 Self-assembled carrier-free nanomaterials for antibacterial[61,65]图7 自组装无载体纳米药物用于抗菌[61,65]
3.3 其他作用
3.3.1 抗炎作用
动脉粥样硬化是动脉中的一种慢性炎症,减少斑块炎症对减少动脉粥样硬化血栓的发生具有重要意义[66]。Nasr 等[67]首先将透明质酸(hyaluronic acid,HA)与阿托伐他汀(atorvastatin,ATV)结合得到两亲性聚合物HA-ATV,然后通过反溶剂沉淀法在水溶液中自组装形成以ATV 为疏水核心的纳米药物(HA-ATV NPs)。与游离ATV 相比,HA-ATV NPs 可以通过HA 和CD44 的相互作用靶向炎症性动脉粥样硬化斑块,从而减轻炎症反应。此外,抗炎药物偶联聚合物可自组装形成纳米药物,改善水溶性,提高其在炎症治疗中的效果,如迷迭香酸[68]和吲哚美辛(indomethacin,ⅠND)[69]。其中,ⅠND 是一种具有很好疗效的抗炎药物,但其水不溶性和极低的生物利用度严重限制了其临床转化[70]。为了改善ⅠND的水不溶性,Lin等[69]将PEG通过酰胺键共价连接到两个ⅠND药物分子上,并在水溶液中自组装形成纳米前药(ⅠND-PEG-ⅠND NPs),此自组装无载体纳米药物可以实现炎症环境中代谢活跃过表达的组织蛋白酶B的释放[71],可特异性水解酰胺键。此外,与游离ⅠND 相比,ⅠND-PEG-ⅠND NPs 显著降低了对正常成骨细胞的毒性,并对巨噬细胞表现出更强的抗炎作用。
3.3.2 抗氧化作用
ROS 是生物体中正常细胞的代谢物,正常水平的ROS 对于维持细胞信号传导和其他细胞内功能至关重要。然而,过度的ROS 会破坏氧化还原状态并引起氧化应激。氧化应激会对细胞造成严重损害,导致一系列严重疾病,例如眼疾、中风、败血症、阿尔茨海默病和帕金森病等[72-73]。目前被广泛用于去除生物体中过量ROS 的抗氧化剂在生理条件下具有稳定性低、非特异性和短寿命的缺点[74]。因此,开发新型无载体纳米药物以有效消除细胞中过表达的ROS 并防止细胞氧化应激损伤具有重要意义。Zhu等[75]使用9-芴基甲氧羰基-色氨酸(Fmoc-Trp)、槲皮素(quercetin,Que)和Fe2+作为构建模块,通过配位和静电相互作用自组装形成Fmoc-Trp-Fe2+-Que(FTFQ)NPs。FTFQ NPs很大程度提高了Que 的生物利用度,并通过直接/间接方式降低Aβ 的聚集能力,减小Aβ 寡聚体/纤维诱导的神经毒性,用于阿尔茨海默病的协同治疗。Zheng 等[76]在热处理辅助下通过静电作用驱动带负电荷的透明质酸和带正电荷的米托醌(MitoQ)自组装制备新型线粒体特异性抗氧化纳米药物(MitoO NPs)。MitoQ NPs在线粒体中亚细胞的分布比游离MitoQ高2~3倍,可以显著提高线粒体ROS 清除率,减少眼部ROS 的积累,从而缓解干眼病症状。
4 结论与展望
自组装无载体纳米药物是近几年开发的一种新型药物,在生物医学领域不断展示其潜在的应用价值,得到了国内外研究学者的广泛关注。本文主要从无载体纳米药物自组装机理、制备方法及其在抗肿瘤、抗菌、抗氧化等方面的应用系统阐述了自组装无载体纳米药物的研究进展。目前,自组装无载体纳米药物的制备方法主要包括自上而下、反溶剂沉淀法、模板辅助沉淀法和体内自组装法。近年来,科研工作者将其开发应用于抗肿瘤、抗菌、抗炎及抗氧化等生物医学领域。虽然自组装无载体纳米药物可以降低毒性,表现出良好的治疗效果,但将其应用于临床治疗还需要进一步地深入研究和开发利用,未来自组装无载体纳米药物在生物医学领域的重点研究可以围绕以下方面展开:
a.进一步研究和阐明无载体纳米药物自组装机制。目前大多数研究者通常通过经验筛选药物配方[77],通过分析药物分子的结构,推测能否形成弱相互作用力进行自组装。目前已报道的自组装纳米药物数量非常有限,未来仍需要进一步探索药物自组装机制并扩展自组装药物分子库。可以通过建立数据库、计算机辅助分子结构模拟和单晶衍射等方法详细研究和了解药物分子的空间几何结构以及药物分子之间可能存在的弱相互作用,并且借助计算机建模来预测药物分子的自组装行为[78-79],从而更好地理解分子自组装机制,筛选出更多药物自组装配方,这对于新型无载体纳米药物的设计与开发具有非常重要的指导意义。
b.深入研究无载体纳米药物辅料的毒性和在体内的代谢途径,系统探讨辅料对自组装无载体纳米药物发挥药效的动力学影响机制。在无载体纳米药物的制备过程中,一般会使用辅料如PEG、蛋白质、细胞膜和聚乳酸-羟基乙酸共聚物(poly(lactic-co-glycolic acid,PLGA)等增加纳米药物的稳定性[36],目前,辅料对纳米药物的缓释和治疗效果影响的相关研究仍然非常缺乏。
c.防止无载体纳米药物早期渗漏,提高其稳定性。无载体纳米药物通常通过弱相互作用力自组装而成,其纳米结构容易受到体内复杂环境的影响,导致药物在到达靶点之前发生渗漏,具有不稳定性[7]。目前已经有部分研究学者试图通过加入少量的聚乙二醇、蛋白质和细胞膜等[80]来提高其稳定性和治疗效果。此外,研究表明,可以通过对药物分子进行修饰,引入在靶点能刺激响应性断裂的链接,从而实现选择性药物释放,但同时也可能带来工业生产处理和稳定性问题。因此,自组装无载体纳米药物的稳定性可能会严重限制其在临床应用的实际应用,应该积极探索与其他改性方法相结合,寻求更优的方法提高其稳定性,防止无载体纳米药物早期渗漏,从而开发出能够应用于临床治疗的高效稳定无载体纳米药物,这是未来非常重要的研究方向之一。
d.精准控制无载体纳米药物在应用中的粒径大小和药物缓释比例,以期实现更好的治疗效果。无载体纳米药物粒径大小决定其生物分布、肿瘤渗透、细胞内化、血浆和组织间隙清除,以及体内排泄,所有这些对癌症的整体治疗效果都有着举足轻重的影响力。粒径较小的药物有利于渗透到肿瘤深处,发挥更强的肿瘤抑制能力,但其在肿瘤组织处的保留时间又随着粒径增大而增加[7]。因此,非常有必要拓展新的合成方法制备在生物组织不同环境内粒径可调的无载体纳米药物,从而实现更好的治疗效果。此外,无载体纳米药物可能有多成分单体药物组成,深入研究并精准控制不同药物的缓释比例,可以为其临床治疗发挥更好作用提供科学指导。
e.实现大规模工业化生产。在工业化的大规模生产中,由于药物浓度较高,难以保证纳米颗粒的理化性质与实验室制备一致。研究表明,冷冻干燥是保证无载体纳米药物贮存稳定性的良好选择[81],但冷冻干燥配方中颗粒的再分散性和胶体稳定性仍然是一个难题。因此,在未来的研究中,无载体纳米药物的制备技术应满足工业化生产的要求,其重现性、浓缩性、无菌性、冻干性和存储性等技术细节需要高度重视。

