抗A 抗B 血型定型试剂的质量分析
胡泽斌 于婷 孙彬裕 薄淑英 曲守方 黄杰
按照临床输血的要求,ABO 血型的鉴定必须以正、反定型试验结果相互参照来确定[1-3]。所谓正定型是指用标准抗A 和抗B 血型定型试剂来测定红细胞上的A 抗原和B 抗原;反定型是指用标准A 型细胞和B 型细胞来测定血清或血浆中有无相应的抗A 和抗B 抗体。ABO 血型正定型用抗A抗B 血型定型试剂(单克隆抗体)被列为血液筛查类体外诊断试剂,按照药品中的生物制品进行批签发管理[4-6]。国家药品监督管理局批准了4 家国产和2 家进口抗A 抗B 血型定型试剂(单克隆抗体),用于临床ABO 血型正定型鉴定。
中国食品药品检定研究院负责对抗A 抗B 血型定型试剂(单克隆抗体)进行批签发工作的具体实施,对该品种按照《中国药典》[7]进行全部检验。本研究对4 家国产A 抗B 血型定型试剂(单克隆抗体)近5 年来的产品质量进行检测分析,梳理此品种的质量风险,为保障血筛诊断试剂批签发工作提供技术支撑。
1 材料与方法
1.1 材料
1.1.1 试剂
O 型、B 型、A 型、A1型、A2型、A2B 型红细胞,由中国食品药品检定研究院提供;4 家待检测试剂抗A 抗B 血型定型试剂(单克隆抗体),分别来自北京金豪制药股份有限公司、河北医科大学生物医学工程中心、上海血液生物医药有限责任公司、长春博德生物技术有限责任公司。
1.1.2 标准品
抗A 抗B 血型定型试剂效价测定用国家参考品,批号:280020-201702,抗A 参考品为蓝色冻干品,抗B 参考品为黄色冻干品,由中国食品药品检定研究院提供。
1.1.3 仪器
澄明度检测仪(生产厂家:天津市精拓仪器科技有限公司,型号:YB-2型)、离心机(生产厂家:北京时代北利离心机有限公司,型号:DT5-3)、久保田离心机(生产厂家:日本株式会社久保田制作所,型号:KA-2200)、恒温培养箱(生产厂家:上海一恒科技有限公司,型号:GHP-9080)、秒表(生产厂家:上海金雀表业有限公司,型号:J9-2 II)、微量移液器(生产厂家:艾本德(上海)国际贸易有限公司,型号:10~100 μL,100~1 000 μL)。
1.2 方法
按照《中国药典》2020 版三部生物制品通则中对抗A 抗B 血型定型试剂(单克隆抗体)的成品检定要求,对4 家抗A 抗B 血型定型试剂(单克隆抗体)成品进行全部性能指标的检测,包括外观、特异性、亲和力、效价测定、冷凝集素和不规则抗体测试、稳定性试验。
1.2.1 外观
取待检试剂5 支,打开外包装。采用澄明度仪检查法,选择2200 lx 光照度,手持瓶颈部于遮光板边缘处,轻轻旋转和翻转容器使溶液中可能存在的可见异物悬浮,分别在黑色和白色背景下,在明视距离(待检试剂至人眼的清晰观察距离,通常为25 cm)目视检查20 s。肉眼观察液体情况。
1.2.2 特异性
取A1、B、O 型红细胞各3 例,分离红细胞后混合,洗3 次后用生理氯化钠溶液配成2%红细胞悬液使用。将试管排2 行,第1 行每支加待检试剂0.1 mL,第2 行每支加生理氯化钠溶液,然后分别加入2%A1、A2B、B、O 型红细胞悬液0.1 mL。置18~25℃15 min,1 000 r/min 离心1 min 离心半径16.5 cm,肉眼观察结果。生理氯化钠溶液做红细胞悬液对照。
1.2.3 亲和力
取A1、A2、A2B、B 型红细胞各3 例,分离红细胞后混合,洗3 次后用生理氯化钠溶液配成配成10%红细胞悬液使用。取0.05 mL 待检试剂置洁净玻片上,加等体积10%红细胞悬液立即混匀,面积直径要求10 mm2以上,滴入红细胞悬液同时,即刻记录肉眼可见凝集出现时间及3 min 凝块大小。
1.2.4 效价测定
取A1、A2、A2B 、B 型红细胞各3 例,分离红细胞后混合,洗3 次后用生理氯化钠溶液配成2%红细胞悬液使用。将试管排成2 行,每行10 支,每支加0.1 mL 生理氯化钠溶液,将待检试剂或国家参考品0.1 mL 二倍系列稀释,加入相应的2%红细胞悬液0.1 mL。置18~25℃15 min,1 000 r/min 离心1 min 离心半径16.5 cm,肉眼观察结果。
1.2.5 冷凝集素和不规则抗体测定
每一待检试剂排5 行试管,每行13 支,各加待检试剂0.1 mL,前3 行的前10 管分别加入10 例O型2%红细胞悬液0.1 mL,后3 管分别加入3 例A型或者B 型2%红细胞悬液0.1 mL。第1 行置4℃,第2 行置18~25℃,第3 行置37℃,静置2 h 观察结果;第4 和第5 行,前10 管分别加入10 例O型5%红细胞悬液0.1 mL,后3 管分别加入3 例A型或者B 型5%红细胞悬液0.1 mL;第4 行置18~25℃,第5 行置37℃,静置2 h 后观察结果。
1.2.6 稳定性
待检试剂的有效期为1 年的在37℃加热7 d,有效期为2 年的在37℃加热14 d。按上述1.2.1-1.2.5 方法进行外观、特异性、亲和力、效价测定、冷凝集素和不规则抗体测定项目的检测。
2 结果
2.1 外观结果
对4 家国产抗A 抗B 血型定型试剂共336 批进行外观检查,抗A 试剂均为透明的蓝色液体,抗B 试剂均为透明的黄色液体,且均无摇不散的沉淀或异物。4 家企业的抗A 抗B 血型定型试剂的外观项目检测结果均符合《中国药典》规定。
2.2 特异性结果
对4 家企业共336 批次的抗A 抗B 血型定型试剂进行特异性检查,结果表明,抗A 试剂与A1、A2B 红细胞均产生凝集,与O 及B 型红细胞均不凝集,抗B 试剂与B 红细胞均产生凝集,与A1、O 红细胞均不凝集,均无溶血和其他不易分辨的现象。4 家企业的抗A 抗B 血型定型试剂的特异性项目检测结果均符合《中国药典》规定。
2.3 亲和力结果
对4 家企业共336 批次的抗A 抗B 血型定型试剂进行亲和力检查,结果表明,抗A 试剂与A1、A2、A2B 红细胞出现凝集的时间均分别≤15 s、≤30 s、≤45 s,抗B 试剂与B 红细胞出现凝集的时间均≤15 s,且在3 min 内凝集块均达到1 mm2以上。见表1。4 家企业的抗A 抗B 血型定型试剂的亲和力项目检测结果均符合《中国药典》规定。
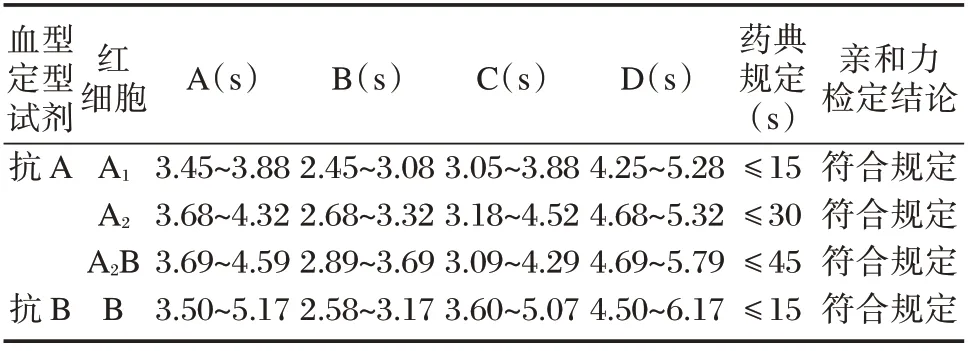
表1 抗A 抗B 血型定型试剂亲和力结果Table 1 Affinity results of anti-A and anti-B blood typing reagents
2.4 效价测定结果
效价滴度以产生“+”凝集的待检试剂最高稀释度计算,不计红细胞悬液体积。对4 家企业共336 批次的抗A 抗B 血型定型试剂进行效价测定,结果表明,抗A 试剂与A1、A2、A2B 型红细胞的凝集效价均不低于国家参考品的同步测定结果,抗B试剂与B 型红细胞的凝集效价均不低于国家参考品的同步测定结果。见表2。4家企业的抗A抗B血型定型试剂的效价测定项目检测结果均符合《中国药典》规定。
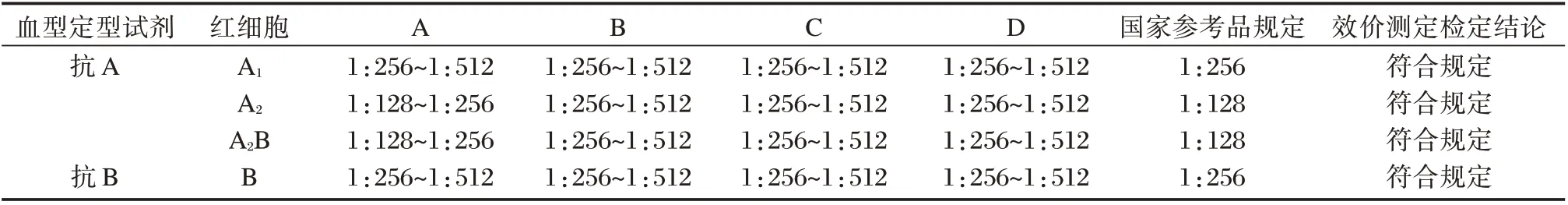
表2 抗A 抗B 血型定型试剂效价测定结果Table 2 Titer results of anti-A and anti-B blood typing reagents
2.5 冷凝集素和不规则抗体测定结果
对4 家企业共336 批次的抗A 抗B 血型定型试剂进行效价测定,结果表明,抗A 试剂与2%的10 例非血缘性O 型红细胞和3 例B 型红细胞在4℃、18~25℃、37℃三个反应条件下均不出现凝集反应,也不发生溶血。抗B 试剂与2%的10 例非血缘性O 型红细胞和3 例A 型红细胞在4℃、18~25℃、37℃三个反应条件下均不出现凝集反应,也不发生溶血;抗A 试剂与5%的10 例非血缘性O型红细胞和3 例B 型红细胞在18~25℃、37℃两个反应条件下均不出现凝集反应,也不发生溶血。抗B 试剂与5%的10 例非血缘性O 型红细胞和3例A 型红细胞在18~25℃、37℃两个反应条件下均不出现凝集反应,也不发生溶血。4 家企业的抗A抗B 血型定型试剂的冷凝集素和不规则抗体测定项目检测结果均符合《中国药典》规定。
2.6 稳定性试验结果
4 家企业336 批次的抗A 抗B 血型定型试剂在37℃加热7 d 或14 d 后,与4℃保存的试剂相比外观没有明显变化,抗A 试剂仍为透明的蓝色液体,抗B 试剂仍为透明的黄色液体,且均无摇不散的沉淀或异物;与4℃保存的试剂相比特异性没有变化,抗A 试剂仍与A1、A2B 红细胞凝集,与O 及B 型红细胞不凝集,抗B 试剂仍与B 红细胞产生凝集,与A1、O 红细胞不产生凝集,且均无溶血和其他不易分辨的现象;与4℃保存的试剂相比,加热后的抗A 抗B血型定型试剂与红细胞出现的凝集时间略有0.50~1.50 s 延迟,但仍符合《中国药典》规定;与4℃保存的试剂相比,加热后的抗A 抗B 血型定型试剂的效价测定结果略低,但仍满足国家参考品的要求;与4℃保存的试剂相比冷凝集素和不规则抗体测定结果没有变化,全部试管均不出现非特异性凝集反应,也未发生溶血。4 家企业336 批次的抗A 抗B血型定型试剂的稳定性试验结果均符合《中国药典》规定。
3 讨论
生物制品批签发[8],是指国家药品监督管理局对获得上市许可的疫苗类制品、血液制品、用于血源筛查的体外诊断试剂以及国家药品监督管理局规定的其他生物制品,在每批产品上市销售前或者进口时,经指定的批签发机构进行审核、检验,对符合要求的发给批签发证明的活动。未通过批签发的产品,不得上市销售或者进口。为规范生物制品批签发行为,保证生物制品安全有效,根据新制修订《药品管理法》和《疫苗管理法》,2020 年12 月11 日国家市场监督管理总局令第33 号《生物制品批签发管理办法》公布,本办法自2021 年3 月1 日起施行。新《生物制品批签发管理办法》进一步明确了批签发职责分工和重大质量风险产品查处程序,明确了批签发机构的职责,强调对于发现的质量问题、缺陷和风险及时进行调查评估,采取必要措施处理。
中国食品药品检定研究院[9]是负责抗A 抗B血型定型试剂(单克隆抗体)的唯一批签发机构,一直非常重视该品种的产品质量,坚持对每一批试剂进行全部检测项目的质量检定。2018 年以来,中国食品药品检定研究院共签发了336 批4 家国产抗A 抗B 血型定型试剂,签发量达741 956 800 人份,对试剂成品进行了外观、特异性、亲和力、效价测定、冷凝集素和不规则抗体测试、稳定性试验等6 个项目的检验,质量全部合格。总体来讲,北京金豪制药股份有限公司、河北医科大学生物医学工程中心、上海血液生物医药有限责任公司、长春博德生物技术有限责任公司4 家国产抗A抗B 血型定型试剂的质量稳定。
抗A 抗B 血型定型试剂(单克隆抗体)的批签发工作主要有三个环节:资料审核、产品检定、出具检验报告及批签发证明。产品检定依据《中国药典》进行全部项目的检定,包括外观、特异性、亲和力、效价测定、冷凝集素和不规则抗体测试、稳定性试验共6 个项目。《中国药典》每5 年进行一次修订,但是针对抗A 抗B 血型定型试剂(单克隆抗体)这个品种,2015 版[10]与2020 版的内容没有发生任何变化,所以2018 年以来对抗A 抗B 血型定型试剂(单克隆抗体)的产品检定依据了相同的技术指标和判定方法。
在6 个检定项目中,效价是反映不同厂家生产的抗A 抗B 血型定型试剂的灵敏度,是试剂检出能力的关键评价指标,在临床输血等ABO 血型鉴定中发挥重要作用[11-13],因此,在效价测定中采用了抗A 抗B 血型定型试剂效价测定用国家参考品这样一把标尺来进行统一评价[14-15]。《中国药典》规定,抗A 抗B 血型定型试剂在半成品检定中需要进行特异性、效价测定、冷凝集素和不规则抗体测定、无菌检查以及稳定性试验,半成品的稳定性试验同样采用37℃加热7 天(有效期1 年)或14 天(有效期2年)后进行特异性、效价测定、冷凝集素和不规则抗体测定以及无菌检查,在实际工作中企业对此反映较多,认为半成品已经进行4 个关键指标的检测,加热之后再进行一遍全部项目检测,大大延迟了产品的放行,尤其是无菌检查采用直接接种法需要14 天时间。是否有必要对半成品和成品均进行稳定性检验,以及半成品加热后是否必须再进行一次无菌检测,希望引起更多的讨论与思考,在下一版药典修订时对此进一步研判。