温度、冷层积和化学试剂处理对3种莎草科植物种子萌发的影响
王 娜, 张中华, 周华坤, 徐文华*
(1.中国科学院西北高原生物研究所, 青海省寒区恢复生态学重点实验室, 青海 西宁 810008; 2.中国科学院大学, 北京 100049)
莎草科植物(Cyperaceae)是陆地生态系统的重要构成者,具有水土保持、土壤改良、水源净化等作用,也是青藏高原东部高寒草甸天然草地资源中饲用价值高、家畜喜食、耐牧性极强的一类优良牧草,是高寒草甸生态系统中分布最为广泛、数量最多的科属。莎草科植物适应性好,生境广阔,具有很高的潜在价值,部分植物种是高寒草甸的建群种,其良好生长对高寒草甸植被恢复以及生态系统维持具有重要的现实意义及生态学价值。但莎草科植物种子普遍具有休眠、萌发困难的特性,严重制约了对其的开发利用。
种子的休眠与发芽特性因种而异,因此不同种子应选择适宜其本身的方法来破除休眠,提高发芽率。目前对莎草科植物种子休眠与萌发特性的研究已取得了一定的进展,现有研究发现变温和光暗交替有利于苔草属种子的萌发[1],但是也有研究发现光照不影响莎草科植物种子萌发,甚至莎草科植物种子在自然光照梯度下几乎不会萌发[2]。关于光照对莎草科植物种子萌发的影响还存在争议,部分种子之间存在物种特异性[1]。激素和化学试剂处理已被证实是对莎草科植物种子萌发有利的技术[3],除此以外,低温层积打破种子休眠,促进种子萌发的技术已经在多数实验中得到验证[4-5],而且低温层积对嵩草属和薹草属种子的发芽率、初始发芽天数和发芽指数的影响因种皮的完整性、层积基质和草种不同而异[5]。
由于青藏高原高寒草甸地理环境特殊,探索该区种子休眠具有重要的生态学意义[6-8]。但是迄今为止,对于青藏高原莎草科植物种子萌发特性的研究方法较为单一,萌发技术研究的广度、深度还不够,对于高寒草甸这一特殊生境的研究更是鲜见报道,本研究通过不同物理和化学方法处理、化学处理+冷层积综合处理,并且结合扫描电镜观测方法探索化学试剂处理对种子表皮的影响,试图探讨不同莎草科种子的适宜萌发温度和光照条件,试验处理对不同莎草科种子萌发的影响以及不同莎草科种子的休眠影响因素,从而寻求快速有效提高莎草科植物种子发芽率的方法,降低栽培草地建植成本,为青藏高原地区生态系统的恢复和畜牧业发展提供理论支持和技术指导。
1 材料与方法
1.1 材料与试剂
供试草种青藏薹草(Carexmoorcroftii)(以下简称QZ)、帕米尔薹草(Carexpamirensis)(以下简称PME)、华扁穗草(Blysmussinocompressus)(以下简称HB)的种子采集于海北高寒草地生态系统国家野外科学观测研究站(青海省海北藏族自治州门源回族自治县境内)。采集地生境:海拔多在3 400~3 450 m之间,地处37°29′~ 37°45′ N,101°12′~101°23′ E;年平均气温-1.7℃;最热月7月平均气温10.1℃,最冷月1月平均气温-15.2℃。年降水量平均为582.1 mm,其中约80%降水量分布于植物生长季的5 — 9月;11月—次年2月降水量仅占年降水量的4%[9-10]。种子采集装袋后带回实验室阴干(在此期间其果皮和种皮未受到影响),后置于牛皮纸信封中于室温通风良好的条件下贮藏备用。供试的莎草科植物种子基本信息如表1所示。

表1 供试莎草科植物种子信息Table 1 Information of tested cyperaceae species seeds
试验所用试剂:NaOH (AR,96%)、H2SO4(AR,98%)、NaHClO (60%)、戊二醛固定液(4%)、磷酸缓冲液(0.2 M,pH 3.5)、丙酮(AR,99.5%)、乙酸异戊酯(AR,99%,2.5 L)。
1.2 方法
1.2.1种子萌发实验 萌发试验开始于2022年1月底,采用培养皿内纸上萌发法,试验开始前,所有种子用0.1% KMnO4溶液浸泡消毒10 min,再用蒸馏水冲洗3次,用滤纸吸干种子表面水分后在直径为9 cm的圆形培养皿中放置2层用无菌蒸馏水润湿的滤纸作为发芽床,将种子轻放于发芽床上,加盖后放置在培养箱里,每个培养皿放置50粒颗粒饱满的种子,设置3个重复。在整个试验持续期间保持滤纸湿润,每天统计发芽种子数。以露白为种子发芽的标准。计算各种子的发芽率、萌发时滞天数。
萌发时滞:指从发芽试验开始到第1粒种子萌发所用时间。
发芽率=试验结束时已萌发种子数/供试种子总数×100%。
1.2.2温度与光照处理 根据种子采集地的气温设置了8个不同的温度处理(包括5个恒温和3个变温)和2种光照条件,共计16类处理,具体设置见表2。
以上每种处理组合设置3个重复,每个重复50粒种子,每天统计萌发个数,试验持续30天。
1.2.3冷层积处理 根据种子采集地的气温本研究确定了4℃的层积温度。每种种子设置3个重复,每个重复50粒种子,分别置于培养皿中,加入无菌蒸馏水至刚好淹没种子,用封口膜密封,于4℃冰箱中分别层积放置30天、60天、90天。每隔5天翻动检查并冲洗换水1次,保持种子湿润。以室温条件下干燥贮藏未经层积处理的种子作为对照,以温度试验的结果选取萌发率适中的温度条件作为层积处理后的培养条件,所以将层积处理完成的培养皿随机置于设置为B25(15℃/25℃)温度条件的培养箱内,光照条件设置为光照条件1(表2)下进行萌发实验,以上处理均设置3个重复,每个重复50粒种子,每天统计萌发个数并补充水分,持续30 d。以露白为种子发芽的标准。
1.2.4化学试剂处理及化学试剂+冷层积处理 根据查询到的关于莎草科植物种子萌发文献资料中所用的萌发率较好的3种化学试剂和浓度处理方式对3种莎草科植物种子进行分别处理。
(1)用40%的氢氧化钠(NaOH)溶液浸种30 min[11-13];
(2)用49%的硫酸(H2SO4)溶液浸种10 min[13-14];
(3)用10%的次氯酸钠(NaHClO)溶液浸种1 h[15]。
试剂处理后的种子都用无菌蒸馏水反复冲洗后,放置在培养箱中培养。同样的将B25温度条件设置为试剂处理后的萌发温度,置于光照条件1中(表2)进行萌发实验,定期更换滤纸,及时处理发霉的种子,对照选取为同温度下未经任何处理的种子。每个处理3个重复,每个重复50粒种子,每天统计萌发个数,持续30天。以露白为种子发芽的标准。
同时,对经化学试剂处理后的种子用无菌蒸馏水反复冲洗后,再置于4℃冰箱中冷层积处理1个月,期间每隔5 d翻动检查并冲洗1次,保持种子湿润,然后放置在B25、光照条件1(表2)的培养箱条件下进行萌发培养,每天统计萌发个数,持续30天。
1.2.5扫描电子显微镜观察 选取上述供试种子及不同化学试剂处理后种子各20枚,置于解剖镜下横切或纵切,装入青霉素小瓶,贴好标签,然后将种子置于浓度4%的戊二醛中固定12 h,再用pH值为6.8的磷酸缓冲液冲洗5次,每次15 min,之后分别用30%,50%,70%,80%,90%,95%,100%丙酮梯度脱水,其中30%~95%浓度的丙酮只脱水一次,时间为20 min,而100 %浓度的丙酮进行脱水3次,每次30 min,脱水后用乙酸异戊酯置换2次,每次20 min,然后用二氧化碳临界点干燥仪(IXRF VFD-21 s)干燥,最后粘台,放置在扫描电镜(SU8010)下观察种皮、胚、胚乳及种子横、纵切面结构并拍照。
用扫描电镜观察不同化学试剂处理对种皮的影响,结合发芽率试验探究不同化学试剂处理对莎草科植物种子发芽的影响。
1.2.6数据处理 本文的所有数据在R语言(Version 4.1.1,R Foundation for Statistical Computing,Vienna,Austria)统计软件中进行分析。首先对所有数据在分析前均进行Shapiro-Wilk正态分布和levene’s方差齐性检验,对非正态分布或方差不齐的数据进行反正弦平方根转换;若转换后不符合正态检验,则对数据进行kruskal非参数检验和Behrens-Fisher事后多重比较,对符合正态分布的数据进行单因素方差分析(One-way ANOVA)。然后Tukey’s HSD用于检验处理间多重比较的差异显著性。统计数据以平均值标准误差(Mean±SE)表示。采用Origin (Version 2018C SR,OriginLab Corporation,Northampton,MA,USA)软件进行绘图。
2 结果与分析
2.1 培养温度和光照对种子萌发的影响
不同种子的萌发率受温度和光照影响不同,其中华扁穗草(HB)种子萌发率受到温度和光照的显著影响(P<0.05),萌发时滞仅受到温度的显著影响(P<0.05)。帕米尔薹草(PME)种子的萌发率和萌发时滞仅受到温度的显著影响(P<0.05),而青藏薹草(QZ)在不同温度和光照处理中没有萌发(表3)。
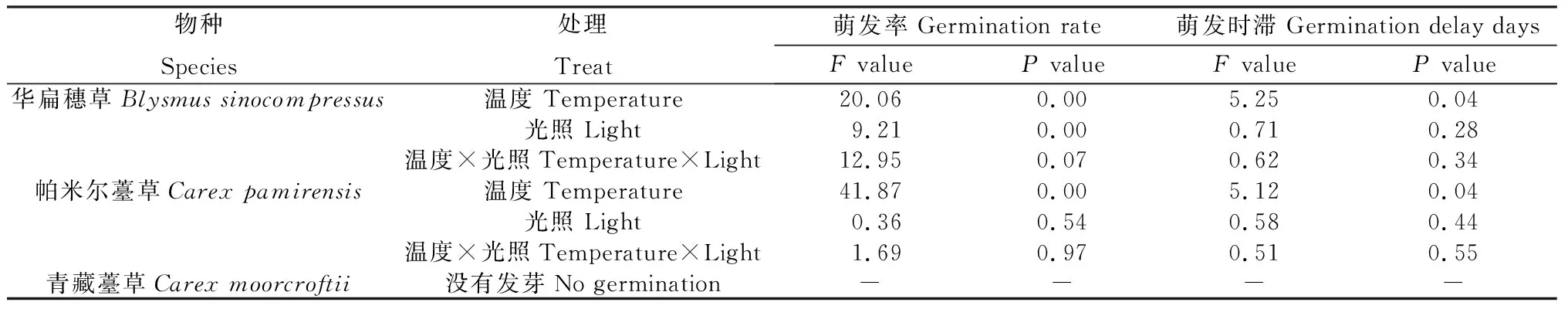
表3 不同温度和光照对3种莎草科植物种子萌发率和萌发时滞的影响Table 3 Effects of different temperatures and light intensities on seed germination rate and germination delay of three cyperaceae plants
具体在每个温度梯度上,有昼夜交替的光照条件下(表4),华扁穗草(HB)种子的最高萌发率为52.67%,出现在B25 (15℃/25℃)处理中,而随着变温温度的升高,种子的萌发率逐渐降低,最低达到B35 (15℃/35℃)处理下的3.33%,显著低于B25温度处理的种子萌发率(P<0.05);帕米尔薹草(PME)种子萌发率随着变温温度的升高,呈现先升高再降低的趋势,萌发率在B30(15℃/30℃)处理中最高,为56.67%。而且这两种种子在变温处理中的萌发率均好于在恒温处理中的萌发率。在24 h全黑暗的温度处理中,HB种子仅在B35处理下有少量萌发,萌发率仅为1.33%,与昼夜交替光照条件下的萌发率差距明显(P<0.05);PME种子的萌发率在全黑暗下与昼夜交替光照下没有明显差距,甚至略有上升,同样表现为变温条件下比恒温条件下的萌发率高、随着变温梯度萌发率先上升后下降的变化趋势。

表4 温度和光照对种子萌发率的影响Table 4 Effects of temperature and light on seed germination rate
萌发时滞的变化与萌发率的变化情况类似(表5)。HB种子萌发时滞随着变温幅度增加显著增加(P<0.05),恒温条件下萌发时滞高于变温条件。而PME种子无论在昼夜交替光照条件还是全黑暗条件下,随着变温温度升高,均有萌发时滞天数先减少后增加的趋势,尽管恒温条件中出现了最短的萌发时滞,但萌发率并不高。

表5 温度和光照对种子萌发时滞的影响Table 5 Effects of temperature and light on the time delay of seed germination 单位:d
通过数据分析,我们认为光照对HB种子的萌发是必需的,说明HB为喜光性种子;光照对PME种子的萌发几乎没有影响,说明PME种子为光不敏感性种子。对于HB和PME,变温下的物种萌发率显著高于恒温下的萌发率(P<0.05),变温下HB种子的萌发率最高达到52.67% (B25、光照),PME种子的萌发率最高达到56.67%(B30、光照),恒温处理下普遍较低甚至为0,说明变温处理更适合HB和PME种子的萌发。
2.2 冷层积处理对种子萌发的影响
本研究对3种莎草科植物种子施加了3种冷层积梯度(冷层积30天、60天、90天)处理,结果表明(表6、图1),HB种子和PME种子萌发率和萌发时滞均显著受冷层积时间的影响(P<0.05);青藏薹草(QZ)种子仅在层积时间90天有所萌发。

表6 冷层积时间对3种莎草科植物种子萌发率和萌发时滞的影响Table 6 Effects of stratification on seed germination rate and germination delay days of three cyperaceae species

图1 层积对种子萌发的影响Fig.1 Effect of stratification on seed germination注:不同小写字母表示同一物种层积不同时间萌发率之间存在显著差异(P<0.05)。CJ30代表冷层积30天;CJ60代表冷层积60天;CJ90代表冷层积90天Note:Different lowercase letters indicate significant differences in germination rates at different stratification times for the same species (P<0.05). CJ30 represents cold stratification 30 days;CJ60 represents cold stratification 60 days;CJ90 represents cold stratification 90 days
所有种子在冷层积处理之后置于15℃/25℃的温度培养条件下培养,如图1所示,与对照组相比,华扁穗草(HB)种子经冷层积处理30天后萌发率显著提高到81.33%(P<0.05);冷层积处理60天、90天的萌发率相同,而且显著高于对照组的萌发率(P<0.05),但是并没有与冷层积处理30天的萌发率有显著差异。与对照组相比,帕米尔薹草(PME)种子经冷层积处理30天后萌发率反而显著降低了(P<0.05),而冷层积处理60天、90天的萌发率比对照组萌发率有所提高但差异并未达到显著性。另外,随着冷层积时间延长,PME种子萌发率显著提高(P<0.05),冷层积处理30天、60天、90天后的萌发率分别达到17.33%,48.00%和58.67%。
HB种子经冷层积处理60天时萌发时滞最小,为5天,与冷层积处理90天的萌发时滞没有显著性差异,但是与对照组及冷层积处理30天的萌发时滞均存在显著性差异(P<0.05)。PME种子经冷层积处理90天的萌发时滞最小,为7天,与对照组的萌发时滞有显著性差异(P<0.05)。青藏薹草(QZ)只有在冷层积90天处理下有少量种子萌发,萌发率为1.33%,萌发时滞为9天。
通过数据分析表明:与对照组相比,冷层积处理能显著提高HB种子的萌发率(P<0.05),使萌发率最高达到90%(冷层积60天、90天处理),并降低其萌发时滞,使发芽时间提前到了5天(冷层积60天处理);冷层积处理使PME种子的萌发率最高达到58.67%(冷层积90天处理),同时使发芽时间提前到了7天。
2.3 化学试剂处理及化学试剂+冷层积处理对种子萌发的影响
本研究对3种莎草科植物种子进行了三种化学试剂处理及化学试剂处理后冷层积30天的处理。通过分析发现(表7、表8),化学试剂仅对HB种子萌发率有显著影响(P<0.05),对PME和QZ种子萌发率的影响未达到显著水平,对三种种子的萌发时滞均没有显著影响。化学试剂+冷层积处理对HB种子的萌发率和萌发时滞影响显著(P<0.05),仅对PME种子的萌发率有显著影响(P<0.05),对QZ种子萌发率和萌发时滞没有显著影响。
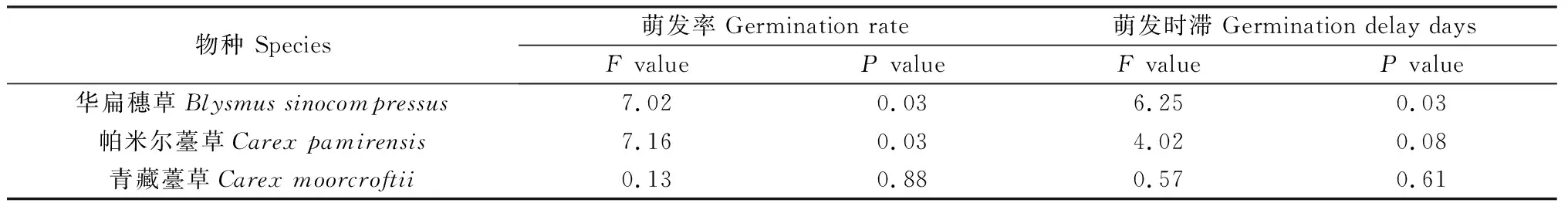
表8 化学试剂+冷层积处理对3种莎草科植物种子萌发率和萌发时滞的影响Table 8 Effects of chemicals + cold stratification on seed germination rate and germination delay days of three cyperaceae species
如图2A所示,华扁穗草(HB)种子在H2SO4+冷层积综合处理后的萌发率由仅用H2SO4处理后 21.33%提高到了92.67%(P<0.05),与对照组52.67%的萌发率相比也有显著性差异(P<0.05),但是与仅通过冷层积处理30天后81.33%的萌发率没有显著差异;NaOH +冷层积综合处理后的萌发率达到96.00%,比仅用NaOH处理后12.00%的萌发率提高了近7.00倍(P<0.05),与对照组52.67%的萌发率相比也有显著性差异(P<0.05),但是与仅冷层积处理30天后81.33%的萌发率没有显著差异;NaHClO +冷层积综合处理后的萌发率为83.33%,比仅用NaHClO处理后20.00%的萌发率提高了3.16倍(P<0.05),与对照组的萌发率相比显著提高(P<0.05),但与仅冷层积处理30天后的萌发率没有显著性差异;如图2B所示,H2SO4+冷层积综合处理和NaOH +冷层积综合处理后的萌发时滞最低,均为3天,与对照组的萌发时滞(10天)和仅冷层积30天处理后的萌发时滞(9天)相比均有显著性差异。
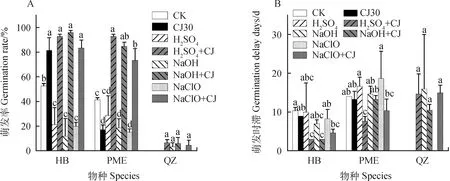
图2 化学试剂处理及化学试剂+冷层积处理对种子萌发的影响Fig.2 Effects of different chemicals and chemicals + stratification on seed germination注:不同小写字母表示同一物种不同处理之间萌发率或萌发时滞存在显著差异(P<0.05)。CK代表对照组;CJ30代表冷层积30天;H2SO4 + CJ代表H2SO4处理后又冷层积处理30天;NaOH + CJ代表NaOH处理后又冷层积处理30天;NaHClO + CJ代表NaHClO处理后又冷层积处理30天Note:Different lowercase letters indicate significant differences in germination rates or germination delay days between treatments for the same species (P<0.05). CJ30 represents cold stratification for 30 days;H2SO4 + CJ represents cold stratification for 30 days after H2SO4 treatment. NaOH + CJ represents cold stratification for 30 days after NaOH treatment;NaHClO + CJ represents cold stratification for 30 days after NaHClO treatment
帕米尔薹草(PME)种子在H2SO4+冷层积综合处理后的萌发率(92.67%)比仅用H2SO4处理后的萌发率(28.67%)提高了2.23倍(P<0.05),比对照组的萌发率(41.33%)提高了1.24倍(P<0.05),而且比仅冷层积处理30天后的萌发率(17.33%)提高了4.34倍(P<0.05);NaOH +冷层积综合处理后的萌发率(84.67%)比仅用NaOH处理后的萌发率(16.11%)提高了5.00倍(P<0.05),比对照组的萌发率(41.33%)提高了1.04倍(P<0.05),比仅冷层积处理30天后的萌发率(17.33%)提高了3.89倍(P<0.05);NaHClO +冷层积综合处理后的萌发率(73.33%)比仅用NaHClO处理后的萌发率(15.33%)提高了3.78倍(P<0.05),比对照组的萌发率(41.33%)提高了0.72倍(P<0.05),比仅冷层积处理30天后的萌发率(17.33%)提高了3.23倍(P<0.05);在萌发时滞中,H2SO4+冷层积综合处理后的萌发时滞最低,为7天,与对照组的萌发时滞(14天)和仅冷层积30天处理后的萌发时滞(13天)相比均有显著性差异。
青藏薹草(QZ)种子经过NaOH处理、NaOH +冷层积处理、H2SO4+冷层积处理和NaHClO +冷层积处理后均有种子萌发,但是平均萌发率最高只达到10%,萌发时滞最短为10天。
通过数据分析表明:不管是HB种子还是PME种子,NaOH +冷层积、H2SO4+冷层积和NaHClO +冷层积综合处理后萌发率均显著高于对照组的萌发率。对于PME种子,3种化学试剂+冷层积综合处理后的萌发率不仅显著高于对照组的萌发率,同时也显著高于仅冷层积处理30天后的萌发率。HB种子萌发率最高达到96.00%(NaOH +冷层积处理),萌发时滞最低达到3天(NaOH +冷层积处理,H2SO4+冷层积处理);PME种子萌发率最高达到92.67%(H2SO4+冷层积处理),萌发时滞最低达到7天(H2SO4+冷层积处理)。
2.4 化学试剂处理对种子表皮的作用
研究中选取的化学试剂主要对种皮结构有影响,以青藏薹草为例,电镜观测发现不同化学试剂处理对青藏薹草种皮的影响不同,与没有经过化学试剂处理的青藏薹草表皮,即与图3A和图3B对比分析,H2SO4,NaOH,NaHClO对果皮均有不同程度的机械破坏作用,并且使种皮明显变薄(图3D、图3F、图3H)。
其中49% 的H2SO4处理10 min,种皮表面己出现较明显的酸蚀洞(图3C),对栅栏层也有一定程度的破坏,并且使青藏薹草种皮最外层细胞出现大量的裂孔,种皮厚度约67.5 μm(图3D)。
40% NaOH溶液处理30 min对种皮的机械破坏效果较好,不但去掉了薹草种子角质层(图3E),而且使部分最外层大型厚壁细胞脱落,种皮厚度约79.4 μm(图3F)。
10%的NaHClO溶液处理1 h对青藏薹草种皮的腐蚀较为明显,去掉了种子角质层(图3G),甚至去掉了种皮最外层的大型厚壁细胞,种皮厚度约68.5 μm,并且使中间纵向致密细胞层变得更加疏松(图3H)。
3 讨论
3.1 温度与光照对种子萌发的影响
种子的萌发过程是种子的胚在内部多种酶的催化作用下发生的一系列物质转化和能量传递过程[16],在这个过程中与酶的活性息息相关的就是温度,酶保持最大活性需要适宜的温度,温度过高和过低都会降低酶的活性,进而体现在种子的萌发过程中[17]。本研究表明,HB种子萌发率最高的温度是变温15℃/25℃,而PME种子萌发率最高的温度条件是15℃/30℃,这说明同一环境中的不同种莎草科植物种子具有不同的萌发适宜温度,在自然环境中草种的萌发具有时空分异性;而且两种种子在变温条件下的萌发率均远高于恒温条件下,与其他植物种子的萌发试验结果相似[18-23]。变温可加快酶的催化作用,促进贮藏物质的转化,其次变温有利于种壳软化,使种胚利于突破种皮,促进萌发[24]。
光照是影响种子萌发的诸多环境因素之一,光照诱导种子萌发的作用是作为指示萌发适宜环境的信号来终止种子休眠[25],光照对种子萌发的影响存在差异,有研究显示光照可能促进[19]、抑制[26]或者不影响[27]种子的萌发过程。而本研究发现光照对HB种子的萌发是必需的,但是对PME种子的萌发几乎没有影响,说明HB为萌发喜光性种子,而PME为萌发光不敏感性种子,在HB种子的萌发中要注意光照条件。
3.2 冷层积处理对种子萌发的影响
冷层积是一种有效的解除种子休眠的方法,冷层积处理可降低种子中的抑制物质含量,使种皮软化、提高透性、种胚发育后熟,解除种胚生理抑制作用引起的生理休眠型[28-30],对于HB种子来说,冷层积处理能显著提高HB种子的萌发率,并显著降低萌发时滞天数;PME种子在冷层积30天之后萌发率甚至显著下降,而更长时间的冷层积会在一定程度上提升萌发率,冷层积同样提升了QZ种子的萌发,冷层积90天之后QZ种子在培养期内出现了种子萌发。这说明HB,PME和QZ种子均存在一定程度的生理休眠现象。
种子的萌发时滞天数越低,说明其发芽越迅速。具有较低的萌发时滞天数的物种能在适宜的条件下迅速发芽,这直接关系着该物种繁衍、种群维持和发展[31-34]。本研究表明,冷层积对供试高寒草甸植物HB,PME,QZ种子萌发特性的影响因草种不同而异。HB种子和PME种子经冷层积处理后,萌发更迅速,且冷层积时间越长,萌发时滞天数越低,发芽越整齐。这也与鱼小军等对高寒草甸植物种子萌发特性的研究结果一致[32]。
3.3 化学试剂对种子萌发的影响
硬实是植物种子中普遍存在的现象,硬实种子是由于种皮坚硬而很难进行影响吸胀萌发的种子[35-36]。在本研究中,化学试剂处理降低了HB和PME种子的萌发率和萌发时滞,显著促进了QZ种子的萌发过程,而且以QZ种子为例,结合电镜观察,可以发现一定浓度的H2SO4,NaOH,NaHClO均能不同程度的破坏种子木质坚硬的种皮结构和种皮最外层大型厚壁细胞,增大种皮细胞间隙,使中间纵向致密组织变得疏松,减轻其机械障碍和透性障碍,让水分和氧气易于进入种子,有利于种子与外部之间的物质交流,从而解除种子硬实外皮的物理休眠,提高其发芽率[13]。
有研究指出,化学处理联合应用冷层积处理,可成功打破部分莎草科植物种子和其它植物种子的休眠,提高其萌发率[15,37-38],张国云等研究也表明在不考虑品种因素的情况下,NaOH溶液处理结合冷层积处理后平均发芽率最高[13]。本研究也表现为种子采用化学试剂浸种+冷层积综合处理措施后萌发率比常规化学试剂处理和仅低温层积处理的种子更高,且萌发也更迅速。
本研究中,QZ种子萌发最困难,温度、冷层积和化学试剂处理对QZ种子萌发的影响并不显著,可能与QZ种子中的内源抑制物含量过高或者基因调控有关[39-41]。因此,QZ种子的休眠和萌发特性以及如何进一步提高QZ种子的发芽率还有待进一步深入研究。
综上所述,青藏高原莎草科种子在自然条件下的萌发率低,一方面是其生长的地区环境恶劣,植物的适应性生活策略所致[42];另一方面是莎草科种子小、种皮硬实、外覆光滑且较厚的角质层导致种皮对水分和氧气的不透性,限制种子的萌发。种皮硬实有利于收获和储藏、抵抗逆境,但不利于杂草防治和种子繁殖检验与加工[43-44]。大量研究表明,牧草种子硬实可以通过物理方法和化学方法有效的破除[45-49],本研究结果表明采用化学试剂浸种+冷层积综合处理措施比常规化学试剂处理和仅低温层积处理的种子萌发率更高、萌发更迅速,并结合扫描电镜发现化学试剂处理对种皮均有不同程度的机械破坏作用,使种皮明显变薄,说明化学试剂H2SO4,NaOH,NaHClO均能有效破除莎草科种子硬实。这对特殊地域植被种子的萌发具有一定的理论参考价值。
4 结论
同一区域内采集的不同莎草科种子适宜萌发的温度并不一样,而且变温条件下种子的萌发率显著高于恒温条件下的萌发率;光照对种子萌发的影响因物种而异,华扁穗草为萌发喜光性种子、帕米尔薹草为萌发光不敏感性种子。一定浓度的硫酸(H2SO4)、氢氧化钠(NaOH)和次氯酸钠(NaHClO)溶液通过破坏种皮最外层大型厚壁细胞,增大种皮细胞间隙,促进水分和氧气进入种子,从而增加萌发率。冷层积处理或化学试剂+冷层积综合处理能显著提高华扁穗草、帕米尔薹草和青藏薹草种子的萌发率。所以在促进种子萌发的技术中,应综合多种技术联合处理,可以较好地促进种子的萌发。

