半野生番茄GZ-01旱性砧木增强嫁接植株耐
韦建明 黄 鑫 米 娜 张大龙 李云洲*
(1 贵州大学农学院,贵州贵阳 550025;2 山东农业大学园艺科学与工程学院,山东泰安 271018)
番茄(Solanum lycopersicum)是现代蔬菜的主导产业,也是乡村振兴的优势产业(聂大杭 等,2022)。随着全球温室气体的不断排放,全球温度的不断升高,干旱已经成为威胁番茄安全生长的重要因素之一(Sunarti et al.,2022),因此提升栽培番茄抗旱能力对保障我国番茄安全生产具有重要意义。
干旱胁迫早期可以激活丝裂原活化蛋白激酶(mitogen-activated protein kinase,MAPK)信号途径(Li et al.,2017;Mo et al.,2021),MAPK 级联信号由三级组成:MAPKKK、MAPKK、MAPK,MAPK 处于整个级联信号系统下游位置,在番茄基因组中有16 个SlMAPKs(Kong et al.,2012),其中SlMAPK1、SlMAPK2、SlMAPK3以及SlMAPK6参与番茄抗旱防御反应(Li et al.,2013)。脱落酸(abscisic acid,ABA)在植物抗旱过程中发挥重要作用(Lucas et al.,2013),9-顺式环氧类胡萝卜素双加氧酶(9-cis-epoxycarotenoid dioxygenase,NCED)和脱落酸8’-羟化酶(ABA 8’-hydroxylase,ABAH)是ABA 合成通路中的关键酶,而NCED1和CYP7070A1是番茄中ABA 合成与代谢的关键基因(Nitsch et al.,2009)。ABA 可以通过调控番茄叶片气孔关闭影响叶片蒸腾速率和植株抗旱性(Li et al.,2021)。另外,番茄在干旱胁迫后会激发细胞内氧化应激反应,累积超氧阴离子和过氧化氢(H2O2)(Das &Roychoudhury,2014;Hu et al.,2017;Podgórska et al.,2017)。抗氧化酶如超氧化物歧化酶(SOD)、过氧化物酶(POD)、过氧化氢酶(CAT)和抗坏血酸过氧化物酶(APX)等在保护细胞膜免受H2O2、破坏等方面发挥重要作用(Gill &Tuteja,2010;Miller et al.,2010;Das &Roychoudhury,2014;Hernández et al.,2016)。
嫁接是解决番茄抗旱的方法之一,该方法简单、高效、经济(Marsic et al.,2018),通过嫁接可以将两种不同性状的植株连接在一起,其中一种作为地下部分,称为砧木,另一种作为地上部分,称为接穗(潘可可 等,2022)。嫁接可以将砧木中的抗性基因转移至接穗中,提高接穗的抗性(蒋梦婷 等,2019)。Zhang 等(2019)报道,嫁接番茄可以缓解植株活性氧(reactive oxygen species,ROS)的产生,提高植株光合能力和对干旱的耐受性。
本试验通过传统嫁接技术分析贵州半野生番茄GZ-01 砧木在提高嫁接植株耐旱性方面的作用,通过比较嫁接植株及果实生长生理表型与ABA、MAPK 级联信号系统相关基因的表达,挖掘GZ-01提高嫁接植株耐旱性机制,以期为贵州本土特色番茄砧木资源的开发利用提供参考与借鉴。
1 材料与方法
1.1 试验材料
红果番茄R(干旱敏感型)、粉果番茄P(耐旱型)和半野生番茄GZ-01 均来自贵州大学农学院植物病理教研室,其中GZ-01 被用作砧木,R和P 作为接穗。
1.2 试验设计
试验于2020 年6 月至2022 年6 月在贵州大学农学院进行。种子经过温汤浸种后在人工气候箱内进行催芽,催芽温度为(28±2)℃,3 d 后露白,播种于育苗钵(5.0 cm×5.0 cm×10.0 cm)并放置在人工气候箱内进行基质培养生长,生长温度为(25±2)℃,光/暗周期为16 h/8 h,待幼苗长至3~4片真叶时采用切接法进行嫁接。试验共设2个处理:嫁接植株RGZ-01(R 为接穗,GZ-01 为砧木)和PGX-01(P 为接穗,GZ-01 为砧木)。以R、P 和GZ-01 番茄植株作为实生苗对照,RR、PP 为自嫁接植株对照。嫁接后,用透明的塑料保鲜膜覆盖保水,便于嫁接苗伤口愈合,在弱光处放置24 h。每天8:00 和17:00 轻轻打开塑料保鲜膜以降低相对湿度,并在嫁接7 d 后转移至人工培养室进行培养,温度为(25±1)℃,光/暗周期为16 h/8 h,采用霍格兰氏营养液进行浇灌(Sanchez-Rodriguez et al.,2010),14 d 后转移至温室中进行胁迫处理。干旱胁迫采用20% PEG-6000 溶液浇灌植株根部,每天8:00 和17:00 各浇1 次,每次浇灌100 mL,连续浇灌7 d,每处理30 株。
1.3 嫁接植株及果实生长生理指标测定
干旱处理7 d 后,每处理随机选取3~5 株,测定植株从上往下数第3~5 片真叶鲜质量和根部鲜质量,然后将叶片和根通过烘箱进行干燥,测定叶片和根部干质量;使用便携式叶绿素测定仪(型号:CL-01)测定从上往下数第3~5 片真片的叶绿素含量;采用外渗电导法测定从上往下数第3~5片真叶的相对电解质渗漏率(REL)(李福德 等,2019);使用游标卡尺测量叶长、叶宽、节长、茎粗。
绿熟期、成熟期每处理随机选取10 个果实,使用游标卡尺测量果实横径、纵径。
1.4 叶片失水率测定和气孔形态观察
干旱处理7 d 后,每处理随机选取3~5 株,将从上往下数第3 片真叶取下并立即称重记作初始重量W0,之后分别在叶片离体0.5、1.0、1.5、2.0、2.5、3.0 h 时测重记作Wt,计算叶片失水率。
干旱处理7 d 后,取从上往下数第3 片真叶,用镊子剥离背面表皮放置在载玻片上,加盖玻片后在高景深显微镜(型号:VHX-7000)下进行气孔开闭状态的观察与拍摄,并参照Xue 等(2021)的方法在叶片离体3.0 h 时统计气孔开放状态比例,每处理随机观察10 片叶片。
叶片失水率=(W0-Wt)/W0×100%
1.5 防御酶活性测定
参照Shu 等(2021)的方法,分别取干旱处理1、3、5、7 d 时从上往下数第3~5 片真叶进行液氮速冻,用于苯丙氨酸解氨酶几丁质酶(CHI)、β-1,3-葡聚糖酶(GLU)、苯丙氨酸解氨酶(PAL)和多酚氧化酶(PPO)的提取及活性测定。每处理随机测定3~5 株。
1.6 抗氧化酶活性测定
参照Xu 等(2012)的方法,分别取干旱处理0、2、4 d 时从上往下数第3~5 片真叶,测定超氧化物歧化酶(SOD)、过氧化氢酶(CAT)、过氧化物酶(POD)和抗坏血酸过氧化物酶(APX)的活性。每处理随机测定3~5 株。
1.7 过氧化氢(H2O2)和超氧阴离子()含量测定
干旱处理0、1、2、3、4、5、6、7 d,分别取植株从上往下数第3~5 片真叶,参照Xu 等(2012)的方法测定H2O2含量,使用超氧阴离子含量检测试剂盒〔生工生物工程(上海)股份有限公司〕测定含量;干旱处理0、4 d 时叶片中H2O2和的积累量分别通过3,3’-二氨基联苯胺(DAB)和硝基蓝四唑(NBT)染色法进行染色、拍照,具体方法参考Li 等(2017)的方法。每处理随机测定3~5 株。
1.8 基因相对表达量测定
取干旱处理0、3 h 时植株生长点叶片0.5 g,液氮速冻备用。RNA 提取使用总RNA 提取试剂盒(南京诺维赞生物科技有限公司;型号:R401-01),反转录采用反转录试剂盒(HiScript1st Strand cDNA Synthesis Kit;型号:R211-01)。使用CFX96TMReal-time System 荧光定量PCR 仪(美国Bio-Rad 公司)进行qRT-PCR。以Actin作为内参基因,对不同处理番茄叶片的基因表达水平进行归一化处理。所有基因特异性引物序列如表1 所示。qRT-PCR 反应体系:95 ℃ 2 min,94 ℃ 30 s,40个循环;60 ℃ 15 s,72 ℃ 15 s。

表1 实时荧光定量PCR 分析所用引物序列
1.9 数据统计分析
利用Excel 2019 软件进行数据整理,使用GraphPad Prism 8 软件作图。采用SPSS v24.0 软件进行方差分析,运用Duncan’s 新复极差法比较各处理的差异显著性(P<0.05)。
2 结果与分析
2.1 干旱胁迫下嫁接植株及果实生长生理指标测定
由图1 可知,干旱胁迫下,未嫁接(R、P、GZ-01)、嫁接(RGZ-01、PGZ-01)和自嫁接(RR、PP)番茄植株底部叶片均逐渐变黄,但RGZ-01 和PGZ-01 的株高明显高于其他植株。RGZ-01 的叶绿素含量、叶长、叶宽、茎粗、坐果率、叶干鲜质量、根干鲜质量均显著高于相应对照R,但其节长和相对电解质渗漏率显著低于R;PGZ-01 除叶长、叶宽与相应对照P 无显著差异外,其他指标测定结果与RGZ-01 一致,且节长和根鲜质量显著高于RGZ-01。RR、PP 的叶绿素含量和叶干质量分别显著高于相应对照R 和P,但叶长、叶宽、叶鲜质量、根干鲜质量和相对电解质渗漏率均与R、P 无显著差异。
以GZ-01 为砧木的嫁接番茄植株RGZ-01 和PGZ-01 的坐果率均显著高于未嫁接(R、P)和自嫁接植株(RR、PP)(图1),且PGZ-01 绿熟期和成熟期果实的横、纵径均高于其他植株(图2)。综上表明,GZ-01 砧木能够增强嫁接植株的耐旱性,且耐旱接穗P 与GZ-01 嫁接更加削弱了干旱诱导的生长抑制。
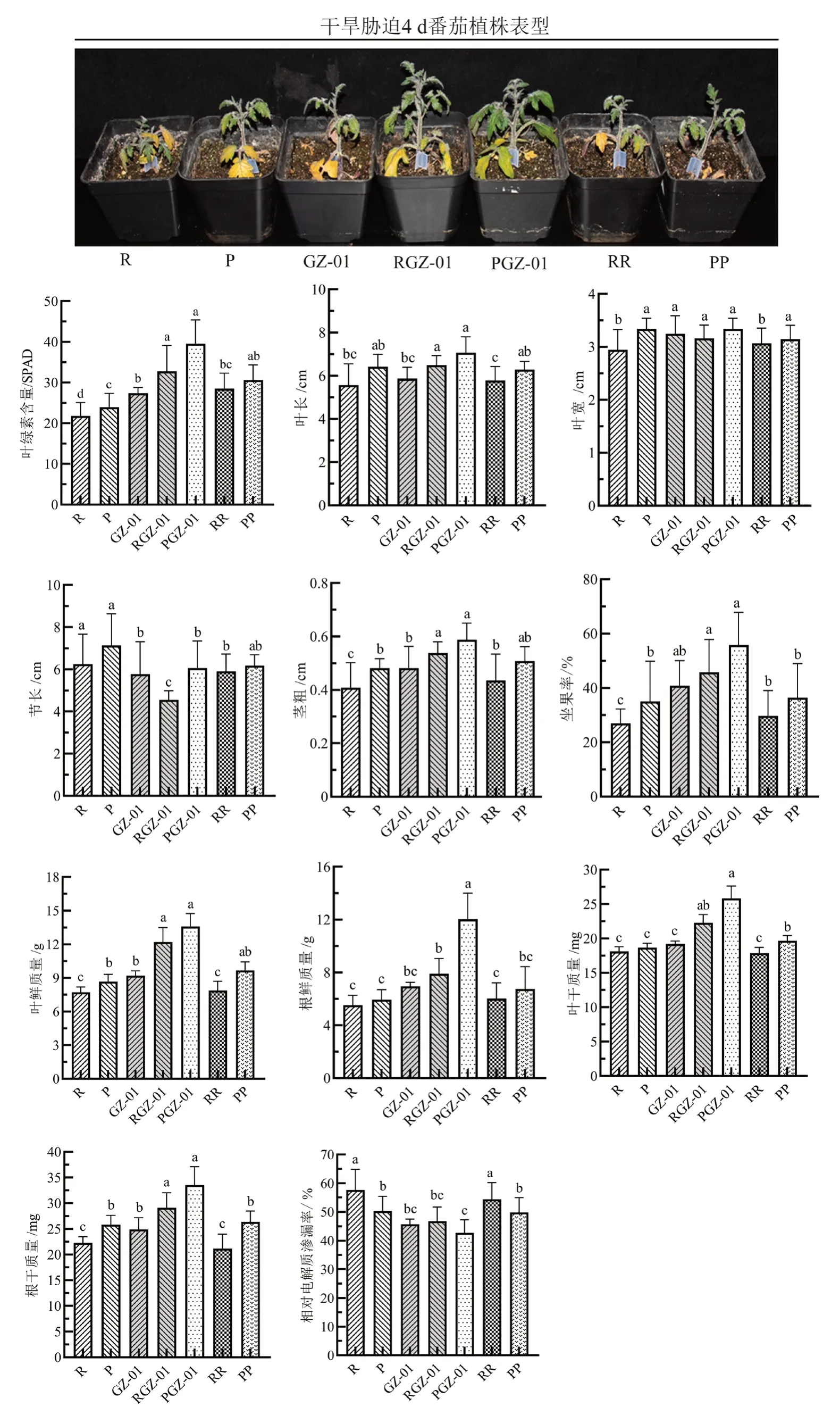
图1 干旱胁迫下GZ-01 砧木对嫁接植株生长生理指标的影响
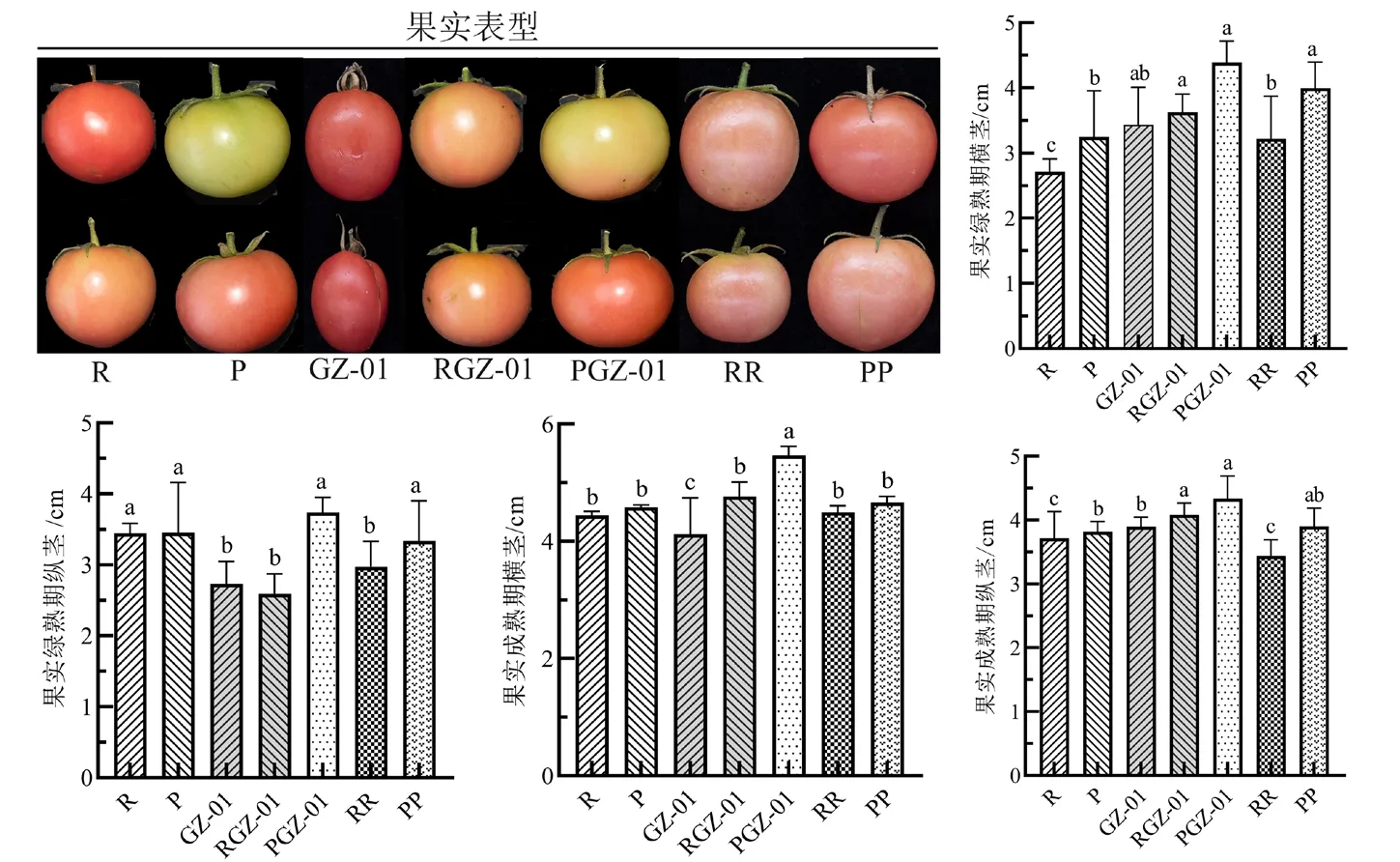
图2 干旱胁迫下GZ-01 砧木对嫁接植株果实生长的影响
2.2 干旱胁迫下嫁接植株叶片失水率测定和气孔形态观察
不同干旱处理番茄植株离体叶片失水率及气孔形态变化如图3 所示,离体叶片均随时间变化持续失水,在干旱处理3.0 h 时,嫁接植株RGZ-01、PGZ-01 与自嫁接植株RR、PP 的水分散失率分别为12.57%、10.35%、16.59%和14.95%;且不同处理植株叶片气孔均呈现3 种状态,分别为关闭状态、半开闭状态和关闭状态。叶片离体3.0 h 时,未嫁接番茄植株的气孔开放状态比例为75.94%(R)、75.59%(P)和61.83%(GZ-01),嫁接植株气孔开放状态比例为15.29%(RGZ-01)和7.64%(PGZ-01),自嫁接植株气孔开放状态比例为19.89%(RR)和14.08%(PP);RGZ-01、PGZ-01 的气孔关闭状态比例均高于其他植株,其中嫁接番茄PGZ-01的气孔关闭状态比例最大。以上结果均表明,以GZ-01 为砧木的嫁接番茄植株在干旱胁迫下抗性更强,且耐旱接穗P 与GZ-01 嫁接耐旱性更强。
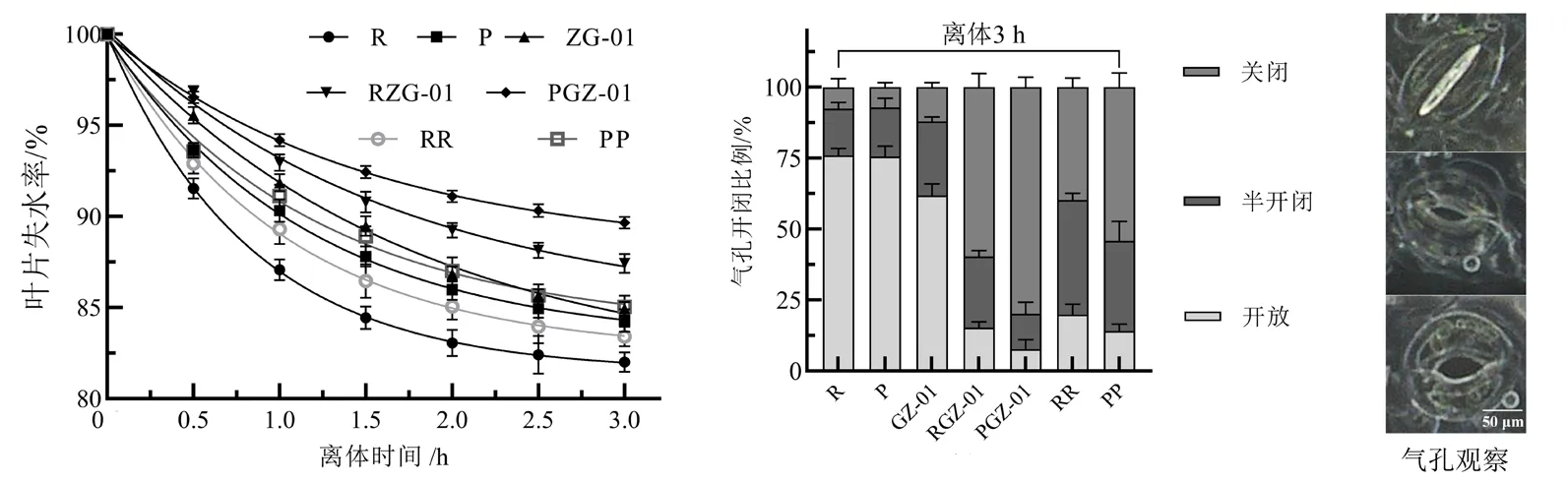
图3 干旱胁迫下GZ-01 砧木对嫁接植株离体叶片失水率和气孔形态的影响
2.3 干旱胁迫下嫁接植株防御酶活性测定
由表2 可知,除干旱处理1 d 后的PPO 活性外,嫁接植株PGZ-01、RGZ-01 的CHI、GLU、PAL和PPO 活性均高于未嫁接植株R、P、GZ-01 和自嫁接植株RR、PP。其中,干旱处理3 d 时,RGZ-01 和PGZ-01 的CHI 活性最大;干旱处理5 d 时,RGZ-01 和PGZ-01 的GLU 和PPO 活性最大;干旱处理1 d 时,RGZ-01 和PGZ-01 的PAL 活性最大,且PGZ-01 的防御酶活性均高于RGZ-01。
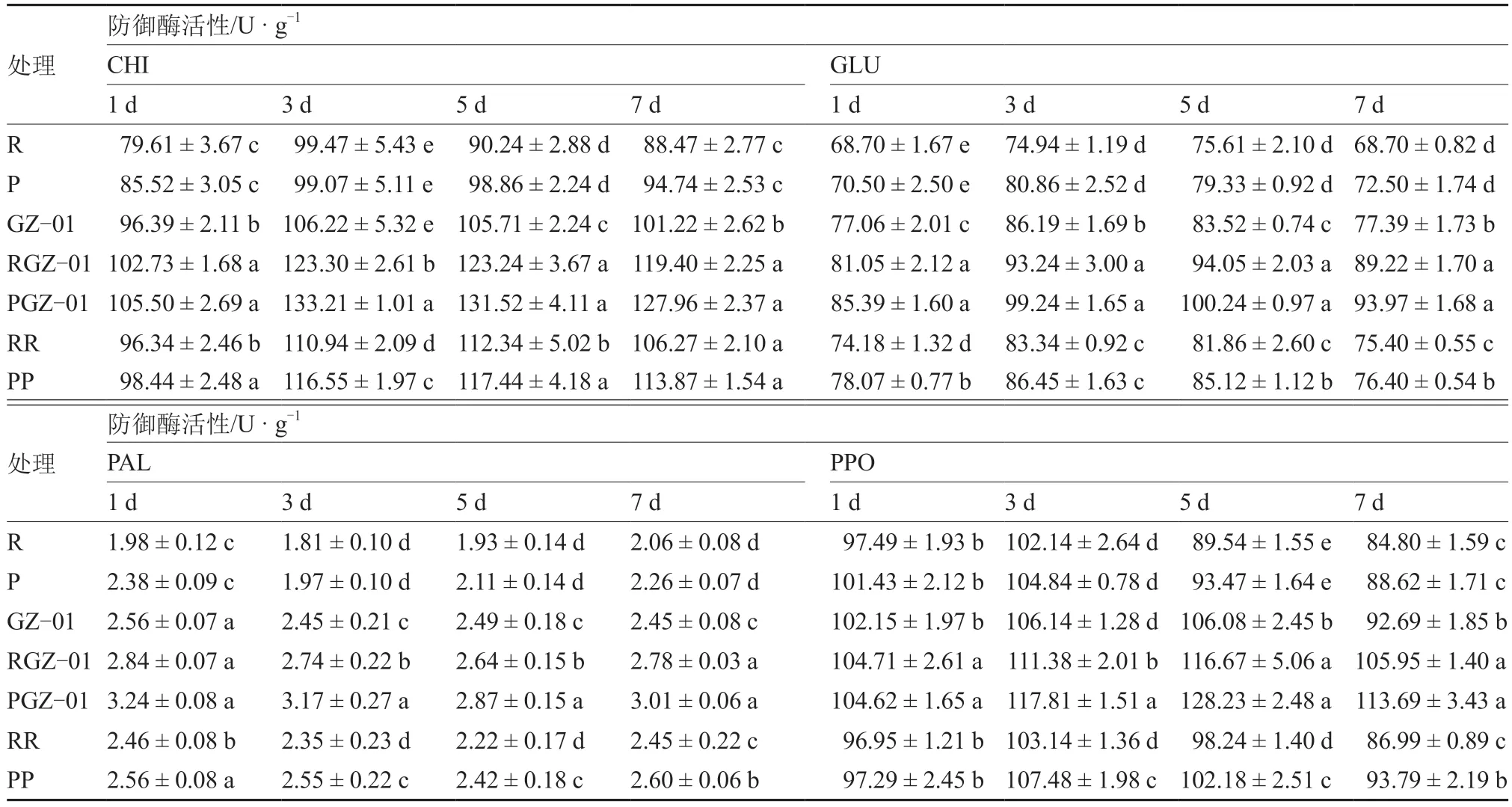
表2 干旱胁迫下GZ-01 砧木对嫁接植株防御酶活性的影响
2.4 干旱胁迫下嫁接植株抗氧化酶活性和H2O2、含量测定
由图4 可知,干旱处理0 d 时,未嫁接、嫁接与自嫁接植株的抗氧化酶活性并无显著性差异,而干旱处理2、4 d 时,嫁接植株(RGZ-01、PGZ-01)抗氧化酶活性均显著高于未嫁接植株(R、P、GZ-01)和自嫁接植株(RR、PP),且PGZ-01 抗氧化酶活性均高于RGZ-01。其中,干旱胁迫2 d时,PGZ-01 的SOD、POD、CAT 和APX 活性分别比RGZ-01 高2.63%、7.67%、19.59%和6.27%。干旱胁迫4 d 时,PGZ-01 的SOD、POD、CAT 和APX活性分别比RGZ-01 高6.02%、10.24%、11.83%和15.62%;PP 抗氧化酶活性均显著高于其对应实生苗,RR 除CAT 外,其他抗氧化酶活性均显著高于其对应实生苗。
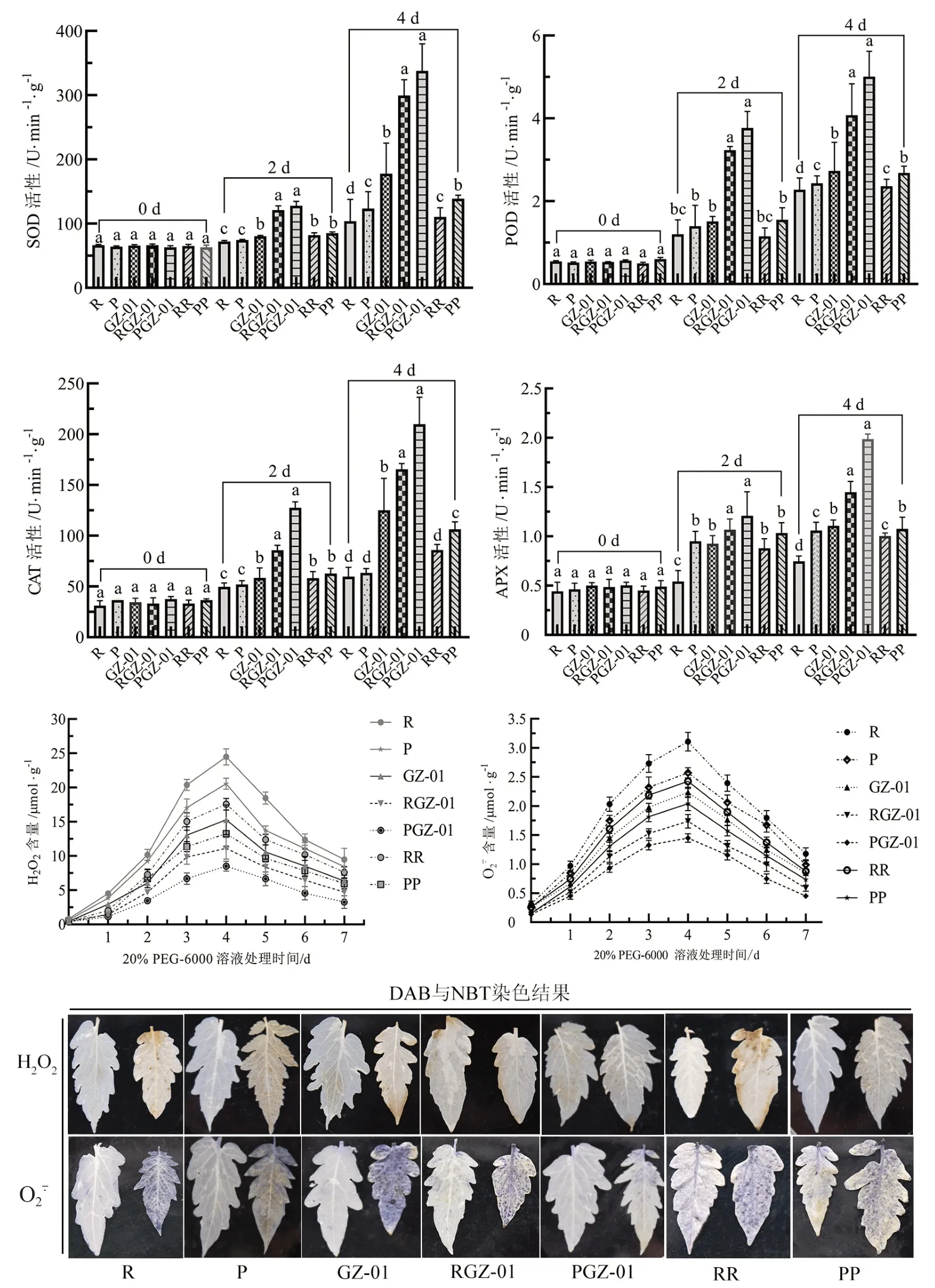
图4 干旱胁迫下GZ-01 砧木对嫁接植株抗氧化酶活性和H2O2、积累的影响
干旱处理后各处理番茄植株H2O2和含量迅速激增,并均在干旱处理4 d 时达到最大,而后随着干旱胁迫时间的延长,H2O2和含量呈下降趋势,直至7 d 时达到最低,且嫁接植株RGZ-01、PGZ-01 的H2O2和含量在7 d 的干旱处理过程中均低于自嫁接和未嫁接番茄植株;其中PGZ-01最低,RGZ-01 次之。通过DAB 与NBT 染色发现,在干旱处理0 d 时,未嫁接、自嫁接和嫁接番茄植株的H2O2、积累并无明显差异;干旱处理4 d 时,未嫁接和自嫁接番茄植株的叶片有大面积黄褐色与深蓝色斑块产生,并有不断向四周扩散的趋势,而嫁接植株PGZ-01 和RGZ-01 仅有少量浅黄色斑块和蓝色斑点产生。综上表明,GZ-01砧木能够通过嫁接调节接穗抗氧化酶活性和减少H2O2、的积累量,具有清除植株体内活性氧,从而减轻植株的ROS 损伤。
2.5 干旱胁迫下嫁接植株ABA 和MAPKs 防御相关基因的表达量测定
为探究GZ-01 砧木增强嫁接植株抗旱的分子机制,测定了不同嫁接处理番茄叶片ABA、MAPKs 信号通路相关基因的表达(图5)。与干旱胁迫0 h 相比,胁迫3 h 后不同嫁接处理番茄叶片中除SlMAPK1、SlMAPK2和SlMAPK6外,SlNCED1、SlCYP301A1、SlMAPK3基因表达量均升高;此外,PGZ-01 和RGZ-01 叶片中其他防御相关基因的相对表达量显著高于其他植株,其中PGZ-01 防御相关基因的相对表达量均为最高。以上结果表明,在干旱胁迫诱导下,GZ-01 砧木能够通过嫁接调控MAPK 级联信号途径、ABA 信号途径参与干旱胁迫的抗性反应,在嫁接番茄植株抵御干旱胁迫中发挥重要作用。
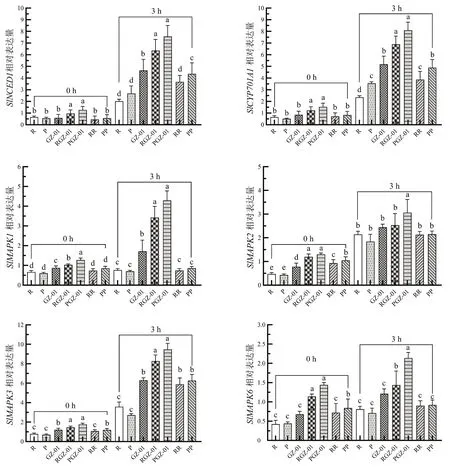
图5 干旱胁迫下GZ-01 砧木对嫁接植株ABA 和MAPKs 防御相关基因表达的影响
3 讨论
本试验通过20% PEG-6000 溶液模拟干旱胁迫发现,MAPKs 防御相关基因在参与调控植株耐旱性中发挥重要作用,这个结果在Wang 等(2017)的研究中被证实,该研究通过CRISPR-Cas9 技术敲除番茄SlMAPK3,发现敲除株系对干旱更敏感。另外,张龙等(2021)通过过表达SlMAPK3发现可以提高番茄植株的田间抗旱性。除SlMAPK3外,过表达SlMAPK1同样可以提高番茄植株对干旱的抗性(Wang et al.,2018)。这与在拟南芥中报道的MAPK3/6 蛋白参与系统诱导抗性一致(Beckers et al.,2009;岳宁波 等,2020)。此外,本试验还发现GZ-01 砧木能够影响接穗叶片气孔开闭比例,进而影响叶片蒸腾速率,从而直接影响植株耐旱性。Xue 等(2020)研究发现,MAPK 级联信号关键蛋白MAPK3/6 底物MAPK Substrates in the Stomatal Lineage(MASS)蛋白可以影响气孔发育。Lampard 等(2008)报道,MAPK 级联信号系统中MKK4/MKK5 或MPK3/MPK6 关键蛋白功能丧失会破坏气孔及叶片表皮细胞,导致气孔簇的形成。而本试验中,GZ-01 砧木嫁接植株中MAPK 级联信号关键基因SlMAPK1、SlMAPK2、SlMAPK3的表达量明显增加,但并未发现气孔簇的形成,推测GZ-01 砧木通过MAPK 级联信号系统调控气孔开闭,从而影响接穗的蒸腾量和耐旱性,但具体机制仍需进一步研究。
除MAPKs 外,Danquah 等(2014)报道ABA信号在调控干旱胁迫方面也发挥着重要作用。Liu 等(2016)发现ABA 可以通过调节气孔开闭影响植株抗旱性。本试验中,干旱胁迫下GZ-01砧木嫁接植株的ABA 合成相关基因SlNCED1和SlCYP701A1的表达量上调,促进了ABA 的累积,从而促使气孔关闭,减少水分蒸腾作用,增强植株的耐旱性。而MAPK 级联信号通路参与调控保卫细胞ABA 信号,从而影响植株的抗旱性(Liu et al.,2022)。因此,本试验中GZ-01 作为砧木嫁接可以提高嫁接植株的耐旱性,推断可能是通过调节MAPK 级联信号关键蛋白激酶SlMAPK3 的活性,影响ABA 信号途径,调节气孔开闭,从而提高植株的耐旱性。
Luna 等(2005)报道干旱胁迫可以诱导植物ROS 的累积,诱导脂质过氧化和造成细胞膜损伤,进而对整个植株造成损害。本试验条件下,RGZ-01与PGZ-01 番茄植株中H2O2和含量始终低于其他植株,而PGZ-01 的H2O2和含量又始终低于RGZ-01。表明GZ-01 砧木能够清除嫁接植株ROS,增强嫁接植株耐旱性,且耐旱性强弱与接穗植株有关。由于接穗R 和P 的耐旱性不同,推测相同砧木嫁接植株的耐旱性取决于接穗耐旱性;也可能是不同接穗和砧木的亲和性不同,导致同样砧木不同接穗的嫁接植株耐旱性存在差异。
4 结论
以半野生番茄GZ-01 作砧木进行嫁接可以通过降低嫁接植株叶片气孔开放状态比例,提高防御酶及抗氧化酶活性,降低植株叶片中ROS 的积累来缓解干旱胁迫对植株叶片细胞的损伤;通过诱导嫁接植株中MAPK 介导的信号通路和ABA 相关防御基因的表达,最终增强嫁接植株的耐旱性,且耐旱性强弱与接穗植株相关。

