蛋白质定量质谱技术及其在食品加工用酵母中的应用
胡 娜,利佳炜,闫珍珍,陈 雄,李 欣*
(工业发酵省部共建协同创新中心,发酵工程教育部重点实验室,湖北省工业微生物重点实验室,湖北工业大学生物工程与食品学院,湖北 武汉 430068)
蛋白质是生命体生理功能的主要参与者和执行者,是基因响应和环境变化之间沟通的桥梁[1],因此研究蛋白质变化能直观阐明生命体产生差异性状的原因。对生物体开展高通量高精度的蛋白质水平分析,有利于探究环境或外源物质对蛋白质合成的影响,发现蛋白基因表达调控机制的关键位点[2]。早期所建立的蛋白质定性方法如化学测序法、酶联免疫吸附剂试验、蛋白质免疫印迹法以及双向荧光差异电泳法等[3-5]已不能满足新时代蛋白质研究的需求。随着蛋白质序列数据库的不断完善,以定量为目的的检测成为当下及未来的研究趋势。
细胞蛋白质组检测难度大,获取酵母蛋白质组学所需的量化数据必须结合自动化技术和计算机技术。质谱法是结合这两种技术实现高通量自动化表征蛋白质组的理想手段。其中液相色谱-串联质谱(liquid chromatography-tandem mass spectrometry,LC-MS/MS)技术作为代表性技术之一,在研究蛋白质丰度跨度较大的酵母时,可分析鉴定出低丰度的蛋白质[6]。基于LC-MS/MS可将蛋白质组学研究分为两类:“自上而下”蛋白质组学[7]和“自下而上”蛋白质组学[8]。“自上而下”蛋白质组学可直接完整获取蛋白质序列信息,而“自下而上”蛋白质组学通过鉴别多肽来获取蛋白质信息。相比较而言,“自下而上”蛋白质组定量技术不仅能在复杂体系中高效获取蛋白质组信息,还能高通量的处理蛋白种类庞杂的样品[9]。食品加工用酵母作为一类在基础研究、食品酿造和工业发酵等领域被广泛应用的真核微生物,其蛋白质组学研究一直受到相关研究人员的关注。在食品加工用酵母蛋白质组学中应用“自下而上”蛋白质组学技术适用性更广。基于此,本综述主要介绍近5 年“自下而上”蛋白质组定量技术及其应用于食品加工用酵母研究的最新进展。
1 “自下而上”蛋白质组定量技术
“自下而上”蛋白质组技术提出后经过不断优化改进,逐渐适用于各个物种领域的研究,如植物、动物、微生物以及人体的各个组织或器官等[10-12]。在酵母这类微生物结构中,该技术由质谱定量分析蛋白质组降解的肽段推测所含蛋白质浓度为原理展开(图1)。从技术流程的角度大致可分为标记定量(label quantification,LQ)法和无标记定量(label-free quantification,LFQ)法[13-14]两大类。同位素标记作为分子领域最常见的技术手段之一,在定量蛋白质组学中也有适应性技术革新。同位素氨基酸标记细胞培养技术(stable isotope labeling by amino acids in cell culture,SILAC)通过细胞培养基中添加含13C标记的赖氨酸来开展研究。Sun Yu等[15]采用SILAC研究酿酒酵母(Saccharomyce cerevisiae)BY4741菌株生长期间的蛋白质组变化,发现衰老细胞与热量限制(calorie restriction,CR)细胞的蛋白质组之间显著相关,从而进一步佐证了CR参与细胞衰老。然而单个同位素体内标记法鉴别蛋白质组的效率有限,并且限制了酵母细胞的培养条件,所以目前研究多采用对多肽中多种氨基酸基团进行体外同时标记。LFQ与同位素标记定量技术相比操作更简便、价格更低廉、可对体态微小的生命体进行大规模蛋白质组定量研究。

图1 “自下而上”测定酵母蛋白质组流程Fig.1 Flow chart of the “bottom-up” procedure for proteomic analysis of yeast
2 酵母蛋白质组定量技术研究进展
同位素标记相对和绝对定量(isobaric tags for relative and absolute quantitation,iTRAQ)标记法正逐渐成为常用的蛋白质同位素标记技术之一[16]。iTRAQ标记法采用4 种或8 种同位素标签对多肽的氨基酸基团特异性标记,并可同时对多个样品批量处理,针对酵母中相对分子质量高的蛋白质、极碱性蛋白质和极酸性蛋白质都有极高的检出率[17]。此外,美国Thermo Scientific公司研发了一种新型多肽体外标记技术为串联质谱标签标记(tandem mass tag,TMT)技术[18]。迄今为止,TMT标记技术可同时运用16 种同位素对多肽的氨基基团进行特异性标记,以此增加鉴定位点从而提升蛋白质鉴定效率[19]。Gassaway等[20]通过TMT标记技术针对酿酒酵母蛋白质组开展的研究,测定发酵过程中11 个时间点的蛋白质和磷酸化位点的变化,辨析不同蛋白质复合体的结构、生长和代谢途径的差异化表现。
LFQ要求蛋白质酶解产物进入质谱分析前需使用分馏技术使样品充分分散,例如超滤辅助样品制备(filter-aided sample preparation,FASP)[21]、二维聚丙烯酰胺凝胶电泳(two-dimensional polyacrylamide gel electrophoresis,2D-PAGE)[22]、高pH值反相多肽分馏(high pH reversed-phase fractionation,HRP)[23]、超高效液相色谱(ultra performance liquid chromatography,UPLC)[24]等各种分离技术。蛋白分离技术结合质谱技术构成了酵母蛋白质组LFQ的完整方案。Zaman等[25]结合HRP分馏法分析添加过氧化氢和正常情况下酵母发酵过程中蛋白质组差异,并提出该流程可适用于检测植物的蛋白质组从而推进植物代谢工程的研究进展。
近5 年来,运用同位素标记定量技术鉴定酵母蛋白质组的相关研究如表1所示。以酿酒酵母为研究对象的LFQ蛋白质组检测方案如表2所示。
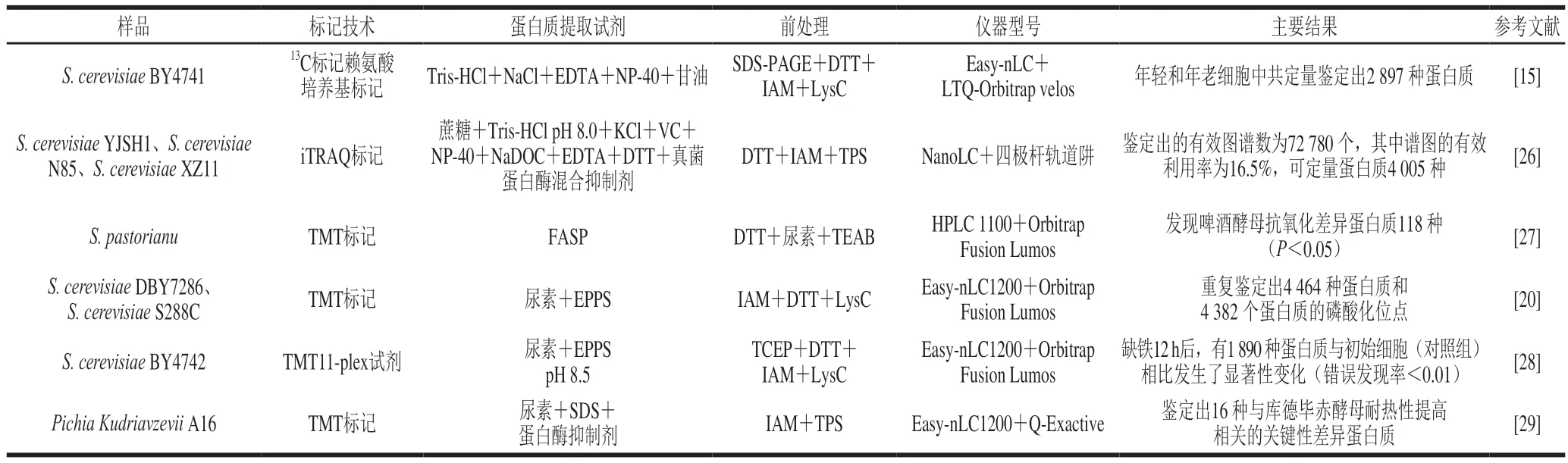
表1 同位素标记定量法测定酵母蛋白质组技术方法Table 1 Isotope labeling methods for quantitative determination of yeast proteins

表2 LFQ测定酿酒酵母蛋白质组技术方法Table 2 Label-free labeling methods for the quantitative determination of yeast proteins
蛋白质组定量技术是以质谱为理论依据开发的创新方法,而质谱对蛋白质测定的精准度受到以下因素的影响:1)提取方案的差异;2)检测对象的差异;3)结果信息分析手段的差异。因此,酵母蛋白质组定量技术的优化需从这3 个影响因素着手。酵母蛋白质组测定过程中的关键技术点在于:蛋白质组提取技术、蛋白质组鉴定技术、生物学信息分析技术(图2)。

图2 酵母蛋白质组分析技术路线图Fig.2 Technical roadmap for yeast proteomic analysis
2.1 蛋白质组提取技术
针对酵母蛋白质组定量技术而言,细胞蛋白质有效溶出率是首要关注重点[32]。然而,大多数酵母的细胞壁较厚,难以使胞内蛋白质全部溶出。目前胞内酵母蛋白的释放多采用物理破裂方法,如超声波细胞裂解法和珠磨振荡研磨法等。MP Biomedicals公司建立的FastPrep Lysis Matrix C beads技术[33]就是通过优化研磨珠材质进而提升提取效率。然而,超声波细胞裂解法和珠磨振荡研磨法提取过程中产生的热量会造成蛋白质损失。因此,为确保高效破裂细胞的同时且无蛋白质损耗,在低温条件(通常为4 ℃)下采用温和提取液进行短时高效的细胞破壁处理可能是最优提取方法。
蛋白质提取最常见的方法是采用高浓度尿素(8 mol/L尿素+碳酸氢铵或Tris-HCl)来提高蛋白质溶解度[23]。然而,高浓度尿素也会带来不利的影响,如导致后续添加的蛋白酶变性并且需要增加脱盐处理的步骤,而脱盐处理不可避免地会对蛋白质造成损失。为优化提取方案,Almeida等[34]对多种提取液进行对比,发现大多数提取溶液配制复杂且均需要加入蛋白酶抑制剂,而美国Sigma-Aldrich公司的CelLytic Y试剂[35]在无需加入蛋白酶抑制剂的同时,不仅可以高效裂解酵母细胞还可以避免蛋白质损失。现有多家国际生物检测公司推出更便捷的试剂,如美国Thermo Scientific公司的Y-PER™酵母蛋白提取试剂[36]中含有机缓冲剂、温和的非离子洗涤剂以及各种盐溶液;美国Sigma-Aldrich公司ProteoPrep®总蛋白提取试剂盒[37]中所含成分为4 种提取剂、碘乙酰胺和三丁基膦溶液;生工生物工程(上海)股份有限公司的一步法酵母活性蛋白提取试剂盒[38]的组成成分为提取试剂、蛋白酶抑制剂、DTT以及PMSF;美国Invent生物技术公司的Minute™酵母、细菌和微藻等厚胞壁微生物总蛋白提取试剂盒[39]含有变性缓冲液、天然缓冲液和蛋白提取粉。上述公司研发的试剂盒均采用多种温和裂解液复合而成,在防止酵母蛋白质变性的同时,可尽可能地缩短提取时间,以获取酵母胞内完整的蛋白质组。
2.2 蛋白质组鉴定技术
LC-MS/MS技术是量化蛋白质组浓度的有效手段,主要是通过最大化提取蛋白质序列信息,进而与数据库进行有效比对分析。LC-MS/MS中液相系统的主要目的是最大化分散样品并充分提高质谱仪的利用率。研究表明美国Thermo Scientific公司的新型Vanquish Neo UHPLC[40]系统可缩短样品进样时间,增加蛋白质检测的覆盖率。LC-MS/MS中起关键作用的是质谱系统,主要透过一级相对分子质量分析推断出发生何种翻译后的修饰,再测定二级碎片离子的相对分子质量推断出翻译后修饰发生的位点[41-42]。依据MS1或MS2的信号强度鉴别多肽序列从而定位对应的蛋白质,以此达到定性、定量分析蛋白质组的目的。
为进一步提升质谱仪的性能,不同特点的质谱仪联用是一条可行的策略,包括能准确鉴别同位素标记位点的四极杆-飞行时间(quadrupole-time of fligh,Q-TOF)质谱仪、能对肽段精准定性的静电场轨道阱以及能提升多肽鉴定覆盖率的线性离子阱(linear ion trap,LIT)等进行多种质谱仪联用模式[23,43]。张伟等[44]利用四极杆、静电场轨道阱和线性离子阱三合一质谱系统检测酵母中蛋白质组,在假阳性率q<0.01的情况下图谱的有效梯度解析率可达到42.1%。随着质谱仪性能不断优化,蛋白质定量效果有显著的提升。周岳等[45]以最新的Orbitrap Exploris 480质谱仪配备电动离子漏斗进一步提高质谱灵敏度。离子传输组件则采用最新的双弯曲四极杆以提高抗污染能力,同时兼容高场非对称波形离子迁移谱(high-field asymmetric wave formion mobility spectrometry,FAIMS)技术。此设备可提高对蛋白质组分析的灵敏度和稳定性,进一步优化数据依赖采集(data dependent acquisition,DDA)、数据独立采集(data independent acquisition,DIA)以及TMT标记法的关键质谱参数。无论是辨认同位素标记点还是鉴定蛋白质或肽段都需要尽可能提高质谱的灵敏度、分辨率及可重复性。Johnson等[46]研究表明傅里叶变换离子回旋共振质谱仪(fourier-transform ion-cyclotron resonance mass spectrometry,FT-ICR-MS)在m/z400时可提供约为200 000的分辨能力,能发现在其他类型的质谱仪中被遗漏的同位素峰簇并能直接确定蛋白质翻译后的修饰位点。交联质谱技术(cross-linking mass spectrometry,XL-MS)以非特异光化学反应为基础,能高效鉴别蛋白质复合物结构[47]。Gutierrez等[48]验证了XL-MS在大型蛋白质复合物中使用光交叉连接鉴定的可行性,并且开发了以琥珀酰二嗪亚砜为基础的新型质谱交联剂,以便质谱快速准确地鉴定光交叉连接的位置。然而,这些新技术在酵母蛋白质研究中的应用还不够普遍,其可行性仍有待验证。常见定量质谱仪的优劣对比如表3所示。

表3 各类质谱技术的对比Table 3 Comparison of various mass spectrometry techniques
2.3 生物信息分析技术
生物信息技术包括对完整蛋白质及多肽的质谱数据预处理、数据库搜索鉴定以及翻译修饰后的位点定位等几个方面[49],其中的关键核心是对质谱中得到的数据结果进行有效解析。随着数据库的不断完善,质谱获取的生物信息通过数据库进行对比从而预测结果是最常用的定性方法,一般与基因本体(gene ontology,GO)、蛋白质直系同源簇(cluster of orthologous groups of proteins,COG)、京都基因和基因组(Kyoto Encyclopedia of Genes and Genomes,KEGG)、蛋白质家族(protein families,Pfam)、亚细胞定位(subcellular localization)[50-51]等数据库进行联用。但是这些理论序列并不能直接精准鉴别所有酵母中的蛋白质序列,需对其做出两方面改进。其一,从分析软件着手,改变质谱结果扫描策略;其二,从数据库着手,开发针对性酵母蛋白质数据库。
常见的质谱仪DDA扫描模式可完整扫描出一般化合物相对分子质量的生物学信息,但对于肽段离子的扫描存在限制性和随机性,会导致生物信息的缺失率增高。现多采用的DIA扫描技术将质谱的整个全扫描范围分为若干个窗口,高速、循环地对每个窗口中的所有离子进行选择、碎裂、检测,以此弥补DDA扫描模式造成的生物信息缺失,从而进一步提升数据利用率[52]。在复杂的酵母样品体系中,DIA扫描模式是通过二级质谱信号进行定量,减少了在一级质谱信号中存在的相似质荷比离子的干扰。Santos等[53]提出两者结合的混合数据采集(mixed-data acquisition,MDA)技术有利于克服无标签定量法常见瓶颈的问题,即m/z值无法区分。选用MDA技术提升酵母蛋白质组分析的效率可能成为当下及未来的一种新趋势。如今,改善多级质谱扫描策略可增进蛋白质定量统计方法的有效率。通常蛋白质结果分析选用Protein Pilot软件[54],其主要针对特异性肽链的序列分析鉴定。Tian Xiaobo等[55]在一级质谱中利用DIA扫描模式对含LysC的酵母蛋白质进行分析,并利用乙酰-异亮氨酸-脯氨酸标签(acetyl-isoleucine-proline,Ac-IP)进行三重标记蛋白质定量分析。为增加蛋白质结果可信度,来自瑞典研究所的Zhu Yafeng等[56]提出了一种专为质谱数据中的差异蛋白表达分析而开发的定量统计分析策略DEqMS。通常方差评估着重依赖于肽段量化的数量,而增加了单肽鉴定方案的DEqMS能更准确地评估蛋白质方差估计的数据依赖性。以上研究是基于提升特殊肽段离子鉴定蛋白质的效率为目标而进行的创新,为完善生物信息分析完整度还需建立更具针对性的蛋白质序列数据库。一些研究人员已开始尝试建立单一酵母针对性蛋白质组序列数据库,如Picotti等[57]建立了一种由酿酒酵母多肽序列生成的数据库,可用于精确分析酿酒酵母蛋白质的数量性状位点(quantitative trait loci,QTL),由此构建了一套完整的酿酒酵母蛋白质组学分析方法。Rathod等[58]开发并建立了第一个酵母磷酸肌苷结合蛋白(yeast phosphoinositide-binding proteins,YPIBP)数据库,主要用于多种酵母磷酸化蛋白质组的鉴定。
3 蛋白质组定量技术在食品加工用酵母研究中的应用前景
酵母被广泛应用于酒、调味品、乳品、酵素、面包等食品发酵和食品酿造过程中。酵母蛋白质组定量技术有助于分析工业发酵和食品酿造中酵母蛋白质变化,以及不同应用条件下酵母蛋白质的响应特征,从而阐明酵母代谢特征和调控机制,开发出更有应用优势的酵母菌株并实现加工工艺的优化和产品品质的提升。近5 年研究人员对食品加工用酵母蛋白质组的研究如表4所示。

表4 近5 年食品加工用酵母蛋白质组的研究Table 4 Proteomic studies on yeasts used for food processing in the past five years
3.1 探究蛋白质合成机制
为提升酒、乳品和酵素等食品的产量进行酵母功能性改造不失为一种选择。Negoro等[68]采用定量蛋白质组学技术对高产苹果酸的菌株进行蛋白质差异化解析,发现高产苹果酸的关键因素与清酒中内含葡萄糖诱导降解缺陷(glucose-induced degradation deficient,GID)蛋白编码基因(GID1-GID9)有关,其中GID1、GID2、GID3、GID4、GID5、GID8和GID9表达的产物均可使酿酒酵母产出的苹果酸含量提升。本团队对鲁氏接合酵母(Zygosaccharomyces rouxii)进行基因组测序,以此寻找蛋白质编码基因序列的信息[69]。Li Zhen等[70]对含核糖体蛋白rP59的菌体定量解析多种蛋白质的基因表达位点,由此提出核糖体组装与蛋白基因表达调控的耦合模型。通过蛋白质组定量技术可研究mRNA的转录、加工和翻译期间的不同影响机制。酵母中还含有多处mRNA-蛋白质调控位点[71],进而增加了mRNA合成蛋白质过程的可变性。这个过程的关键点在于mRNA合成蛋白时会先产生一段特殊的肽链序列——信号肽,其可引导新生蛋白穿过内质网膜进行分泌。蛋白质定量技术提供了蛋白质序列的精确信息,可为找寻特殊的信号肽序列提供可能性。华东理工大学的Zhu Jinxiang等[72]根据毕赤酵母整个蛋白质的鉴定结果,检验出a信号肽密码子对毕赤酵母所携带蛋白质的分泌效率产生影响,从而设计出更合理的a信号肽密码子以此改进毕赤酵母的基因序列。
3.2 探究蛋白质修饰及应用
真核微生物的蛋白质成熟需经过加工处理,即翻译后的修饰过程,该过程与调控生命进程的变化息息相关。蛋白质在修饰过程中会发生磷酸化、泛素化、甲基化、糖基化、脂基化或乙酰化等[73-74]变化。参与酵母的生长发育、信号传导以及病变发生发展的许多蛋白质都需要以不同的方式进行翻译后修饰。定量蛋白质组分析技术为揭示蛋白质翻译后修饰的基本规律和明确蛋白质的修饰进程提供了强有力的技术支持。酵母细胞对于合成基酒和天然基酒中高分子质量多糖和低聚糖的差异性化起作用[75]。袁铁铮[76]则通过LFQ蛋白质组技术法分析不同碳源培养条件下的树干毕赤酵母(Pichia stipitis)磷酸化蛋白质组变化情况,结果显示葡萄糖培养下酵母细胞内存在351 种磷酸化蛋白质,而木糖会明显增加其中45 种磷酸化修饰蛋白的丰度。代谢途径汇聚分析则表明糖酵解(embden-meyerhof-parnas pathway,EMP)、三羧酸循环(tricarboxylic acid cycle,TCA)和戊糖磷酸途径(pentose phosphate pathway,PPP)中的部分关键酶的磷酸化修饰都受到碳源的影响。Matsuki等[77]研究酿酒酵母细胞的内质网应激与未折叠蛋白反应(unfolded protein response,UPR)途径时,发现在该时期添加衣霉素可提升内质网上的核糖体蛋白uS10、uS3和eS7的泛素化水平。
3.3 探究环境胁迫及调控机制
食品发酵过程中为达到产品工业化生产,往往会导致发酵环境不利于酵母的生长。在高浓度环境下酵母蛋白质组学会产生明显变化,研究酵母高产性菌株可从蛋白质组学的角度进行分析。蛋白质组的浓度变化与酵母生长调控路径有密切联系。在发酵过程中酵母细胞会伴随发生一系列环境胁迫,如在工业发酵和食品酿造的过程中常常会受到高温、高糖、高含量的有机酸或乙醇等物质的干扰。环境胁迫不仅会使酵母生长进程发生改变,还会同步影响酵母蛋白质组浓度。研究发现酵母蛋白质组定量技术结合生物信息学能够预测在酵母生长、物质跨膜运输、中间代谢或呼吸过程中起决定性作用的蛋白质数量以及其作用效果。由此结果建立在不同应激反应条件下的早期和晚期细胞生物学模型,有助于完整阐释逆境与蛋白质的关系[78]。此外,探究酵母在多种不利环境条件的蛋白质组变化,有助于建立更优质的食品发酵体系。袁铁铮[76]利用LFQ蛋白质组技术在培养条件分别为木糖和葡萄糖的毕赤酵母中共鉴定出4 085 种蛋白质,表达上调的蛋白质分别有1 551 种和789 种。进一步发现在木糖培养条件下,PPP和脂肪酸代谢途径的差异蛋白质大部分上调。本团队针对源于酱油发酵中的鲁氏接合酵母在热激下的响应条件进行探索[79],对其蛋白质组结果进行预判,基于文献提出合理性假设并将验证其可行性。在食品发酵的过程中,酵母也可能因为外源物质中残留的有害物质影响其蛋白质的特异性表达。Liu Shuai等[80]通过无标记蛋白质组定量技术研究加入青蛤凝集素孵育24 h后酿酒酵母蛋白表达谱的变化,分析在发酵过程中刺激机制的具体影响及原因。
3.4 探究细胞器的响应机制
细胞器在酵母生长过程中都起到重要作用,蛋白质组在细胞器的分布情况决定其不同效应的响应。在酵母细胞器中,核糖体是蛋白质合成的场所,线粒体是为细胞生长提供能量的场所,各个细胞器上的膜是体内传递信息的必经通道。蛋白质组学的结果不仅能反映外源胁迫时酵母生长路径的变化,还能更精细反映在受到外界胁迫时不同细胞器产生的响应机制。核糖体蛋白、线粒体蛋白、膜蛋白等都对酵母的生长发育产生影响,因此Azizi等[30]采用新型S-BPS鉴定出酿酒酵母的3 043 种蛋白,能更全面地检出膜蛋白、线粒体蛋白和核糖体蛋白,为后续探究在不同逆境下细胞器蛋白的变化提供可行性实验基础。Giardina等[81]以iTRAQ标记质谱技术对酿酒酵母进行蛋白质组学分析,表明糖酵解酶、糖异生酶和线粒体蛋白的下调会导致糖酵解、糖异生和线粒体功能的变化。酵母蛋白质组不仅会对体内的细胞器发生响应性变化,一些研究人员还发现酵母为适应匮乏的生长条件会利用细胞外囊泡(extracellular vesicles,Evs)进行细胞之间的蛋白质运输。Winters等[82]对酿酒酵母蛋白质组学进行分析,在低葡萄糖条件下生长的酵母细胞中鉴定了377 种与细胞内囊泡簇(intracellular vesicle clusters,IVC)相关蛋白质,表明在低碳源的情况下Evs可作为蛋白质的运输载体。
3.5 探究发酵食品的风味形成
酵母与发酵食品风味形成紧密相关,研究酵母蛋白质组学可探究发酵食品风味形成机制。葡萄酒酿造过程有上百种酵母共同作用,不同配比均会使葡萄酒产生不同的香气和风味。García-Ríos等[83]对库德里阿兹威酵母(S.kudriavzevii)、葡萄汁酵母(S.uvarum)和酿酒酵母进行蛋白质组学分析,发现在低温酿造葡萄酒时这三种酵母能更好地维持产品的风味。啤酒酿造工艺中的蛋白质组学源自于小麦和酵母的200多种独特蛋白质[84]。研究发现不同风味的酒类发酵与酵母蛋白质组学密切相关,因此可以通过研究酵母的蛋白质组学进而优化啤酒酿造工艺。Kerr等[85]探究市售啤酒中蛋白质差异与风味之间的关系,通过蛋白质组定量技术发现啤酒发酵中1 418 种特异性蛋白质影响成品啤酒的口感和风味。蛋白质组学还能够用于识别和测量糖蛋白及其特异性修饰位点。酵母细胞在起泡酒的酿造过程中发生的自溶会对起泡酒的感官质量产生影响。Porras-Agüera等[86]对起泡酒进行第二次的密封发酵及其陈酿期的酿酒酵母蛋白质组学进行研究,发现其在CO2超压条件下参与甘油合成的相关蛋白质含量增加,但参与活性氧、乙醇、乙醛和乙酸等代谢物反应过程中的蛋白质含量降低。
3.6 探究肉类替代品的制造
随着技术的发展和对环境的保护,人造蛋白制品的应用不断增加。Humpenöder等[87]提出发酵微生物获得蛋白可替代全球牛肉消耗的20%。其中最受关注的“人造肉”研制成为热点。酵母蛋白作为一种新型的微生物蛋白资源,具有较好的加工性能,可规避豆类蛋白自身的豆腥味、过敏源及其限制性氨基酸缺乏等问题。Duppala等[88]对可运用在新型“人造肉”汉堡中的毕赤酵母进行蛋白质组学分析,发现毕赤酵母是一种可以生产大量异源蛋白质且自身含大量蛋白的优良“人造肉”基础原料。为增加素肉的观感,通常利用酵母生产血红蛋白使产品富有红褐色的质地。Reyes等[89]利用毕赤酵母为大豆植物肉提供血红蛋白及其他蛋白质,经过“自下而上”蛋白质组学分析发现该制品对人体无慢性致敏性和毒性风险。研究人员利用酵母基因编辑技术使重组血红蛋白基因在酵母中高效表达。Ishchuk等[90]通过对酿酒酵母进行ROX1、HMX1、VPS10和AHSP基因的组合改造,进一步测定改造菌株的蛋白质组从而优化酵母血红素密码子,使其高产血红蛋白,并可防止血红蛋白的降解。酵母蛋白质对植物肉质替代品的优化改良起到了有效作用,对其酵母蛋白质组进行测定,可实现对“人造肉”成分更加精准的把控。
4 结语
蛋白质组学以揭示生命体的整个活动规律为目的,主要用于阐明生命体蛋白质的表达模式以及功能作用。近5 年来随着研究的不断深入,酵母蛋白质组学不仅涉及定性分析,还进一步拓展至精确的定量分析。蛋白质组研究结果也呈现出由静态描述转变为动态描述的趋势。这为蛋白质组测定提出了更高要求,如高效低损耗的提取纯化技术、快速的分离技术、高精度多维度的质谱定量技术和全面的特定数据库等。蛋白质组学计量技术的进步也必将推动人们对酵母生理响应机制、逆境耐受机理和微生物互作关系的理解,可助力于优良食品加工用酵母的选育、食品发酵工艺的优化、发酵食品品质的提升、酵母合成生物学工作的开展等。

