葡萄柚籽提取物及其纳米乳对大肠杆菌和金黄色葡萄球菌生物菌膜的抑制作用
王思亓,梁晓云,张 晨,张文栋,程 宇,宓晓雨,赵王晨,王龙凤,江 芸*
(南京师范大学食品与制药工程学院,江苏 南京 210023)
近年来食源性腐败菌和致病菌生物菌膜引起的食品安全问题受到国内外学者广泛关注。生物菌膜是指附着于各种物质表面被细菌自产的胞外聚合物(extracellular polymeric substances,EPS)包裹的有一定三维结构和功能的细菌群体[1-2]。据报道,生物菌膜中细菌对抗生素和化学试剂的抗性比浮游细菌高10~1 000 倍[3]。因此,食品加工环境中的生物菌膜已成为细菌交叉污染的重要来源,可导致严重的公共卫生问题[4]。大肠杆菌和金黄色葡萄球菌是主要的食源性有害菌,因这两种菌污染而引发的食物中毒事件时有发生[5-6]。大多数大肠杆菌和金黄色葡萄球菌菌株都有形成生物菌膜的能力[7]。
近年来,控制生物菌膜已成为研究热点[8-10]。其中,植物源天然抗菌物质在抑制食源性有害菌生长增殖、有效延长食品货架期方面已有大量报道。精油是从植物不同部位提取的复杂混合物,大部分具有广谱抑菌作用[11-12]。然而,由于水溶性和生物利用度低、化学稳定性差、挥发性高等问题,精油及其成分的实际应用受到较大限制[13]。为了保持其生物活性,减少其对食品感官特性的影响,将精油制备成纳米乳液是一种可行的方式[14-15]。目前,精油纳米乳抑菌方面的研究报道越来越多。葡萄柚籽提取物(grapefruit seed extract,GSE)已被证实具有较好的广谱抗菌活性[16],其抗菌活性主要来源于多酚类黄酮,如柚皮苷、柠檬苦素、槲皮素、山柰酚、橙皮苷及其他化合物[17-18]。GSE已被成功开发成多种形式的商品进入国内外市场。本课题组前期以美国GSE浓缩口服液NutriBiotic产品为研究对象,制备成葡萄柚籽提取物纳米乳(grapefruit seed extract nanoemulsion,GNE),有效提高了GSE抗菌活性[19],而关于GNE对食源性有害菌生物菌膜抑制方面的研究尚鲜见报道。
本研究以大肠杆菌和金黄色葡萄球菌为实验细菌,比较GSE和GNE对两种菌生物菌膜形成的抑制效应,包括分析生物菌膜中黏附菌数变化、EPS含量变化,利用扫描电子显微镜(scanning electron microcopy,SEM)和共聚焦激光扫描显微镜(confocal laser scanning microscope,CLSM)观察生物菌膜微观形态结构变化。进一步比较GSE和GNE对两种菌单种菌膜和混合菌膜的清除效果。从而为食源性有害菌生物菌膜的有效控制提供理论参考,为GSE在市场的推广应用提供科学支撑。
1 材料与方法
1.1 菌株、材料与试剂
大肠杆菌为本实验室前期从某企业猪肉屠宰线分离所得;金黄色葡萄球菌ATCC 25923(以下简称金葡菌)购自北京北纳创联生物技术研究院。
胰蛋白胨大豆琼脂(tryptone soya agar,TSA)、酵母提取物(yeast extract,YE)、胰蛋白胨大豆肉汤(tryptic soy broth,TSB)、麦康凯琼脂、Baird-Parker琼脂 北京陆桥技术有限公司;LIVE/DEAD®BacLight Bacterial Viability Kits(L7012) 美国Molecular Probes公司;GSE(有效成分33%) 美国NutriBiotic公司;磷酸盐缓冲液 南京峰昌生物科技有限公司;氯化钠、乙醇 南京化学试剂有限公司;总蛋白定量检测试剂盒南京建成生物工程研究所。
1.2 仪器与设备
M2多功能酶标仪 美国Molecular Devices公司;SZX超净工作台 上海浦东跃欣仪器厂;LDZX-30FBS立式压力蒸汽灭菌锅 上海申安医疗器械厂;SG403A Sterile GDRD生物安全柜 美国Baker公司;拍打式均质器 青岛众瑞智能仪器有限公司;生化培养箱上海新苗医疗器械制造有限公司;QL-200微型漩涡混合仪海门其林贝尔仪器有限公司;SU8020 SEM 日本Hitachi公司;LSM880 CLSM 德国Carl Zeiss公司。
1.3 方法
1.3.1 菌液的制备
将-80 ℃冻存的大肠杆菌和金葡菌经TSA-YE平板划线,于37 ℃培养24 h,挑取单菌落接种至TSB液体培养基中,37 ℃振荡(220 r/min)培养18 h进行活化,2 次活化后的菌液浓度达到9(lg(CFU/mL))左右,菌落总数经TSA培养计数验证。
1.3.2 GNE的制备
GNE的制备参照Guo Mingming等[20]的方法稍作修改。将6.0%(以体系总质量计,下同)GSE、2.2%中链甘油三酯、0.8%吐温80和91.0%去离子水混合后用磁力搅拌器搅拌30 min以获得粗乳液。然后将GSE粗乳液用均质机以5 000 r/min高速均质4 min。随后,使用超声波细胞破碎仪对粗乳液超声处理(200 W、15 min)以获得稳定均匀、GSE终质量分数为1.98%的纳米乳液。
1.3.3 GSE和GNE对两菌生物菌膜的干预实验
前期实验得出GNE对大肠杆菌和金葡菌的最小抑菌质量分数(minimum inhibitory concentration,MIC)分别为1.2%、0.6%[19],本实验选用GNE浓度为1/2 MIC进行抑制菌膜形成实验。用TSB将GSE和GNE母液分别稀释成质量分数为0.6%、0.3%的工作液,作为大肠杆菌和金葡菌生物菌膜形成的培养液,同时以正常TSB作为对照组。吸取1.3.1节的菌液,加入载有不锈钢片(75 mm×25 mm×1 mm)和130 mL上述3 种培养液的玻璃盒中,菌液浓度约为6(lg(CFU/mL))。于37 ℃分别静置培养24、48、72、120 h,规定时间取出钢片,用无菌生理盐水漂洗3 次以去除钢片表面未黏附的游离菌体,分别进行以下指标分析。
1.3.3.1 生物菌膜中黏附菌数的测定
将载有生物菌膜的不锈钢片放入装有80 mL无菌生理盐水的均质袋中,采用拍击-冲击法采集钢片表面的黏附菌体[21],在8 击/s条件下拍击60 s,吸取均质液进行梯度稀释,涂布至TSA-YE平板中,37 ℃培养24 h后计数。
1.3.3.2 生物菌膜EPS中蛋白质和多糖含量分析
菌膜分别培养24、72 h,取出钢片漂洗后用棉球擦拭法采集生物菌膜[22]。将擦拭的棉球置于装有10 mL无菌生理盐水和一定量玻璃珠的离心管中,涡旋3 min,使棉球上的菌体充分脱落,去除棉球,然后将菌悬液离心(5 000×g、4 ℃、10 min)。获得的上清液即为EPS样本。用总蛋白定量检测试剂盒测定蛋白质含量。在562 nm波长处蛋白质含量与溶液吸光度成正比,采用酶标仪测定A562nm,得到蛋白质含量的标准曲线方程为:y=0.000 8x+0.159(R2=0.997 6),根据标准曲线方程计算上清液中的胞外蛋白质含量[23]。
采用苯酚-硫酸法测定胞外多糖含量。将各组的EPS样本取2 mL至10 mL离心管中,加入1 mL体积分数6%苯酚溶液,混匀后逐滴加入5 mL体积分数95%硫酸溶液。将反应液置于室温冷却,避光孵育。孵育完成后在490 nm波长处测定其OD值。采用葡萄糖作为标准品绘制标准曲线,得到多糖含量的标准曲线方程为:y=16.669x+0.178 4(R2=0.998),最后根据标准曲线方程计算得出EPS中多糖的含量[23]。
1.3.3.3 生物菌膜SEM观察
按照1.3.3节的方法在3 种培养液中制备生物菌膜,其中不锈钢片为10 mm×10 mm×1 mm。分别在24、72 h时取出不锈钢片,生理盐水漂洗后将黏附生物菌膜的钢片放入体积分数2.5%戊二醛溶液中,在4 ℃下固定过夜,随后加入体积分数1%锇酸溶液固定2 h,最后用灭菌水冲洗3 次。将固定好的样品用乙醇梯度脱水15 min并干燥,用于SEM观察。
1.3.3.4 生物菌膜CLSM观察
按照1.3.3节的方法制备生物菌膜,在24、72 h取出不锈钢片,漂洗后吸取LIVE/DEAD®荧光染液对不锈钢片表面进行染色,室温避光条件下充分作用15 min后,用无菌蒸馏水充分洗涤不锈钢片以除去多余荧光染料,室温避光条件下放置自然干燥,使用CLSM(10×)观察染色后的生物菌膜结构。LIVE/DEAD®为由核酸染料SYTO 9和碘化丙啶(propidium iodide,PI)复配的荧光染料,SYTO-9与PI能分别使活、死细胞在CLSM下呈现绿色、红色荧光,其中SYTO 9激发波长和吸收波长分别为480 nm和500 nm,PI激发波长和吸收波长分别为490 nm和635 nm。三维投影使用ZEN Blue Lite 2_3软件的z-stacks简易3D功能重建。
1.3.4 GSE和GNE对单种菌膜和混合菌膜的清除实验
1.3.4.1 选择性培养计数平板的确定
为了对混合菌膜中大肠杆菌和金葡菌分别计数,首先需要确定合适的选择性平板。将1.3.1节大肠杆菌和金葡菌的培养菌液进行梯度稀释,选取合适的稀释度分别涂布在麦康凯琼脂平板和Baird-Parker琼脂平板上,37 ℃培养24 h,观察细菌生长情况进行验证。
1.3.4.2 大肠杆菌和金葡菌单种菌膜和混合菌膜的制备
将1.3.1节大肠杆菌和金葡菌的培养菌液单独或同时接种至装有不锈钢片(75 mm×25 mm×1 mm)和TSB的玻璃盒中,其中两种菌浓度均为6(lg(CFU/mL)),37 ℃静置培养72 h,取出钢片,漂洗后用1.3.4.1节确定的选择性平板37 ℃培养24 h,对两种菌分别进行培养计数。
1.3.4.3 GSE和GNE处理单种菌膜和混合菌膜
将1.3.4.2节得到的载有菌膜的不锈钢片,漂洗后分别放入由生理盐水配制的质量分数为1.2%和1.8%的GSE、GNE溶液中37 ℃处理24 h,以生理盐水37 ℃处理24 h为对照。处理结束后取出不锈钢片,漂洗后按照1.3.3.1节方法进行均质,吸取均质液进行梯度稀释,采用1.3.4.1节确定的选择性平板分别对菌膜中大肠杆菌和金葡菌黏附菌数进行培养计数,37 ℃培养24 h。按下式进一步计算清除率。
式中:A为GSE、GNE 处理组生物菌膜中黏附菌数/(CFU/mL);B为生理盐水对照组生物菌膜中黏附菌数/(CFU/mL)。
1.4 数据处理与分析
采用Origin 2021b软件绘图。数据处理应用SPSS 23.0软件进行统计分析,采用Duncan’s单因素方差分析进行多重比较,采用T检验进行两组之间显著性比较(以P<0.05表示差异显著)。实验重复3 次。
2 结果与分析
2.1 GSE和GNE对两菌生物菌膜形成时黏附菌数的影响
GSE和GNE处理后大肠杆菌和金葡菌生物菌膜中黏附菌数的变化情况如图1所示。大肠杆菌和金葡菌经37 ℃、24 h培养后,对照组生长到7~8(lg(CFU/cm2))。经0.6%的GSE、GNE处理后,大肠杆菌生物菌膜中黏附菌数对数值比对照组减少1~2(lg(CFU/cm2)),且随着作用时间的延长,GNE 的抑制活性强于GSE,120 h时大肠杆菌黏附菌数对数值比GSE组少0.9(lg(CFU/cm2))。GSE和GNE对金葡菌生物菌膜表现出更强的抑制作用,随着GSE和GNE作用时间的延长,抗金葡菌生物菌膜作用明显增强,且相同质量分数的GNE抑制效果亦强于GSE,120 h时金葡菌黏附菌数对数值比GSE组少0.6(lg(CFU/cm2))。结果表明,GSE和GNE在1/2 MIC下能有效抑制两菌生物菌膜的形成,且对金葡菌的抑制作用更强。
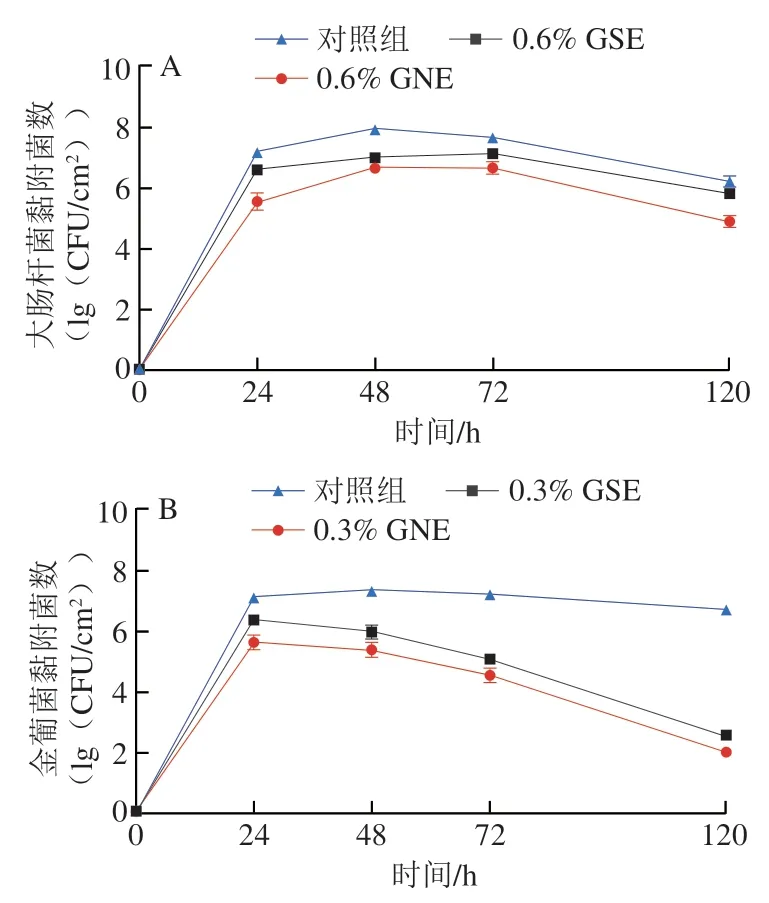
图1 生物菌膜形成过程中黏附菌数变化Fig.1 Changes in the number of adherent cells during biofilm formation
2.2 生物菌膜中胞外蛋白质和多糖含量的变化
GSE和GNE处理下大肠杆菌和金葡菌生物菌膜中胞外蛋白质、胞外多糖含量变化如图2、3所示。24 h时,3 个处理组之间大肠杆菌胞外蛋白质、胞外多糖含量均无显著性差异,表明菌膜形成24 h时GSE、GNE对大肠杆菌胞外蛋白质、胞外多糖产生的影响无显著差异;而24 h时3 个处理之间金葡菌胞外蛋白质、胞外多糖含量存在显著差异(P<0.05),表明菌膜形成24 h时GSE、GNE显著抑制了金葡菌胞外蛋白质、胞外多糖的产生,且GNE抑制效果显著强于GSE。72 h时,3 个处理之间两种菌蛋白质、胞外多糖含量均存在显著差异(P<0.05),表明菌膜形成72 h时GSE、GNE显著抑制了大肠杆菌和金葡菌胞外蛋白质和多糖的产生,且GNE抑制效果显著强于GSE。GSE、GNE处理组菌膜形成72 h时胞外蛋白质和多糖含量显著高于24 h时(P<0.05)。

图2 生物菌膜中胞外蛋白质含量变化Fig.2 Changes in the amount of extracellular proteins in biofilm
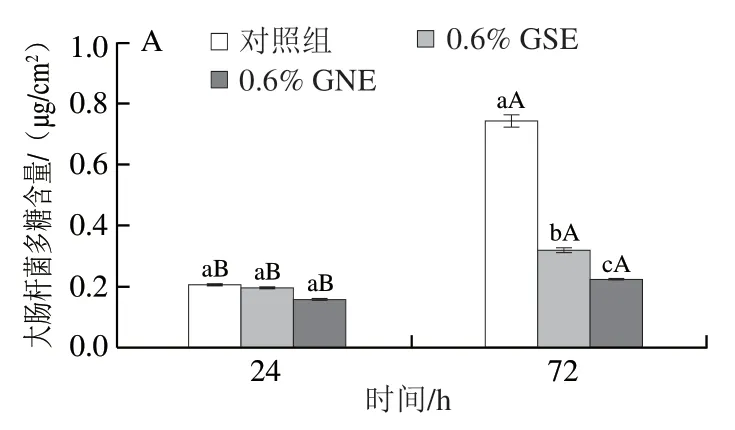
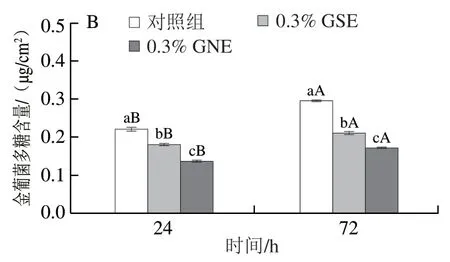
图3 生物菌膜中胞外多糖含量变化Fig.3 Changes in the amount of extracellular polysaccharides in biofilm
2.3 大肠杆菌和金葡菌生物菌膜SEM观察结果
采用SEM 观察大肠杆菌和金葡菌在TSB、1/2 MIC GSE和GNE分别培养24 h和72 h时生物菌膜的微观结构,如图4A所示,大肠杆菌于TSB培养24 h时形成三维结构,堆叠产生了较为疏松的生物菌膜,在菌体外有少量黏液产生;培养72 h时形成致密的三维结构,菌体周围有较厚的黏液层包裹。72 h时GSE组和GNE组菌体的团聚及黏液分泌情况要多于24 h时,但均明显少于TSB对照组,表明GSE和GNE抑制了大肠杆菌生物菌膜微观结构的形成及EPS的产生,且GNE抑制作用强于GSE。由图4B可知,与大肠杆菌类似,GSE和GNE也抑制了金葡菌生物菌膜微观结构的形成及EPS的产生。SEM观察结果与2.1节黏附菌菌数变化结果趋势一致,且印证了2.2节GSE和GNE对EPS的抑制作用。

图4 大肠杆菌和金葡菌生物菌膜SEM图(×5 000)Fig.4 SEM images of bioflims formed by E.coli and S.aureus (×5 000)
2.4 大肠杆菌和金葡菌生物菌膜CLSM观察结果
采用CLSM 观察大肠杆菌和金葡菌在TSB、1/2 MIC GSE和1/2 MIC GNE条件下培养24 h和72 h时生物菌膜中活/死菌的分布情况。如图5所示,大肠杆菌培养24 h时,对照组中大量菌体黏附于钢片表面,有少量小的细菌“团状物”出现,而GSE和GNE组钢片表面黏附菌体少于对照组,并且有较多红色死菌分布其中。培养72 h时,3 组菌膜厚度与24 h相比均有所增加,对照组中黏附菌体更多,并形成了聚集的立体结构;GSE和GNE组红色死菌更多。金葡菌与大肠杆菌类似,对照组菌体的聚集方式由小型团状物变为致密的立体结构。从24 h到72 h,GSE和GNE组的菌膜厚度有所增加,但相比于对照组,菌膜结构中疏松红色区域明显增加,这表明GSE和GNE都具有抑制生物菌膜形成的能力。

图5 大肠杆菌和金葡菌生物菌膜CLSM图(×10)Fig.5 CLSM images of biofilms formed by E.coli and S.aureus (×10)
2.5 大肠杆菌和金葡菌混合菌膜形成情况
为了对混合菌膜中两种菌分别进行计数,首先确定了两种菌的选择性计数平板。如图6所示,大肠杆菌在麦康凯琼脂平板上生长良好,而在Baird-Parker琼脂平板上不生长,金葡菌则相反,表明可以采用麦康凯琼脂平板、Baird-Parker平板分别作为混合菌膜中大肠杆菌、金葡菌的计数平板。

图6 大肠杆菌和金葡菌混合培养计数培养基的确定Fig.6 Determination of media for enumeration of mixed culture of E.coli and S.aureus
大肠杆菌和金葡菌在TSB中37 ℃、72 h单种菌膜和混合菌膜形成情况见图7。大肠杆菌与金葡菌混合成膜时,混合菌膜中大肠杆菌与其单种菌膜形成量没有显著性差异,而混合菌膜中金葡菌的菌膜量显著少于其单种菌膜形成量(P<0.05)。
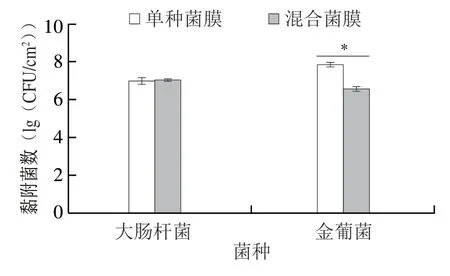
图7 大肠杆菌和金葡菌混合菌膜形成72 h时黏附菌数Fig.7 Number of adherent cells in mixed biofilms formed by E.coli and S.aureus at 72 h
2.6 GSE和GNE对两菌单种菌膜和混合菌膜清除作用
将大肠杆菌和金葡菌培养72 h的单种菌膜和混合菌膜分别于生理盐水、GSE、GNE中处理24 h,结果如图8所示。大肠杆菌单种菌膜能够被GSE、GNE显著清除,其中质量分数1.2%时GSE、GNE清除作用无显著差异,而质量分数1.8%时GNE清除作用显著强于GSE(P<0.05),清除率增加27.2%。金葡菌单种菌膜亦能被GSE、GNE显著清除,且质量分数越高清除作用越强,两种质量分数下GNE清除作用均显著强于GSE(P<0.05),质量分数1.8%时GNE比GSE清除率高7.7%。相同质量分数的GSE、GNE对金葡菌的清除作用强于对大肠杆菌的清除作用。混合菌膜中大肠杆菌和金葡菌也能被GSE、GNE显著清除,其中混合菌膜中大肠杆菌在质量分数1.8%时GNE清除作用强于GSE,清除率增加13.2%,混合菌膜中金葡菌在1.2%、1.8%两种质量分数下GNE清除作用均显著强于GSE(P<0.05),清除率分别增加9.7%、14.3%。通过清除率比较GSE、GNE对单种菌膜和混合菌膜的清除作用,发现对混合菌膜中大肠杆菌和金葡菌的清除作用均弱于对单种菌膜的清除作用,1.8%的GNE 对混合菌膜中大肠杆菌、金葡菌的清除率分别比对两菌单种菌膜清除率低14.9%和6.2%。结果表明混合菌膜中两种菌对GSE、GNE抗性增强。
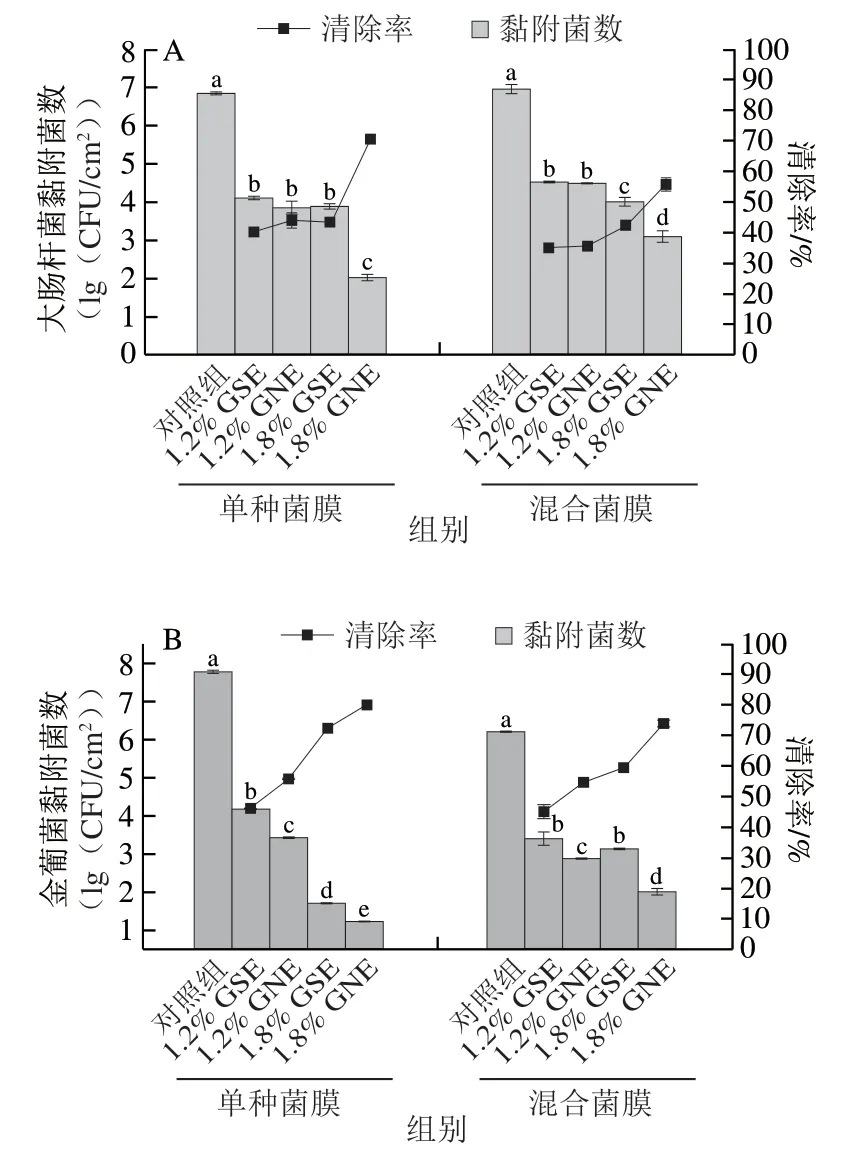
图8 GSE和GNE对单种菌膜和混合菌膜清除作用Fig.8 Effects of GSE and GNE on eliminating single and mixedspecies biofilms
3 讨论
精油是天然衍生的芳香化合物,大部分精油具有强烈的抗菌、抗病毒和抗真菌活性,其作为天然抗菌剂在食品保鲜应用研究方面被广泛报道[12,16,24]。关于精油抑制生物菌膜方面的报道也越来越多。研究发现,佛手精油可有效抑制单核细胞增生李斯特菌生物菌膜形成[25]。地中海地区不同种类植物精油均可抑制铜绿假单胞菌生物菌膜的形成[26]。夹竹桃精油、薄荷和茴香精油均可抑制大肠杆菌生物菌膜的形成,抑制能力依次减弱[27]。薄荷精油、百里香酚、牛至精油等可有效抑制金葡菌生物菌膜的形成[28-30]。本研究发现GSE对大肠杆菌和金葡菌生物菌膜、EPS形成具有抑制作用,而且1/2 MIC对金葡菌生物菌膜形成抑制效果强于大肠杆菌,这可能是由于革兰氏阴性细菌外膜的特征结构,使其对亲脂性分子更具抗性[31]。本实验还发现,GSE对两种菌成熟菌膜具有较好清除效果。Song等[32]也发现GSE在抑制菌膜形成和已形成菌膜清除方面有积极效果。
但是,GSE存在水溶性低、生物活性低、有苦味等问题,使其实际应用受到限制。本课题组前期研究发现,将GSE制备成GNE改善了其水溶性,制备成的GNE是O/W型乳液,纳米尺寸的液滴比表面积大,提高了有效成分的生物活性;此外,GNE对细菌细胞壁、细胞膜的破坏作用增强,细胞内蛋白质和核酸渗漏加剧,相比于GSE表现出更强的抑菌作用[19]。佛手柑精油纳米乳对金葡菌的MIC为0.38%[33],甜橙精油纳米乳液对大肠杆菌的MIC介于7.7%~11.0%之间;对金葡菌的MIC约为11%[34]。本课题组制备的GNE对大肠杆菌和金葡菌的MIC分别为1.2%和0.6%,抑菌性能较强[19]。近年来,逐渐出现精油纳米乳液抑制生物菌膜方面的报道。Moghimi等[35]关于百里香精油及其纳米乳对耐多药鲍曼不动杆菌菌膜的抑制实验结果显示,乳液处理24 h时抗菌膜效果比相应精油高36%。Prakash等[36]研究发现柠檬草精油纳米乳液抗鼠伤寒沙门氏菌生物菌膜活性比相应精油高11.61%。本研究也得到类似结论,GNE可以有效抑制大肠杆菌和金葡菌生物菌膜的形成,并且作用效果强于GSE,1/2 MIC GNE作用120 h时两菌菌膜形成量对数值均比GSE组少0.6(lg(CFU/cm2))以上,1.8%的GNE对已形成的大肠杆菌和金葡菌菌膜清除率分别比GSE高7.7%~27.2%。本研究采用SEM和CLSM也观察到了GSE和GNE对生物菌膜的抑制效果,与菌膜计数分析结果相印证。本研究还发现GSE和GNE减少了生物菌膜胞外蛋白质和多糖含量,这与Amrutha等[37]关于香辛料油纳米乳、Wang Renjie等[38]关于D-柠檬烯纳米乳减少EPS产生的研究结论类似。
自然环境中绝大多数菌膜都是多菌种混合生物菌膜,混合生物菌膜中不同菌种之间可呈现协同、拮抗等不同相互作用。有研究发现粪肠球菌、铜绿假单胞菌等会促进大肠杆菌的菌膜形成[39-40]。另一些研究发现,大肠杆菌可抑制铜绿假单胞菌、成团泛菌生物菌膜的形成,但对沙拉厂分离株的菌膜形成没有影响[41]。本研究中,大肠杆菌与金葡菌混合成膜时,大肠杆菌未受影响,而大肠杆菌对金葡菌菌膜形成产生了抑制作用,这与Manoharadas[42]、Ohn[43]等的研究结论相似。多菌种混合成膜时发生的不同交互效应可能与不同菌种、不同菌株、培养温度、培养基质等多种因素有关。
目前,对精油和纳米乳清除混合菌膜方面的报道尚有限[44]。本研究中,GSE和GNE对已经形成的混合菌膜表现出良好的清除效果。但是,混合菌膜表现出更强的抗性,在相同质量分数下GSE和GNE对其清除率均低于对单种菌膜。Zhang Hongfei等[45]采用低能X射线清除单核细胞增生李斯特菌与荧光假单胞菌的混合菌膜时也发现,相比于单种菌膜,混合菌膜抗性更强。Reigada等[46]在用万古霉素清除铜绿假单胞菌和金葡菌形成的混合生物菌膜时也发现混合生物菌膜比单种菌膜更难清除的现象。实际生产加工中,食品加工接触表面形成的生物菌膜大多是由多种细菌组成的混合菌膜,因此需要更加关注混合菌膜抗性增强后的食品安全风险评估和控制。
GNE比化学消毒剂安全性高,比柚皮素、百里香酚等单一成分抗菌剂价格低廉,并且本实验证实GNE具有较高的生物活性、较强的菌膜抑制能力。近年来,纳米乳液在食品保鲜方面的应用也有研究报道。Radi等[47]制备橙皮精油纳米乳并对鲜切橙片进行涂膜处理,结果表明橙皮精油纳米乳能够发挥有效的保鲜作用。吴玲艳[48]制备的非吗啉纳米乳涂膜剂能有效保证甘薯的品质,延长货架期。雷凯[49]制备了香芹酚纳米乳-羧甲基壳聚糖复合食品包装膜并用于小麦面包贮藏,结果表明,小麦面包保质期随香芹酚浓度的增加而延迟,最长可达7 d。因此,将GNE应用于果蔬的涂膜保鲜,或加入可降解材料制备成保鲜膜用于食品包装贮藏等具有广阔的应用前景。
4 结论
有害菌的生物菌膜给食品安全性带来了严重危害,本实验结合食品加工实际环境探究天然绿色产品GSE和具有更高生物活性及稳定性的GNE对大肠杆菌和金葡菌生物菌膜的抑制作用。GSE和GNE在低质量分数下均可以抑制大肠杆菌和金葡菌生物菌膜的形成,并且可以减少胞外蛋白质和多糖的分泌,SEM和CLSM微观形态观察也得到一致的结论。生物菌膜的培养计数结果发现两种菌混合成膜时,金葡菌的菌膜形成受到大肠杆菌显著抑制。对已形成的生物菌膜进行清除实验,发现GSE和GNE也表现出积极的作用,且对金葡菌菌膜的清除作用更强。但是,相比于单种菌膜,混合菌膜表现出更强的抗性,1.8%的GNE对混合菌膜中大肠杆菌、金葡菌的清除率分别比对两菌单种菌膜清除率低14.9%和6.2%。这一结论提示有害菌混合生物菌膜抗性更强,可能会带来更严重的食品安全风险。比较GSE和GNE发现,GNE抑制菌膜形成及清除菌膜均强于GSE,1/2 MIC GNE作用120 h时两菌菌膜形成量对数值均比GSE组少0.6(lg(CFU/cm2))以上,1.8%的GNE对已形成的单种菌膜和混合菌膜的清除率比GSE高7.7%~27.2%。本研究可为GSE和GNE在生物菌膜控制方面的推广应用提供一定的科学依据。

